2. 成都医学院检验医学院,成都 610500
2. College of Laboratory Medicine, Chengdu Medical College, Chengdu 610500, China
放射治疗是肿瘤治疗的重要手段之一,60%~70%的肿瘤患者在治疗过程中都会接受放射治疗[1],10%~30%的患者在接受胸部治疗时肺发生不同程度的损伤[2]。放射性肺损伤(radiation-induced lung injury,RILI)最常见的症状是呼吸困难、干咳等症状,严重时还会造成慢性肺功能不全、肺心病等[3]。电离辐射引起肺细胞死亡的调控机制尚不明确,深入探究电离辐射引起的肺细胞死亡调控机制对辐射损伤的防治具有重要的意义。
电离辐射介导肺细胞发生铁死亡是通过引发水分子电离产生过量的活性氧(ROS),损伤肺细胞脂质膜结构,破坏肺细胞内氧化还原平衡。此外,电离辐射引起的DNA直接损伤也会造成细胞死亡[4]。铁死亡可作为RILI的预防、诊断和治疗的靶标,在RILI的治疗中展现出巨大前景。獐牙菜苦苷除了具有良好的抗炎、抗氧化的作用,还具有抑制脂质过氧化物形成等作用[5]。目前临床上缺乏预防放射性肺损伤的药物,亟待研发不良反应小、高效的放射性肺损伤的防护剂。因此,本研究拟通过构建放射性肺损伤细胞/小鼠模型,探索獐牙菜苦苷预防放射性肺损伤的功能及机制,为今后獐牙菜苦苷预防放射性肺损伤提供支持。
材料与方法 1、主要试剂与仪器二甲基亚砜(DMSO)(D8371)、谷胱甘肽(GSH)试剂盒(BC1175)、丙二醛(MDA)试剂盒(BC0025)、Masson三色试剂盒(G1340)、苏木素伊红(HE)试剂盒(G1120)购于北京索莱宝公司。獐牙菜苦苷,购自成都赛诺联创生物公司。高糖培养基(DMEM)、胎牛血清、胰酶、青霉素-链霉素双抗溶液、磷酸盐缓冲液(PBS)购自以色列Biological Industries(BI)公司。细胞计数试剂CCK-8(BS350B)购自北京Biosharp公司。乳酸脱氢酶试剂盒(C0017)、4′, 6-二脒基-2-苯基吲哚(DAPI)(C0060)、2,7-二氯荧光素二乙酸酯(DCFH-DA)探针(S0033S)购自上海碧云天生物科技公司。正常熔点琼脂糖(A434537)及低熔点琼脂糖(A104063)购自上海阿拉丁公司。氟硼二吡咯(BODIPYTM581/591-C11)探针购自美国Invitrogrn公司。铁离子荧光探针FerroGreen购自日本同仁化学公司。蛋白浓度测定(BCA)试剂盒(23235)购自上海赛默飞公司。γ-H2AX(201082-7G2)、GAPDH(301341)、GPX4(381958)单克隆抗体购自成都正能生物技术有限责任公司。xCT单克隆抗体购自英国Abcam公司。白细胞介素-6(IL-6)(MM-0163M1)、白细胞介素-1β(IL-1β)(MM-0905M1)试剂盒购自江苏酶免实业有限公司。X-RAD 225生物辐照仪购自美国Precision X-ray公司。
2、细胞分组及照射条件人支气管上皮细胞株(Beas-2B)和人胚肺成纤维细胞株(HELF)分别购自American Type Culture Collection(美国ATCC公司)公司和武汉普诺赛公司。将Beas-2B、HELF细胞接种在孔板里,进行X射线照射,能量225 kV,源靶距50 cm,剂量率2.0 Gy/min,照射野大小为15 cm×10 cm。分为3个组,对照组不进行任何处理,照射组采用10 Gy X射线照射,照射+獐牙菜苦苷组照射前加入一定浓度的獐牙菜苦苷预处理24 h后接受10 Gy X射线照射。
3、动物分组及照射条件SPF级6~8周龄的雄性C57BL/6J小鼠15只,体重18~22 g,均购自成都达硕实验动物有限公司,实验动物使用许可证号SCXK 2020-0030。所有小鼠置恒温(25±2)℃、恒湿45%~50%、12 h光照与黑暗条件、无菌净化屏障系统内饲养。按随机数字表法分为对照组、照射组和照射+獐牙菜苦苷组,每组5只。照射+獐牙菜苦苷组(100 mg/kg)于每次照射前连续灌胃5 d,200 μl/d,其他组别均给予等量的生理盐水。照前使用2% 戊巴比妥钠麻醉小鼠(75 μl/只),使照射野固定于小鼠肺部进行辐照,X射线能量225 kV,源靶距50 cm,剂量率2.0 Gy/min,总剂量15 Gy。
4、细胞存活检测Beas-2B和HELF细胞以5 000个/孔接种到96孔板中,每个浓度设置6个平行孔,培养箱中孵育24 h,弃掉培养液,用0、26、65、130、260、390 μmol/l浓度獐牙菜苦苷处理细胞24 h,给予10 Gy X射线照射,24 h后按照CCK-8试剂盒说明书步骤操作并计算细胞存活率。
5、LDH释放检测前期实验步骤与细胞存活实验一致,加药后照射24 h后吸去培养液,用PBS清洗1次。更换无血清培养液,将各培养孔分成:无细胞的培养液孔,未经药物处理的对照细胞孔,未经药物处理的用于后续裂解的细胞孔,药物处理的细胞孔(每组6个平行孔)。到预定检测时间点前1 h,从细胞培养箱里取出孔板,在未经药物处理的用于后续裂解的细胞孔中加入试剂盒提供的LDH释放试剂,反复吹打数次混匀后继续在培养箱中孵育。到达预定时间后,将孔板400×g离心5 min。取各孔的上清液120 μl,加入到新的96孔板相应孔中,随即进行样品测定并计算LDH释放率。
6、平板克隆存活实验Beas-2B和HELF细胞调整合适的浓度接种于6孔板中(对照组细胞数为500个/孔,照射组和照射+獐牙菜苦苷组为1 000个/孔),培养箱中孵育24 h,弃掉培养液,用130 μmol/l獐牙菜苦苷处理细胞后培养24 h,给予X射线照射。继续培养14 d,每2~3 d换液,直至孔板中出现肉眼可见的细胞克隆,终止培养。4% 多聚甲醛固定细胞15 min,染色30 min后洗去染色液,计数≥ 50个细胞的克隆数,并根据克隆存活率计算细胞存活分数:克隆形成率(%)=克隆数/接种细胞数×100%。
7、ROS水平检测Beas-2B和HELF细胞调整浓度为105个/ml接种到12孔板中,加药和辐射步骤同上,每孔加入0.5 ml含10 μmol/L DCFH-DA探针的无血清培养液,培养箱中避光孵育30 min。PBS清洗细胞后用0.25% 胰酶消化细胞2 min,PBS重悬细胞于EP管中,用流式细胞仪(FITC通路)检测ROS水平变化。
8、免疫荧光实验将细胞爬片进行消毒后放入24孔板中,加药和辐射步骤同上。每孔加入4% 多聚甲醛固定15 min,PBS清洗后采用1% Triton-X处理,PBS清洗,2% 牛血清蛋白(BSA)溶液常温封闭细胞2 h,4℃下γ-H2AX(1 ∶200)一抗孵育过夜,PBS清洗后荧光二抗孵育2 h。DAPI对细胞核进行染色5 min(1 ∶1 000),爬片置于荧光显微镜下进行观察。
9、彗星电泳实验加药和辐射步骤同上。离心弃上清,PBS重悬,调整细胞浓度,将细胞悬液和低熔点琼脂糖混合后平铺在覆盖有0.5% 正常熔点琼脂糖的载玻片上,盖玻片覆盖,在4℃放置5~8 min。取出盖玻片后添加一层正常熔点琼脂糖。盖玻片再次覆盖,在4℃放置5~8 min。将载玻片分别置于细胞裂解缓冲液和碱性电泳缓冲液后,电压25 V、恒流300 mA、20 min条件下电泳。每片载玻片上避光滴加15 μl的溴化乙锭溶液,盖上盖玻片,避光染色20 min,荧光显微镜下观察。
10、脂质过氧化物水平测定加药和辐射步骤同上。每孔加入0.5 ml无血清培养液配置的浓度为10 μmol/L的BODIPYTM581/591 C11的探针,培养箱中避光孵育30 min,PBS清洗细胞后用0.25%胰酶消化细胞2 min,PBS重悬细胞于EP管中,用流式细胞仪(FITC、PE通路)检测脂质过氧化水平变化。
11、Fe2+ 含量测定加药和辐射步骤同上。每孔加入0.5 ml用无血清培养液配置的浓度为10 μmol/L的FerroOrange的探针,培养箱中避光孵育30 min,PBS清洗细胞后用0.25% 胰酶消化细胞2 min,PBS重悬细胞于EP管中,用流式细胞仪(PE通路)检测Fe2+ 含量。
12、Western blot检测收集各组细胞,加入适量含蛋白酶抑制剂的裂解液,冰上裂解30 min,4℃,1 000×g离心10 min,分离细胞上清,BCA法蛋白定量。浓缩胶电压80 V,30 min,分离胶电压120 V,90 min条件下进行电泳。电压120 V,恒流300 mA,1 h条件下进行转膜。5% 脱脂奶粉封闭1 h,加入一抗GPX4(1 ∶1 000)、xCT(1 ∶1 000),4℃孵育过夜,3-羟甲基-氨基甲烷-盐酸缓冲盐(TBST)溶液洗膜,二抗室温孵育2 h(1 ∶10 000),TBST溶液洗膜后超敏电化学发光(ECL)化学显影。Image J软件定量分析后绘图。
13、病理学观察X射线照射后30 d,对小鼠麻醉后进行眼球取血,收集各组小鼠血清及肺组织。全血4℃ 1 000 g离心10 min,分离血清,-80℃保存。处死小鼠,取小鼠部分肺组织,进行GSH、MDA含量测定,余下部分用4% 多聚甲醛固定,石蜡包埋,切片,脱水,进行HE及Masson染色后光学显微镜下观察并拍照。
14、免疫组织化学检测石蜡切片脱蜡复水,抗原修复后,置于3% H2O2溶液中10 min清除内源性过氧化物酶,加入正常山羊血清室温封闭30 min,加入一抗γ-H2AX(1 ∶200)、GPX4(1 ∶300)后4℃孵育过夜,PBS清洗,滴加二抗室温孵育30 min,PBS清洗,二氨基联苯胺(DAB)溶液显色,适时终止反应,苏木素复染,梯度乙醇脱水,二甲苯透明后封片观察。
15、ELISA检测提前将血清和试剂盒从冰箱中拿出复温1 h,将需要的板条取出。使用标准品制作标曲,将待测样品加入样品孔中。在标准品孔和样本孔中加入辣根过氧化物酶(HRP)标记的检测抗体100 μl。封板膜盖住反应板,放入恒温箱中37℃孵育1 h。配制洗涤液,将反应板从恒温箱中拿出,撕掉封板膜,弃掉液体,在吸水纸上拍干,每孔加满洗涤液,静置20 s,甩去洗涤液在吸水纸上拍干重复5次。每孔加入底物A、B各50 μl,用封板膜盖住反应板,将反应板放入恒温箱中37 ℃孵育15 min。每个孔加入终止液50 μl,酶标仪在450 nm处读取每个孔的吸光值。
16、统计学处理采用GraphPad Prism 6.0软件进行统计分析,数据符合正态分布及方差齐性,计量资料用x ± s表示。组间比较采用两独立样本t检验。P<0.05为差异具有统计学意义。
结果 1、獐牙菜苦苷提高受照细胞存活率、降低细胞的LDH释放率采用0、26、65、130、260、390 μmol/L的獐牙菜苦苷预处理细胞24 h后,经过10 Gy照射后24 h,与照射组相比,不同浓度的獐牙菜苦苷干预后,细胞的存活率随浓度都有一定的增加,且在浓度为130 μmol/L的浓度时,细胞存活率最高,差异有统计学意义(Beas-2B:t=5.50,P<0.05;HELF:t=3.79,P<0.05,表 1)。细胞的LDH释放率都有所下降,且獐牙菜苦苷在130 μmol/L的浓度时,细胞LDH释放率最低,差异有统计学意义(Beas-2B:t=5.30,P<0.05;HELF:t=8.41,P<0.05,表 2)。以上结果表明獐牙菜苦苷对于细胞具有促增殖作用,使用獐牙菜苦苷对细胞进行照射前预处理,有效提升了细胞的存活率,并且在130 μmol/L的浓度时,体现出最优的抗辐射效果。因此,后续细胞实验将使用130 μmol/L獐牙菜苦苷进行预处理。
|
|
表 1 不同浓度獐牙菜苦苷对10 Gy X射线照射后Beas-2B、HELF细胞存活率的影响(%, x ± s) Table 1 Effects of different swertiamarin concentrations on the survival rates of the Beas-2B and HELF cells after irradiation with 10 Gy X-rays(%, x ± s) |
|
|
表 2 10 Gy X射线照射后不同獐牙菜苦苷浓度下Beas-2B、HELF细胞LDH释放率(%, x ± s) Table 2 LDH release rates of the Beas-2B and HELF cells after irradiation with 10 Gy X-rays under different swertiamarin concentrations(%, x ± s) |
2、獐牙菜苦苷促进X射线照射后细胞克隆形成能力
对照组、照射组、照射+獐牙菜苦苷组Beas-2B和HELF细胞的的克隆形成率分别为(74.00± 5.03)%、(5.33±1.86)%、(27.67±3.28)%、(83.67±3.18)%、(11.33±2.03)%、(35.00±3.79)%。与对照组相比,照射组的克隆形成率明显降低(Beas-2B:t=12.80,P<0.05;HELF:t=19.18,P<0.05)。说明X射线照射能够明显抑制Beas-2B和HELF细胞的生长,使其发生增殖性死亡现象。而照射+獐牙菜苦苷组克隆形成率较照射组显著回升(Beas-2B:t=5.92,P<0.05;HELF:t=5.51,P<0.05),说明獐牙菜苦苷的处理能够明显缓解因电离辐射所导致的增殖抑制现象(图 1)。
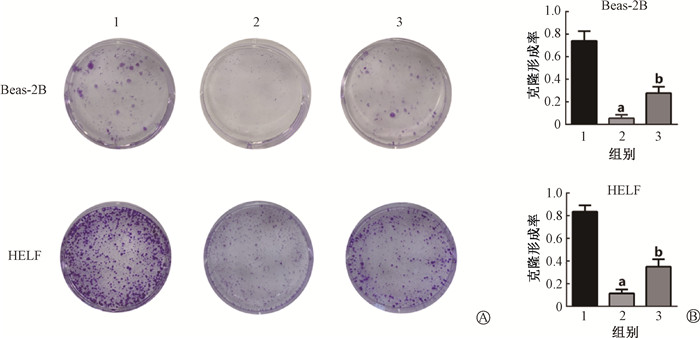
|
注:1.对照组;2.照射组;3.照射+獐牙菜苦苷组。a与对照组相比,t=12.80、19.18,P<0.05;b与照射组相比,t=5.92、5.51,P<0.0 图 1 獐牙菜苦苷促进X射线照射后细胞克隆形成能力 克隆形成染色 × 2.5 A.Beas-2B和HELF细胞克隆形成图; B.Beas-2B和HELF细胞克隆形成统计 Figure 1 Swertiamarin promoting cell clonality after X-ray irradiation Clone formation staining × 2.5 A. Clone formation diagram of Beas-2B and HELF cells; B. Statistical analysis of clone formation in Beas-2B and HELF cells |
3、獐牙菜苦苷减少X射线照射诱导的细胞ROS水平积累
与对照组相比,照射组的细胞ROS水平明显上升,差异有统计学意义(Beas-2B:t=18.52,P<0.05;HELF:t=8.08,P<0.05),而獐牙菜苦苷预处理24 h后的细胞ROS水平下降,差异有统计学意义(Beas-2B:t=16.99,P<0.05;HELF:t=4.10,P<0.05,表 3)。这一结果表明电离辐射能够诱导细胞内ROS产生,并且獐牙菜苦苷能够通过抑制细胞内ROS水平的升高,发挥辐射防护的效果。
|
|
表 3 10 Gy X射线照射后Beas-2B、HELF各组细胞ROS水平(%, x ± s) Table 3 ROS levels in the Beas-2B and HELF cells of various groups after irradiation with 10 Gy X-rays(%, x ± s) |
4、獐牙菜苦苷降低X射线照射后细胞DNA损伤水平
在DNA损伤标志物γ-H2AX免疫荧光实验中,对照组、照射组、照射+獐牙菜苦苷组Beas-2B和HELF细胞的DNA焦点数分别为3.33±0.88、148.70±15.68、53.67±5.78、3.67±0.33、61.33±2.03、15.67±2.33。与对照组相比,Beas-2B和HELF细胞经10 Gy X射线照射后,细胞内γ-H2AX焦点数明显增加(t=9.25、28.06,P<0.05),而照射+獐牙菜苦苷组细胞中γ-H2AX焦点显著降低(t=5.68、14.77,P<0.05,图 2 A~B)。彗星实验中,对照组、照射组、照射+獐牙菜苦苷组Beas-2B和HELF细胞的彗星拖尾百分比分别为(2.83±0.39)%、(77.59±0.41)%、(22.47±1.84)%、(13.99±2.13)%、(88.29±3.46)%、(36.91±1.81)%。相比于对照组,照射组的Bease-2B和HELF细胞核拖尾明显增加, 尾部DNA含量明显增加(t=13.80、5.85,P<0.05),而相较于照射组,照射+獐牙菜苦苷组Beas-2B和HELF细胞核拖尾变短, 尾部DNA含量明显减少(t=8.27、3.44,P<0.05,图 2 C~D)。以上实验结果均表明獐牙菜苦苷预处理能有效降低X射线照射诱导的DNA损伤水平(图 2)。
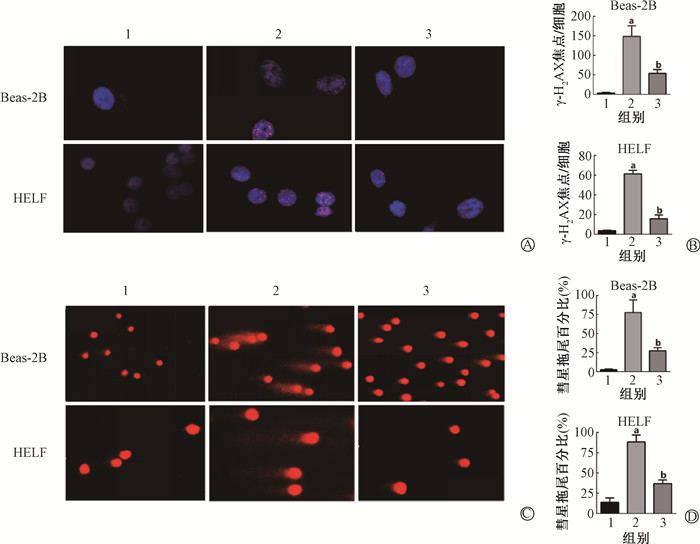
|
注:1.对照组;2.照射组;3.照射+獐牙菜苦苷组。a与对照组相比,t=9.25、28.06、13.80、5.85,P<0.05;b与照射组相比,t=5.68、14.77、8.27、3.44,P < 0.05 图 2 獐牙菜苦苷降低X射线照射后细胞DNA损伤水平 免疫荧光染色 ×1 000 彗星实验Beas-2B × 100,HELF × 200 A.X射线照射Beas-2B和HELF细胞24 h后细胞免疫荧光图; B.Beas-2B和HELF细胞γ-H2AX焦点数量化; C. X射线照射Beas-2B和HELF细胞24 h后细胞彗星实验图; D.Beas-2B和HELF细胞彗星拖尾量化 Figure 2 Swertiamarin reducing the level of DNA damage in cells after X-ray irradiation Immunofluorescence staining × 1 000; Comet assay images of Beas-2B × 100 and HELF × 200 A. Cellular immunofluorescence images of the Beas-2B and HELF cells after 24 h of X-ray irradiation; B. Quantification of γ-H2AX foci in the Beas-2B and HELF cells; C. Comet assay images of the Beas-2B and HELF cells after 24 h of X-ray irradiation; D. Quantification of comet tails in the Beas-2B and HELF cells |
5、獐牙菜苦苷降低X射线照射后细胞的铁死亡水平
脂质过氧化作为铁死亡的金标准,通过流式细胞术测定细胞内的脂质过氧化物水平发现,与对照组相比,照射组的细胞脂质过氧化物水平明显升高,差异具有统计学意义(Beas-2B:t=12.29,P<0.05;HELF:t=30.19,P<0.05),而獐牙菜苦苷预处理组的细胞,脂质过氧化水平明显低于照射组,差异具有统计学意义(Beas-2B:t=3.00,P<0.05;HELF:t=9.71,P<0.05,表 4)。进一步通过流式细胞术测定细胞内的Fe2+ 含量发现,与对照组相比,照射组的Fe2+ 含量明显升高,差异具有统计学意义(Beas-2B:t=9.47,P<0.05;HELF:t=8.74,P<0.05),而獐牙菜苦苷预处理组的细胞,Fe2+ 含量明显低于照射组,差异具有统计学意义(Beas-2B:t=3.52,P<0.05;HELF:t=10.97,P<0.05,表 5)。Beas-2B和HELF细胞经10 Gy X射线照射后,与对照组相比,xCT和GPX4蛋白含量明显下降(Beas-2B:t=2.45、5.19,P<0.05;HELF:t=5.09、4.09,P<0.05)。而与照射组相比,照射+獐牙菜苦苷组细胞中的xCT和GPX4蛋白含量明显回升(Beas-2B:t=3.27、2.90,P<0.05;HELF:t=7.07、3.01,P<0.05,图 3A~F)。以上结果提示电离辐射能够在一定程度上诱导细胞发生铁死亡,并且獐牙菜苦苷可能通过抑制细胞铁死亡的发生,发挥辐射防护的效果。
|
|
表 4 10 Gy X射线照射后Beas-2B、HELF各组细胞脂质过氧化水平(%, x ± s) Table 4 Lipid peroxidation levels in the Beas-2B and HELF cells of various groups after irradiation with 10 Gy X-rays(%, x ± s) |
|
|
表 5 10 Gy X射线照射后Beas-2B、HELF各组细胞Fe2+水平(%, x ± s) Table 5 Fe2+ levels in the Beas-2B and HELF cells of various groups after irradiation with 10 Gy X-rays(%, x ± s) |
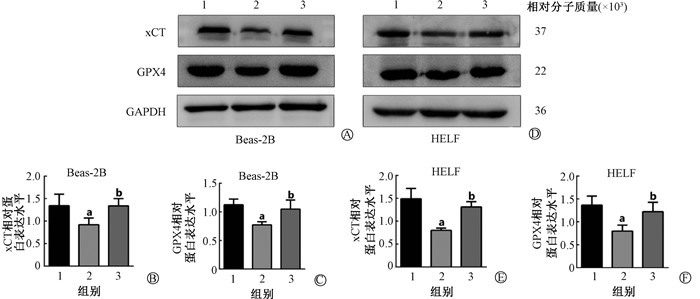
|
注:1.对照组;2.照射组;3.照射+獐牙菜苦苷组。a与对照组相比,t=2.45、5.19、5.09、4.09,P<0.05;b与照射组相比,t=3.27、2.90、7.07、3.01,P<0.05 图 3 獐牙菜苦苷降低X射线照射后细胞的铁死亡水平 A.Beas-2B细胞经X射线照射24 h后,xCT、GPX4蛋白表达; B.Beas-2B细胞xCT蛋白水平量化; C.Beas-2B细胞GPX4蛋白水平量化; D.HELF细胞经X射线照射24 h后,xCT、GPX4蛋白表达; E.HELF细胞xCT蛋白水平量化; F.HELF细胞GPX4蛋白水平量化 Figure 3 Swertiamarin reducing the ferroptosis level in cells after X-ray irradiation A. Expressions of the xCT and GPX4 proteins in the Beas-2B cells after 24 h of X-ray irradiation; B. Quantification of xCT protein level in the Beas-2B cells; C. Quantification of GPX4 protein level in the Beas-2B cells; D. Expressions of xCT and GPX4 proteins in the HELF cells after 24 h of X-ray irradiation; E. Quantification of xCT protein level in the HELF cells; F. Quantification of GPX4 protein level in the HELF cells |
6、獐牙菜苦苷减少X射线照射诱导的小鼠肺组织病理损伤和胶原纤维沉积
与对照组相比,照射组的小鼠肺组织可见肺泡结构破坏,肺间隔增厚,而獐牙菜苦苷预处理组的小鼠肺泡壁破坏程度减轻,肺间隔增厚也明显缓解。Masson染色结果表明,与对照组相比,照射组小鼠肺组织蓝色胶原纤维沉积增加。与照射组相比,獐牙菜苦苷预处理组的小鼠肺组织胶原纤维沉积减少。以上结果提示獐牙菜苦苷具有预防放射性肺损伤的作用(图 4)。
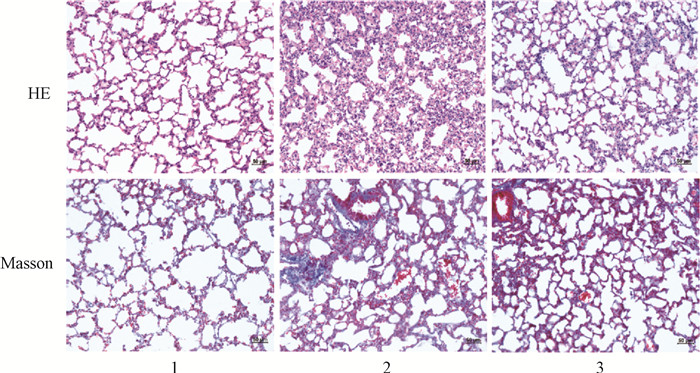
|
注:1.对照组;2.照射组;3.照射+獐牙菜苦苷组 图 4 獐牙菜苦苷减少X射线辐射诱导的小鼠肺组织病理损伤和胶原纤维沉积 ×200 Figure 4 Swertiamarin reducing X-ray radiation-induced pathological injury and collagen fiber deposition in the lung tissues of mice × 200 |
7、獐牙菜苦苷对X射线照射后小鼠肺组织DNA损伤及氧化应激水平的影响
与对照组相比,照射组的小鼠肺组织GSH含量明显下降(t=2.36,P<0.05),MDA含量明显升高(t=5.11,P<0.05)。与照射组相比,獐牙菜苦苷预处理组小鼠肺组织中GSH含量明显回升(t=2.65,P<0.05),而MDA含量明显降低(t=2.71,P<0.05),差异有统计学意义(图 5 A~B)。γ-H2AX是DNA双链损伤的标志物,与对照组相比,照射组小鼠肺组织的γ-H2AX蛋白表达增加(t=7.89,P<0.05),GPX4蛋白表达下降(t=4.31,P<0.05)。而獐牙菜苦苷预处理组的小鼠肺组织中的γ-H2AX蛋白表达较照射组明显降低(t=4.19,P<0.05),GPX4蛋白含量显著上调(t=2.31,P<0.05)。以上结果提示,獐牙菜苦苷可能通过降低动物体内的氧化应激水平及DNA损伤程度,从而起到辐射防护作用(图 5)。
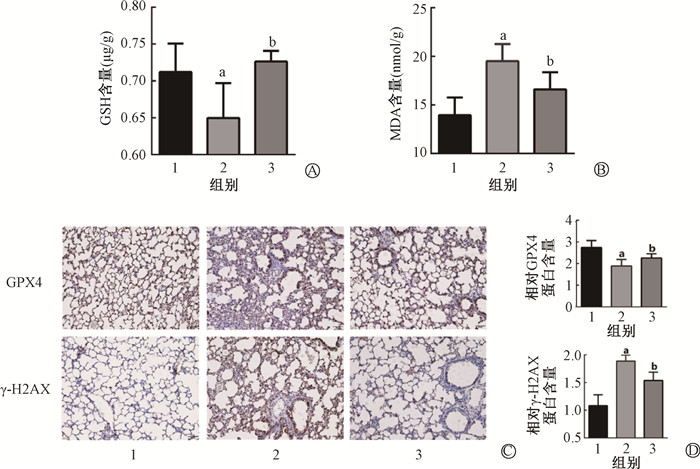
|
注:1.对照组;2.照射组;3.照射+獐牙菜苦苷组。a与对照组相比,t=2.36、5.11、4.31、7.89,P<0.05;b与照射组相比,t=2.65、2.71、2.31、4.19,P<0.05 图 5 獐牙菜苦苷对X射线照射后小鼠肺组织DNA损伤及氧化应激水平的影响 免疫组化 × 200 A.小鼠肺组织的GSH含量测定;B.小鼠肺组织的MDA含量测定; C.小鼠肺组织GPX4及γ-H2AX免疫组织化染色; D.GPX4及γ-H2AX免疫组织量化 Figure 5 Effects of swertiamarin on the levels of DNA damage and oxidative stress in lung tissue of mice after X-ray irradiationImmunohistochemical image × 200 A. Determination of GSH content in lung tissue of mice; B. Determination of MDA content in lung tissue of mice; C. Immunohistochemical staining of GPX4 and γ-H2AX in lung tissue of mice; D. Immunohistochemical quantification of GPX4 and γ-H2AX |
8、獐牙菜苦苷对X射线照射后小鼠血清中炎性因子水平的影响
与对照组相比,照射组小鼠血清中IL-6、IL-1β含量均增加(t=9.06、4.07,P<0.05)。而獐牙菜苦苷预处理组的小鼠血清中的IL-6、IL-1β含量较照射组明显降低,差异有统计学意义(t=4.56、3.16,P<0.05,表 6)。结果表明,獐牙菜苦苷可以有效降低X射线照射导致的小鼠体内炎性因子的升高,减少了小鼠肺组织中炎性因子的聚集及产生。
|
|
表 6 15 Gy X射线照射后不同组别小鼠血清炎性因子水平(x ± s) Table 6 Levels of serum inflammatory factors in different groups of mice after 15 Gy X-ray irradiation(x ± s) |
讨论
放射性肺损伤是胸部肿瘤患者放疗后最常见的并发症,严重影响患者的生活质量。深入研究电离辐射引起的肺部细胞损伤及组织功能紊乱的调控机制对放射性肺损伤的防治以及放疗效率的提高有重要意义[6]。电离辐射攻击的主要目标之一是细胞遗传物质DNA,DNA的损伤引起细胞凋亡[7]。此外电离辐射使细胞内水分子电离诱导大量的ROS产生[8],破坏细胞内的氧化还原平衡,引起细胞脂质过氧化损伤,最终导致细胞发生铁死亡[9]。因此,本研究主要从DNA损伤及氧化应激的角度来探索獐牙菜苦苷对电离辐射的防护作用机制。
铁死亡是一种铁依赖性的细胞程序性死亡[10-11],电离辐射后GPX4活性降低[12],脂质过氧化物累积,氧化平衡状态被打破,同时细胞内出现DNA损伤,引发细胞死亡[13-14]。肺泡壁微血管屏障被破坏,炎性因子大量分泌促进炎性细胞的浸润。IL-1β激活放射后肺组织趋化因子信号通路,引发促纤维化的TGF-β分泌[15]。IL-6促进纤维蛋白原、C反应蛋白等急性反应蛋白合成,与放射性肺损伤的发生呈正相关[16]。
氨磷汀是目前临床上已经被批准的,在放疗过程中可保护正常细胞免受辐射损害的防护剂。但是,氨磷汀服用后常出现恶心、呕吐、低血压等不良症状。因此,临床上亟待开发新型高效、不良反应小的辐射防护药物。在本研究中,獐牙菜苦苷作为一种天然的环醚萜类苷类化合物,在使用130 μmol/L的獐牙菜苦苷预处理细胞后与照射组相比,细胞的增殖能力明显提高,ROS水平下降,DNA损伤减轻,缓解了xCT的功能抑制,提高了GPX4的表达,进一步降低了脂质过氧化物,说明獐牙菜苦苷可以在细胞水平上抵抗电离辐射引起的DNA损伤和铁死亡。獐牙菜苦苷预处理后也有效减少了射线暴露下诱发的小鼠肺组织间隔增厚和破损肺泡结构,缓解了射线暴露下诱发的肺组织损伤。同时,小鼠肺组织中的γ-H2AX蛋白含量明显下调,GPX4蛋白含量有所增加,说明了肺组织的DNA双链损伤以及氧化损伤有所缓解。獐牙菜苦苷可以减少小鼠体内的炎性细胞聚集和产生,小鼠血清中IL-1β、IL-6明显下调。此外,獐牙菜苦苷预处理组小鼠肺组织中的GSH含量增加,铁死亡产物MDA含量降低,展现出獐牙菜苦苷调节体内氧化平衡的能力。以上结果表明,獐牙菜苦苷可通过调节ROS水平,提高射线暴露后的细胞增殖能力,缓解辐射后的DNA损伤及铁死亡,从而对辐射损伤发挥良好的防护作用。
本研究在体内外实验中发现在使用獐牙菜苦苷干预后,电离辐射诱导的DNA损伤及铁死亡得到了一定程度的缓解,说明獐牙菜苦苷具有较好的预防放射性肺损伤的作用。本研究结果为明确獐牙菜苦苷在电离辐射防护中的作用提供了理论依据,并为其后续在临床辐射防护中的应用奠定了理论基础。
利益冲突 无
作者贡献声明 王瑾瑜负责实验操作、论文撰写;公利鑫负责实验指导;赵哲、张甘负责数据分析;李静怡负责课题设计与论文修改
| [1] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [2] |
Rodemann HP, Blaese MA. Responses of normal cells to ionizing radiation[J]. Semin Radiat Oncol, 2007, 17(2): 81-88. DOI:10.1016/j.semradonc.2006.11.005 |
| [3] |
Abratt RP, Morgan GW, Silvestri G, et al. Pulmonary complications of radiation therapy[J]. Clin Chest Med, 2004, 25(1): 167-177. DOI:10.1016/S0272-5231(03)00126-6 |
| [4] |
Zhang S, Zhang J, Fan X, et al. Ionizing radiation-induced ferroptosis based on nanomaterials[J]. Int J Nanomedicine, 2022, 17: 3497-3507. DOI:10.2147/IJN.S372947 |
| [5] |
Leong XY, Thanikachalam PV, Pandey M, et al. A systematic review of the protective role of swertiamarin in cardiac and metabolic diseases[J]. Biomed Pharmacother, 2016, 84: 1051-1060. DOI:10.1016/j.biopha.2016.10.044 |
| [6] |
Wei Y, Gong Y, Wei S, et al. Protection of the hematopoietic system against radiation-induced damage: drugs, mechanisms, and developments[J]. Arch Pharm Res, 2022, 45(8): 558-571. DOI:10.1007/s12272-022-01400-7 |
| [7] |
Straub JM, New J, Hamilton CD, et al. Radiation-induced fibrosis: mechanisms and implications for therapy[J]. J Cancer Res Clin Oncol, 2015, 141(11): 1985-1994. DOI:10.1007/s00432-015-1974-6 |
| [8] |
Forrester SJ, Kikuchi DS, Hernandes M S, et al. Reactive oxygen species in metabolic and inflammatory signaling[J]. Circ Res, 2018, 122(6): 877-902. DOI:10.1161/CIRCRESAHA.117.311401 |
| [9] |
Li X, Zhuang X, Qiao T. Role of ferroptosis in the process of acute radiation-induced lung injury in mice[J]. Biochem Biophys Res Commun, 2019, 519(2): 240-245. DOI:10.1016/j.bbrc.2019.08.165 |
| [10] |
Jiao Y, Cao F, Liu H. Radiation-induced cell death and its mechanisms[J]. Health Phys, 2022, 123(5): 376-386. DOI:10.1097/HP.0000000000001601 |
| [11] |
Chen PH, Tseng WH, Chi JT. The intersection of DNA damage response and ferroptosis-A rationale for combination therapeutics[J]. Biology (Basel), 2020, 9(8): 187. DOI:10.3390/biology9080187 |
| [12] |
Miao Y, Chen Y, Xue F, et al. Contribution of ferroptosis and GPX4′s dual functions to osteoarthritis progression[J]. EBioMedicine, 2022, 76: 103847. DOI:10.1016/j.ebiom.2022.103847 |
| [13] |
Su LJ, Zhang JH, Gomez H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxid Med Cell Longev, 2019, 2019: 5080843. DOI:10.1155/2019/5080843 |
| [14] |
Zeng X, L iJ, Yang F, et al. The effect of narcotics on ferroptosis-related molecular mechanisms and signalling pathways[J]. Front Pharmacol, 2022, 13: 1020447. DOI:10.3389/fphar.2022.1020447 |
| [15] |
Lierova A, Jelicova M, Nemcova M, et al. Cytokines and radiation-induced pulmonary injuries[J]. J Radiat Res, 2018, 59(6): 709-753. DOI:10.1093/jrr/rry067 |
| [16] |
Hou G, Li J, Liu W, et al. Mesenchymal stem cells in radiation-induced lung injury: from mechanisms to therapeutic potential[J]. Front Cell Dev Biol, 2022, 10: 1100305. DOI:10.3389/fcell.2022.1100305 |
 2024, Vol. 44
2024, Vol. 44


