2. 湖北省疾病预防控制中心传染病防治所急性传染病预防控制部,武汉 430079
2. Department of Acute Infectious Disease Prevention and Control, Institute of Infectious Disease Control and Prevention, Hubei Center for Disease Control and Prevention, Wuhan 430079, China
放射性或核紧急情况可能会导致数十人或者上百人的大规模伤亡,目前能实现短时间内简易分辨照射剂量的工具仍缺乏[1-2]。染色体畸变分析和微核分析是个体剂量评估最有效的生物模拟技术,但需耗费大量的人力、物力和时间[3],这使得在紧急情况下对人群进行辐射的评估和干预变得困难。因此,急需一种工具,可以从事故场景中快速、高效诊断未受影响或受照射剂量可控病例,以及需要紧急干预的辐射病例。辐射脂质组学是一种研究辐射诱导反应的脂质代谢反应新方法,可以在短时间内高通量地检测脂质分子的变化[4-5],从而全面了解辐射对脂质代谢的影响。近年来在动物研究领域取得了许多新的发现和进展[6-7],辐射标志物的新成果为研究辐射动物模型奠定了坚实的基础,并为非人灵长类动物或人类模型的研究提供了更多的可能性。本研究在前期已经建立的动物辐射诱导潜力标志物和剂量估算模型基础上,探索以全身照射的白血病病例血液样本开展生物模拟,筛选辐射扰动的脂质标志物。
机器学习(machine learning, ML)是一门多领域交叉学科[8],位于人工智能(artificial intelligence, AI)的核心,通过大数据计算和模拟学习行为,获取新信息,不断训练和完善已有的成果。目前机器学习用于辐射领域的研究主要为肿瘤放射治疗的影像学和预后的研究[9-10]。本研究通过高通量辐射响应脂质代谢物与机器学习算法相结合,探索辐射剂量分类模型的建立和验证,有助于更好地应对辐射事故,并为应急响应提供数据支持。
材料与方法 1、研究对象2023年3—9月北京市某综合医院25例准备接受骨髓移植的白血病病例,收集病例接受0、4、8和12 Gy 60Co γ射线全身照射前后的血液样本。3例病例分别在0、4和12 Gy各缺失1份样本,累计收集到97份血液样本。其中,对照组为放射治疗前24份0 Gy血液样本,辐射组包括73份接受照射的样本(4、8和12 Gy剂量下分别为24、25和24份)。研究对象纳入标准为年龄>18岁,准备接受骨髓移植的确诊白血病病例,无其他纳入排除标准。本研究通过中国疾病预防控制中心辐射防护与核安全医学所伦理委员会批准(审批号:[2023]-1),所有参与者在纳入研究前均签署知情同意书。
2、血浆制备样本采集后转运至实验室,离心分离血浆,分装冻存于-80℃。检测前血浆样品于4℃解冻,提取100 μl血浆至1.5 ml离心管,加入300 μl异丙醇∶乙腈=1∶1。离心半径6 cm,12 000 r/min离心10 min,加入20 μl内标,待检测。
3、超高效液相色谱-质谱分析(ultra-high performance liquid chromatography mass spectrometry, UPLC-MS)ACQUITY® UPLC I-CLASS系统(美国沃特世公司生产)和XEVO® TQ-S Micro三重四极杆串联质谱仪(美国沃特世公司生产)以正离子和负离子分离模式洗脱。脂质在2.1 × 100 mm,1.7 μm BEH C8色谱柱上,毛细管电压为3.0 kV。正离子流动相A为乙腈∶水=6 ∶4和5 mmol/L甲酸铵+0.1%甲酸;流动相B为异丙醇∶乙腈=9 ∶1和5 mmol/L甲酸铵+0.1%甲酸。负离子流动相A为乙腈∶水=1 ∶9和1 mmol/L乙酸铵+0.04%乙酸,流动相B为异丙醇∶乙腈=1 ∶1,洗脱流速为0.3 ml/min,温度为55℃。
4、数据处理和统计学分析通过Skyline 19.1软件将原始数据进行校准峰值、变量积分和数据归一化,使用多反应监测(multiple reaction monitoring, MRM)转换来量化脂质。Simca 14.1软件开展正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA),根据变量投影重要度(variable importance in projection, VIP)>1、P<0.05来筛选对照组和辐射组组间辐射响应有统计学意义的脂质。通过拟合0、4、8、12 Gy这4个剂量组脂质浓度与辐射剂量线性模型,根据R2值>0.9来筛选辐射诱导剂量响应脂质。
5、机器学习建模和验证对照组和辐射组组间辐射响应有统计学意义的脂质作为变量。将对照组和辐射组97份样本均纳入数据集,用简单随机抽样方法抽取80%作为训练集,剩下20%作为验证集,训练集和验证集样本无重叠。使用R 4.3.2软件,调用机器学习数据包运行函数。分别采样决策树(dicision tree, DT)、支持向量机(support vector machine, SVM)、轻量梯度增强机(light gradient boosting machine, Light GBM)、随机森林(random forest, RF)、K最邻近(K-nearest neighbors, KNN)这5种机器学习方法,识别独立的特征因子并拟合曲线,建立分类预测模型。为确保稳健性,本研究用不同的交叉验证种子重复了20次优化过程。一旦训练完成固定训练模型,然后使用验证集数据开展模型验证和指标评价。根据灵敏度、特异度、准确度、精准度、召回率和F1值来评价训练集建立的模型和验证集验证模型的性能。F1=2 ×(精准度×召回率)/(精准度+召回率),取值范围是0到1,越接近1,模型性能越好。受试者工作特征(receiver operating characteristic, ROC)曲线计算曲线下面积(area under the curve, AUC),AUC范围在0.5和1之间,越接近1模型分辨性能越高。
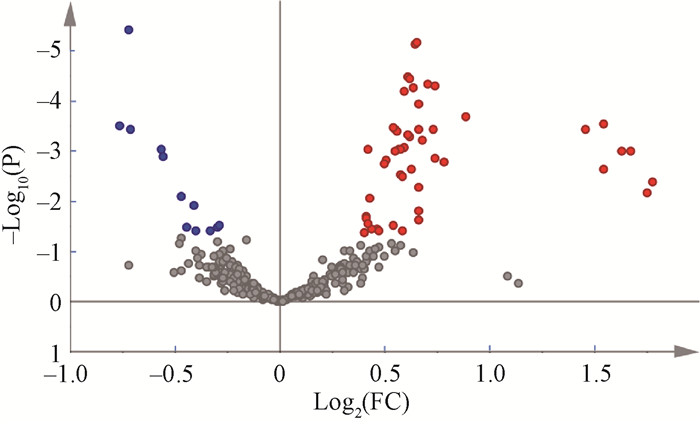
结果 1、辐射诱导脂质代谢物本研究通过高特异性和高灵敏度的超高效液相色谱质谱分析方法,建立了人体辐射效应脂质数据库。采用监督模型偏最小二乘法判别分析,辐射组与对照组相比,62个脂质代谢物差异有统计学意义(t=-4.91~4.74,P<0.05)。其中全身照射后浓度显著上升的脂质代谢物50个,包括:38个鞘磷脂(sphingomyelin, SM), 7个胆固醇酯(cholesteryl ester, CE), 2个神经酰胺(ceramide, Cer), 2个磷脂酰肌醇(phosphatidylinositol, PI), 1个己糖神经酰胺(hexosylceramide, HexCer);浓度显著下降的脂质代谢物12个,包括:5个溶血磷脂酰胆碱(lysophosphatidylcholine, LysoPC),3个醚磷脂酰胆碱(alkyl ether phosphatidylcholine, PCO), 1个Cer, 1个磷脂酰乙醇胺(phosphatidylethanolamine, PE), 1个PI, 1个溶血磷脂酰乙醇胺(lysophosphatidylethanolamine, LysoPE),见图 1。7个CE变化倍数(fold change, FC)>2,提示辐射后有显著变化,具有分辨样本是否受到照射的能力,具备成为辐射诱导分类标志物潜力。分别为CE 18 ∶1、CE 18 ∶2、CE 18 ∶3、CE 20 ∶3、CE 20 ∶4、CE 20 ∶5和CE 22 ∶6。
|
注:火山图显示与对照组相比,辐射引起的脂质差异;P < 0.05,即-Log10(P) > 1.31表示差异具有统计学意义;Log2(FC)为变化倍数(FC)取以2为底的对数;Log2(FC)> 0的脂质为红色,表示上调;Log2(FC) < 0的脂质为蓝色,表示下调;差异无统计学意义的脂质为灰色 图 1 对照组与辐射组426个血浆脂质代谢物火山图 Figure 1 Volcano plot of 426 plasma lipid metabolites in the control and radiation groups |
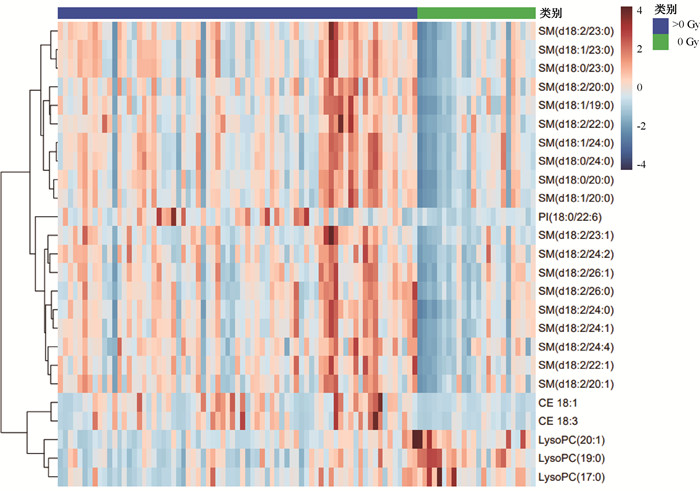
进一步采用热力图分析对照组与辐射组间变化程度最大的脂质差异代谢物,主要为:CE 22 ∶6(3.37倍),CE 20 ∶3(3.34倍),CE 18 ∶2(3.18倍),CE 20 ∶4(3.09倍),CE 18 ∶1(2.91倍),CE 20 ∶5(2.91倍),CE 18 ∶3(2.74倍),LysoPC (20 ∶0)(0.68倍),LysoPC (19 ∶0)(0.61倍),LysoPC (20 ∶1)(0.59倍)。图 2热力图分析,显示对照组与辐射组间差异最显著的25个脂质代谢物中SM占比为76%(19/25),其他6个脂质分别为3个LysoPCs,2个CEs和1个PI。其中辐射诱导后出现上调的脂质为19个SMs, PI(18 ∶0/22 ∶6), CE 18 ∶1, CE 18 ∶3;照射后出现下调的脂质3个,为LysoPC(20 ∶1), LysoPC(19 ∶0), LysoPC(17 ∶0)。其中,热力图中筛选出的辐射响应脂质均包含于火山图分析中筛选出的差异脂质。
|
注:SM.鞘磷脂;PI.磷脂酰肌醇;CE.胆固醇酯;LysoPC.溶血磷脂酰胆碱。横坐标为纳入研究的97个样本,纵坐标为明显扰动的脂质代谢物。一种脂质代谢物在热力图上占据一行,通过颜色深浅来表示该脂质代谢物在不同样品中的表达水平。红色代表上调,蓝色代表下调,颜色越深表示脂质代谢物表达量越高 图 2 97份样本中对照组与辐射组差异最显著的前25个脂质代谢物 Figure 2 Top 25 lipid metabolites with the most significant differences between the control and radiation groups in 97 samples |
2、辐射诱导剂量反应响应脂质
从辐射组与对照组中筛选的62个差异有统计学意义的脂质中,开展进一步剂量响应脂质筛选。共计20个脂质响应曲线R2值>0.9,包括11个SM ∶SM (d18 ∶0/17 ∶0), SM (d18 ∶0/18 ∶0), SM (d18 ∶1/18 ∶0), SM (d18 ∶1/19 ∶0), SM (d18 ∶1/20 ∶0), SM (d18 ∶2/20 ∶0), SM (d18 ∶2/22 ∶1), SM (d18 ∶2/23 ∶1), SM (d18 ∶2/24 ∶0), SM (d18 ∶ 2/26 ∶0) 和SM (d18 ∶2/26 ∶1),7个CE: CE 18 ∶ 1, CE 18 ∶2, CE 18 ∶3, CE 20 ∶3, CE 20 ∶4, CE 20 ∶5, CE 22 ∶6, 1个Cer (d18 ∶2/18 ∶0) 和1个PI (18 ∶2/18 ∶2)。在0~12 Gy的剂量范围内,从4个剂量点样本不同的脂质代谢物中筛选出20种具有良好剂量反应的脂质代谢物。大多数脂质在12 Gy时变化最明显,这也验证了辐射剂量组在更高剂量时可以更好地分离和鉴定。随着剂量的增加,19种脂质代谢物的浓度显著增加,而PI(18 ∶2/18 ∶2)的浓度显著下降。为了更直观地展示这些脂质的变化模式,图 3中选取了其中的4种具有代表性的脂质代谢物进行了图形展示。这20种脂质既可用作人体急性辐照后的分类标记,也可用于区分不同辐射剂量组的标记。

|
注:PI.磷脂酰肌醇;Cer.神经酰胺;SM.鞘磷脂;CE.胆固醇酯 图 3 20个辐射响应的剂量响应脂质代谢物中的4个脂质(x ± s) A. PI (18 ∶2/18 ∶2);B. Cer (d18 ∶2/18 ∶0);C. SM (d18 ∶0/17 ∶0);D. CE 20 ∶5 Figure 3 Four dose-responsive lipids from 20 radiation-responsive lipid metabolites (x ± s) A. PI (18 ∶2/18 ∶2); B. Cer (d18 ∶2/18 ∶0); C. SM (d18 ∶0/1770); D. CE 20 ∶5 |
3、机器学习建模和评价
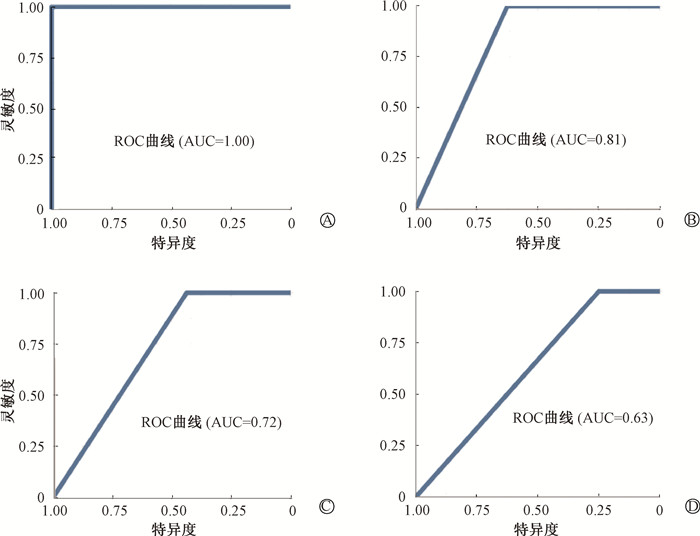
通过辐射组与对照组筛选出的62个差异脂质代谢物作为建立模型的研究变量,分别调用5种机器学习方法。训练模型和模型验证得到以下参数(表 1),除KNN模型验证集灵敏度为0.90以外,其他4个模型的训练集和验证集以及KNN模型的训练集灵敏度均为1.00。特异度只有KNN和随机森林模型训练集模型达到1.00,其他模型均低于0.50。5个模型训练集的准确度和精准度指标均高于0.80,但是验证集出现下降。KNN模型验证集召回率为0.9,其他5个模型均处于高召回率状态。综合评价指标F1值显示,支持向量机、决策树、Light GBM模型训练性能较好,但是验证集的F1值在0.7~0.8之间,而KNN的验证集F1值低于0.7,效果不理想。5种机器学习中模型训练和验证效果最好的模型为随机森林,训练集F1值达到最佳性能1.00,验证集F1值为0.80。图 4中随机森林和支持向量机ROC曲线显示,随机森林在训练集中AUC为1.00,模型验证AUC为0.81,均显示出优秀的建模能力和良好的分辨能力。支持向量机模型训练和验证AUC分别为0.72和0.63,表明模型建立可以达到中等性能,而分辨能力不够好。随机森林模型在辐射分类判定中的表现,证明了其在处理复杂、高维度数据时的优良性能。
|
|
表 1 5种机器学习模型训练集和验证集评价指标 Table 1 Evaluation metrics for the training and validation sets of five machine learning-based models |
|
注:AUC. 曲线下面积;ROC. 受试者工作特征曲线 图 4 随机森林和支持向量机模型训练和模型验证ROC曲线 A.随机森林模型训练;B.随机森林模型验证;C.支持向量机模型训练;D.支持向量机模型验证 Figure 4 ROC curves of the training and validation of the random forest and support vector machine-based models A. Training of the RF-based model; B. Validation of the RF-based model; C. Training of the SVM-based model; D. Validation of the SVM-based model |
讨论
辐射脂质组学可以用于短时间高通量检测辐射诱导的脂质代谢反应。本课题组之前的研究表明,在大鼠模型的血浆样本和肠组织中筛选出脂肪酸FA、SM、Cer、LysoPC、磷脂酰胆碱(Phosphatidylcholine, PC)、PC-O、醚磷脂酰乙醇胺(Alkyl ether Phosphatidylethanolamine, PE-O)、甘油三酯(Triacylglyceride, TG)等辐射后具有良好反应的脂质代谢物[11-13],具备成为辐射敏感标志物的潜质。Li等[14]在人组织中开展辐射研究,发现6种TG对辐射诱导效应明显。Unger等[15]分析了11例食管癌放疗病例血浆样本,发现SM、PI、LysoPE、LysoPC、PC、FA等脂质放疗后出现显著变化。本研究在人类样本中开展高通量脂质筛选,血浆中受到辐射扰动的脂质代谢物主要为SM、CE、LysoPC、Cer、PI、HexCer、PCO、PE、LysoPE。差异最显著的25个脂质代谢物中SM占比为76%。同时,在0~12 Gy的剂量范围内,从4个剂量点样本不同的脂质代谢物中筛选出SM、CE、Cer、PI等20种具有良好剂量反应的脂质代谢物,其中含11个SM。鞘磷脂在动物和人类样本中均表现出辐射诱导显著的效应。鞘磷脂在细胞膜的鞘磷脂代谢过程中发挥着关键作用,能够增加膜流动性、影响膜成分和功能。此外,鞘磷脂还参与了细胞内的信号转导过程,因此推测辐射可以通过破坏鞘磷脂代谢来影响细胞膜的稳定性及功能,同时影响信号转导过程,进一步导致辐射损伤。
当前放射领域的剂量估算模型建立主要基于logistic回归方法[11-12],但模型的验证和评价探索研究却显不足。机器学习模型在各个领域都有广泛的应用,包括线性回归、决策树、随机森林、支持向量机和朴素贝叶斯等模型。本研究通过前期筛选的辐射敏感脂质,探索建立人类样本急性电离辐射快速分类的评价模型的新思路。经过多个机器模型的评价,随机森林模型的灵敏度和准确度等各项评价指标,以及训练集和验证集ROC曲线均显示出明显的优势,但存在验证集特异度较低的问题。随机森林具有预测精度高和泛化能力强的特点,同时在特征选择和缺失值处理方面相对稳健,适合于人类复杂背景的样本分析[8]。机器学习模型的训练和优化需要大量的数据和计算资源,样本量的不足也会造成训练不足,对预测结果产生一定的偏差。本研究初步验证了辐射组学技术与机器学习算法模型联合应用的可行性,下一步将收集多中心、大样本量来训练模型,优化参数和结构,提升剂量估算模型的准确性和可靠性。因医学伦理学的要求,健康人群无法进行全身照射实验,全身照射治疗的病人被视为最接近实际的最佳辐射生物模拟模型。放疗后脂质代谢物的变化揭示生物体对辐射的微妙反应,本研究发现了有潜力的辐射相关生物标志物,并探索了剂量响应趋势。
本研究表明,机器学习和脂质组学联合建立的预测模型,是未来开发应对短时间内大量个体中高通量、人工智能的快速分类鉴定工具的新思路。目前的模型可能还不够成熟和完善,但它提供了一个理论框架和工具,帮助我们更好地探索和优化辐射剂量估算模型研究。随着人工智能的出现和机器学习等技术的不断发展[16],辐射脂质组学结合机器学习模型研究,提示脂质组学在识别早期辐射风险、估算辐射照射剂量和开发精准辐射医疗等方面具有广阔的发展前景。
利益冲突 无
作者贡献声明 陈琦负责实验操作和论文撰写;赵骅、蔡恬静、高义哲协助数据处理和技术指导;高玲、刘青杰负责课题设计和论文修改
| [1] |
Li S, Lu X, Feng JB, et al. Developing gender-specific gene expression biodosimetry using a panel of radiation-responsive genes for determining radiation dose in human peripheral blood[J]. Radiat Res, 2019, 192(4): 399-409. DOI:10.1667/RR15355.1 |
| [2] |
Sun JL, Li S, Lu X, et al. Identification of the differentially expressed protein biomarkers in rat blood plasma in response to gamma irradiation[J]. Int J Radiat Biol, 2020, 96(6): 748-758. DOI:10.1080/09553002.2020.1739775 |
| [3] |
Swartz HM, Williams BB, Flood AB. Overview of the principles and practice of biodosimetry[J]. Radiat Environ Biophys, 2014, 53(2): 221-232. DOI:10.1007/s00411-014-0522-0 |
| [4] |
Karahalil B. Overview of systems biology and omics technologies[J]. Curr Med Chem, 2016, 23(37): 4221-4230. DOI:10.2174/0929867323666160926150617 |
| [5] |
Yan J, Risacher SL, Shen L, et al. Network approaches to systems biology analysis of complex disease: integrative methods for multi-omics data[J]. Brief Bioinform, 2018, 19(6): 1370-1381. DOI:10.1093/bib/bbx066 |
| [6] |
赵骅, 习聪, 田雪蕾, 等. 全身照射后大鼠血浆代谢特征分析[J]. 中华放射医学与防护杂志, 2021, 41(6): 401-406. Zhao H, Xi C, Tian XL, et al. Analysis of the metabolic characteristics in rat plasma after total body irradiation[J]. Chin J Radiol Med Prot, 2021, 41(6): 401-406. DOI:10.3760/cma.j.issn.0254-5098.2021.06.001 |
| [7] |
田雪蕾, 刘海翔, 陆雪, 等. 环状RNA hsa_circZDHHC21_004对60Co γ射线照射后人小肠上皮细胞HIEC-6增殖能力的影响[J]. 中华放射医学与防护杂志, 2023, 43(5): 321-327. Tian XL, Liu HX, Lu X, et al. Effect of circular RNA hsa_circZDHHC21_004 on the proliferation of the human small intestinal epithelial cells HIEC-6 exposed to 60Co γ-rays[J]. Chin J Radiol Med Prot, 2023, 43(5): 321-327. DOI:10.3760/cma.j.cn112271-20230104-00002 |
| [8] |
Haug CJ, Drazen JM. Artificial intelligence and machine learning in clinical medicine, 2023[J]. N Engl J Med, 2023, 388(13): 1201-1208. DOI:10.1056/NEJMra2302038 |
| [9] |
Cheng J, Pan Y, Huang W, et al. Differentiation between immune checkpoint inhibitor-related and radiation pneumonitis in lung cancer by CT radiomics and machine learning[J]. Med Phys, 2022, 49(3): 1547-1558. DOI:10.1002/mp.15451 |
| [10] |
Qin Q, Huang B, Wu A, et al. Chinese radiation intestinal injury research group. development and validation of a post-radiotherapy prediction model for bowel dysfunction after rectal cancer resection[J]. Gastroenterology, 2023, 165(6): 1430-1442.e14. DOI:10.1053/j.gastro.2023.08.022 |
| [11] |
Zhao H, Xi C, Tian M, et al. Identification of potential radiation responsive metabolic biomarkers in plasma of rats exposed to different doses of cobalt-60 gamma rays[J]. Dose Response, 2020, 18(4): 1559325820979570. DOI:10.1177/1559325820979570 |
| [12] |
Xi C, Zhao H, Lu X, et al. Screening of lipids for early triage and dose estimation after acute radiation exposure in rat plasma based on targeted lipidomics analysis[J]. J Proteome Res, 2021, 20(1): 576-590. DOI:10.1021/acs.jproteome.0c00560 |
| [13] |
Liu HX, Lu X, Zhao H, et al. Enhancement of acylcarnitine levels in small intestine of abdominal irradiation rats might relate to fatty acid β-oxidation pathway disequilibration[J]. Dose Response, 2022, 20(1): 15593258221075118. DOI:10.1177/15593258221075118 |
| [14] |
Li W, Wang T, Zhang X, et al. Distinct lipid profiles of radiation-induced carotid plaques from atherosclerotic carotid plaques revealed by UPLC-QTOF-MS and DESI-MSI[J]. Radiother Oncol, 2022, 167: 25-33. DOI:10.1016/j.radonc.2021.12.006 |
| [15] |
Unger K, Li Y, Yeh C, et al. Plasma metabolite biomarkers predictive of radiation induced cardiotoxicity[J]. Radiother Oncol, 2020, 152: 133-145. DOI:10.1016/j.radonc.2020.04.018 |
| [16] |
Hosny A, Parmar C, Quackenbush J, et al. Artificial intelligence in radiology[J]. Nat Rev Cancer, 2018, 18(8): 500-510. DOI:10.1038/s41568-018-0016-5 |
 2024, Vol. 44
2024, Vol. 44


