正电子发射断层扫描与X射线计算机断层成像设备(positron emission tomography/X-ray computed tomography,PET/CT)在疾病诊断分期与疗效监测评估等方面发挥重要作用,根据PET探测器中光电转换器,一些文献将使用传统光电倍增管(photomultiplier tube, PMT)的PET/CT称为模拟PET/CT或传统PET/CT,将使用硅光电倍增管(silicon photomultiplier, SiPM)的PET/CT称为数字或新一代PET/CT[1]。本研究将上述两种PET/CT分别称为PMT PET/CT和SiPM PET/CT。
SiPM由单光子雪崩二极管阵列组成,与PMT相比,SiPM具有高收益、低噪声、工作所需偏置电压低等优势,磁场不敏感特性使其适用于PET/MRI,出色的单光子时间分辨力与光子探测效率使SiPM成为目前最适合TOF-PET的器件之一[2-3]。
空间分辨力是表征PET性能的重要指标之一,PET图像质量与定量精度是临床诊断中密切关注的问题。与PMT PET相比,新一代SiPM PET空间分辨力、定量精度和图像质量等得到提升[4-5]。已有较多研究使用NEMA NU2标准对PMT PET和SiPM PET进行对比[6-8],但NEMA NU2标准中图像质量评价指标较为单一,空间分辨力测量条件较为理想。Q.Clear算法对图像质量的影响已有较多研究[9-11],但空间分辨力方面研究较少,尤其是轴向空间分辨力。本研究使用额外的图像质量和定量精度评价指标,以及模拟临床成像条件的椭圆分辨力模体,利用PMT PET/CT与SiPM PET/CT进行成像,并对不同β值对Q.Clear算法重建结果的影响进行初步探索,体现SiPM PET较PMT PET在空间分辨力、定量精度及图像质量等方面的优势。
材料与方法 1、PET/CT设备使用美国GE公司Discovery Elite(Elite)型PET/CT(PMT PET/CT)与美国GE公司Discovery Meaningful Insights(MI)[2]型PET/CT(SiPM PET/CT)进行模体图像采集与重建。Elite和MI闪烁晶体材料均为硅酸钇镥(lutetium-yttrium oxyorthosilicate, LYSO)。Elite探测单元由54个(9 × 6)LYSO与含有4个阳极的方形PMT耦合构成,MI探测单元由36个(4 × 9)LYSO与18个(3 × 6)SiPM耦合构成[6, 12]。
2、模体采用椭圆分辨力模体(Toshiba)和NEMA NU2-2018图像质量(image quality, IQ)模体评估两台PET/CT空间分辨力和定量精度与图像质量。分辨力模体长16 cm,长轴内径34 cm,短轴内径21.5 cm,内含10条内径为1 mm的线源[13]。在模体长轴一侧,自中心向外周分布有5条平行于模体中心轴的线源,分别距模体中心0、4、8、12、16 cm,相邻线源间距为4 cm。剩余线源分布在模体短轴和其他方向。因模体长轴线源分布最多且最具代表性,故仅分析模体长轴5条线源[13]。分辨力模体测量PET空间分辨力的可行性已在先前研究得到验证[13]。IQ模体与散射模体的几何结构详见NEMA NU2-2018[14]。
3、放射性药物与模体灌注放射性药物为中国医学科学院肿瘤医院院内加速器自制18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)。分辨力模体背景中灌注无放射性的水模拟人体散射,线源中灌注18F-FDG溶液。对于Elite和MI,在扫描开始时刻分辨力模体线源活度分别为217.93和185.00 MBq,该剂量水平测量PET空间分辨力的可行性已在先前研究中得到验证[13]。IQ模体背景与小球内灌注18F-FDG溶液,在扫描开始时刻,对于Elite和MI,小球活度浓度分别为20.91和21.28 kBq/ml(模拟人体显像:体重70 kg,注射370 MBq 18F-FDG),背景活度浓度分别为5.23和5.36 kBq/ml,散射模体线源活度分别为117.41和115.63 MBq。
4、图像采集与重建分辨力模体定位于PET探测环中心,使用两种摆放方式采集:模体柱体轴与PET轴向方向平行以测量横断面空间分辨力,柱体轴与PET轴向方向垂直以测量轴向空间分辨力。IQ模体定位于PET探测环中心,散射模体与IQ模体相接。模体在扫描开始前均已充分摇匀。对分辨力模体和IQ模体分别进行单床位与两床位扫描,扫描方法一致。模拟临床成像流程,依次进行定位像、CT衰减校正与PET扫描。CT扫描管电压120 kV,管电流150 mA,螺距0.984;PET数据使用6 min每床位3D列表模式采集,床位重叠7层。图像采集开始前设备均完成PET与CT日常质控,工作状态均为正常。
对于Elite和MI的采集数据使用OSEM+PSF+TOF(VPFX-S)重建,迭代次数为2。采用滤波核为4 mm的高斯后滤波。重建矩阵256 × 256,重建视野直径分别为70和50 cm,重建后PET体素大小分别为2.73 mm × 2.73 mm × 3.27 mm和1.95 mm × 1.95 mm × 2.79 mm。受设备参数选择范围限制,Elite和MI子集数分别为24和17。
为研究Q.Clear算法中β值对空间分辨力、定量精度和图像质量的影响,MI采集的模体数据额外使用Q.Clear算法重建,β取值范围150~550,间隔100。IQ模体重建矩阵256 × 256。为保证分辨力模体经Q.Clear重建后断层图像中的线源能覆盖足够像素以完成高斯拟合,选用386 × 386矩阵获得更小像素尺寸,重建后PET体素大小为1.30 mm × 1.30 mm × 2.79 mm。在临床工作中β值默认为350,在进行两台PET/CT性能对比时,使用Elite VPFX-S、MI VPFX-S和Q.Clear(β=350)进行比较。
5、数据处理(1) 椭圆分辨力模体:选取3层在分辨力模体柱体轴与PET轴向方向平行时采集的横断面图像,提取线源径向和切向剖线数据。选取3层在分辨力模体柱体轴与PET轴向方向垂直时采集的冠状面图像,提取线源轴向剖线数据。通过Matlab对剖线数据进行高斯拟合,计算拟合后函数半高宽(full width at half maximum, FWHM)。FWHMx,FWHMy和FWHMz分别表示径向、切向和轴向空间分辨力。
(2) IQ模体:小球ROIH与背景ROIB的勾画参照NEMA NU2-2018[14]。选取肺插件中心层及上下15层,在肺插件中心位置勾画直径为(30±2)mm的ROIL。ROIH与ROIL的勾画与数据提取通过GE Xeleris 3.0工作站中Volumetrix MI完成,ROIB的勾画与数据提取使用Matlab完成。
6、评价指标(1) 恢复系数:恢复系数(recovery coefficient,RC)能够直观描述部分容积效应(partial volume effect,PVE)严重程度,对于热灶RC理想值为1。小球RC按照公式(1)~(2)计算:
| $ R C_{\max , j}=\frac{C_{\mathrm{H} \text { max }, j}}{a_{\mathrm{H}}} $ | (1) |
| $ R C_{\text {mean }, j}=\frac{C_{\mathrm{H}, j}}{a_{\mathrm{H}}} $ | (2) |
式中,j为小球直径,j=37、28、22、17、13、10 mm;RCmax, j和RCmean, j分别为直径为j的小球最大恢复系数和平均恢复系数;CHmax, j和CH, j分别为直径为j的ROIH内所有像素值的最大值和平均值,Bq/ml。
(2) NEMA NU2-2018图像质量指标:按照NEMA NU2-2018[14]计算小球对比度恢复系数(contrast recovery ratio,CRC)、背景变异百分比(percent background variability,PBV)和肺插件残余误差(residual error,RE)。
(3) 背景变异系数:背景变异系数(background coefficient of variation,BCV)描述了ROIB内像素间变异水平,按照公式(3)计算[10]:
| $ B C V_j=\frac{1}{k} \sum\limits_{k=1}^k \frac{S D_{\text {inner }, j, k}}{C_{\mathrm{B}, j, k}} \times 100 \% $ | (3) |
式中,CB, j, k为所有直径为j的ROIB内所有像素值平均值,Bq/ml;k为背景中直径为j的ROIB的数量,k=60;SDinner, j, k为背景中直径为j的ROIB内像素值标准差。PBV描述了ROI间变异水平,与BCV从不同角度描述图像背景噪声。
(4) 对比噪声比:对比噪声比(contrast-to-noise ratio,CNR)与设备探测能力密切相关,根据Rose准则,当目标物CNR>5时才可被探测到[15]。小球CNR按照公式(4)计算[16]:
| $ C N R_j=\frac{1}{12} \sum\limits_{k=1}^{12} \frac{C_{\mathrm{H}, j}-C_{\mathrm{B}, j, k}}{S D_{\text {inner }, j, k}} $ | (4) |
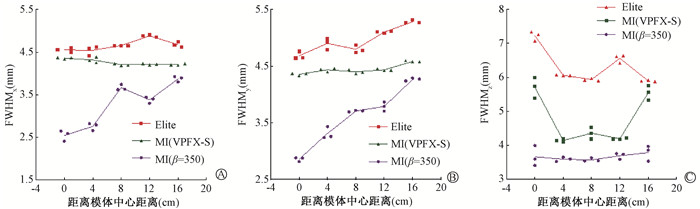
(1) 空间分辨力:FWHM随线源位置的变化如图 1所示。与MI(VPFX-S)相比,在径向、切向和轴向Elite分别提高FWHM平均值4.43% ~ 15.72%、7.53% ~ 15.23%和6.40% ~ 56.60%,MI(β=350)分别降低FWHM平均值6.49% ~ 45.02%、7.80% ~ 35.60%和13.31% ~ 36.80%。
|
注:FWHM.半高宽 图 1 不同位置两台PET/CT空间分辨力测量结果 A. 径向;B. 切向;C. 轴向 Figure 1 Measurements of spatial resolution on two PET/CT scanners at different positions A. Radial; B. Tangential; C. Axial |
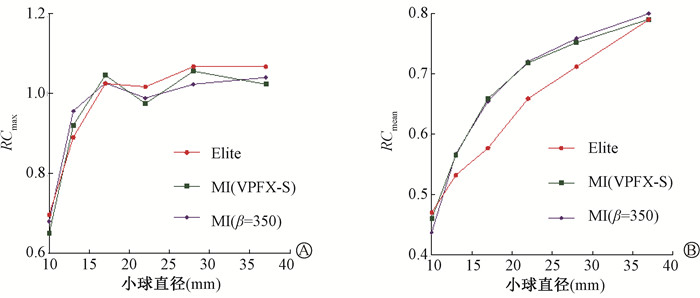
(2) 定量精度与图像质量:RCmax、RCmean随小球直径变化见图 2。小球直径≤17 mm时RCmax随小球直径增加均明显提高;小球直径>17 mm时RCmax变化进入“平台期”,随小球直径增加RCmax均在小范围内波动。RCmean随小球直径增加呈稳定增长趋势。除10 mm小球外,MI(VPFX-S)提高RCmean0.10% ~ 14.13%。CRC随小球直径变化见图 3,均随小球直径增大而增大。
|
注:恢复系数 图 2 两台PET/CT的RC随小球直径变化趋势 A. RCmax;B. RCmean Figure 2 Relationships between RC obtained from two PET/CT scanners and the sphere diameter A. RCmax; B. RCmean |
|
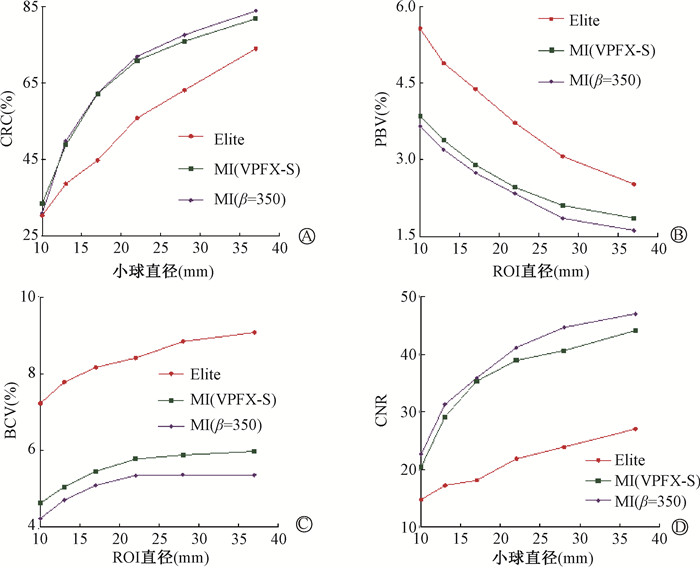
注:CRC.对比度百分比;PBV.背景变异百分比;BCV.背景变异系数;CNR.对比噪声比 图 3 两台PET/CT不同图像质量指标随ROI直径变化趋势 A. CRC;B. PBV;C. BCV;D. CNR Figure 3 Relationships between various image quality metrics obtained from two PET/CT scanners and the ROI diameter A. CRC; B. PBV; C. BCV; D. CNR |
PBV随ROIB直径变化见图 3。MI(VPFX-S)的PBV较Elite降低26.20%~33.82%,Q.Clear的PBV较MI(VPFX-S)降低5.02%~13.05%。BCV随ROIB直径变化见图 3。MI重建得到的BCV均小于Elite。MI(VPFX-S)的BCV较Elite降低31.29%~35.97%,Q.Clear的BCV较MI(VPFX-S)降低6.64%~10.31%。CNR随小球直径变化见图 3。与Elite相比,MI(VPFX-S)提高小球CNR 38.31%~94.95%,Q.Clear的小球CNR较MI(VPFX-S)增加1.66%~10.90%。Q.Clear得到的RE最小。
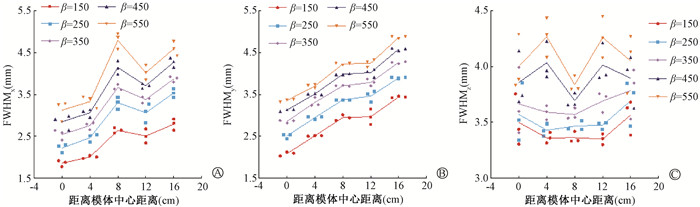
2、β值对Q.Clear算法的影响(1) 空间分辨力:不同β值得到的FWHM随线源位置变化如图 4所示。随着β值增大FWHM增加。径向和切向的FWHM均在模体中心处最小,径向FWHM存在局部的上下浮动。轴向FWHM在距离模体中心4~12 cm处最小。
|
图 4 不同β值得到的不同位置空间分辨力测量结果 A. 径向;B. 切向;C. 轴向 Figure 4 Measurements of spatial resolution at various positions under different β values A. Radial; B. Tangential; C. Axial |
(2) 定量精度与图像质量:不同β值的Q.Clear算法重建得到的恢复系数如图 5所示。RCmax与RCmean随β值增大得到提高。β值为150时所有小球RC均最接近1。β值对图像质量影响如图 6所示。相同直径小球CRC随β值减小而增大。β值对背景噪声的影响较为明显,β值越小,PBV与BCV越高。相同直径小球CNR随β值减小而降低。当小球直径为10 mm时,增大β值提高CNR 8.63%~22.34%。不同β值的RE随图像层数变化趋势相似。相同图像层数的RE随β值增大而增大。
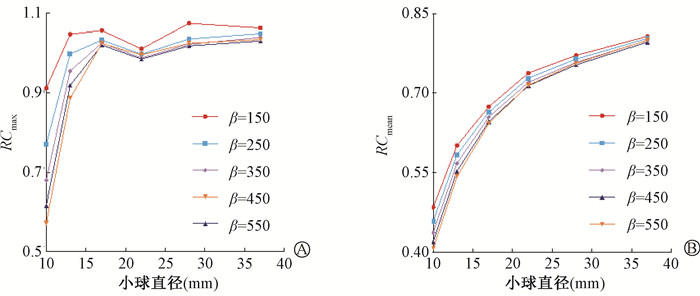
|
RC.恢复系数 图 5 不同β值得到的RC随小球直径变化趋势 A. RCmax;B. RCmean Figure 5 RC under different β values varying with the sphere diameter A. RCmax; B. RCmean |

|
注:CRC.对比度百分比;PBV.背景变异百分比;BCV.背景变异系数;CNR.对比噪声比 图 6 不同β值得到的图像质量指标随ROI直径变化趋势 A. CRC;B. PBV;C. BCV;D. CNR Figure 6 Image quality metrics under different β values varying with the ROI diameter A. CRC; B. PBV; C. BCV; D. CNR |
讨论
PET数字化是对信号进行采样并将探测到的γ光子信息转换为数字信号并输出的过程,对于使用SiPM的光电转换器,若输出信号为数字信号则被称为数字光电转换器,否则被称为模拟光电转换器[17]。由此可见,将使用SiPM作为光电转换器的PET/CT定义为数字PET/CT是不恰当的,但目前国外已有较多研究将使用SiPM的PET/CT统称为数字PET/CT[1, 4-5, 7, 18]。
PET系统性能难以通过某个指标评估。本研究在模拟临床成像条件下,对椭圆分辨力模体和IQ模体成像,利用多个评价指标全面比较了PMT PET/CT(Elite)和SiPM PET/CT(MI)中PET系统的性能,对Q.Clear算法的优势进行初步探索。结果显示,MI表现出更好的空间分辨力、定量精度和图像质量。Q.Clear在图像重建方面更具优势,但改变了空间分辨力的空间分布。β值对最大定量值影响较为明显。
晶体尺寸是影响空间分辨力的主要因素[19-20]。MI晶体横截面积较小,因此MI(VPFX-S)的空间分辨力均小于Elite,但横断面空间分辨力差异不明显,考虑与PSF建模有关[21]。视野边缘的空间分辨力较视野中心差,PSF建模有利于改善此问题,因此OSEM的径向与切向空间分辨力分布更均匀,但局部存在周期性浮动,考虑与线源相对于像素网格的位置有关[21]。已有研究证明TOF技术对PET横断面空间分辨力影响不大,但有助于将事件分配到正确的轴向切片中[22]。Elite与MI晶体厚度相同(25 mm),因此MI TOF分辨力的提高考虑为MI(VPFX-S)轴向空间分辨力改善的原因之一。
Elite与MI得到的RC差距不明显,与Gnesin等[5]对多台不同PET对比的结果相同,考虑因PSF建模降低了不同设备间定量精度差异。小球直径≤17 mm时,RCmax随小球直径增加而增加的趋势较明显,考虑因PVE对小病灶影响较严重;小球直径>17 mm时,RCmax变化进入“平台期”,考虑此时小球直径足够大PVE影响减弱。
MI较好的TOF分辨力降低了图像噪声,空间分辨力的提高使MI(VPFX-S)对比度恢复优于Elite[23]。高对比度和低噪声提高了目标物探测能力,MI(VPFX-S)的所有小球CNR均高于Elite。MI(VPFX-S)较Elite衰减与散射精度更好,不同层面间波动幅度更小,考虑与MI TOF分辨力提高有关。
Q.Clear通过向目标函数中加入惩罚函数,达到图像多次迭代过程中压制图像噪声的目的[24],其空间分辨力在3个方向上均优于OSEM并随β值减小而提高。Q.Clear空间分辨力的空间分布与OSEM相反,横断面空间分辨力分布更为不均,轴向空间分辨力变化较小。目前有关β值对空间分辨力影响的研究数量较少,具体机制有待研究。10 mm小球CNR受β值变化影响最小,除受PVE影响严重外,还与惩罚函数边缘保留特性敏感度降低有关[25]。Q.Clear中惩罚函数在低活度区施加更多平滑改善低活度区背景噪声[24],明显降低RE。10 mm小球RCmax受β值影响较大,使用SUVmax进行定量评估时应对重建所用β值给予重视。综上,β值的选择应在定量精度与图像质量间权衡,或根据不同临床场景或目的确定不同的最佳β值[18, 24]。
本研究局限性如下:为保证重建条件与临床一致,Elite与MI PET/CT使用相同矩阵不同DFOV导致PET像素大小存在差异。像素大小影响PET空间分辨力、定量精度和图像质量[26],对本实验结果是否有影响仍需进一步研究。此外,IQ模体在模拟人体时具有局限性,未来将开发新的模体,进一步模拟真实成像场景,研究不同设备或不同重建算法对空间分辨力及图像质量的影响。
利益冲突 无
作者贡献声明 苏雪松负责设计研究思路、设计研究方案、研究方案可行性、文献调研与整理、处理实验数据并撰写论文;耿建华负责提出研究方向,建立研究基本框架和设计论文框架;王奕斌负责参与并指导实验中PET/CT日常质控与数据采集;王雪鹃、郑容、李静负责参与论文审核及修订
| [1] |
López-Mora DA, Carrió I, Flotats A. Digital PET vs analog PET: clinical implications?[J]. Semin Nucl Med, 2021, 52(3): 302-311. DOI:10.1053/j.clmed.2021.10.004 |
| [2] |
Sonni I, Baratto L, Park S, et al. Initial experience with a SiPM-based PET/CT scanner: influence of acquisition time on image quality[J]. EJNMMI Phys, 2018, 5(1): 9. DOI:10.1186/s40658-018-0207-x |
| [3] |
Lecoq P, Gundacker S. SiPM applications in positron emission tomography: toward ultimate PET time-of-flight resolution[J]. Eur Phys J Plus, 2021, 136(3): 1-16. DOI:10.1140/epjp/s13360-021-01183-8 |
| [4] |
López-Mora DA, Flotats A, Fuentes-Ocampo F, et al. Comparison of image quality and lesion detection between digital and analog PET/CT[J]. Eur J Nucl Med Mol Imaging, 2019, 46(6): 1383-1390. DOI:10.1007/s00259-019-4260-z |
| [5] |
Gnesin S, Kieffer C, Zeimpekis K, et al. Phantom-based image quality assessment of clinical 18F-FDG protocols in digital PET/CT and comparison to conventional PMT-based PET/CT[J]. EJNMMI Phys, 2020, 7(1): 1. DOI:10.1186/s40658-019-0269-4 |
| [6] |
Hsu DFC, Ilan E, Peterson WT, et al. Studies of a next-generation silicon-photomultiplier-based time-of-flight PET/CT system[J]. J Nucl Med Off Publ Soc Nucl Med, 2017, 58(9): 1511-1518. DOI:10.2967/jnumed.117.189514 |
| [7] |
Chicheportiche A, Marciano R, Orevi M. Comparison of NEMA characterizations for Discovery MI and Discovery MI-DR TOF PET/CT systems at different sites and with other commercial PET/CT systems[J]. EJNMMI Phys, 2020, 7(1): 4. DOI:10.1186/s40658-020-0271-x |
| [8] |
Wagatsuma K, Miwa K, Sakata M, et al. Comparison between new-generation SiPM-based and conventional PMT-based TOF-PET/CT[J]. Phys Med, 2017, 42: 203-210. DOI:10.1016/j.ejmp.2017.09.124 |
| [9] |
Naghavi-Behzad M, Vogsen M, Gerke O, et al. Comparison of image quality and quantification parameters between Q.Clear and OSEM reconstruction methods on FDG-PET/CT images in patients with metastatic breast cancer[J]. J Imaging, 2023, 9(3): 65. DOI:10.3390/jimaging9030065 |
| [10] |
Xu L, Cui C, Li R, et al. Phantom and clinical evaluation of the effect of a new Bayesian penalized likelihood reconstruction algorithm (HYPER Iterative) on 68Ga-DOTA-NOC PET/CT image quality[J]. EJNMMI Res, 2022, 12(1): 73. DOI:10.1186/s13550-022-00945-4 |
| [11] |
Wu Z, Guo B, Huang B, et al. Does the beta regularization parameter of bayesian penalized likelihood reconstruction always affect the quantification accuracy and image quality of positron emission tomography computed tomography?[J]. J Appl Clin Med Phys, 2021, 22(3): 224-233. DOI:10.1002/acm2.13129 |
| [12] |
Bettinardi V, Presotto L, Rapisarda E, et al. Physical performance of the new hybrid PET∕CT Discovery-690[J]. Med Phys, 2011, 38(10): 5394-5411. DOI:10.1118/1.3635220 |
| [13] |
骆飞. SPECT断层图像分辨力及其影响因素的研究[D]. 北京: 北京协和医学院, 2014. Luo F. Spatial resolution and its influence factors on single-photon emission computed tomography[D]. Beijing: Peking Union Medical College, 2014. |
| [14] |
National Electrical Manufacturers Association. Performance measurements of positron emission tomography (PET): NEMA NU2-2018[S]. Rosslyn: NEMA, 2018.
|
| [15] |
Cherry SR, Sorenson JA, Phelps ME. Physics in nuclear medicine[M]. Boca Raton: Elsevier Health Sciences, 2012.
|
| [16] |
Moretti TJ, Leon SM, Schaeffer CJ, et al. Characterization of time of flight and resolution modeling on image quality in positron emission tomography[J]. J Appl Clin Med Phys, 2022, 23(10): e13751. DOI:10.1002/acm2.13751 |
| [17] |
国家药品监督管理局. YY/T 1878-2023正电子发射断层成像装置数字化技术要求[S]. 北京: 中国标准出版社, 2023. National Medical Products Administration. YY/T 1878-2023 Technical requirements for digitization of positron emission tomography device[S]. Beijing: Standards Press of China, 2023. |
| [18] |
Lindstr m E, Sundin A, Trampal C, et al. Evaluation of penalized-likelihood estimation reconstruction on a digital time-of-flight PET/CT scanner for 18F-FDG whole-body examinations[J]. J Nucl Med Off Publ Soc Nucl Med, 2018, 59(7): 1152-1158. DOI:10.2967/jnumed.117.200790 |
| [19] |
Zhang J, Maniawski P, Knopp MV. Performance evaluation of the next generation solid-state digital photon counting PET/CT system[J]. EJNMMI Res, 2018, 8(1): 97. DOI:10.1186/s13550-018-0448-7 |
| [20] |
陈英茂, 耿建华, 田嘉禾, 等. PET显像部分容积效应的实验研究[J]. 中国医学影像技术, 2004, 20(1): 99-102. Chen YM, Geng JH, Tian JH, et al. Partial volume effect in PET image: phantom study[J]. Chin J Med Imaging Technol, 2004, 20(1): 99-102. |
| [21] |
Murata T, Miwa K, Miyaji N, et al. Evaluation of spatial dependence of point spread function-based PET reconstruction using a traceable point-like 22Na source[J]. EJNMMI Phys, 2016, 3(1): 26. DOI:10.1186/s40658-016-0162-3 |
| [22] |
Moses WW. Time of flight in PET revisited[J]. IEEE Trans Nucl Sci, 2003, 50(5): 1325-1330. DOI:10.1109/TNS.2003.817319 |
| [23] |
Rahmim A, Qi J, Sossi V. Resolution modeling in PET imaging: Theory, practice, benefits, and pitfalls[J]. Med Phys, 2013, 40(6Part1): 064301. DOI:10.1118/1.4800806 |
| [24] |
Ahn S, Ross SG, Asma E, et al. Quantitative comparison of OSEM and penalized likelihood image reconstruction using relative difference penalties for clinical PET[J]. Phys Med Biol, 2015, 60(15): 5733. DOI:10.1088/0031-9155/60/15/5733 |
| [25] |
Wangerin KA, Ahn S, Wollenweber S, et al. Evaluation of lesion detectability in positron emission tomography when using a convergent penalized likelihood image reconstruction method[J]. J Med Imaging, 2016, 4(1): 011002. DOI:10.1117/1.JMI.4.1.011002 |
| [26] |
王瑞. 临床成像条件下PET/CT图像空间分辨率的模型研究[D]. 北京: 北京协和医学院, 2020. DOI: 10.27648/d.cnki.gzxhu.2020.000567. Wang R. The influence of clinical imaging conditions on the spatial resolution of PET/CT images[D]. Beijing: Peking Union Medical College, 2020. DOI: 10.27648/d.cnki.gzxhu.2020.000567. |
 2024, Vol. 44
2024, Vol. 44


