2. 国家恶性肿瘤临床医学研究中心 乳腺癌防治教育部重点实验室 天津市肿瘤防治重点实验室 天津市恶性肿瘤临床医学研究中心, 天津 300060;
3. 天津市肿瘤医院空港医院核医学科 国家恶性肿瘤临床医学研究中心, 天津 300308;
4. 天津医科大学肿瘤医院放射科, 天津 300060
2. National Clinical Research Center for Cancer, Tianjin Key Laboratory of Breast Cancer Prevention and Therapy, Key Laboratory of Cancer Prevention and Therapy, Tianjin's Clinical Research Center for Cancer, Tianjin 300060, China;
3. Department of Radiology, Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China;
4. Department of Nuclear Medicine, Tianjin Cancer Hospital Airport Hospital, National Clinical Research Center for Cancer, Tianjin 300308, China
2022年2月国家癌症中心发布的统计数据显示,我国乳腺癌发病率约为45.37/10万[1],居女性恶性肿瘤首位,严重威胁广大女性的健康。其中,三阴性乳腺癌(TNBC)占所有乳腺癌分子分型的10.0%~20.0%[2]。其对内分泌治疗和靶向治疗均不敏感,仅对化疗敏感,具有高度异质性,早期发生复发和转移风险高,预后较差[3]。而不同分子分型乳腺癌的临床特征、生物学行为、治疗方案选择以及预后有较大的差异,所以尽早确定乳腺癌的分子分型对于指导临床实践意义重大。目前乳腺癌分子分型的确定主要依赖于病理检测分析,存在有创、耗时长、易漏诊等缺点,且由于肿瘤的异质性,靶病灶的激素受体和HER-2的表达状态在时间和空间上经常存在差异[4-5]。
18F-氟脱氧葡萄糖-正电子体层扫描成像(18F-FDG PET/CT)作为功能性影像检查,可以反映乳腺癌组织葡萄糖代谢的功能信息,同时可以为临床提供半定量参数进行分析。大量研究证实,PET代谢参数和影像组学特征与乳腺癌患者的激素受体状态和分子亚型具有相关性[6-11]。因此,18F-FDG PET/CT有望提供一种安全、可靠的非侵入性检查手段来识别乳腺癌的基因表达谱,从而及时诊断乳腺癌的分子亚型,以便于临床制定个性化治疗方案。本研究旨在评估18F-FDG PET/CT在三阴性乳腺癌分子分型预测中的应用价值。
资料与方法 1、病例资料回顾性收集2010年1月1日至2022年12月31日在天津医科大学肿瘤医院分子影像及核医学诊疗科行18F-FDG PET/CT检查,并经组织病理学检查结果证实的原发性乳腺癌患者的资料。纳入标准:所有患者经术后或穿刺病理证实原发性乳腺癌;接受18F-FDG PET/CT检查前未行任何放化疗、靶向药物及手术切除等抗肿瘤治疗;PET/CT图像清晰,能够进行PET相关参数测量和靶区勾画;组织病理学资料齐全可行乳腺癌分子分型;无其他恶性肿瘤病史。排除标准:患者的临床资料不完整;图像质量不佳,影响靶区勾画或PET参数测量;病理相关检测不齐全,无法确定乳腺癌分子分型;哺乳期或妊娠患者。
严格按照入排标准进行病例筛选,搜集所有入组患者的年龄、月经情况、临床分期、病理类型、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor 2,HER-2)表达状态、分子分型等临床资料,并重新调取患者的18F-FDG PET/CT图像提取CT形态学特征并测量PET代谢参数。激素受体和HER-2均为阴性的患者即为三阴性乳腺癌,据此将患者分为三阴性乳腺癌组(三阴组)和非三阴性乳腺癌(非三阴组)。
2、扫描方法所有患者均行18F-FDG PET/CT全身扫描,显像仪器为美国GE公司Discovery Elite型PET/CT,显像剂18F-FDG应用德国ABX公司的FDG前体试剂套盒通过美国GE公司Tracerlab FX-FDG合成器进行合成,应用MINI trace回旋加速器进行放射性标记,pH值约为7.0,放射化学纯度≥ 95%。扫描前受检者须禁食4~6 h,测量身高(cm)、体重(kg)及空腹血糖,血糖浓度<11.1 mmol/L,18F-FDG注射剂量按照3.70~4.81 MBq/kg计算。注射显像剂后患者平卧休息50~60 min。扫描前15 min患者排空膀胱。患者取仰卧位,双手上举,扫描范围从颅顶至股骨中段。首先进行全身螺旋CT扫描,参数为:管电压120 kV、自动曝光控制技术(30~210 mA,噪声指数25)、层厚5 mm、螺距0.75。随后同机采集PET图像,采用三维+飞行时间技术(TOF)+点扩展函数(SharpIR)法进行采集,采集矩阵为192×192,采集时间为2 min/床位,并应用迭代算法重建经CT衰减校正后的PET图像。采集数据结束后将数据传入Xeleris工作站。
3、CT形态学特征提取及PET代谢参数测量重新调取患者的CT图像,对乳腺癌原发灶的形态学特征进行评估和测量,主要包括病灶的部位(左乳/右乳)、数量(单灶/多灶)、大小(最大径)、边缘(边缘模糊/边缘规整)、合并钙化、累犯邻近乳头或皮肤、同侧腋下淋巴结转移及脑转移情况。将患者的原始图像调入美国GE公司Advantage Workstation 4.6后处理工作站,应用美国GE公司PET Volume Computed Assisted Reading软件勾画ROI,以乳腺癌原发病灶最大标准化摄取值(maximum standard uptake value,SUVmax)的42%为阈值,分别测量靶病灶的SUVmax、平均标准化摄取值(SUVmean)、标准化摄取值峰值(SUVpeak)、肿瘤代谢体积(metabolic tumor volume,MTV)和病灶糖酵解总量(total lesion glycolysis,TLG)。以上均由两位有5年以上PET/CT工作经验的医师独立进行,二人出现意见分歧时,由另一位具有10年以上PET/CT阅片经验的医师进行复核后做出最终判断。
4、18F-FDG PET/CT影像组学分析将样本中70%的患者作为训练集,剩余30%的患者作为测试集(训练集与测试集的划分仅用于特征筛选)进行影像组学分析。影像组学分析的步骤包括病灶感兴趣体积(volume of interest,VOI)的勾画、影像组学特征的提取筛选、影像组学模型的建立和效能评估。其中VOI的勾画是在PET和CT图像上分别采用3D Slicer 4.10.2软件(www.slicer.org)实现的。利用Python 3.7.1软件中的Pyradiomics模块进行影像组学特征的提取(n=1 218)。然后,通过Wilcoxon检验、Spearman相关性分析和最大相关最小冗余(MRMR)进行影像组学特征的降维筛选。最后,将最终选择出来的影像组学特征依据机器学习分类器随机森林(RF)构建影像组学模型,并将入选特征以及特征相应的权重进行线性组合,计算每个患者的影像组学分数(Rad-score)。应用SMOTE算法来解决不同组间数据量的欠平衡。
5、统计学处理符合正态分布的定量变量结果均以x±s表示,不符合正态分布的定量资料以中位数(四分位间距)[M(Q1,Q3)] 表示。计量资料的比较采用卡方检验,服从正态分布的计数资料的比较采用两独立样本t检验,不服从正态分布的计数资料使用Mann-Whitney U秩和检验,对于上述检验采用SPSS 22.0软件进行分析。通过受试者工作(ROC)曲线分析,计算出曲线下面积(AUC),准确度、灵敏度和特异度分别在训练队列和测试队列中评估构建的影像组学模型与综合性影像组学模型对于TNBC的分子分型预测的效能。最后,考虑到本影像组学研究样本量较小,使用十折交叉验证来计算这些影像组学特征模型的平均性能,应用Delong检验比较不同ROC曲线的差异性。P<0.05为差异具有统计学意义。采用Hosmer-Lemeshow检验评估模型拟合优度。
结果 1、临床特征及CT形态学特征比较本研究共纳入227例患者,均为女性,年龄为(52.16±11.04)岁(24~78岁),其中浸润性导管癌209例,占总数的92.07%。按照患者激素受体和HER-2表达情况将患者分为两组,即三阴性乳腺癌82例,非三阴性乳腺癌145例(Luminal A型7例,Luminal B型109例,HER-2过表达型29例)。两组患者的临床特征和CT形态学特征比较,三阴组和非三阴组患者在年龄、绝经情况、肿瘤部位(左右侧)、数量(单发/多发)、是否合并钙化、是否合并脑转移、病理类型、临床分期差异无统计学意义(P>0.05),肿瘤直径、边界是否规整、是否累及邻近皮肤或乳头、是否有同侧腋下淋巴结转移差异有统计学意义(t=-3.19,χ2=7.30、8.10、5.34,P < 0.05),见表 1。
|
|
表 1 三阴组与非三阴组患者临床特征及CT形态学特征的比较 Table 1 Comparison of clinical characteristics and CT morphological features between the TNBC and non-TNBC groups |
2、PET代谢参数比较
结果如表 2所示,三阴组患者的SUVmax、SUVmean及SUVpeak均显著高于非三阴组患者,差异均具有统计学意义(t=3.80、3.30、3.42,P<0.05);两组患者间的MTV及TLG差异无统计学意义(P>0.05)。这说明三阴性乳腺癌的葡萄糖代谢水平更高,往往表现为更高的SUV值;而MTV和TLG还与肿瘤体积有关,在一定程度上反映了肿瘤负荷,对三阴性乳腺癌的诊断价值可能不高。
|
|
表 2 三阴组与非三阴组患者PET代谢参数的比较[x±s/M(Q1,Q3] Table 2 Comparison of PET metabolic parameters between the TNBC and non-TNBC groups[x±s/M(Q1, Q3] |
3、18F-FDG PET/CT影像组学分析在三阴性乳腺癌分子分型诊断中的价值
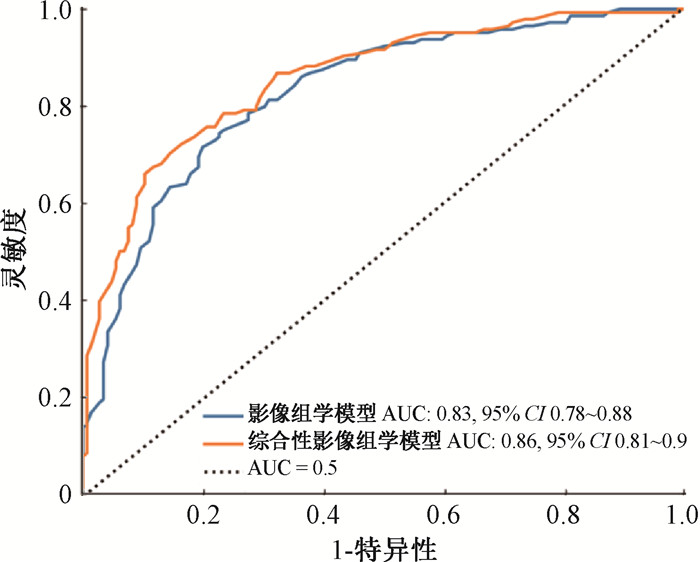
最终选择纳入构建影像组学模型的10个影像组学特征,其中基于CT图像的影像组学特征有4个,基于PET图像的影像组学特征有6个。ROC曲线分析显示,AUC为0.83(图 1),准确度为75.9%,灵敏度为74.5%,特异度为77.2%,表明该影像组学模型能够有效预测三阴性乳腺癌的分子分型。
|
图 1 影像组学模型与联合临床特征信息的综合性影像组学模型对三阴性乳腺癌分子分型预测的ROC曲线比较 Figure 1 Comparison of ROC curves for the prediction of the molecular subtypes of TNBC derived from the radiomic model and the comprehensive radiomic model combined with clinical characteristics |
此外,根据前面的统计分析筛选出的在三阴性乳腺癌组和非三阴性乳腺癌组间差异具有统计学意义的7个特征,包括肿瘤直径、边缘、合并同侧腋下淋巴结转移、累犯邻近乳头或皮肤、SUVmax、SUVmean及SUVpeak,将其纳入上述影像组学模型,构建一个联合临床特征信息的综合性影像组学模型。ROC曲线分析显示,该综合性影像组学模型的ROC曲线下面积AUC为0.86,准确度为77.2%,灵敏度为78.6%,特异度为75.9%。相比于单纯影像组学模型,预测效能略有提升,且经Delong检验证实,差异有统计学意义(Z=-3.27,P < 0.01)。绘制的校准曲线和决策曲线也表明(图 2),本研究构建的影像组学模型和综合性影像组学模型的拟合情况良好,且均具有潜在的临床应用价值。

|
图 2 影像组学模型与联合临床特征信息的综合性影像组学模型对三阴性乳腺癌分子分型预测的校准曲线(A) 和决策曲线(B)比较 Figure 2 Comparison of calibration curves (A) and decision curves (B) for the prediction of the molecular subtypes of TNBC derived from the radiomic model and the comprehensive radiomic model combined with clinical characteristics |
讨论
乳腺癌分子分型可以在一定程度上反映肿瘤的异质性,有助于临床制定个性化治疗方案,改善患者预后[12-13]。其中三阴性乳腺癌的ER、PR和HER-2表达均为阴性,是预后最差的一种分子亚型,其病死率远超其他分子亚型[14-15],一直以来备受关注。因此,尽早、准确地区分TNBC和非TNBC对于临床治疗方案的选择非常重要。
临床研究表明,不同分子亚型乳腺癌患者原发病灶对18F-FDG的摄取具有差异性[6-7],具有更高侵袭性的分子亚型乳腺癌病变往往会表现出葡萄糖高代谢,这一现象可以被18F-FDG PET/CT捕获并反映在代谢参数中[10-11, 16]。本研究也得出类似的结果,三阴组患者的SUVmax、SUVmean及SUVpeak均高于非三阴组患者,且差异有统计学意义,而MTV和TLG差异没有统计学意义。这可能是因为MTV代表FDG摄取增加的肿瘤体积,反映的是肿瘤负荷,往往与患者预后的关系更加密切[17-18];而TLG是感兴趣区内SUVmean和MTV的乘积,可以在一定程度上同时反映肿瘤的侵袭性和预后,这也得到了多数学者的认同。
有多项临床研究报道过18F-FDG PET/CT在TNBC分子分型诊断中的价值。Arslan等[19]证实在所有乳腺癌分子亚型中,TNBC的SUVmax最高,Luminal A型的SUVmax最低。Groheux等[20]、Keam等[21]和Soussan等[22]的研究均得出了TNBC乳腺癌原发灶的SUVmax显著高于非TNBC的结论,但他们都没有对SUVpeak、TLG等代谢参数进行分析。Chiaccio等[23]研究结果表明在鉴别TNBC和Luminal A型乳腺癌方面,TLG的诊断效能优于SUVmax,其诊断的敏感性和特异性分别为80%和63%,最佳阈值为TLG=21.7。而Chen等[24]回顾性分析了99例乳腺癌患者的PET/CT图像后,发现TLG对TNBC诊断的敏感性低于SUVmax(52.6% vs. 73.7%),但特异性和准确性均较高(76.3%vs.70.0%、71.7%vs.69.7%)。
伴随着大数据人工智能分析技术的不断发展进步,基于医学影像图像的影像组学研究开展得如火如荼[25]。影像组学研究通过从大样本的影像图像中提取高通量的影像组学数据,将影像异质性的定量研究提升到了新的高度。多项研究结果表明,基于钼靶、超声和核磁等多种模态影像构建的影像组学模型在乳腺癌的分子分型诊断中发挥了重要价值。不仅如此,基于18F-FDG PET/CT图像构建影像组学模型来预测乳腺癌的分子分型的研究也日益增多[26]。前期研究也再次证实了PET/CT影像组学在乳腺癌分子分型预测中的独特优势[27-28]。在前期研究的基础上,本研究着重于TNBC的分子分型预测的影像组学研究。不仅构建了基于18F-FDG PET/CT的影像组学模型,还在筛选有效临床特征和PET代谢参数后,构建了联合这些有效临床信息的综合影像组学模型,来系统性综合性的评价18F-FDG PET/CT在TNBC分子分型预测中的应用价值。
本研究共纳入了227例乳腺癌患者进行18F-FDG PET/CT影像组学分析。在影像组学分析之前,先系统分析了三阴组与非三阴组在众多临床信息特征方面的差异。单因素分析显示,三阴性乳腺癌与非三阴性乳腺癌患者在肿瘤直径、边缘、腋下淋巴结转移、累犯邻近乳头或皮肤及代谢参数SUV方面差异有统计学意义。三阴性乳腺癌患者原发灶体积相对较大,呈侵袭性生长趋势,因大量摄取葡萄糖表现为较高的SUV值,肿瘤边缘多不规则,更容易累犯邻近皮肤、乳头、胸肌等组织器官,较早发生腋下淋巴结转移,具有显著的侵袭性和早期转移趋势。这与三阴性乳腺癌分化较差,恶性程度高,增殖速度快,且病灶多呈浸润性生长[29-30],常与周边腺体组织相互交错,导致肿瘤边缘不规则,相对更容易早期发生局部侵犯及前哨淋巴结转移[31-32]的生物学行为相符合。由此可见,这些临床特征信息从不同角度反映了三阴组与非三阴组之间的差异,需要综合考虑这些因素,才能够系统性综合性有效预测三阴性乳腺癌的分子分型。本研究构建的18F-FDG PET/CT影像组学模型,具有良好的预测效能,其AUC达到0.83,准确度、灵敏度和特异度均高于70%。而在将上述临床特征信息纳入影像组学分析构建综合影像组学模型后,其预测效能进一步提升,AUC高达0.86,提示三阴性乳腺癌的分子分型预测需要综合考虑多维度的临床和影像信息。
综上,本研究证实18F-FDG PET/CT在三阴性乳腺癌分子分型诊断中具有较高的预测价值,尤其是基于18F-FDG PET/CT图像构建的综合性影像组学模型在三阴性乳腺癌分子分型的预测效能方便具有明显的优势,有助于临床尽早明确诊断并制定相应的治疗方案,进而改善患者预后。本研究仍有一些不足之处,该回顾性研究纳入样本量较小,尤其是三阴组与非三阴组样本量不平衡,部分结果容易产生偏倚;构建的综合性影像组学模型相对于单纯的影像组学模型,在三阴性乳腺癌分子分型预测效能提升方面还有很大的进步空间,需要细致分析其在临床应用转化方面的价值,并开展前瞻性多中心的大样本研究来验证和完善。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 刘建井负责研究设计、组织实施和论文撰写;边海曼、王子阳负责数据整理和统计分析;付蔷、杨芳负责病历和图像资料搜集、参数测量和特征提取;戴东、陈薇、朱磊负责图像分析、PET/CT阅片和研究指导;徐文贵负责研究协调、论文修改和最终审校
| [1] |
Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9. DOI:10.1016/j.jncc.2022.02.002 |
| [2] |
Foulkes WD, Smith IE, Reis-Filho JS. Triple-negative breast cancer[J]. N Engl J Med, 2010, 363(20): 1938-1948. DOI:10.1056/NEJMra1001389 |
| [3] |
Jiang YZ, Ma D, Suo C, et al. Genomic and transcriptomic landscape of triple-negative breast cancers: subtypes and treatment strategies[J]. Cancer Cell, 2019, 35(3): 428-440.e5. DOI:10.1016/j.ccell.2019.02.001 |
| [4] |
Grosselin K, Durand A, Marsolier J, et al. High-throughput single-cell ChIP-seq identifies heterogeneity of chromatin states in breast cancer[J]. Nat Genet, 2019, 51(6): 1060-1066. DOI:10.1038/s41588-019-0424-9 |
| [5] |
Turner NH, Di Leo A. HER2 discordance between primary and metastatic breast cancer: assessing the clinical impact[J]. Cancer Treat Rev, 2013, 39(8): 947-957. DOI:10.1016/j.ctrv.2013.05.003 |
| [6] |
Koo HR, Park JS, Kang KW, et al. 18F-FDG uptake in breast cancer correlates with immunohistochemically defined subtypes[J]. Eur Radiol, 2014, 24(3): 610-618. DOI:10.1007/s00330-013-3037-1 |
| [7] |
Yoon HJ, Kang KW, Chun IK, et al. Correlation of breast cancer subtypes, based on estrogen receptor, progesterone receptor, and HER2, with functional imaging parameters from 68Ga-RGD PET/CT and 18F-FDG PET/CT[J]. Eur J Nucl Med Mol Imaging, 2014, 41(8): 1534-1543. DOI:10.1007/s00259-014-2744-4 |
| [8] |
An YS, Kang DK, Jung YS, et al. Tumor metabolism and perfusion ratio assessed by 18F-FDG PET/CT and DCE-MRI in breast cancer patients: Correlation with tumor subtype and histologic prognostic factors[J]. Eur J Radiol, 2015, 84(7): 1365-1370. DOI:10.1016/j.ejrad.2015.03.026 |
| [9] |
Sasada S, Masumoto N, Suzuki E, et al. Prediction of biological characteristics of breast cancer using dual-phase FDG PET/CT[J]. Eur J Nucl Med Mol Imaging, 2019, 46(4): 831-837. DOI:10.1007/s00259-019-4259-5 |
| [10] |
Kitajima K, Fukushima K, Miyoshi Y, et al. Association between 18F-FDG uptake and molecular subtype of breast cancer[J]. Eur J Nucl Med Mol Imaging, 2015, 42(9): 1371-1377. DOI:10.1007/s00259-015-3070-1 |
| [11] |
Koolen BB, Vrancken Peeters MJ, Wesseling J, et al. Association of primary tumour FDG uptake with clinical, histopathological and molecular characteristics in breast cancer patients scheduled for neoadjuvant chemotherapy[J]. Eur J Nucl Med Mol Imaging, 2012, 39(12): 1830-1838. DOI:10.1007/s00259-012-2211-z |
| [12] |
Hu Z, Fan C, Oh DS, et al. The molecular portraits of breast tumors are conserved across microarray platforms[J]. BMC Genomics, 2006, 7: 96. DOI:10.1186/1471-2164-7-96 |
| [13] |
Sorlie T, Tibshirani R, Parker J, et al. Repeated observation of breast tumor subtypes in independent gene expression data sets[J]. Proc Natl Acad Sci USA, 2003, 100(14): 8418-8423. DOI:10.1073/pnas.0932692100 |
| [14] |
Braunstein LZ, Niemierko A, Shenouda MN, et al. Outcome following local-regional recurrence in women with early-stage breast cancer: impact of biologic subtype[J]. Breast J, 2015, 21(2): 161-167. DOI:10.1111/tbj.12371 |
| [15] |
Kumar P, Aggarwal R. An overview of triple-negative breast cancer[J]. Arch Gynecol Obstet, 2016, 293(2): 247-269. DOI:10.1007/s00404-015-3859-y |
| [16] |
Zhang J, Jia Z, Zhou M, et al. The SUVmax for 18F-FDG correlates with molecular subtype and survival of previously untreated metastatic breast cancer[J]. Clin Nucl Med, 2013, 38(4): 256-262. DOI:10.1097/RLU.0b013e3182816318 |
| [17] |
Chen S, Ibrahim NK, Yan Y, et al. Risk stratification in patients with advanced-stage breast cancer by pretreatment 18F-FDG PET/CT[J]. Cancer, 2015, 121(22): 3965-3974. DOI:10.1002/cncr.29565 |
| [18] |
Satoh Y, Nambu A, Ichikawa T, et al. Whole-body total lesion glycolysis measured on fluorodeoxyglucose positron emission tomography/computed tomography as a prognostic variable in metastatic breast cancer[J]. BMC Cancer, 2014, 14: 525. DOI:10.1186/1471-2407-14-525 |
| [19] |
Arslan E, Çermik TF, Trabulus F, et al. Role of 18F-FDG PET/CT in evaluating molecular subtypes and clinicopathological features of primary breast cancer[J]. Nucl Med Commun, 2018, 39(7): 680-690. DOI:10.1097/MNM.0000000000000856 |
| [20] |
Groheux D, Giacchetti S, Moretti JL, et al. Correlation of high 18F-FDG uptake to clinical, pathological and biological prognostic factors in breast cancer[J]. Eur J Nucl Med Mol Imaging, 2011, 38(3): 426-435. DOI:10.1007/s00259-010-1640-9 |
| [21] |
Keam B, Im SA, Koh Y, et al. Early metabolic response using FDG PET/CT and molecular phenotypes of breast cancer treated with neoadjuvant chemotherapy[J]. BMC Cancer, 2011, 11: 452. DOI:10.1186/1471-2407-11-452 |
| [22] |
Soussan M, Orlhac F, Boubaya M, et al. Relationship between tumor heterogeneity measured on FDG-PET/CT and pathological prognostic factors in invasive breast cancer[J]. PLoS One, 2014, 9(4): e94017. DOI:10.1371/journal.pone.0094017 |
| [23] |
Chiacchio S, Evangelista L, Alsharif A, et al. Association between semiquantitative PET parameters and molecular subtypes of breast invasive ductal carcinoma[J]. Q J Nucl Med Mol Imaging, 2018, 62(1): 101-111. DOI:10.23736/S1824-4785.17.02810-2 |
| [24] |
Chen W, Zhu L, Yu X, et al. Quantitative assessment of metabolic tumor burden in molecular subtypes of primary breast cancer with FDG PET/CT[J]. Diagn Interv Radiol, 2018, 24(6): 336-341. DOI:10.5152/dir.2018.17367 |
| [25] |
Conti A, Duggento A, Indovina I, et al. Radiomics in breast cancer classification and prediction[J]. Semin Cancer Biol, 2021, 72: 238-250. DOI:10.1016/j.semcancer.2020.04.002 |
| [26] |
Krajnc D, Papp L, Nakuz TS, et al. Breast tumor characterization using 18F-PET/CT imaging combined with data preprocessing and radiomics[J]. Cancers (Basel), 2021, 13(6): 1249. DOI:10.3390/cancers13061249 |
| [27] |
Liu J, Bian H, Zhang Y, et al. Molecular subtype classification of breast cancer using established radiomic signature models based on 18F-FDG PET/CT images[J]. Front Biosci (Landmark Ed), 2021, 26(9): 475-484. DOI:10.52586/4960 |
| [28] |
Liu J, Zhang Z, Bian H, et al. Predictive value of radiomic signature based on 2-18F-FDG PET/CT in HER2 status determination for primary breast cancer with equivocal IHC results[J]. Eur J Radiol, 2023, 167: 111050. DOI:10.1016/j.ejrad.2023.111050 |
| [29] |
Borri F, Granaglia A. Pathology of triple negative breast cancer[J]. Semin Cancer Biol, 2021, 72: 136-145. DOI:10.1016/j.semcancer.2020.06.005 |
| [30] |
Dogan BE, Menezes G, Butler RS, et al. Optoacoustic imaging and Gray-scale US features of breast cancers: correlation with molecular subtypes[J]. Radiology, 2019, 292(3): 564-572. DOI:10.1148/radiol.2019182071 |
| [31] |
Farrokh D, Ameri L, Oliaee F, et al. Can ultrasound be considered as a potential alternative for sentinel lymph node biopsy for axillary lymph node metastasis detection in breast cancer patients?[J]. Breast J, 2019, 25(6): 1300-1302. DOI:10.1111/tbj.13475 |
| [32] |
Ma D, Jiang YZ, Xiao Y, et al. Integrated molecular profiling of young and elderly patients with triple-negative breast cancer indicates different biological bases and clinical management strategies[J]. Cancer, 2020, 126(14): 3209-3218. DOI:10.1002/cncr.32922 |
 2024, Vol. 44
2024, Vol. 44


