2. 河南省人民医院 郑州大学人民医院 河南大学人民医院影像科, 郑州 450003;
3. 郑州大学第一附属医院外科医学部, 郑州 450052;
4. 河南省第三人民医院 河南省职业病医院放射卫生科, 郑州 450008
2. Department of Radiology, Henan Provincial People's Hospital, Zhengzhou University People's Hospital, Henan University People's Hospital, Zhengzhou 450003, China;
3. Department of Surgery, First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
4. Department of Radiological Health, Third People's Hospital of Henan Province, Henan Institute of Occupational Medicine, Zhengzhou 450008, China
膀胱癌是男性最常见的恶性肿瘤之一,全球范围内每年新发膀胱癌的病例数约为40万,其中90%以上发生在50岁以上的人群[1]。膀胱癌的治疗方法包括手术、放疗和化疗等多种方式。放疗适用于手术无法切除的局部晚期或复发患者,对术后高危患者作为辅助治疗,是膀胱癌综合治疗中不可缺少的重要手段[2]。
膀胱癌治疗的疗效不断提高,但存在治疗后第二原发肿瘤发生的可能。在盆腔肿瘤中,已有研究证实,在前列腺癌患者放疗后发生第二膀胱肿瘤和第二直肠肿瘤的概率分别为0.04%~0.15%与0.02%~0.11%[3],且辐射诱发的相对风险具有很强的年龄依赖性[4]。因此,患者在治疗后需要接受定期的随访和检查,以便及早发现第二原发肿瘤,从而采取有效的治疗措施。
鉴于此,本研究利用美国国立癌症研究所肿瘤监测、流行病学和结果数据库(surveillance,epidemiology and end results,SEER)统计出膀胱癌放疗后直肠癌累积发生率,并进一步对数据进行统计分析,寻找临床特征,明确导致第二原发肿瘤直肠癌发生的高危因素,从而利于未来对高风险患者进行提前干预。
资料与方法 1、数据来源与研究对象利用SEER Stat 4.3.0.0软件检索并筛选SEER数据库中1975—2017年经病理检查确诊为膀胱癌且ICD-10编码为C67.0-C67.9(排除任何变量编码为空值、未知)的有完整生存数据的患者75 120例。
纳入标准:原发肿瘤病理确诊为膀胱癌;膀胱癌术后患者;具有完整的临床资料与随访信息;膀胱癌放疗为外照射;随访时间≥5年。排除标准:膀胱肿瘤不是第一原发肿瘤;未进行手术;初诊时存在远处转移;膀胱癌诊断后生存时间<5年;在放疗、手术、肿瘤分期、年龄、生存状态或随访信息上存在缺失的病例。
2、观察指标一般而言,从放疗后到实体瘤发生至少有5年的潜伏期[5],这项研究的主要目标是探讨膀胱癌治疗后5年以上发生的直肠癌风险。SEER遵循国际肿瘤疾病分类第3版指南,区分第二原发肿瘤和复发性疾病。第二原发肿瘤直肠癌的随访从膀胱癌诊断后5年开始,以最先发生开始到患直肠癌的诊断日期、死亡日期或随访到30年后结束。随访的截止时间为2017年12月30日(2022年12月SEER数据发布)。
纳入研究指标包括患者年龄、性别、种族、婚姻状况、诊断年份、肿瘤分期、肿瘤分级、根治性手术、外照射放疗、化疗、生存时间和生存状态。根据肿瘤分期,分成早期和局部晚期。诊断年龄分为3组:<50岁、50~60岁、≥60岁。肿瘤组织学分化良和好的为Ⅰ~Ⅱ组、差和未分化为的Ⅲ~Ⅳ组。辅助放疗分为是和否,辅助化疗分为是和否。主要研究终点是膀胱癌单纯手术组与手术联合放疗组累积发生率。
3、统计学处理使用R软件4.3.0.0进行统计分析。Fine-Gray竞争风险回归分析用于评估直肠癌发生的累积发生率。通过计算直肠癌发生的风险比(HR)和95% CI,将发生非直肠癌和死于其他疾病的作为竞争事件。单因素风险模型中P<0.05纳入多变量风险模型进一步验证,使用森林图展示单变量风险模型的结果。χ2检验用于分类变量,Fisher精确检验用于数量低于5以下数据。Mann-Whitney检验分别用于分析具有正态分布和非正态分布的连续变量。P<0.05为差异具有统计学意义。
放疗相对风险(RR)采用泊松回归分析估计术后放疗组的膀胱癌患者与手术后未放疗组相比,直肠癌发生率的相对风险和95% CI用R 4.3.0.0软件统计。为了进一步验证与放疗相关的直肠癌的发生风险,计算膀胱癌治疗之后发生直肠癌的平均潜伏时间、直肠癌平均诊断年龄和直肠癌诊断年份分层的RR。
结果 1、基本特征根据纳入和排除标准,在75 120例患者中,70 045例(92.4%)为白人,中位年龄65.8岁(54~74岁),中位随访时间为159个月(59~501个月),共有2 236例(3%)接受了术后放疗,72 884例(97%)仅接受了手术治疗。膀胱癌患者按治疗方式划分的基线特征见表 1。非放疗组平均诊断年龄为(65.4±12.1)岁,中位年龄67.0岁(6.0~99.0岁),放疗组平均诊断年龄为(67.3±11.1)岁,中位年龄(68.0岁)(1.00~97.0岁),差异有统计学意义(P<0.001)。非放疗组随访时间平均(165±87.7)个月,中位时间143个月(59.0~515个月),放疗组随访时间平均(152±83.8)个月,中位随访时间128个月(59.0~470个月),差异有统计学意义(P<0.001)。潜伏期5年后,非放疗组313名患者(0.43%)和放疗组21例患者(0.93%)发展为直肠癌。膀胱癌治疗后发生直肠癌的中位潜伏时间分别为169(95.3~239.0)和172(100.7~ 252.0)个月(P=0.54)。膀胱癌患者的基线特征见表 1。
|
|
表 1 75 120例膀胱癌非放疗组与放疗组患者临床资料比较 Table 1 Comparison of clinical data of 75120 patients with bladder cancer between the NRT and RT groups |
2、直肠癌累积发生率
膀胱癌确诊后合并直肠癌的累积发生率为0.47%,其中未接受放疗的患者发生率为0.43%,接受放疗的患者为0.93%(χ2=2.91,P =0.004,图 1)。

|
图 1 接受放疗(RT)和未接受放疗(NRT)的患者第二原发肿瘤直肠癌累积发病率的比较 Figure 1 Comparison of the cumulative incidence of second primary rectal cancer between the RT and NRT groups |
3、膀胱癌中放疗后发展成直肠癌的竞争风险回归分析
在75 120例患者中,根据324例最终发展为直肠癌作为终点事件,进一步分析膀胱癌进展为直肠第二恶性肿瘤患者竞争风险的单因素和多因素回归结果。根据表 1中列出的所有变量进行单变量竞争风险回归分析,诊断年份、是否放疗与进展为直肠癌竞争风险有关(P<0.05,表 2)。在多因素竞争风险分析,发现诊断年份与放疗仍然是进展为直肠癌恶性肿瘤的独立危险因素,其中,诊断时间越晚,患直肠癌可能性越小(HR=0.61,95%CI 0.42~0.91,P=0.042),放疗可以提高进展为直肠癌的风险(HR=1.86,95%CI 1.26~2.74,P=0.009)。
|
|
表 2 膀胱癌中发展成直肠癌的单因素竞争风险回归分析 Table 2 Univariate competing risk regression analysis of the development of bladder cancer into rectal cancer |
4、膀胱癌患者与发生第二原发肿瘤直肠癌的放疗相对风险(RR)
泊松回归分析发现,诊断时年龄越小,发生第二肿瘤风险越高(≤50岁vs.>50岁:RR=7.89,95%CI 2.97~21.30, P<0.001);诊断年份越早,发生第二肿瘤风险越高(1975—1985 vs. 1985—1994:RR=2.59,95%CI 1.20~4.86,P<0.001),见图 2;而膀胱癌治疗之后发生直肠癌的潜伏时间与发生风险无关(RR=0.79,95%CI 0.35~1.79,P=0.57)。
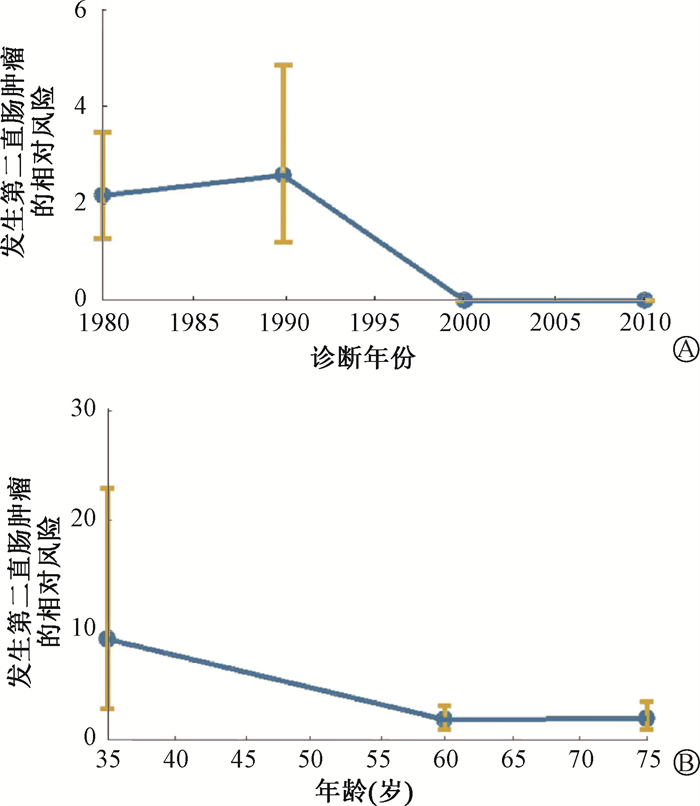
|
图 2 诊断年份(A)和诊断年龄(B)与发生第二肿瘤风险的相关性曲线 Figure 2 Correlation curves between the risk of the second tumor and the year (A) or age (B) of diagnosis |
进一步使用泊松回归分析计算放疗组患者与非放疗组患者发生第二原发肿瘤直肠癌的相对风险(RR),放疗组患者相对风险均更高(RR=2.20,95%CI 1.45~3.18,P < 0.001),诊断日期调整后(RR=1.77,95%CI 1.17~2.57,P=0.009)。
讨论盆腔放疗是治疗许多恶性肿瘤的一种常见手段,盆腔放疗在控制局部复发的同时,也增加了患者远期发生第二原发肿瘤的风险。为了减少盆腔放疗后引起第二原发肿瘤的风险,放疗计划应该尽可能减少对正常组织的辐射剂量。此外,定期的随访和筛查也非常重要,以便早期检测和治疗第二原发肿瘤。
本研究是以人群为基础的大型研究,探讨了膀胱癌患者放疗后发生第二原发肿瘤直肠癌的相对风险。在风险因素方面,诊断年龄越小,诊断年份越早,放疗后患直肠癌的相对风险增大;膀胱癌治疗之后发生直肠癌的潜伏时间与发生风险无关,即潜伏时间早晚与是否发生第二肿瘤是两个独立的事件。而对于盆腔放疗引起第二肿瘤的发生率,目前尚无定论。Moschini等[6]研究发现,外照射会增加膀胱癌风险(P < 0.001),不增加直肠癌风险(P=0.4),10年累积膀胱癌发病率为2.34%(95%CI 2.16%~2.53%)。Aksnessæther等[7]研究发现,前列腺区域外照射后发生第二恶性肿瘤风险增高(HR=1.19, 95%CI 0.92~1.54),膀胱区域外照射后发生第二恶性肿瘤风险提高(HR=2.54,95%CI 1.14~5.69),二者均无结直肠癌风险的增加。Wallis等[8]研究指出,前列腺癌放疗会增加直肠第二恶性肿瘤风险(HR=1.79,95%CI 1.34~2.38)。Lin等[3]研究发现,前列腺癌放疗后发生膀胱和直肠第二肿瘤风险均有所增加。Arnold等[9]发现,宫颈癌放疗后10年发生第二肿瘤的风险明显提高(SIR:1.8,95%CI 1.4~2.2)。Rombouts等[10]发现,直肠癌放疗后增加宫颈癌、前列腺癌风险,但不增加卵巢癌风险。而Martling等[11]认为直肠癌放疗后发生前列腺癌的风险降低。
本研究发现,膀胱癌放疗后与未放疗后发生直肠癌的中位潜伏时间无明显差异,均在13.5年左右。罗云秀和林少民[12]发现鼻咽癌放疗后出现第二肿瘤的潜伏时间一般>10年,本研究结论与其相似。本研究总结了近年来盆腔放疗引起第二恶性肿瘤的相关研究,膀胱癌放疗引起第二肿瘤直肠癌的风险存在争议,可能是因为膀胱与直肠距离更远,直肠跌落剂量已较低,然而不同研究者认为前列腺癌放疗后引起直肠第二肿瘤也存在争议,很可能是不同研究之间的放疗技术、剂量、随访时间等存在较大差异。本研究发现,SEER数据库放疗组和非放疗组的患者中,30年随访期间直肠癌的累积发生率分别为0.93%和0.43%。总体而言,膀胱放疗后发生直肠癌的概率 < 1%,为极低概率事件。
既往研究显示,第二原发肿瘤与放疗剂量、初次照射时的年龄、性别、放疗方式、辐射类型和个人基因敏感性之间存在相关性。本研究发现年龄越小,发生风险越高。Zhou等[13]发现接受放疗后,肺癌术后患者发生第二原发性实体肿瘤和胃肠道肿瘤的风险增加,进一步分析发现年轻人和老年人风险较大,在肺癌诊断后10多年容易出现第二原发肿瘤。Wang[14]的研究也发现随着随访时间的延长,经典霍奇金淋巴瘤患者发生第二原发肿瘤的风险增加,且女性、年龄较小、晚期、化疗和放疗患者的风险更为明显。其背后原因可能是诊断年龄小的患者有足够长的随访时间,而年龄大的患者难以观察到终点事件,因此在临床工作中,对年龄偏小的患者需要着重强调第二肿瘤的可能性。本研究发现,未接受化疗的患者发生第二肿瘤的风险反而更高,考虑到本研究中未将放疗剂量、患者一般情况等数据纳入,因此这部分的结果可能是由于不化疗的患者一般情况较差,或接受放疗剂量较大等导致的,从而增加了风险。本研究还发现,1995年前的诊断年份跟发生第二原发肿瘤相关,可能与1995年样本量不足有关。Zhen等[15]发现,诊断年份是神经母细胞瘤治疗后发生第二原发肿瘤的唯一独立危险因素,本研究结果与其类似,这主要与当时技术有关。随着精准放疗与调强放疗替代传统二维或三维照射,直肠受照剂量不断降低,因此患病风险逐渐降低,与3D-CRT相比,接受调强放疗/容积旋转调强放疗(IMRT/VMAT)的患者盆腔第二原发肿瘤的10年累积发生率明显更低(10.7%和6.0%,P=0.033),证实了前列腺癌放疗后第二盆腔肿瘤的发生率与治疗技术显著相关[16]。一些研究者发现放疗剂量与第二原发肿瘤呈正相关性,宫颈癌根治性放疗数十年内发生膀胱癌、直肠癌、阴道癌、非霍奇金淋巴瘤的风险明显增加[17]。直肠受照剂量是降低第二肿瘤发生的关键所在:相对风险在2~4 Gy时呈超线性增加,在10~30 Gy之间趋于平稳,此后在50 Gy以上下降,ERR/Gy估计值在辐射暴露10年内显着增加,为2.76(95% CI 0.94~4.98)[18]。另外,一项研究发现,放疗总剂量和分次量与放疗后直肠癌的发生率呈正相关,而治疗时间和治疗方式则与发生率关系不大[10]。除了降低受照剂量,选择不同射线类型也有影响,与光子线相比,质子可形成特异性剂量峰(Bragg peak),使高剂量集中于肿瘤周围而正常组织剂量极低,质子放疗可以降低瘤周剂量和患第二肿瘤风险,在年轻患者中更加突出[19]。另外,Xi等[20]研究提示,60Co γ射线比X射线累积发生第二原发肿瘤率更高,其本质与降低照射剂量、剂量内部均一性等相关。
放疗引起第二原发肿瘤的机制尚不完全清楚,但目前认为,放疗可导致DNA双链断裂和染色体异常,这些改变可能会增加细胞发生突变和肿瘤的风险。另外,放疗还可能导致免疫功能抑制,影响机体对癌细胞的免疫监视和清除能力,从而增加发生肿瘤的风险[21]。
本研究尚存在一定局限性:①SEER数据库病理信息不完整,如p53和Ki-67表达、手术切缘情况。②没有具体的放化疗方案,如放疗不同模式(调强或适形放疗)、直肠受照剂量(总剂量及分次剂量)、分割模式(常规分割或大分割),缺少化疗方案及用药剂量,因此无法分析此类细节对第二肿瘤的影响。③作为一项回顾性研究,存在选择偏倚,所得结果有待前瞻性试验进一步验证。
本研究使用不同的方法综合评估放疗与第二肿瘤之间的关系,在本项队列研究中,接受放疗的膀胱癌患者比不接受放疗的患者更有可能发展第二原发肿瘤直肠癌,总体发病率 < 1%,而且诊断时间越早、诊断时年龄越小,后续发生第二恶性肿瘤的风险越高。值得注意的是,膀胱癌治疗之后发生直肠癌的潜伏时间与发生风险无关,因此,在临床随访过程中,在放射治疗完成后均建议安排规律的临床随访,不能因为距离时间久而放松警惕。未来需进行随机对照试验以进一步验证本研究结论,并需要进一步的亚组分析来评估不同亚群的放疗相对风险。
利益冲突 无
作者贡献声明 孙微波负责研究设计、数据统计分析及论文撰写;孙明霞、李海婷、李子园、田勤、马丽佳协助研究设计;闫泽晨、任翼麟、刘中阳负责数据收集和整理;程晓军、朱绍成指导研究设计、结果分析和论文修改
| [1] |
Uhlig A, Seif Amir Hosseini A, Simon J, et al. Gender specific differences in disease-free, cancer specific and overall survival after radical cystectomy for bladder cancer: a systematic review and meta-analysis[J]. J Urol, 2018, 200(1): 48-60. DOI:10.1016/j.juro.2017.11.150 |
| [2] |
Fonteyne V, Rammant E, Ost P, et al. Evaluating the current place of radiotherapy as treatment option for patients with muscle invasive bladder cancer in Belgium[J]. Clin Genitourin Cancer, 2018, 16(6): e1159-e1169. DOI:10.1016/j.clgc.2018.07.026 |
| [3] |
Lin J, Zhan X, Chen R, et al. Increased burden of second bladder cancer and rectal cancer in prostate cancer treated with radiotherapy: results from surveillance, epidemiology, and end results[J]. Cancer Control, 2023, 30: 10732748231177544. DOI:10.1177/10732748231177544 |
| [4] |
Shuryak I, Sachs RK, Brenner DJ. Cancer risks after radiation exposure in middle age[J]. J Natl Cancer Inst, 2010, 102(21): 1628-1636. DOI:10.1093/jnci/djq346 |
| [5] |
Preston DL, Ron E, Tokuoka S, et al. Solid cancer incidence in atomic bomb survivors: 1958-1998[J]. Radiat Res, 2007, 168(1): 1-64. DOI:10.1667/RR0763.1 |
| [6] |
Moschini M, Zaffuto E, Karakiewicz PI, et al. External beam radiotherapy increases the risk of bladder cancer when compared with radical prostatectomy in patients affected by prostate cancer: a population-based analysis[J]. Eur Urol, 2019, 75(2): 319-328. DOI:10.1016/j.eururo.2018.09.034 |
| [7] |
Aksnessæther BY, Myklebust TÅ, Solberg A, et al. Second cancers in patients with locally advanced prostate cancer randomized to lifelong endocrine treatment with or without radical radiation therapy: long-term follow-up of the Scandinavian Prostate Cancer Group-7 Trial[J]. Int J Radiat Oncol Biol Phys, 2020, 106(4): 706-714. DOI:10.1016/j.ijrobp.2019.11.027 |
| [8] |
Wallis CJ, Mahar AL, Choo R, et al. Second malignancies after radiotherapy for prostate cancer: systematic review and meta-analysis[J]. BMJ, 2016, 352: i851. DOI:10.1136/bmj.i851 |
| [9] |
Arnold M, Liu L, Kenter GG, et al. Second primary cancers in survivors of cervical cancer in the Netherlands: implications for prevention and surveillance[J]. Radiother Oncol, 2014, 111(3): 374-381. DOI:10.1016/j.radonc.2014.04.011 |
| [10] |
Rombouts A, Hugen N, Elferink M, et al. Increased risk for second primary rectal cancer after pelvic radiation therapy[J]. Eur J Cancer, 2020, 124: 142-151. DOI:10.1016/j.ejca.2019.10.022 |
| [11] |
Martling A, Smedby KE, Birgisson H, et al. Risk of second primary cancer in patients treated with radiotherapy for rectal cancer[J]. Br J Surg, 2017, 104(3): 278-287. DOI:10.1002/bjs.10327 |
| [12] |
罗云秀, 林少民. 放疗诱发第二原发肿瘤[J]. 中华放射医学与防护杂志, 2021, 41(7): 552-556. Luo YX, Lin SM. Radiation therapy-induced second primary malignant neoplasms[J]. Chin J Radiol Med Prot, 2021, 41(7): 552-556. DOI:10.3760/cma.j.issn.0254-5098.2021.07.015 |
| [13] |
Zhou B, Zang R, Song P, et al. Association between radiotherapy and risk of second primary malignancies in patients with resectable lung cancer: a population-based study[J]. J Transl Med, 2023, 21(1): 10. DOI:10.1186/s12967-022-03857-y |
| [14] |
Wang F. Risk and outcome of second primary malignancy in patients with classical Hodgkin lymphoma[J]. Medicine (Baltimore), 2022, 101(48): e31967. DOI:10.1097/MD.0000000000031967 |
| [15] |
Zhen H, Guan H, Ma J, et al. Risk of developing second malignant neoplasms in patients with neuroblastoma: a population study of the US SEER database[J]. Radiat Oncol, 2021, 16(1): 228. DOI:10.1186/s13014-021-01943-x |
| [16] |
Buwenge M, Scirocco E, Deodato F, et al. Radiotherapy of prostate cancer: impact of treatment characteristics on the incidence of second tumors[J]. BMC Cancer, 2020, 20(1): 90. DOI:10.1186/s12885-020-6581-5 |
| [17] |
Kleinerman RA, Curtis RE, Boice JD Jr, et al. Second cancers following radiotherapy for cervical cancer[J]. J Natl Cancer Inst, 1982, 69(5): 1027-1033. |
| [18] |
Veiga LH, Holmberg E, Anderson H, et al. Thyroid cancer after childhood exposure to external radiation: an updated pooled analysis of 12 studies[J]. Radiat Res, 2016, 185(5): 473-484. DOI:10.1667/RR14213.1 |
| [19] |
Romero-Expósito M, Toma-Dasu I, Dasu A. Determining out-of-field doses and second cancer risk from proton therapy in young patients-an overview[J]. Front Oncol, 2022, 12: 892078. DOI:10.3389/fonc.2022.892078 |
| [20] |
Xi M, Liu SL, Zhao L, et al. Prognostic factors and survival in patients with radiation-related second malignant neoplasms following radiotherapy for nasopharyngeal carcinoma[J]. PLoS One, 2013, 8(12): e84586. DOI:10.1371/journal.pone.0084586 |
| [21] |
McAleenan A, Kelly C, Spiga F, et al. Prognostic value of test (s) for O6-methylguanine-DNA methyltransferase (MGMT) promoter methylation for predicting overall survival in people with glioblastoma treated with temozolomide[J]. Cochrane Database Syst Rev, 2021, 3(3): CD013316. DOI:10.1002/14651858.CD013316.pub2 |
 2024, Vol. 44
2024, Vol. 44


