2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850
2. Beijing Institute of Radiation Medicine, Academy of Military Medical Sciences of the PLA Academy of Military Science, Beijing 100850, China
随着科学技术的迅速发展,移动通信已经进入5G时代。中国互联网络信息中心发布的《中国互联网络发展状况统计报告》显示,自2022年12月至2023年6月我国网民人均每天接触手机的时长≥3 h[1]。目前关于电磁场生物效应的研究主要以3G和4G通讯频段为主。随着5G通讯技术的发展和广泛应用,5G射频电磁场(radio-frequency electromagnetic fields,RF-EMFs)是否会对人体健康产生不利影响尚需进一步评估[2]。射频辐射(radiofrequency radiation,RFR)对中枢神经系统功能的影响尚存争议,其作用机制不明。一方面,有些研究采用流行病学调查和动物行为学实验研究发现,频率为1 800和2 450 MHz等的RFR短期或长期暴露可导致神经系统损伤,表现为学习记忆能力下降、睡眠紊乱、脑电图异常等[3-5];另一方面,有的研究发现RFR对神经系统未见明显的损伤效应[6]。此外,目前大部分研究关注射频暴露终止后神经系统结构和功能的变化,在射频实时暴露条件下能否干扰和影响神经系统功能的相关研究鲜有报道。
本研究采用C57BL/6N小鼠作为研究对象,模拟5G通讯中常使用的2 650 MHz RFR环境进行全身暴露,评估其对小鼠的安全性,以期为5G射频暴露对神经系统的影响提供实验依据。
材料与方法 1、动物及分组采用SPF级雄性C57BL/6N小鼠99只,6~8周龄,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0006。饲养环境:室温22~24℃,湿度50%~60%,昼夜节律(12 h/12 h),自由进食饮水。对小鼠进行适应性饲养1周后用于实验检测。将上述小鼠进行编号,按照随机数表法分为健康对照组(CON)和射频辐射组(RFR),每组各10只。
2、仪器与主要试剂电磁混响室照射系统(reverberation chamber,RC,深圳天许通信技术有限公司);电磁辐射分析仪(NBM-550,德国Narda公司);光纤温度检测系统(THR-NC-1084C,加拿大Fiso公司);旷场实验系统(南京千奥星科生物科技有限公司);微透析系统(瑞典CMA公司),微透析探针(CMA7,瑞典CMA公司);ANY-maze动物行为分析系统(7.16,美国Stoelting公司);XSelec HSS T3色谱柱(186004788,美国Waters公司);全景数字扫描系统(Pannoramic MIDI,匈牙利3DHISTECH公司);Sim4Life三维人体组织医学电磁仿真软件平台(Version 6.2,瑞士IT′IS基金会)。
3、RC有效工作区场强检测RC是由信号源、功率放大器、天线、双层铜网屏蔽体、电磁搅拌器和中央区动物暴露平台等构成的,在电磁搅拌器的作用下,可在中央有效工作区产生相对均匀的各向同性RF-EMFs,适用于小鼠全身均匀暴露[7]。
场强测量方法:将NBM-550电磁辐射分析仪探头放置于电磁混响室有效工作区中心点,分析仪通过数据连接线外接电脑,可通过NBM-TS-V4软件实时记录和观察场强变化。首先开启信号源、功率放大器、射频天线和电磁搅拌器,按照实验条件设置对载频、电平等参数进行设定,待开机预热30 min后对RC有效工作区进行场强测定;将RC 40 cm × 40 cm有效工作区等分为4×4的16个网格,每个网格区域大小为10 cm × 10 cm,检测时将电磁辐射分析仪探头置于每个网格的中心点,每隔1 s记录一次场强值,共记录6 min,取平均值作为该区域场强(V/m),采用Sim4Life软件对小鼠比吸收率(specific absorption rate,SAR)进行仿真模拟计算。
4、小鼠核心温度测量将小鼠放入有机玻璃制成的固定容器内,该容器周壁均匀分布孔洞以保证散热,检测时将上述固定装置放置于RC有效工作区中央位置,由直肠插入温度检测仪光纤传感器(直径2.5 mm),深度约7 mm。在稳定2 min后开始记录,于RC开机前(3 min)、辐射过程中(15 min)和关机后(3 min)监测小鼠肛温的变化。
5、小鼠电磁辐射方法本研究采用2 650 MHz RF-EMFs(连续波)作为信号源参数,将RFR组小鼠置于辐射盒在电磁混响室有效工作区进行全身均匀暴露,持续时间为单次3 h。CON组进行同等条件的假辐射,其余操作与RFR组保持相同。
6、新物体识别实验小鼠按随机数表法分为CON组和RFR组,每组10只。本实验所用行为学箱不含金属物质,不对RC辐射场强度和均匀度产生干扰。新物体识别实验包括适应期、训练期和测试期,用于检测小鼠认知能力的变化。首先将小鼠置于RF-EMFs预暴露3 h后,持续在RFR实时暴露过程中和暴露终止后1 d进行新物体识别实验。将小鼠面向内壁放入旷场箱自由活动5 min,以消除环境应激和恐惧;在旷场箱中距离两侧壁10 cm对角放入2个相同的物体(A和B),让小鼠自由探索5 min;将A替换为新物体C,允许小鼠继续自由探索5 min,ANY-maze记录小鼠分别对两物体的接触次数和时间,计算新物体辨别指数(recognition index,RI)和时间占比(exploration time ratio,ETR),公式为:RI=新物体次数/ (新物体次数+旧物体次数) ×100%,ETR=新物体时间/ (新物体时间+旧物体时间) ×100%。使用75%乙醇擦拭行为学箱消除气味的干扰,开始测试下一只小鼠。
7、社交实验将小鼠按照随机数表法分为CON组和RFR组,每组10只,另选择2只陌生小鼠单笼饲养,和假鼠模型一起作为实验小鼠的社交对象。本实验所用行为学箱不含金属物质,不对RC辐射场强度和均匀度产生干扰。采用RF-EMFs对小鼠进行预暴露3 h后,在连续RFR实时暴露过程中和暴露终止后1 d进行10 min社交实验检测小鼠社交偏好的变化。首先,将实验小鼠面向内壁放入旷场箱自由活动5 min,以消除环境应激;然后,将陌生小鼠与模型小鼠分别放入束缚容器(亚克力圆形照射盒)中,对角距离两壁5 cm放置在旷场箱中,采用ANY-maze记录5 min内小鼠接触陌生同类和假鼠模型的次数和时间,作为评估小鼠的社交偏好的指标。在开始下一只小鼠测试之前,使用75%乙醇擦拭除味。
8、旷场实验将小鼠按随机数表法分为CON组和RFR组,每组10只。本实验所用行为学箱不含金属物质,不对RC辐射场强度和均匀度产生干扰。于实验开始前,将小鼠放入行为学室对环境和操作者进行适应,30 min/d,连续3 d。检测时先将小鼠置于RF-EMFs预暴露3 h,紧接着在RFR实时暴露过程中和暴露终止后1 d进行5 min旷场实验,检测小鼠自主行为学和情绪的变化。从固定位置将小鼠面向内壁放入旷场箱,允许小鼠自由探索5 min,采用ANY-maze对小鼠的运动轨迹进行记录,分析小鼠运动的总路程、进入中央区的次数及停留时间,作为小鼠焦虑样行为的指标。在开始下一只小鼠测试之前,使用75%乙醇擦拭行为学箱并晾干,以消除气味的干扰。
9、微透析检测神经递质水平变化使用1%戊巴比妥钠腹腔注射麻醉小鼠(50 mg/kg),备皮和消毒后,将小鼠头颅固定于脑立体定位仪,垂直埋入非金属套管,套管尖端坐标为海马(X:-2.06 mm;Y:1.5 mm;Z:-1.2 mm),术后恢复7 d用于实验检测。实验开始时,移除套管封堵,缓慢插入微透析探针,探针半透膜长1 mm,位于海马CA1和DG区,然后连接微量注射泵和冷冻收集仪。之后将小鼠置于RC有效工作区同步进行RFR或假辐射,首先用微量注射泵注入复方氯化钠灌流平衡1 h(流速0.5 μl/min),舍弃平衡的废液继续灌流120 min,共收集60 μl透析液暂存于冷冻收集仪中,保持4℃恒温;全部收集结束将透析液长期保存在-80℃冰箱。
质谱法检测:进行样本前处理,将每10 μl透析液依次加入10 μl 100 mmol/L 4-碳酸钠、10 μl BzCl[2%(V/V)乙腈溶液]和5 μl内标混合物,每次加入后涡旋混合,20℃环境中放置5 min后,12 000 r/min,离心半径5 cm,离心10 min。取上清24 μl,加入6 μl内标混合物涡旋混合,进样。内标混合物的配置将苯甲酰氯换为d-5苯甲酰氯,其他与样本前处理相同。使用XSelect HSS T3色谱柱(2.5 μm,2.1 mm × 50 mm);流动相为A(水,含0.05%甲酸):B (甲醇,含0.05%甲酸),进行梯度洗脱,流速为0.3 ml/min;柱温为30℃;样品室温度为6℃;进样量为1 μl。进而检测和分析小鼠海马透析液神经递质5-羟色胺(5-HT)、乙酰胆碱(ACh)、谷氨酸(Glu)和γ-氨基丁酸(GABA)浓度的变化。
10、小鼠海马组织形态观察将小鼠进行编号,采用随机数表法分为CON组和RFR组,每组样本量为6只。于RF-EMFs暴露后即刻和1 d,采用1%戊巴比妥钠腹腔注射对小鼠进行麻醉(50 mg/kg),断头处死,于冰上剥离小鼠脑组织,放入缓冲甲醛溶液中固定。进行常规石蜡切片,苏木素-伊红染色,使用全景数字扫描系统进行观察和分析。
11、小鼠海马组织突触结构观察将小鼠按照随机数表法分为CON组和RFR组,每组3只,采用1%戊巴比妥钠腹腔注射麻醉小鼠(50 mg/kg),于冰上剥离小鼠海马组织,放入2.5%戊二醛溶液固定。磷酸盐缓冲液漂洗3次,每次15 min,用1%锇酸溶液重新固定样品1~2 h后,经无水乙醇和丙酮常规梯度脱水,使用环氧树脂与丙酮的混合液半浸透;纯环氧树脂浸透过夜。利用超薄切片机进行切片处理,厚度为60 nm,切片放置在载网上,醋酸铀避光对样品进行染色处理20 min,枸橼酸铅避光染色15 min后,于透射电镜下观察。
12、统计学处理使用SPSS 27.0.1软件分析数据,数据符合正态分布,以x±s表示。本实验采用单因素两水平的实验设计,采用Student′s t检验进行统计学分析。P < 0.05为差异有统计学意义。
结果 1、电磁混响室2 650 MHz有效工作区场强分布及核心温度变化电磁混响室结构如图 1所示,根据检测结果,本实验条件下RC有效工作区场强范围为160~220 V/m,平均场强为191.88 V/m。采用使用Sim4Life软件进行建模和仿真计算,小鼠RFR全身平均比吸收率约为7.3 W/kg。
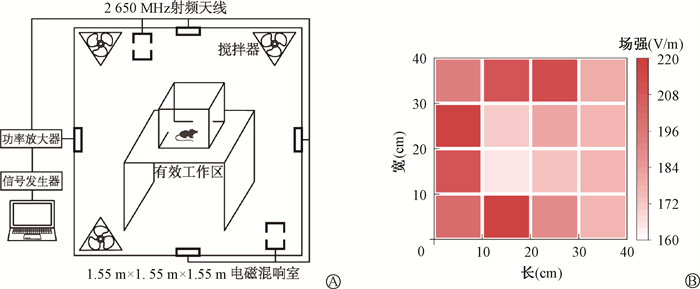
|
图 1 电磁混响室内场强分布A. 电磁混响室示意图;B. 有效工作区场强分布情况 Figure 1 Field strength distribution in electromagnetic reverberation chamber A. Schematic diagram of the electromagnetic reverberation chamber; B. Field strength distribution in the effective working area |
2、小鼠核心温度变化
在RFR开始前3 min检测结果显示,在本实验环境下小鼠基础肛温为36.58℃;在小鼠暴露于2 650 MHz电磁混响室过程中,在暴露开始9 min后小鼠肛温趋于稳定,肛温上升最大为0.61℃,此时小鼠体温变化在热安全范围之内。
3、小鼠认知能力的改变通过新物体识别实验发现,与CON组相比,RFR组小鼠的新物体辨别指数以及新物体接触时间占比显著降低(t=4.50、2.53,P<0.05),1 d后两组小鼠差异无统计学意义(P>0.05),见表 1。表明2 650 MHz RFR持续暴露3 h可导致小鼠的认知能力下降,这种损伤在脱离辐射环境1 d后恢复。
|
|
表 1 两组小鼠在新物体识别实验中辨别指数和时间占比的改变(%,x±s) Table 1 Changes in the recognition index and time proportion in the new object recognition test between both groups of mice (%, x±s) |
4、小鼠社交偏好的改变
在社交实验中,与CON组相比,RFR组小鼠接触陌生同类的次数和时间显著下降(t =0.08、0.03,P<0.05),1 d后两组小鼠的接触次数和时间差异无统计学意义(P>0.05),见表 2。提示2 650 MHz RFR实时暴露会影响小鼠的社交偏好。
|
|
表 2 两组小鼠在社交实验中探索同类次数占比和时间占比的改变(%,x±s) Table 2 Changes in the frequency and time proportions for exploring other mice in the social preference test between both groups of mice (%, x±s) |
5、小鼠焦虑样行为变化
在旷场实验中,与CON组相比,RFR组小鼠进入中央区域次数、中央区域停留时间差异无统计学意义(P>0.05)。提示频率为2 650 MHz RFR持续暴露3 h对小鼠的自主行为无明显影响,未导致明显的焦虑样行为。
6、神经递质释放的改变微透析实验结果显示,与CON组相比,RFR组5-HT的释放增加,ACh的释放减少,差异具有统计学意义(t =-2.56、2.21,P<0.05);Glu和GABA的含量未见显著变化(P>0.05),见表 3。表明本实验条件下,2 650 MHz RFR暴露会影响小鼠海马锥体神经元神经递质的释放功能。
|
|
表 3 射频辐射对海马神经递质释放的影响(ng/ml,x±s) Table 3 Effects of RF radiation on the hippocampal neurotransmitter release (ng/ml, x±s) |
7、小鼠脑海马神经元形态改变
苏木素-伊红染色结果显示,CON组小鼠海马组织结构正常,神经元核大而圆,呈淡染色,形态正常,分布均一,血管周围细胞间隙正常;RFR组海马组织结构与CON组相比未见明显改变。表明本实验条件下,2 650 MHz RFR未观察到小鼠海马组织明显的结构损伤。
8、小鼠脑海马组织突触结构的改变CON组与RFR组小鼠海马组织突触形态正常,前后膜边界清晰完整,突触间隙与致密区厚度均一,两组小鼠海马组织突触结构未见明显改变。表明本实验条件下,2 650 MHz RFR对小鼠海马组织突触超微结构无明显影响。
讨论随着信息化时代的到来,越来越多的无线通讯设备投入使用,与日益广泛的物理应用相比,RFR对机体产生的生物效应研究进展则相对滞后。因此,探讨处于RFR环境中人群认知和情绪的变化具有重要意义。RF-EMFs对生物体的影响可分为热效应和非热效应,关于热效应机制明确,但RFR是否以及如何通过非热机制作用于机体尚不明确。在针对RFR生物效应研究中,鉴于手机使用习惯以及大脑丰富的神经元活动而备受关注,热安全范围内的RFR是否会对神经系统的功能产生不利影响尚未取得一致的结论。有动物行为学实验显示,在受到手机辐射或模拟手机辐射频段的RFR暴露中,小鼠的空间记忆能力下降,部分神经递质释放异常,流行病学报告显示RFR会干扰睡眠、学习记忆或脑电等[8-11];有部分学者发现,低于发热阈值的射频暴露对脑功能未见任何不良影响[12-14]。此外,还有小部分研究认为RF-EMFs可引起实验对象认知和识别能力增强[15]。目前众多研究的重点多放在长期或短期的射频暴露中,其共同的特点是无论暴露时长达到1~3个月还是15 min内的高强度暴露,实验的测试时间点均设置在射频暴露终止后,无法发现电磁辐射暴露过程中神经系统功能的异常变化。考虑到人们在人造RFR环境中工作和生活成为一种新的常态,RFR场暴露可能对神经系统的功能产生干扰效应,当实验动物处于实时RFR暴露状态过程中会对神经系统造成怎样的影响,鲜有报道。本研究发现,2 650 MHz RFR环境中小鼠的认知能力显著下降和社交偏好发生异常改变,但对小鼠的焦虑情绪未见明显影响。在神经元水平,本研究发现在RFR暴露环境中小鼠海马神经元的功能发生明显异常,表现为多种神经递质释放的异常变化。此外,通过病理研究发现,本研究所采用的RFR条件对小鼠海马组织结构和突触超微结构未见明显影响。在整个RFR过程中,小鼠核心体温升高最大为0.61℃,处于热安全的范围之内。根据本研究的发现,处于热安全范围内的RFR可引起神经系统功能的明显变化,提示RF-EMFs丰富的环境是影响人群行为包括工作学习效率和社交等重要的不利因素,其安全性值得关注。但在该过程中,RFR热效应和非热效应在多大程度上发挥作用,尚需进一步的研究确认。
海马属于脑边缘系统中的重要组成,与学习、记忆、认知功能有关,尤其是短期记忆[16]。5-HT是重要的中枢神经递质,有多种受体亚型,通过调节其他神经递质直接或间接影响认知功能[17-18]。有研究显示,海马CA1区有大量5-HT1B受体分布,5-HT1B受体激动剂能够导致野生型小鼠的认知能力受损,是海马锥体神经元上调节兴奋性突触传递的重要受体[19-21]。RFR暴露导致了神经递质表达失衡,5-HT释放的增加结合突触后的5-HT1B受体,损伤了小鼠认知记忆的获取,最终表现为神经元的功能性损伤,小鼠的认知记忆功能失衡。海马同样作为调控社会行为的关键脑区,抑制其直接投射可损伤社交行为的表达[22],海马背侧CA1区5-HT5A、5-HT6和5-HT7受体的调节影响社交行为的巩固[23-24]。在RF-EMFs暴露中小鼠所显现出的社交偏好改变是由于5-HT的大量释放促进了抑制性受体5-HT5A、5-HT6和5-HT7的受体功能。此外,在食物偏好转变测试中,可检测到海马ACh含量的增加,实验大鼠会表现出对同伴先前食用食物的偏好[25-26],海马损伤会损坏食物偏好的社会传播[27]。由此可推测,海马ACh释放减少,一定程度上或许也能够通过集体社交影响小鼠偏好的转变。
综上所述,2 650 MHz的RFR实时暴露可导致小鼠认知能力和社交偏好的改变,与海马锥体神经元的功能性损伤导致5-HT、ACh释放含量的改变相关,并在脱离辐射环境后恢复。本研究可为日常接触RFR的安全性提供参考。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘玉杰、王俊负责实验操作、数据分析和论文撰写;李刻勤、常晨旭、刘莹负责采集数据;左红艳、李杨、杨鸿指导实验设计和论文修改;郝延辉、邓桦负责指导论文撰写
| [1] |
国家图书馆研究院. 中国互联网络信息中心发布第52次《中国互联网络发展状况统计报告》[J]. 国家图书馆学刊, 2023, 32(5): 13. National Library Research Institute. China Internet Network Information Center released the 52nd "Statistical Report on the Development of Internet in China"[J]. J Natl Lib China, 2023, 32(5): 13. |
| [2] |
Redmayne M, Maisch DR. ICNIRP guidelines'exposure assessment method for 5G millimetre wave radiation may trigger adverse effects[J]. Int J Environ Res Public Health, 2023, 20(7): 5267. DOI:10.3390/ijerph20075267 |
| [3] |
Eliyahu I, Luria R, Hareuveny R, et al. Effects of radiofrequency radiation emitted by cellular telephones on the cognitive functions of humans[J]. Bioelectromagnetics, 2006, 27(2): 119-126. DOI:10.1002/bem.20187 |
| [4] |
Danker-Hopfe H, Bueno-Lopez A, Dorn H, et al. Spending the night next to a router-Results from the first human experimental study investigating the impact of Wi-Fi exposure on sleep[J]. Int J Hyg Environ Health, 2020, 228: 113550. DOI:10.1016/j.ijheh.2020.113550 |
| [5] |
范红艳, 李景璐, 李曼, 等. 2450 MHz微波辐射对小鼠学习记忆的研究[J]. 毒理学杂志, 2018, 32(6): 469-471. Fan HY, Li JL, Li M, et al. The research on learning and memory in mice after 2450 MHz microwave exposure[J]. J Toxi, 2018, 32(6): 469-471. DOI:10.16421/j.cnki.1002-3127.2018.06.009 |
| [6] |
Traini E, Martens AL, Slottje P, et al. Time course of health complaints attributed to RF-EMF exposure and predictors of electromagnetic hypersensitivity over 10 years in a prospective cohort of Dutch adults[J]. Sci Total Environ, 2023, 856(Pt 2): 159240. DOI:10.1016/j.scitotenv.2022.159240 |
| [7] |
闵霞, 路浩, 李志慧, 等. 电磁混响室搅拌器不同工作状态对局部场强影响的初步研究[J]. 军事医学, 2018, 42(11): 867-871. Min X, Lu H, Li ZH, et al. Influence of electromagnetic reverberation chamber stirrer working in different modes on local field strength[J]. Mil Med Sci, 2018, 42(11): 867-871. |
| [8] |
Salford LG, Brun AE, Eberhardt JL, et al. Nerve cell damage in mammalian brain after exposure to microwaves from GSM mobile phones[J]. Environ Health Perspect, 2003, 111(7): 881-883; discussion A408. DOI: 10.1289/ehp.6039.
|
| [9] |
郑荣淇. 2650MHz电磁辐射对C57小鼠情绪行为及学习记忆的影响研究[D]. 北京: 军事科学院, 2021. DOI: 10.27193/d.cnki.gjsky.2021.000084. Zheng RQ. Effects of 2650 MHz electromagnetic radiation on emotional behavior, learning and memory of C57 mice[D]. Beijing: Academy of Military Sciences, 2021. DOI: 10.27193/d.cnki.gjsky.2021.000084. |
| [10] |
Ahmed NA, Radwan NM, Aboul Ezz HS, et al. The chronic effect of pulsed 1800 MHz electromagnetic radiation on amino acid neurotransmitters in three different areas of juvenile and young adult rat brain[J]. Toxicol Ind Health, 2018, 34(12): 860-872. DOI:10.1177/0748233718798975 |
| [11] |
Bortkiewicz A. Health effects of Radiofrequency Electromagnetic Fields (RF EMF)[J]. Ind Health, 2019, 57(4): 403-405. DOI:10.2486/indhealth.57_400 |
| [12] |
高蒙, 彭怀禹, 王向晖, 等. 长期1.8 GHz电磁辐射对大鼠学习认知能力的影响[J]. 辐射研究与辐射工艺学报, 2021, 39(4): 19-25. Gao M, Peng HY, Wang XH, et al. Effect of long-term 1.8 GHz combined electromagnetic radiation on the learning and cognitive ability of rats[J]. J Radiat Res, 2021, 39(4): 19-25. |
| [13] |
Bodera P, Makarova K, Zawada K, et al. The effect of 1800 MHz radio-frequency radiation on NMDA receptor subunit NR1 expression and peroxidation in the rat brain in healthy and inflammatory states[J]. Biomed Pharmacother, 2017, 92: 802-809. DOI:10.1016/j.biopha.2017.05.133 |
| [14] |
Bouji M, Lecomte A, Gamez C, et al. Neurobiological effects of repeated radiofrequency exposures in male senescent rats[J]. Biogerontology, 2016, 17(5-6): 841-857. DOI:10.1007/s10522-016-9654-8 |
| [15] |
Wang K, Lu JM, Xing ZH, et al. Effect of 1.8 GHz radiofrequency electromagnetic radiation on novel object associative recognition memory in mice[J]. Sci Rep, 2017, 7: 44521. DOI:10.1038/srep44521 |
| [16] |
Hong J, Lu X, Wang J, et al. Triphenyl phosphate disturbs placental tryptophan metabolism and induces neurobehavior abnormal in male offspring[J]. Ecotoxicol Environ Saf, 2022, 243: 113978. DOI:10.1016/j.ecoenv.2022.113978 |
| [17] |
李云峰. 快速起效抗抑郁药研发策略: 单胺(5-HT)-非单胺(Glu/GABA)长反馈神经环路候选假说的提出[J]. 中国药理学与毒理学杂志, 2019, 33(3): 161-173. Li YF. Strategy for development of fast-onset antidepressive agents: candidate hypothesis of monoamine(5-HT)-nonmonoamine (Glu/GABA) long-feedback neural circuit[J]. Chin J Pharmacol Toxicol, 2019, 33(3): 161-173. |
| [18] |
Meneses A. 5-HT systems: emergent targets for memory formation and memory alterations[J]. Rev Neurosci, 2013, 24(6): 629-664. DOI:10.1515/revneuro-2013-0026 |
| [19] |
Eriksson TM, Alvarsson A, Stan TL, et al. Bidirectional regulation of emotional memory by 5-HT1B receptors involves hippocampal p11[J]. Mol Psychiatry, 2013, 18(10): 1096-1105. DOI:10.1038/mp.2012.130 |
| [20] |
Fink AE, Sariñana J, Gray EE, et al. Activity-dependent depression of local excitatory connections in the CA1 region of mouse hippocampus[J]. J Neurophysiol, 2007, 97(6): 3926-3936. DOI:10.1152/jn.00213.2007 |
| [21] |
Nasehi M, Jamshidi-Mehr M, Khakpai F, et al. Possible involvement of CA15-HT1B/1D and 5-HT2A/2B/2C receptors in harmaline-induced amnesia[J]. Pharmacol Biochem Behav, 2014, 125: 70-77. DOI:10.1016/j.pbb.2014.08.007 |
| [22] |
Sun Q, Li X, Li A, et al. Ventral hippocampal-prefrontal interaction affects social behavior via parvalbumin positive neurons in the medial prefrontal cortex[J]. iScience, 2020, 23(3): 100894. DOI:10.1016/j.isci.2020.100894 |
| [23] |
Schain RJ, Freedman DX. Studies on 5-hydroxyindole metabolism in autistic and other mentally retarded children[J]. J Pediatr, 1961, 58: 315-320. DOI:10.1016/s0022-3476(61)80261-8 |
| [24] |
Schmidt SD, Zinn CG, Cavalcante LE, et al. Participation of hippocampal 5-HT (5A), 5-HT (6) and 5-HT (7) serotonin receptors on the consolidation of social recognition memory[J]. Neuroscience, 2022, 497: 171-183. DOI:10.1016/j.neuroscience.2022.06.016 |
| [25] |
Gold PE, Countryman RA, Dukala D, et al. Acetylcholine release in the hippocampus and prelimbic cortex during acquisition of a socially transmitted food preference[J]. Neurobiol Learn Mem, 2011, 96(3): 498-503. DOI:10.1016/j.nlm.2011.08.004 |
| [26] |
Carballo-Márquez A, Vale-Martínez A, Guillazo-Blanch G, et al. Muscarinic receptor blockade in ventral hippocampus and prelimbic cortex impairs memory for socially transmitted food preference[J]. Hippocampus, 2009, 19(5): 446-455. DOI:10.1002/hipo.20530 |
| [27] |
Clark RE, Broadbent NJ, Zola SM, et al. Anterograde amnesia and temporally graded retrograde amnesia for a nonspatial memory task after lesions of hippocampus and subiculum[J]. J Neurosci, 2002, 22(11): 4663-4669. DOI:10.1523/JNEUROSCI.22-11-04663.2002 |
 2024, Vol. 44
2024, Vol. 44


