登月等深空飞行中的偶发太阳粒子事件(solar particle events, SPE)短时间可能使器官剂量达到1 Gy左右,对航天员产生脑损伤等健康风险,导致任务无法顺利完成[1-2]。但目前,美国、俄罗斯等拥有载人航天技术的国家尚未制定专门的深空辐射剂量限值,且SPE风险模型尚不成熟,其所依据的辐射生物效应阈值和量效关系研究中存在如下不足:2 Gy以下剂量的效应研究较少;辐射流行病学调查中存在年龄、性别、统计等多种混杂因素,混淆了辐射对脑等器官的生物效应[3-4]。因此,本研究拟采用90 MeV、2 Gy以下剂量的质子模拟SPE照射,并采用与人体神经生理功能具有相似性的小鼠,在照射条件均一化条件下进行SPE脑损伤效应研究,为深空探测辐射短期限值制定和风险评估提供科学依据。
材料与方法 1、实验动物和照射条件8周龄BALB/c雄性小鼠,(23±2)g,购自斯贝福(北京)生物科技有限公司[动物合格证号:SCXK(京)2019-0010],饲养于中国航天员科研训练中心实验动物中心SPF级动物房。随机分12个实验组,6~12只/组。全身照射,照射剂量分别为0、0.1、0.3、0.5、1、2 Gy,质子能量为90 MeV,剂量率为0.8 Gy/min。本研究严格遵循北京市实验动物管理规定,并得到伦理委员会的批准(批准号:ACC-IACUC-2021-034)。
2、小鼠行为学实验检测(1) 平衡木测试实验:将长100 cm、直径1 cm的木棒固定于距地面50 cm处,测试前1 d将小鼠放在平衡木起点适应1 min,然后用食物在另一端引诱使其自主完整地通过平衡木2次。测试当天记录小鼠通过平衡木的时间(只记录爬行时间,中间若停留,则轻触小鼠,停留时间不计),每只小鼠实验3次,计算通过平衡木时间的平均值,每次测完休息1 h。
(2) 转棒测试实验:转棒为直径3 cm、长8 cm的硬质塑料棒,转棒在5 min内由5 r/min均匀加速至40 r/min。测试前,小鼠在转棒上适应15 min。测试时,测量小鼠在转棒上维持的时间,每只小鼠实验3次,计算转棒维持时间平均值。
(3) 新物体识别实验:采用50 cm × 50 cm × 50 cm的蓝色箱体,测试前,给小鼠两个完全相同的物体,在箱体内适应2 min。记录5 min内小鼠与这两个物体接触的时间(距离物体1 cm左右用口鼻接触物体的时间,趴在物体上不动的时间不计入)。测试时,将其中1个物体用颜色和形状均不同的物体替换,记录5 min内小鼠与这两个物体接触的时间,计算新物体优先识别指数(新物体倾向),优先识别指数=接触新物体的时间/接触2个物体的时间。每只小鼠实验3次,计算新物体优先识别指数平均值。
3、大脑树突棘密度检测采用高尔基体染色法检测海马树突棘密度。处死小鼠后,尽快取出海马,用4%多聚甲醛固定,室温黑暗保存;次日,更换硝酸银溶液浸染,室温避光保存2周;制备厚度为100 μm的冰冻切片,采用FD Rapid GolgiStainTM kit染液(哥伦比亚FD Neuro Technologies公司)染色10 min,用甲酚紫复染,依次用50%、75%、95%乙醇脱水,5 min/次;用100%乙醇对玻片脱水3次,5 min/次,再用二甲苯清洗2次,5 min/次;然后玻片覆盖冰冻切片,显微镜下(物镜× 60)观察海马树突棘类型,分别计数蘑菇状、短粗型、瘦长型、丝状伪足型树突棘的数量,计算树突棘密度(数量/10 μm)。
4、尼氏小体检测采用尼氏染色液(上海碧云天公司)检测海马组织CA1、CA3、DG区的尼氏小体数量。小鼠腹腔注射4%水合氯醛(0.01 g/ml),用静脉注射针头从心尖插入,缓慢灌注磷酸盐缓冲液(PBS) 40 ml冲净脑内血液,再缓慢灌注预冷的4%多聚甲醛固定脑组织,将脑组织浸泡于4℃多聚甲醛中24 h;冰冻切厚度为40 μm的切片,放入盛有尼氏染液的玻璃缸中浸染15 min,清洗2次,乙醇梯度脱水10 min,加入二甲苯,通风处放置10 min,中性树脂封片;显微镜下(物镜× 20)观察蓝紫色显示的尼氏小体和颜色较深皱缩的异常尼氏小体。采用Imagine J软件计数尼氏小体数量,GraphPad Prism8软件进行统计,计算每平方毫米异常尼氏小体数(个/mm2)。
5、氧化应激产物检测分别采用WST-8法和TBA法检测小鼠海马组织超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量,检测试剂盒来自南京建成生物工程研究所。
6、神经递质检测采用高压液相仪(安捷伦科技有限公司四极杆飞行时间质谱仪6550)检测小鼠脑组织5-羟色胺(5-HT)、多巴胺(DA)、γ氨基丁酸(GABA)、谷氨酸(Glu)的含量。神经递质标准品来自美国Sigma公司,用80%甲醇/水(V/V)制备各神经递质标准品,并制备标准曲线。神经递质样品制备,采用皮层与海马组织(约0.1 g)与10倍(W/V)体积的甲醇冰浴,4℃、13 000 × g离心5 min;取200 μl上清并向其中加入25 μl的异丙肾上腺素内标和25 μl的甲醇,漩涡震荡3 min,4℃、13 000 × g离心5 min;重复离心,制备神经递质样品。然后将神经递质标准品和样品注入高压液相仪进行比对分析,获得样品各神经递质含量。
7、凋亡检测采用TUNEL细胞凋亡检测试剂盒(上海碧云天公司)检测海马组织CA1、CA3、DG区的凋亡小体数量。将上述固定的脑组织制备成厚度为10 μm的冰冻切片,用0.1%Triton X-100作用10 min,加入Tunel检测液37℃避光孵育60 min,清洗3次后封片;显荧光微镜下(物镜× 20)观察浅褐色的凋亡小体,采用Imagine J软件计凋亡小体数量,GraphPad Prism8软件进行统计,计算凋亡小体数(个/mm2)。
8、脑损伤阈值判定(1) 脑损伤判定:脑损伤指标(平衡木通过时间、转棒维持时间、新物体优先识别指数、树突棘密度、异常尼氏小体数量、SOD活性、MDA含量、5-HT含量、DA含量、GABA含量、Glu含量、凋亡小体数量)发生显著变化,则判定为脑损伤。
(2) 脑损伤(指标)的阈值判定:2 Gy及以下连续剂量点有显著性,则最小剂量为阈值;2 Gy以内没有显著性,则判定损伤的阈值>2 Gy。
9、统计学处理采用SPSS 19.0软件进行统计学分析, 数据用x±s表示,进行组间样本配对t检验,P﹤0.05为差异有统计学意义。对辐射剂量和效应指标变化程度之间进行线性或线性平方的模拟,取R2≥ 0.6的拟合曲线作为小鼠的辐射脑损伤生物物理模型。
结果 1、质子照射后小鼠行为能力的改变如图 1所示,在2 Gy照后7 d,攀爬时间显著增加(t=2.96,P < 0.05)。在2 Gy照后3和7 d,转棒维持时间显著减少(t=2.85、2.64,P < 0.05)。在2 Gy照后3和7 d,新物体识别倾向显著减少(t=2.87、2.84,P < 0.05)。综上,质子照后3、7 d,在0.1~2 Gy的范围内引发小鼠行为显著变化的最小剂量为2 Gy。
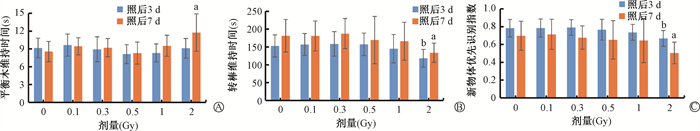
|
注:与0 Gy比较,at=2.96、2.64、2.84,P < 0.05;bt= 2.85、2.87,P < 0.05 图 1 质子照射后小鼠行为能力的改变A. 平衡木维持实验;B. 转棒维持实验;C. 新物体识别实验 Figure 1 Changes in behavioral capacities of mice after proton irradiation A. Balance beam maintenance test; B. Rotarod maintenance test; C. New object recognition test |
2、质子照射后海马病理形态的改变
根据不同形状树突棘分为蘑菇型、细长型、短粗型和丝状伪足型,树突棘染色结果如图 2所示,质子照后3或7 d,随着照射剂量增大,树突棘数量逐渐减少。在1和2 Gy时引起蘑菇状、丝状伪足树突棘密度显著减小,蘑菇状树突棘在2 Gy照后3 d出现显著下降(t=2.72,P < 0.05),1和2 Gy照后7 d,均出现显著下降(t=2.20、3.91,P < 0.05);丝状伪足树突棘在1和2 Gy照后3和7 d均出现下降(t=1.82、2.91、2.30、3.20,P < 0.05)。
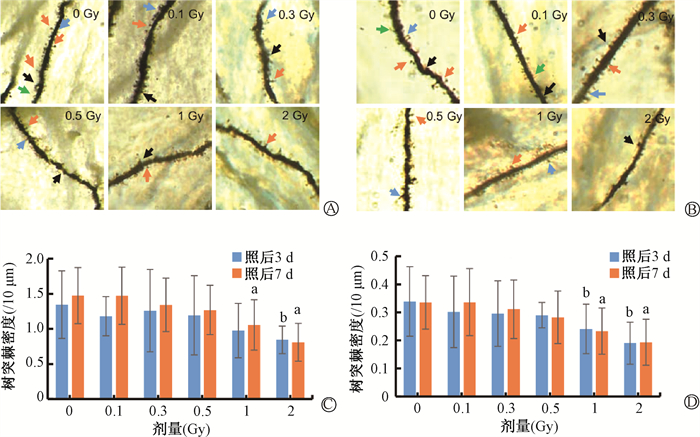
|
注: .蘑菇型; .蘑菇型; .细长型; .细长型; .短粗型; .短粗型; .伪足型。与0 Gy比较,at=2.20、3.91、2.30、3.20,P < 0.05;bt= 2.72、1.82、2.91,P < 0.05
图 2 不同剂量质子照射后高尔基体染色检测海马树突棘形态的改变× 60 A. 照后3 d树突棘形态;B. 照后7 d树突棘形态;C. 照射后蘑菇状树突棘密度;D. 照射后丝状伪足树突棘密度
Figure 2 Morphological changes of hippocampal dendritic spines detected using Golgi staining after proton irradiation at different doses A. Morphology of dendritic spines on day 3 after irradiation; B. Morphology of dendritic spines on day 7 after irradiation; C. Density of mushroom-like dendritic spines after irradiation; D. Density of filopod dendritic spines after irradiation .伪足型。与0 Gy比较,at=2.20、3.91、2.30、3.20,P < 0.05;bt= 2.72、1.82、2.91,P < 0.05
图 2 不同剂量质子照射后高尔基体染色检测海马树突棘形态的改变× 60 A. 照后3 d树突棘形态;B. 照后7 d树突棘形态;C. 照射后蘑菇状树突棘密度;D. 照射后丝状伪足树突棘密度
Figure 2 Morphological changes of hippocampal dendritic spines detected using Golgi staining after proton irradiation at different doses A. Morphology of dendritic spines on day 3 after irradiation; B. Morphology of dendritic spines on day 7 after irradiation; C. Density of mushroom-like dendritic spines after irradiation; D. Density of filopod dendritic spines after irradiation
|
尼氏小体染色结果如图 3显示,随着质子照射剂量增大,海马DG区、CA1区和CA3区这3个区域的蓝紫色的正常尼氏小体数量逐渐减少、皱缩深蓝的异常尼氏小体数量增加。2 Gy剂量下海马DG区、CA1和CA3区异常尼氏小体数量在照后3和7 d均显著增加。2 Gy照后3 d,DG区异常尼氏小体数量显著增加(t=5.33,P < 0.05),1和2 Gy照后第7 d,均显著增加(t=2.82、2.64,P < 0.05)。1和2 Gy照后3 d,CA1区异常尼氏小体数量显著增加(t=2.44,6.02,P < 0.05),1和2 Gy照后7 d,均显著增加(t=3.77、6.60,P < 0.05)。在2 Gy照后3 d,CA3区异常尼氏小体数量显著增加(t=3.85,P < 0.05),在1和2 Gy照后7 d均显著增加(t=3.55、4.93,P < 0.05)。综上,质子照后3和7 d,在0.1~2 Gy的范围内引发脑组织病理形态显著改变的最小剂量为1 Gy。
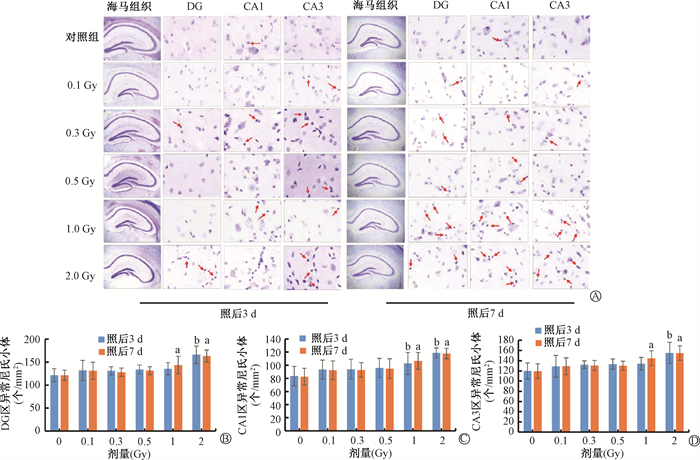
|
注:红色箭头所指为异常尼氏小体。与0 Gy比较,at=3.01、3.05、3.47、3.89、2.56、3.63,P < 0.05; bt= 2.79、3.91、3.54,P < 0.05 图 3 不同剂量质子照射后海马不同区域尼氏小体的改变A. 照射后第3和7天尼氏小体形态尼氏染色×20;B. 海马DG区异常尼氏小体;C. 海马CA1区异常尼氏小体;D. 海马CA3区异常尼氏小体 Figure 3 Changes of Nissl bodies in different regions of the hippocampus after proton irradiation at different doses A. Morphology of Nissl bodies on days 3 and 7 after irradiation Nissl staining×20; B. Number of abnormal Nissl bodies in the DG region of the hippocampus after irradiation; C. Number of abnormal Nissl bodies in the CA1 region of the hippocampus after irradiation; D. Number of abnormal Nissl bodies in the CA3 region of the hippocampus after |
3、质子照射引起脑组织氧化应激产物和神经递质变化
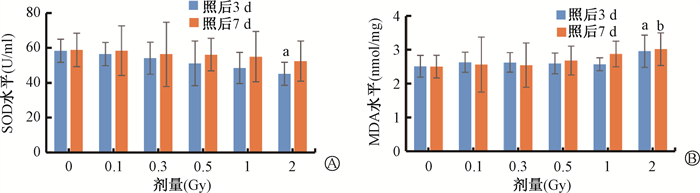
如图 4显示,2 Gy照射后3 d,SOD活力显著下降(t=3.44,P < 0.05),2 Gy照射后3和7 d,MDA含量均显著升高(t=1.90、2.14,P < 0.05)。
|
注:SOD.超氧化物歧氏酶;MDA.丙二醛。与0 Gy比较,at= 3.44、1.90,P < 0.05; bt=2.14,P < 0.05 图 4 不同剂量质子照射后脑组织氧化应激水平的改变A. 质子照射后SOD水平变化;B. 质子照射后MDA水平变化 Figure 4 Changes of oxidative stress levels in brain tissue after proton irradiation A. Changes in SOD levels after proton irradiation; B. Changes in MDA levels after proton irradiation |
由表 1可知,质子照后脑组织神经递质含量发生异常。5-HT含量在2 Gy照后3、7 d均显著增加(t=2.81、2.69,P < 0.05),GABA含量在2 Gy照后7 d显著增加(t=2.11,P < 0.05),DA含量在1、2 Gy照后7 d均显著增加(t=2.52、4.19,P < 0.05),Glu含量在1、2 Gy照后7 d显著增加(t=4.04、3.50,P < 0.05)。综上,质子照后3、7 d,在0.1~2 Gy的范围内引发氧化应激和神经递质显著变化的最小剂量为1 Gy。
|
|
表 1 不同剂量质子照射后脑组织神经递质水平的改变(x±s) Table 1 Changes of neurotransmitter levels in brain tissue after proton irradiation (x±s) |
4、脑组织凋亡检测
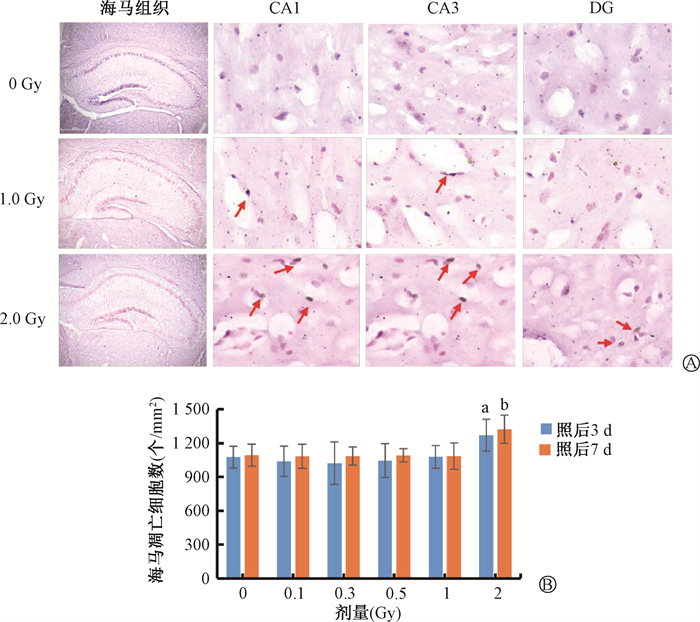
图 5显示,质子照后3 d,海马区浅褐色的凋亡细胞数量增加。2 Gy照后3和7 d与0 Gy相比,差异有统计学意义(t=3.91、3.54,P<0.05)。
|
注:与0 Gy比较,a t= 3.91, P < 0.05; b t=3.54,P < 0.05 图 5 质子照射后海马细胞凋亡水平的改变A. 不同剂量照后3 d海马细胞凋亡典型图Tunel染色×20;B. 照后3和7 d凋亡数 Figure 5 Changes in hippocampal apoptosis levels after proton irradiation detected using Tunel staining A. Typical picture of hippocampal apoptosis; B. Apoptosis on days 3 and 7 after irradiation |
5、剂量-效应关系模型
通过对质子照射剂量和19种脑损伤指标变化程度进行量效关系分析,获得转棒维持时间、平衡木通过时间、新物体识别、蘑菇状树突棘密度、SOD活力、细胞凋亡等14种指标的剂量-效应的数学模型(表 2)。
|
|
表 2 质子照射导致脑损伤的量效关系模型 Table 2 Dose-response models of brain damage induced by proton irradiation |
讨论
空间辐射是空间飞行任务中,不可避免的有害环境因素。在空间飞行过程中,辐射源主要来自持续、稳定、低剂量率的银河宇宙射线(GCR)和不可预见、偶发、高剂量率的SPE等。近地轨道平均日剂量率约为0.5 mSv/d,短期飞行不会造成很大的剂量,辐射风险较小。登月等深空探测过程中脱离了地球的磁场保护,辐射剂量率约为近地轨道的2~3倍[5],在出舱活动或在较薄的屏蔽下遭遇大型SPE时,数小时到几天内深部器官剂量可高达1 Gy左右[6],导致急性确定性效应的风险增大,严重影响航天员健康、任务完成,甚至威胁生命。因此,短期深空飞行中SPE是主要的辐射风险因素,需对此进行重点防护。SPE中质子占绝大多数(96%~99%),其次为α粒子(1%~4%),还有少量的碳、氧、铁等重离子(约0.1%),且能量为100 MeV左右的质子注量率相对较大[7]。X射线和γ射线属于光子,能量在10 MeV以下,而质子属于带电粒子,能量可达上百兆以上。光子和带电粒子均为电离辐射,可引起原子电离产生自由基,引起生物大分子间接损伤,产生一系列的症状。但是质子等带电粒子因其能量高可以引起DNA等生物大分子直接损伤,尤其是簇状损伤,难以修复,因此引发的症状更为严重,具有更高的生物效能。一般而言,以光子的生物效能为1,质子的生物效能为1.1~2[3, 8-9]。脑是高级神经系统的主要部位,具有调控生命活动、精神活动和感觉运动等的功能。通常认为中枢神经系统具有辐射抵抗性,在较高剂量下才会出现神经血管症状,但中枢神经系统的调控功能辐射敏感性较高[3]。虽然光子对神经系统的生物效应研究较多,但是并不能精确地反映SPE(质子占绝大多数)的生物效应。本研究根据SPE的粒子类型、能量和剂量特点,选择能量为90 MeV的质子以及较低的剂量(0、0.1、0.3、0.5、1、2 Gy)在地面模拟太阳粒子事件,探究其对脑的影响,为空间辐射风险评估和辐射风险限值制定提供数据支撑。
表征脑损伤的指标众多,平衡木攀爬时间延长、转棒维持时间减少、新物体倾向性下降均说明行为能力下降[10-12]。树突棘与学习记忆能力相关,树突棘密度越小,学习记忆能力越差[13];尼氏小体负责合成更新细胞器所需的结构蛋白、神经递质所需的酶类以及肽类神经调质,正常尼氏体减少或异常尼氏小体增加说明神经元功能(合成蛋白)受损[14]。氧化应激是自由基在体内产生的一种负面作用,是氧化与抗氧化作用失衡的一种状态,也是导致疾病的重要因素,氧化应激反应越强烈,脑功能损伤越严重[15]。神经递质负责大脑内神经信息的传递,神经递质的含量可以反馈思维能力以及情绪变化方面的问题,神经递质异常越明显,脑功能损伤越严重。谷氨酸是兴奋性神经递质,GABA是抑制性神经递质,二者与学习记忆能力密切相关,二者水平异常增加,会对神经元产生兴奋性毒性[16-18]。海马神经细胞与学习记忆能力有关,其凋亡水平在一定程度上反映学习记忆能力损伤水平[19]。因此,本研究拟采用上述脑损伤相关指标进行质子脑损伤效应研究,进而探索量效关系及剂量阈值。
研究发现在1~2 Gy的较低剂量下,辐射可能导致中枢神经的电生理和神经生化代谢改变,引发厌食、恶心呕吐、疲劳、记忆下降、定向能力障碍和共济失调等症状[6]。本研究利用质子照射模拟太阳粒子事件发现,在较低剂量下小鼠出现行为学能力显著下降表型。深入分析发现小鼠脑组织病理学、氧化能力、神经递质水平和凋亡也发生了显著改变。这些结果进一步说明中枢神经系统易受到辐射的影响,载人航天飞行任务中应加强关注。
辐射剂量限值是载人航天辐射防护中的重要内容,限值制定的重要科学依据为辐射损伤阈值,阈值常通过下述两种方法获得:一是通过剂量-响应曲线的数学预测模型,推算发生一定概率的确定性效应时的剂量,作为剂量阈值。国际放射防护委员会(ICRP)103号报告指出,效应发生率为1%时的剂量,适合于样本量大的研究[20];二是通过统计学的显著性检验,根据发生显著损伤效应的最小剂量来预估。本研究采用后者,并且遵从确定性效应的特征,即剂量达到阈值时发生效应,高于阈值时,随着剂量增加,效应严重程度增加。同时,为了减少实验误差带来的影响以及突出照射实验因素的确定性效应,将2 Gy以下连续剂量点均发生显著性变化的最小剂量点作为阈剂量。
本研究结合文献调研的结果综合分析质子脑损伤阈值。对质子照射小鼠后19种脑损伤指标进行检测,发现质子照射在1 Gy时即可导致树突棘密度显著减小,尼氏小体显著减少,DA含量,Glu含量显著增加;在2 Gy时引发SOD活力下降,MDA含量增加,GABA含量升高,平衡木通过时间延长,转棒上攀爬时间减少,新物体识别倾向性下降,海马细胞凋亡增加,5-HT水平增加。根据产生显著效应的最小剂量作为阈剂量判定,质子照射导致动物脑损伤的阈值为1 Gy。本研究得出的脑损伤阈值与文献报道基本一致。Impey等[21]利用150 MeV的质子1 Gy照射后2周,研究表明,新物体识别能力下降,对新旧环境的区分能力下降,水迷宫空间记忆能力维持能力减弱,神经网络稳定性降低;Saw和Tang[22]、Tidmore等[23]发现,1 Gy的150 MeV质子照射小鼠可上调海马体中的各种氨基酸和总氨基酸合成,而氨基酸tRNA合成酶甲基化大部分下调,海马中胞嘧啶甲基化(5 mC)和羟甲基化(5 hmC)的表观遗传学变化,与动物行为变化相关。Cacao和Cucinotta[24]研究发现,1 Gy质子照射后1个月内引发神经干细胞转基因小鼠Ki67和Dcx标记的干细胞数量下降,引发C57BL/6小鼠新生活性胶质细胞增加,不成熟神经元在质子照射后270 d仍未恢复的剂量阈值为3 Gy。Davis等[25]采用雄性Fischer 344大鼠进行模拟人类精神警惕性测试(PVT),1 Gy或250 mGy的质子照射后22周,大鼠出现持续注意力下降,额叶皮质酪氨酸羟化酶和多巴胺转运蛋白增加。因此,推测引发脑显著损伤的阈值应为1 Gy。另外,本研究得出较低剂量范围内质子对14种脑损伤指标变化的剂量效应数学模型,对于辐射风险模型的建立具有一定的参考价值。
综上,针对登月等深空探测急性辐射剂量限值和SPE的风险模型尚不成熟、质子对脑效应的量效关系研究较少的情况,本项目通过模拟SPE的质子照射对脑的辐射损伤效应进行研究,获得行为学、蘑菇状树突棘密度、SOD活力、细胞凋亡等14种指标的剂量-效应的数学模型,推断脑损伤阈值为1 Gy,为载人深空飞行过程中乘员的脑组织限值制定和风险评估提供了数据支撑,也可为临床质子治疗的不良反应预估提供参考。后续还需要开展中子、重离子等不同类型的空间辐射对组织器官的远期随机性效应和确定性效应进行研究,为制定长期飞行剂量限值和风险评估模型的修订提供生物学依据。
利益冲突 无
志谢 感谢苏州大学林芳团队和中国原子能科学研究院隋丽团队提供的效应指标检测和质子照射方面的支持和帮助
作者贡献声明 张华负责课题设计与论文修改;娄鹏博、赵亚丽负责论文撰写和修改;冯伟伟、王红晖、雷鸣、刘畅负责实验操作和数据分析
| [1] |
Montesinos CA, Khalid R, Cristea O, et al. Space radiation protection countermeasures in microgravity and planetary exploration[J]. Life (Basel), 2021, 11(8): 829. DOI:10.3390/life11080829 |
| [2] |
Tofilon PJ, Fike JR. The radioresponse of the central nervous system: a dynamic process[J]. Radiat Res, 2000, 153(4): 357-370. DOI:10.1667/0033-7587(2000)153[0357:trotcn]2.0.co;2 |
| [3] |
Hu C, Zuo H, Li Y. Effects of radiofrequency electromagnetic radiation on neurotransmitters in the brain[J]. Front Public Health, 2021, 9: 691880. DOI:10.3389/fpubh.2021.691880 |
| [4] |
Hu S, Barzilla JE, Semones E. Acute radiation risk assessment and mitigation strategies in near future exploration spaceflights[J]. Life Sci Space Res (Amst), 2020, 24: 25-33. DOI:10.1016/j.lssr.2019.10.006 |
| [5] |
Boscolo D, Durante M. Dose limits and countermeasures for mitigating radiation risk in moon and Mars exploration[J]. Physics, 2022, 4(1): 172-184. DOI:10.3390/physics4010013 |
| [6] |
Hellweg CE, Berger T, Matthiä D, et al. Radiation in space: relevance and risk for human missions[M]. New York: Springer, 2020.
|
| [7] |
Restier-Verlet J, El-Nachef L, Ferlazzo ML, et al. Radiation on earth or in space: what does it change?[J]. Int J Mol Sci, 2021, 22(7): 3739. DOI:10.3390/ijms22073739 |
| [8] |
Gerweck LE, Kozin SV. Relative biological effectiveness of proton beams in clinical therapy[J]. Radiother Oncol, 1999, 50(2): 135-142. DOI:10.1016/s0167-8140(98)00092-9 |
| [9] |
Nakamura M, Yamasaki T, Ueno M, et al. Radiation-induced redox alteration in the mouse brain[J]. Free Radic Biol Med, 2019, 143: 412-421. DOI:10.1016/j.freeradbiomed.2019.08.020 |
| [10] |
Yan F, Tan X, Wan W, et al. ErbB4 protects against neuronal apoptosis via activation of YAP/PIK3CB signaling pathway in a rat model of subarachnoid hemorrhage[J]. Exp Neurol, 2017, 297: 92-100. DOI:10.1016/j.expneurol.2017.07.014 |
| [11] |
Mohan S, Koller EJ, Fazal JA, et al. Genetic deletion of PGF (2α)-FP receptor exacerbates brain injury following experimental intracerebral hemorrhage[J]. Front Neurosci, 2018, 12: 556. DOI:10.3389/fnins.2018.00556 |
| [12] |
Vergara-Ovalle F, Ayala-Guerrero F, Rosas C, et al. Novel object recognition in Octopus maya[J]. Anim Cogn, 2023, 26(3): 1065-1072. DOI:10.1007/s10071-023-01753-6 |
| [13] |
Zhou Y, Lu H, Liu Y, et al. Cirbp-PSD95 axis protects against hypobaric hypoxia-induced aberrant morphology of hippocampal dendritic spines and cognitive deficits[J]. Mol Brain, 2021, 14(1): 129. DOI:10.1186/s13041-021-00827-1 |
| [14] |
Zheng J, Hu S, Wang J, et al. Icariin improves brain function decline in aging rats by enhancing neuronal autophagy through the AMPK/mTOR/ULK1 pathway[J]. Pharm Biol, 2021, 59(1): 183-191. DOI:10.1080/13880209.2021.1878238 |
| [15] |
Wang H, Zhou XM, Wu LY, et al. Aucubin alleviates oxidative stress and inflammation via Nrf2-mediated signaling activity in experimental traumatic brain injury[J]. J Neuroinflammation, 2020, 17(1): 188. DOI:10.1186/s12974-020-01863-9 |
| [16] |
Struzyńska L, Sulkowski G. Relationships between glutamine, glutamate, and GABA in nerve endings under Pb-toxicity conditions[J]. J Inorg Biochem, 2004, 98(6): 951-958. DOI:10.1016/j.jinorgbio.2004.02.010 |
| [17] |
Nayak P, Chatterjee AK. Effects of aluminium exposure on brain glutamate and GABA systems: an experimental study in rats[J]. Food Chem Toxicol, 2001, 39(12): 1285-1289. DOI:10.1016/s0278-6915(01)00077-1 |
| [18] |
Kokhan VS, Matveeva MI, Bazyan AS, et al. Combined effects of antiorthostatic suspension and ionizing radiation on the behaviour and neurotransmitters changes in different brain structures of rats[J]. Behav Brain Res, 2017, 320: 473-483. DOI:10.1016/j.bbr.2016.10.032 |
| [19] |
Jin Z, Guo P, Li X, et al. Neuroprotective effects of irisin against cerebral ischemia/reperfusion injury via Notch signaling pathway[J]. Biomed Pharmacother, 2019, 120: 109452. DOI:10.1016/j.biopha.2019.109452 |
| [20] |
International Commission on Radiological Protection. The 2007 recommendations of the International Commission on Radiological Protection[M]. Oxford: Pergamon Press.
|
| [21] |
Impey S, Jopson T, Pelz C, et al. Bi-directional and shared epigenomic signatures following proton and 56Fe irradiation[J]. Sci Rep, 2017, 7(1): 10227. DOI:10.1038/s41598-017-09191-4 |
| [22] |
Saw G, Tang FR. Epigenetic regulation of the hippocampus, with special reference to radiation exposure[J]. Int J Mol Sci, 2020, 21(24): 9514. DOI:10.3390/ijms21249514 |
| [23] |
Tidmore A, Dutta SM, Fesshaye AS, et al. Space radiation-induced alterations in the hippocampal ubiquitin-proteome system[J]. Int J Mol Sci, 2021, 22(14): 7713. DOI:10.3390/ijms22147713 |
| [24] |
Cacao E, Cucinotta FA. Modeling heavy-ion impairment of hippocampal neurogenesis after acute and fractionated irradiation[J]. Radiat Res, 2016, 186(6): 624-637. DOI:10.1667/RR14569.1 |
| [25] |
Davis CM, DeCicco-Skinner KL, Hienz RD. Deficits in sustained attention and changes in dopaminergic protein levels following exposure to proton radiation are related to basal dopaminergic function[J]. PLoS One, 2015, 10(12): e0144556. DOI:10.1371/journal.pone.0144556 |
 2024, Vol. 44
2024, Vol. 44


