2. 浙江省疾病预防控制中心,杭州 310051
2. Zhejiang Provincial Center for Disease Control and Prevention, Hangzhou 310051, China
3H和14C均为弱β放射性核素[1],除天然生成以外,核试验、核电站的正常运行以及核事故等均会产生一定量的3H和14C [2-4]。氚在生物体内主要以组织自由水氚(TFWT)和有机结合氚(OBT)的形式存在[5],OBT的生物半排期远长于TFWT,因此需重点关注生物体内OBT的含量。目前生物样品中OBT和14C多数都是分开测定的,存在着费时费力、效率低下等问题[6-9]。采用氧化燃烧法联合分离可有效解决这一问题,但目前存在易爆燃、氧化不完全等问题[10],需对其进行进一步研究,以提高样品的实验回收率。由于海产品中氢和碳元素含量相差较大,氧化燃烧后如何得到适量对应产物以同时满足检测需求以及降低成本,同样也是亟需解决的问题。
本研究拟在前期海产品中14C分离检测研究基础上[11],改进六通道氧化燃烧和联合收集装置,有效解决氚水生成量少和收集二氧化碳所需试剂使用量大导致资源浪费的平衡问题,建立适用于海产品中OBT和14C联合分离的分析方法,系统性研究和比较影响方法分离和测量准确性的因素,评估分析过程中引入的不确定度,为海产品中OBT和14C的监测及放射性污染健康风险评估提供技术支持。
材料与方法 1、样品采集鲻鱼、对虾、梭子蟹、贻贝、海带等5种居民日常食用的代表性海产品各1 kg,清洗后取可食用部分,经真空冷冻干燥处理,得到的样品干样,研磨成粉末备用[11]。
2、仪器改进六道管式氧化燃烧装置(Pyrolyser-6 Trio,英国Raddec公司)[11],液体闪烁计数器(LSC-LB7,日本ALOKA公司),元素分析仪(FlashSmart,美国赛默飞世尔科技有限公司),真空冷冻干燥仪(FreezeZone 4.5 L,美国Labconco公司),万分之一电子天平(AB304-S,瑞士METTLER TOLEDO公司),干燥箱(M720,德国BINDER公司),研磨机(NB-YMY-48A,南北仪器有限公司)。
3、试剂所有试剂均为分析纯及以上纯度。氢氧化钠(NaOH)、氯化铵(NH4Cl)、氯化钙(CaCl2)(天津市大茂化学试剂厂),葡萄糖(上海凌峰化学试剂有限公司),高锰酸钾(KMnO4,杭州萧山化学试剂厂),二甲苯、曲拉通(上海麦克林生化科技有限公司),LSC闪烁液(ULTIMA GOLD uLLT,美国PerkinElmer公司)、2, 5-二苯基恶唑(PPO)、1, 4-双(5-苯基-2-恶唑基)苯(POPOP)(上海阿拉丁生化科技有限公司),3H标准溶液(介质为水,1 022 Bq/g,k = 2时扩展不确定度为0.025,中国计量科学研究院),Na214CO3标准溶液(介质为水,1 069 Bq/g,k = 2时,扩展不确定度为0.020,中国计量科学研究院)。
4、实验方法(1) 氢和碳元素含量测定及燃烧回收率的计算:分别称取5种海产品干样各1.5 mg,调节元素分析仪至CHNS模式,测定氢和碳元素含量后,计算水与碳酸钙(CaCO3)的理论量。氢和碳元素(包含所有氢和碳的同位素)燃烧回收率为氧化燃烧后水量和CaCO3实际收集量与其理论量的比值。
(2) 自制六通玻璃管:本研究根据六通道管式氧化燃烧装置的构造,设计了石英材质的六通玻璃管,其呈树杈形状,上下两层分枝间距10 cm,分别对应燃烧装置的上下两层的5根工作管,为进气口;主干全长15 cm,下端开口为出气口。各通道内径为3 mm,壁厚1 mm;各分支管与主干管的角度均为60°,以使六通玻璃管中少量冷凝水全部流入氚吸收管中,如图 1所示。
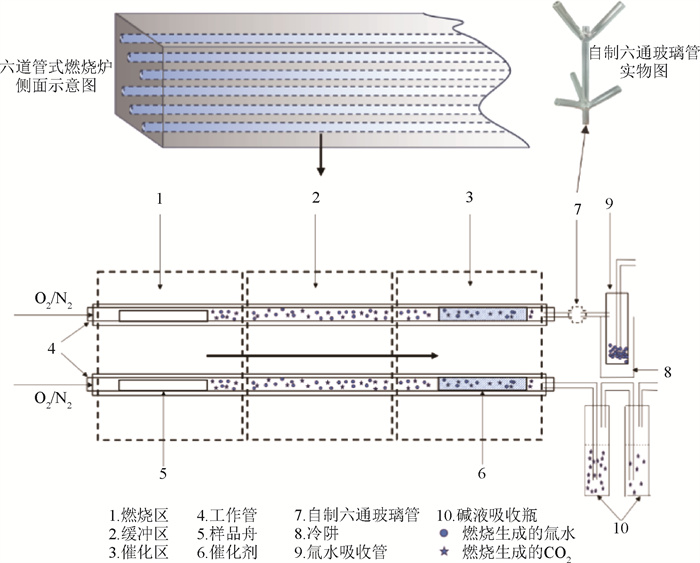
|
图 1 有机结合氚和14C联合分离示意图 Figure 1 Schematic diagram showing the simultaneous separation of OBT and 14C |
联合分离海产品中OBT和14C时,平行称取同一样品,分别放入燃烧炉的6个通道中,安装六通管安装完毕后,5个通道设置相同的3H氧化燃烧程序通过六通管导入氚吸收管收集冷凝水,剩余的1个通道设置14C氧化燃烧程序导入碱液吸收瓶收集CO2。
(3) 冷阱温度影响:平行称取5份5.0 g鲻鱼样品置于燃烧装置的5个通道中,气体流量设置为0.3 L/min,升温速率设置为3℃/min,从50℃加热到400℃,分别在200℃、300℃和400℃保持30 min,然后以5℃/min的升温速率升至800℃,在500℃、600℃和800℃保持30 min。以O2 ∶N2(78∶22)混合气为载气,冷阱温度为分别设为0℃与-110℃。分别称量氚吸收管收集前后质量,得到冷凝水实际收集量,按照前述方法计算不同冷凝温度下5管合并收集氢元素的燃烧回收率。
(4) OBT和14C联合分离:平行称取6份鲻鱼样品5.0 g置于氧化燃烧炉,气体流速设置为0.3 L/min,其中5个通道出口经六通管导入氚吸收管中收集OBT,另1通道用2个串联的各装有50 ml NaOH溶液(3.0 mol/L)的吸收瓶收集14C[11]。其他设置同前。
(5) 5管收集氚水与单管收集比较:平行称取5份5.0 g鲻鱼样品置于燃烧装置的5个通道中,各通道出口直接与氚吸收管连接,以分别收集各管燃烧产生的氚水。程序设置同前OBT分离方法。实验重复3次,分别称量收集前后各氚吸收管质量。
(6) 不同样品联合分离方法回收率:分别称取葡萄糖和5个不同种类海产品,每种样品各6份,每份5.0 g。每种样品的平行样分别放入燃烧炉的6个通道中,采用本研究建立的联合分离方法收集其中氢和碳元素,根据水及CaCO3实际收集量,分别计算各种样品的氢和碳元素燃烧回收率。
(7) 样品纯化:样品燃烧后冷凝收集的水参照以往研究纯化,用适量Na2O2调节pH至7左右,以1~3 g KMnO4与100 ml水样的比例回流2 h,蒸馏并收集中间部分馏出液8.0 g,此为氚水样品[12]。
14C样品按照前期研究结果,将吸收CO2后的NaOH溶液用NH4Cl调节pH至11.0后,加入饱和CaCl2溶液直至无沉淀生成,过滤取沉淀物(CaCO3),并用去离子水和无水乙醇清洗3次,烘干待测,此为14C样品[11]。
(8) 样品测量:取8.0 g纯化后的氚水样品与12 ml ULTIMA GOLD uLLT闪烁液充分混合,暗置12 h后,LSC测量1 000 min,根据样品计数率计算海产品中OBT活度浓度[12]。
称取2.0 g碳酸钙粉末与4 ml去离子水、14 ml自配闪烁液(7.0 g PPO和0.35 g POPOP用1 L二甲苯溶解后加入500 ml曲拉通)混合,暗置12 h后,LSC测量300 min,根据样品计数率计算海产品中14C活度浓度[11]。
(9) 干样中3H活度浓度计算:样品中3H的活度浓度见式(1)~(3):
| $ Y_{\mathrm{H}}=\frac{m_{\text {НТО }} \times 2}{m_1 \times w_{\mathrm{H}} \times 18} $ | (1) |
| $ \begin{aligned} A_{\mathrm{H}}= & \frac{\left(N_{\mathrm{x}}-N_0\right) \times m_{\mathrm{HTO}}}{0.06 \times \varepsilon \times m_2 \times m_1 \times Y}= \\ & \frac{\left(N_{\mathrm{x}}-N_0\right) \times w_{\mathrm{H}} \times 18}{0.06 \times \varepsilon \times m_2 \times 2} \end{aligned} $ | (2) |
| $ L D_{\text {Н }}=\frac{4.65 \times \sqrt{\frac{N_0}{t_0}} \times w_H \times 18}{0.06 \times \varepsilon \times m_2 \times 2} $ | (3) |
式中,YH为燃烧过程中氢的燃烧回收率,%;m1为燃烧装置中海产品干样品质量,g;mHTO为燃烧后收集的水量,g;wH为海产品中氢元素百分含量,%;18为水的相对分子质量;2为每物质量水中含有的氢的物质量;AH为海产品中3H的活度浓度,Bq/kg(干);Nx为分析样品的计数率,计数/min;N0为空白样的计数率,计数/min;ε为仪器计数效率,%;m2为测量所取的水量,g;LDH为方法探测下限,Bq/kg(干);t0为空白样的计数时间,min。本方法鲻鱼干样中3H探测下限为0.75 Bq/kg(干)。
(10) 干样中14C活度浓度计算:样品中14C的活度浓度见式(4)~(6)[11]:
| $ Y_{\mathrm{C}}=\frac{m_{\mathrm{CaCO}_3} \times 12}{m_1 \times w_{\mathrm{c}} \times 100} $ | (4) |
| $ \begin{aligned} A_{\mathrm{c}}= & \frac{\left(N_{\mathrm{x}}-N_0\right) \times m_{\mathrm{CaCO}_3}}{0.06 \times \varepsilon \times m_3 \times m_1 \times Y}= \\ & \frac{\left(N_{\mathrm{x}}-N_0\right) \times w_{\mathrm{c}} \times 100}{0.06 \times \varepsilon \times m_3 \times 12} \end{aligned} $ | (5) |
| $ L D_{\mathrm{C}}=\frac{4.65 \times \sqrt{\frac{N_0}{t_0}} \times w_{\mathrm{C}} \times 100}{0.06 \times \varepsilon \times m_3 \times 12} $ | (6) |
式中,YC为燃烧过程中碳的燃烧回收率,%;m1为燃烧装置中海产品干样品量,g;mCaCO3为样品燃烧后获得CaCO3的量,g;wc为海产品中碳元素含量,%;12为碳的相对分子质量;100为CaCO3的相对分子质量;Ac为海产品中14C的活度浓度,Bq/kg(干);Nx为分析样品的计数率,计数/min;N0为空白样的计数率,计数/min;ε为仪器计数效率,%;m3为测量所取CaCO3的量,g;LDC为方法探测下限,Bq/kg(干);t0为空白样的计数时间,min。本方法鲻鱼干样中14C探测下限为28.88 Bq/kg(干)。
(11) 不确定度评估:根据海产品中3H和14C的计算公式,影响结果不确定性的主要来源包括A类不确定度:仪器计数不确定度urel(Nx);B类不确定度:样品称量不确定度urel(m)、仪器计数效率的不确定度urel(ε)和元素分析的不确定度urel(w)。最终的不确定度由各分量合成后为相对标准不确定度和扩展不确定度。
合成相对标准不确定度urel按式(7)计算:
| $ u_{\mathrm{rel}}=\sqrt{u_{\mathrm{rel}}^2\left(N_x\right)+u_{\mathrm{rel}}^2(m)+u_{\mathrm{rel}}^2(\varepsilon)+u_{\mathrm{rel}}^2(w)} $ | (7) |
本研究以鲻鱼样品中OBT和14C检测过程为例,估算该检测方法各不确定度分量。A类不确定度主要贡献是计数率统计误差,见式(8):
| $ u_{\mathrm{rel}}\left(N_x\right)=\frac{\sqrt{\frac{N_x}{t_x}+\frac{N_0}{t_0}}}{N_x-N_0} $ | (8) |
式中,tx为样品的计数时间,min。
B类不确定度中样品称量不确定度urel(m)主要包含天平偏载误差U1和重复性U2。根据校准证书,万分之一天平允许误差为0.1 mg,按照矩形分布,
| $ u_{r e l}(m)=\frac{\sqrt{U_1{ }^2+U_2{ }^2}}{m_i \times 1000} $ | (9) |
式中,mi为测量所取的水量m2或碳酸钙的量m3,g
仪器计数效率的不确定度urel(ε)主要来源是仪器测量的准确度和重复性u1。3H标准溶液的不确定度为0.025(k=2),14C标准溶液的不确定度为0.020(k=2),因此其相对不确定度分别为0.012 5和0.010。分别重复测定3H和14C标准溶液10次,计算其测量结果相对标准偏差u1(OBT)和u1(C)可分别得到重复性不确定度。按式(10),(11)计算测量OBT和14C时计数效率的不确定度:
| $ u_{\mathrm{rel}}\left(\varepsilon_{\mathrm{OBT}}\right)=\sqrt{0.0125^2+u_1(\mathrm{OBT})^2} $ | (10) |
| $ u_{\mathrm{rel}}\left(\varepsilon_{\mathrm{C}}\right)=\sqrt{0.010^2+u_1(\mathrm{C})^2} $ | (11) |
元素分析的不确定度urel(w)可通过计算多次重复测量结果的相对标准偏差得出。
结果 1、冷阱温度的影响结果冷阱的温度对氚水收集会产生明显影响,温度越低,氚水冷凝的速度越快。3次平行实验结果显示,当冷阱温度为0℃时,氚水实际收集量为12.26~12.91 g,平均燃烧回收率为81.8%,相对标准偏差为2.6%;冷阱温度为-110℃时,氚水实际收集量为14.76~15.31 g,平均燃烧回收率为97.3%,相对标准偏差为1.9 %。为提高氚水冷凝效率,本研究选择冷凝温度为-110℃冷阱。
2、海产品中OBT和14C联合分离联合分离方法如图 2所示,完成整个氧化燃烧过程所需时间约为6.3 h。燃烧完成后,样品残渣呈灰白色,氚吸收瓶中收集的冷凝水为无色澄清液体。
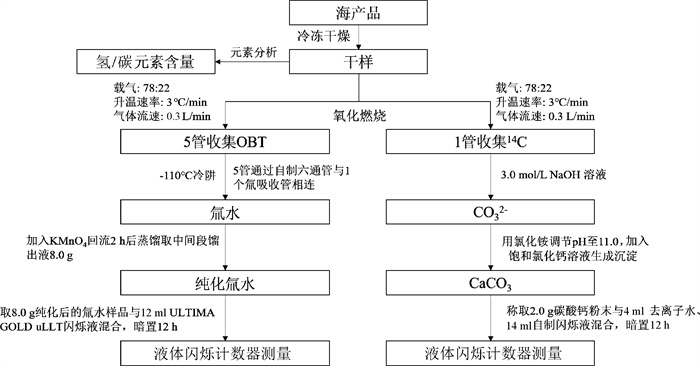
|
图 2 海产品中OBT和14C联合分离流程图 Figure 2 Flow chart of the method for simultaneous separation of OBT and 14C in marine products |
3、收集方式的影响结果
收集的氚水经KMnO4氧化后,需一次或多次蒸馏提纯,损失较大,为满足LSC检测用量,应尽可能提高氚水收集量。采用设备原有设计,单个氚吸收管收集的氚水量为2.81~3.01 g,合并后的氚水量为(14.56±0.15)g。采用六通管,一次性可收集到的氚水量为(14.98±0.29)g,收集量得到提高。
4、不同样品燃烧回收率葡萄糖中氢和碳的燃烧回收率分别为98.7%和93.1%,鲻鱼、对虾、梭子蟹、海带、贻贝5种海产品中氢和碳燃烧回收率分别为92.5%~97.3%和82.7%~96.3%,相对标准偏差均<5%。具体结果列于表 1。
|
|
表 1 5种海产品及葡萄糖中氢和碳燃烧回收率 Table 1 Combustion-based recovery of H and C in five types of marine products and glucose |
5、不确定度评估结果
10次重复性称量结果标准偏差为0.074 mg,按式(9)计算样品称量不确定度见表 4。3H和14C标准溶液重复测定结果相对标准偏差分别为0.002 0和0.004 0。由此可分别计算测量OBT和14C时计数效率的不确定度:
| $ u_{r e l}\left(\varepsilon_{O B T}\right)=\sqrt{0.0125^2+0.0020^2}=0.013 $ |
| $ u_{r e l}\left(\varepsilon_C\right)=\sqrt{0.010^2+0.0040^2}=0.011 $ |
不确定度分量及其贡献率结果列于表 2。OBT和14C检测不确定度贡献来源基本一致,计数引入的不确定度贡献最大,贡献率分别为78.31 %和77.03 %,其次是元素分析和计数效率引入的不确定度,称量引入的不确定度均在0.1 %以下。
|
|
表 2 不确定度分量及贡献率 Table 2 Uncertainty components and contributions |
讨论
本研究在分离海产品中14C的研究基础上,利用燃烧装置以及自研六通玻璃管优势,针对联合分离OBT和14C时存在的冷阱温度影响收集效率、目标产物生成量差异过大等关键问题展开了研究,有效提高了海产品中OBT和14C联合分离效率。
不同冷凝温度对于氚水收集的影响较大,5通道合并收集氚水时,通过氚吸收管的气体流速增加较快,在短时间内需要更低的温度将通过氚吸收管的水蒸气迅速冷凝以提升收集效率。实验结果表明,与0℃相比,-110℃冷凝温度下的氢元素燃烧回收率从81.8%提升至95.3%。
为满足联合分离及LSC测量要求,收集氚水所需的海产品干样量远大于收集14C所需的海产品干样量,在满足氚水收集量的情况下,海产品干样燃烧产生的二氧化碳需要大量的碱吸收液来吸收,同时也需要较多量的NH4Cl和CaCl2等化学试剂[13],造成大量的浪费以及环境污染。本研究采用的六通道管式燃烧炉结合自制六通玻璃管,有效地解决了上述问题。一次性收集5个通道中的氚水且其收集量高于单管收集合并后的量,既可有效解决氚水产生较少无法满足LSC检测、多次氧化燃烧带来的费力耗时及资源消耗较大等问题,又可以解决常规做法中多管收集再转移合并所产生的损耗问题;收集1个通道中产生的CO2可大大减少所需试剂用量,NaOH溶液仅需100 ml,用量相比标准方法(500 ml)仅为五分之一,后续处理所需NH4Cl和CaCl2等试剂也相应减少[13]。
本研究方法条件下,葡萄糖中氢和碳元素的燃烧回收率分别为98.7%和93.1%,氢元素的燃烧回收率高于Chen等[14]的研究(93.7%),表明氢和碳的燃烧和收集效果较好。3次平行性实验相对标准偏差均在5 %以内,表明该方法具有良好精密度。海产品氢和碳燃烧回收率整体水平低于葡萄糖,主要是由于葡萄糖化学结构简单,更容易在高温下发生氧化反应,因此葡萄糖的燃烧结果不能完全代表实际样品。不同种类海产品燃烧结果差异较大,可能与不同样品中脂肪、蛋白质含量不同有关,表明相同条件下样品基质不同会导致燃烧效率存在差异。海产品中氢元素燃烧回收率高于碳元素,一方面可能氢比碳更容易被氧化,另一方面,碳的收集很容易因沉淀、过滤、洗涤等复杂操作而发生损失。元素分析仪的引入虽然可为实际样品燃烧回收率的确定带来便利,但由于测定元素含量时,样品量仅为1.5 mg,取样代表性问题仍有待进一步研究。
不确定度研究结果显示,仪器计数引入的不确定度贡献最大,均在75%以上,其主要原因可能与样品计数越小,仪器测量时波动水平越大有关,与文献结果一致[15-16]。其次是元素含量分析和计数效率的不确定度,称量引入的不确定度可忽略不计。本研究结果也为下一步研究提供了思路,比如可开展测量时间、本底样品、电解浓缩等对计数不确定度以及探测下限影响的研究,以进一步提高方法准确性。
本研究基于前期对于海产品中14C的检测方法研究,通过优化收集条件,建立了适用于不同种类海产品中OBT和14C的联合分离方法,该联合分离体系分离效果良好,可在6.3 h内完成OBT和14C的同时处理和高效收集,显著缩短处理时间,满足应急条件下快速、准确的测量要求;六通道管式燃烧炉联合自制六通管可有效解决氚水生成量少和收集二氧化碳所需试剂使用量大导致资源浪费的平衡问题,符合绿色化学的发展方向。进一步针对分析过程的特殊和复杂性,对方法不确定度分量进行了科学评定和量化,为提高检测准确度提供了技术参考。
利益冲突 无
作者贡献声明 曹艺耀负责实验、数据分析、文章撰写和修改;任鸿负责样品采集和处理;尹亮亮负责数据分析和论文修改探讨;吉艳琴负责实验方案设计、组织实验、指导文章撰写和修改
| [1] |
Babin V, Taran F, Audisio D. Late-stage carbon-14 labeling and isotope exchange: emerging opportunities and future challenges[J]. JACS Au, 2022, 2(6): 1234-1251. DOI:10.1021/jacsau.2c00030 |
| [2] |
United Nations Scientific Comittee on the Effects of Atomic Radiation. UNSCEAR report 2000 Sources and effects of ionizing radiation[R]. New York : UNSCEAR, 2000.
|
| [3] |
Blowers P, Caborn J, Dell T, et al. Determination of carbon-14 in environmental level, solid reference materials[J]. Appl Radiat Isot, 2011, 69(10): 1323-1329. DOI:10.1016/j.apradiso.2011.01.011 |
| [4] |
Zhao C, Wang G, Zhang M, et al. Transport and dispersion of tritium from the radioactive water of the Fukushima Daiichi nuclear plant[J]. Mar Pollut Bull, 2021, 169: 112515. DOI:10.1016/j.marpolbul.2021.112515 |
| [5] |
DeVol TA, Powell BA. Theoretical organically bound tritium dose estimates[J]. Health Phys, 2004, 86(2): 183-186. DOI:10.1097/00004032-200402000-00009 |
| [6] |
Krištof R, Chipanovska N, Kožar Logar J. Determining the amounts of organically bound tritium and radiocarbon using a combined preparation step and liquid scintillation spectrometry[J]. J Radioanal Nucl Chem, 2023, 332(5): 1521-1526. DOI:10.1007/s10967-022-08586-6 |
| [7] |
赵新景, 丁洪深, 刘文娜. 环境生物样品中氚分析测量方法研究[J]. 中国辐射卫生, 2019, 28(5): 525-527. Zhao XJ, Ding HS, Liu WN. Study on tritium analysis and measurement method in environmental organisms samples[J]. Chin J Radiol Health, 2019, 28(5): 525-527. DOI:10.13491/j.issn.1004-714x.2019.05.014 |
| [8] |
刘文娜, 丁洪深, 赵新景. 生物样品中碳-14分析测量方法探讨[J]. 中国辐射卫生, 2022, 31(4): 433-436. Liu WN, Ding HS, Zhao XJ. Analysis and measurement method for carbon-14 in biological samples[J]. Chin J Radiol Health, 2022, 31(4): 433-436. DOI:10.13491/j.issn.1004-714X.2022.04.009 |
| [9] |
Lin F, Yu W, Guo J, et al. A method for the determination of organically bound tritium in marine biota based on an improved tubular-combustion system[J]. J Environ Radioact, 2020, 211: 106084. DOI:10.1016/j.jenvrad.2019.106084 |
| [10] |
Nayak SR, D'Souza RS, Purushotham MM, et al. Determination of organically bound tritium (obt) concentration in fish by thermal oxidation and liquid scintillation counting method[J]. Health Phys, 2021, 120(1): 1-8. DOI:10.1097/HP.0000000000001279 |
| [11] |
Cao Y, Qian Y, Ren H, et al. Determination of carbon-14 in marine biota using oxidation combustion and gel suspension liquid scintillation counting[J]. Food Chem, 2024, 437(Pt 2): 137914. DOI:10.1016/j.foodchem.2023.137914 |
| [12] |
Ren H, Ma X, Zhou L, et al. Toward an efficient determination of tissue-free water tritium in food[J]. Front Public Health, 2023, 11: 1185938. DOI:10.3389/fpubh.2023.1185938 |
| [13] |
生态环境部. HJ 1324-2023生物中氚和碳-14的分析方法 管式燃烧法: [S]. 北京: 生态环境部环境标准研究所, 2023. Ministry of Ecology and Environment of the People's Republic of China. HJ 1324-2023 Determination of tritium and carbon-14 in biological samples-Tube furnace oxidation combustion method[S]. Beijing: Standards Press of China, 2023. |
| [14] |
Chen Q, Zhao G, Chen C, et al. Verification of combustion rate of recovery and counting efficiency in the analysis of organically bound tritium in biota samples[J]. Appl Radiat Isot, 2022, 184: 110202. DOI:10.1016/j.apradiso.2022.110202 |
| [15] |
Yan LL, Ge X, Xiong Q, et al. Uncertainty evaluation for determination of 14C in urine samples by wet oxidation method[J]. Radiat Med Prot, 2021, 2(4): 171-175. DOI:10.1016/j.radmp.2021.10.002 |
| [16] |
陈飞, 申宝鸣, 尹亮亮, 等. 液闪法测量尿氚的不确定度评估[J]. 中国辐射卫生, 2016, 25(3): 349-351+355. Chen F, Shen BM, Yin LL, et al. Uncertainty evaluation for determination of tritium in urine samples with liquid scintillation counter[J]. Chin J Radiol Health, 2016, 25(3): 349-351+355. DOI:10.13491/j.cnki.issn.1004-714x.2016.03.034 |
 2024, Vol. 44
2024, Vol. 44


