2. 上海联影医疗科技股份有限公司,上海 200232;
3. 深圳市联影高端医疗装备创新研究院,深圳 518125
2. Shanghai United Imaging Healthcare Co., Ltd., Shanghai 200232, China;
3. Shenzhen United Imaging Research Institute of Innovative Medical Equipment, Shenzhen 518125, China
在宫颈癌放疗中,女性骨盆解剖结构的复杂性及其在治疗过程中的动态变化对放疗的精准性和效果构成重大挑战:首先是子宫本身的运动,子宫尖部随膀胱充盈在不同方向的运动范围可达65 mm[1],而子宫运动中亦存在极端的宫底位移和子宫旋转情况[2];膀胱在放疗过程中经历持续变化,影响器官本身以及靶区体积和/或其他器官[3];直肠体积变化与靶区体积位移也有显着关系,直肠充盈对子宫颈和上段阴道影响更大[4]。此外,放疗过程中肿瘤体积和形态变化也需考虑,特别是在放疗第2周至第3周,宫颈肿瘤缩退和形变显著改变了器官相对位置[5]。另一方面,放疗技术的进步虽提高了宫颈癌局部控制率[6],但消化系统不良反应仍然严重,如调强放射治疗(intensity-modulated radiation therapy,IMRT)患者中高达70%出现胃肠道不良反应[7]。
在线适应性放疗(online adaptive radiation therapy,OART)结合了个体化、精准化、智能化和多模态融合的特点,旨在提高放疗效果及患者生活质量[8]。人工智能(artificial intelligence,AI)在OART中起着关键作用,尤其是在器官自动分割和在线自动计划优化方面。目前已有32%的放疗中心采用OART进行宫颈癌放疗[9]。本团队在前期提出了基于深度学习的靶区分割方案,大幅提高了分割速度和精度[10]。同时,低剂量扇形束计算机断层扫描(fan beam computed tomography,FBCT)的应用降低了成像剂量,满足临床需求[11]。本研究旨在深入探讨宫颈癌放疗中的解剖学变化和技术挑战,并评估OART在提高治疗精准性和减少不良反应中的潜力。
资料与方法 1、患者准备(1) 入排标准:苏州大学附属第一医院自2023年1月在uRT-linac 506c上正式开展包括宫颈癌OART工作(苏州大学附属第一医院,2023伦理审批第318号)。共纳入11例宫颈癌患者,其中1例为根治性放疗患者,10例为术后辅助放疗患者。纳入标准:①经病理学明确诊断为宫颈癌,国际妇产科联盟(FIGO)I~ⅣA期患者。②年龄20~75岁。③一般状况良好,卡氏评分≥70分。④预期寿命≥6个月。⑤各器官功能基本正常。⑥未接受过盆腔局部放射治疗。排除标准:①既往接受过盆腔局部放疗。②一般状况较差,卡氏评分<70分。③怀孕的患者。④有严重、未控制的器质性病变或感染。⑤存在第二原发肿瘤。⑥计划放疗开始后4周内接受手术干预治疗。
(2) 临床特征:宫颈癌患者平均年龄(52.73 ± 5.59)岁,其中原发灶为鳞癌8例,腺癌3例。所有患者均按期完成OART,1例根治性患者在OART后按期完成CT引导的后装腔内放疗。共有8例患者接受了含铂化疗,6例为序贯放化疗,2例为同步放化疗。具体临床资料详见表 1。
|
|
表 1 11例宫颈癌患者的临床特征 Table 1 Clinical characteristics of 11 cervical cancer patients (n= 11) |
2、放疗定位与计划制定
(1) CT定位及扫描:患者在定位CT扫描,排尿后饮水500 ml。所有患者均采用荷兰飞利浦定位CT机(Brilliance CT Big Bore)进行模拟CT定位,均行CT增强扫描,层厚3 mm。扫描范围为胸11椎体上缘至坐骨结节下5 cm。CT定位图像传输至uRT-TPOIS放疗计划系统(TPS),由TPS自带AI勾画插件作感兴趣区域(ROI),即治疗靶区及OAR自动分割,定义为ROIauto,由高年资放疗医师修改并审核的靶区作为ROIedit,根据修改程度,将ROIauto评估定性为优秀(修改程度≤10%)、良好(10%<修改程度≤20%)、合格(20%<修改程度≤40%)与不合格(修改程度>40%)。
(2) 定义ROI:目标靶区:根据放射治疗肿瘤学研究组(RTOG)及日本临床肿瘤学研究组(JCOG)靶区勾画指南定义靶区勾画范围,如临床靶区(CTV)及阳性淋巴结肿瘤靶区(GTVnd)。危及器官(OAR):对于射野区域内的膀胱、骨盆、小肠、结肠、乙状结肠、左侧股骨头、右侧股骨头、直肠、脊髓分别定义为OAR组织。计划靶区:所有CTV及GTVnd往头、脚、腹、背、左、右6个方向均外扩5 mm作为计划靶区(PTV)。
(3) 处方剂量:术后辅助放疗,PTV:45~50.4 Gy/25~28次,阳性淋巴结计划靶区(PGTVnd)54~56 Gy/25~28次;根治性放疗,PTV:50.4 Gy/28次,PGTVnd 58.8 Gy/28次。
3、OART临床实践流程(1) OART流程:采用上海联影uRT-linac 506c直线加速器实施容积旋转调强放射治疗(VMAT),11名患者每周治疗5次,1次/d。每日OART前行低剂量FBCT扫描,扫描条件:管电压为120 kV,管电流为24 mA,根据美国医学物理学家协会(AAPM)第96号报告[12],腹盆腔组织权重系数为0.015 mSv ·mGy-1 ·cm-1,低剂量条件下腹盆腔的有效剂量为0.71 mSv。随后进行影像引导放射治疗(IGRT),将分次内FBCT图像和定位CT图像进行配准,由高年资放疗医师观察配准结果并判断是否触发OART。若不触发OART则按原计划进行放疗,若触发则进入OART流程。进入OART流程后,可选择自动勾画、形变拷贝或刚性拷贝任意一种方式,在当前FBCT图像上生成ROI勾画,作为ROIOART,ROI轮廓由高年资放疗医师审核、修改、确认,作为ROIOART-edit。随后由物理师即时创建OART计划。因自适应优化算法在推算剂量学参数时参考了原计划剂量分布,如将自适应计划全局最大剂量控制在与原始计划相同水平,故OART计划生成在一定程度上复制了原计划。待计划生成后,由高年资放疗医师与物理师共同评估计划效果,评估后进行批准和排程。计划同步到治疗后交付应用程序端后,由技术员执行出束治疗。
(2) OART计划质量评估:将初始原计划通过刚性拷贝导入到分次FBCT内,生成IGRT计划。采用卷积算法对IGRT计划进行剂量计算,得到原计划应用在分次FBCT内剂量分布。采用靶区平均剂量、OAR平均剂量、适形指数(CI)及均匀性指数(HI)评估OART计划与分次IGRT计划质量优劣。分次治疗间,出束治疗时启用基于电子射野影像系统的在体剂量测定,对患者受照剂量进行实时监测,在3%/3 mm基准下2D-γ通过率>95%视为计划通过。
(3) 临床实践:11名患者经高年资放疗医师判断,启动OART共81次。局部晚期宫颈癌患者联合顺铂40 mg/m2每周增敏化疗。收集OART过程中每个工作模块独立计时,包括ROI修改及审核、OART计划优化、OART计划评估、出束治疗时长4个步骤。在本研究中,平均总时长不包含摆位时间,OART调整平均时长不包含摆位时间及出束治疗时间。每次分次照射过程均由受过OART流程化训练的高年资放疗医师、物理师与技术员各1名参与。
(4) OART触发因素分析:对11例宫颈癌患者的FBCT作回顾性分析,统计触发分次下患者关键OAR(膀胱、直肠、小肠、结肠)的变化情况。分析触发分次内ROIOART与ROIOART-edit之间的形态差异。在排除特殊临床情况、数据处理等问题造成的干扰分次后,对所有触发分次内膀胱体积、直肠/小肠+结肠与靶区的重叠情况进行分析。
(5) OART放疗不良反应评估:参照NRG/RTOG 1203临床研究[13]针对宫颈癌OART急性胃肠道、泌尿系统及造血系统不良反应,依据患者自主报告版本的《常见不良事件评价标准》(PRO-CTCAE)进行评估,在放疗开始后1~ 6周,每周均采集数据1次。
4、数据预处理(1) 轮廓分析参数选定与处理:对于靶区及正常组织的轮廓分析,将ROIauto、ROIedit、ROIOART、ROIOART-edit,从URT-TPOIS导出,通过Dice相似系数(DSC)与95%豪斯多夫距离(HD95%)对两者进行定量比较。
(2) 计划评估参数选定与处理:目标ROI包括:CTV、PTV、GTVnd、PGTVnd、膀胱、直肠、脊髓、结肠、乙状结肠、小肠、左/右侧股骨头、骨盆;体积参数包括各ROI绝对体积;剂量参数包括Dmax、D15%、Dmin、Dmean、V30 Gy、V40 Gy、V45 Gy。累积剂量的准确性在很大程度上取决于图像变形初始步骤产生的形变矢量场。据报道,不同形变配准方法的误差变化很广,从1到10 mm不等[14],具体取决于疾病部位和所使用的形变配准算法。根据肿瘤部位、图像模式和质量、形变配准算法、参数选择、器官体积/运动和其他因素,累加剂量可能会造成更大偏差。因此,参考Shelley等[15]研究方法,在剂量分析采用各分次OART计划中ROI的剂量学指标,累计相加后取平均值,再与IGRT计划相关参数作比较。
采用SPSS 26.0软件进行分析。对具有正态分布的数据采用t检验进行分析,对非正态分布数据或异质方差的数据采用Wilcoxon秩和检验分析。采用二分类logistic回归分析,对11例宫颈癌患者作触发OART的回顾性分析。P<0.05为差异有统计学意义。
结果 1、OART ROI勾画质量评估在OART流程中,OAR均采用AI自动分割,医生审核OAR勾画效果并进行修改。若自动勾画效果满足医生勾画要求,在OART流程中没有额外修改,则认为ROIauto与ROIedit相同,此时DSC为1。
11例患者在定位CT上经AI辅助勾画工具自动分割ROI,得到ROIauto经高年资放疗医师修改及审核后得到ROIedit,其中CTV的DSC为0.85 ± 0.04,不劣于前期发表模型构建的DSC 0.89 ± 0.02[16] (P=0.185);HD95%为(5.64 ± 1.60)mm,优于前期发表模型构建的HD95%[18][(6.28 ± 2.31) mm;t =-2.34,P < 0.05]。在297个分次治疗中,经高年资放疗医师判断,启动81次OART,所有OAR均作自动分割处理。鉴于基线定位靶区是由ROIauto经高年资放疗医师处理后评价结果均为优秀的ROIedit,故OART启动后靶区轮廓分割策略为优先采用CTV刚性拷贝+高年资放疗医师修改。
其中76分次(94%)为CTV刚性拷贝+ OAR ROIOART,5分次(6%)为CTV ROIOART + OAR ROIOART。所有ROIOART经高年资放疗医师修改并审核后生成ROIOART-edit。OART ROI勾画中,CTV有所修改,修改程度用DSC和HD95%来体现。除1个FBCT中乙状结肠存在修改,其他OAR均无修改,即DSC=1,HD95%=0 mm。
2、OART计划质量评估OART计划质量评估:表 2为宫颈癌患者OART与IGRT中靶区95%实际剂量与处方剂量的比较,表 3为宫颈癌患者OART与IGRT中各OAR物理参数的比较。由表 2可知,OART中靶区的热点(Dmax)与冷点(Dmin)分布接近,且OART计划中PTV Dmin明显高于IGRT计划(t=3.52,P < 0.001),表明OART计划较IGRT计划更具剂量学优势。
|
|
表 2 宫颈癌患者OART与IGRT中靶区95%实际剂量与处方剂量的比较(%) Table 2 Comparison between the actual doses and prescribed dose to 95% of target volumes in OART and IGRT plans for cervical cancer patients (%) |
|
|
表 3 宫颈癌患者OART与IGRT中各OAR物理参数的比较(x±s) Table 3 Comparison of physical parameters for each OAR in OART and IGRT plans for cervical cancer patients(x±s) |
(1) 靶区剂量:OART计划中,CTV、PTV、GTVnd、PGTVnd的平均剂量与处方剂量之比均低于分次IGRT中各ROI对应的平均剂量与处方剂量之比,其中有统计学意义的ROI为CTV(P=0.004)与PTV(P=0.035),表明OART计划的靶区平均剂量分布更为紧凑,且剂量整体更接近处方剂量(表 3)。
(2) OAR剂量:OART计划中,膀胱(P=0.005)、直肠(P=0.003)、脊髓(P=0.003)、结肠(P=0.001)、小肠(P=0.004)、左/右侧股骨头(P<0.001)、骨盆(P=0.005)平均剂量均低于分次IGRT中各OAR对应的平均剂量。此外,OART计划中左/右侧股骨头D15%显著低于IGRT计划(P<0.001),结肠与直肠的V30 Gy、V40 Gy、V45 Gy显著低于IGRT计划(P < 0.05)。上述结果表明OART计划的OAR剂量控制更贴近临床要求,OAR受照剂量显著低于IGRT计划(表 3)。
(3) CI、HI和2D-γ通过率:OART计划的CI为0.966 ± 0.006,优于分次IGRT计划的0.952 ± 0.025(P<0.001);HI为0.079 ± 0.040,优于IGRT计划的0.099 ± 0.048(P<0.001)。所有射束在3%/3 mm基准下2D-γ平均通过率为99.1%,最小通过率为97.3%,表明OART计划均通过质量控制要求。
3、OART临床实践示于图 1。由图 1可见,病例1,56岁,宫颈腺癌,FIGO ⅡA1期,行术后同步放化疗,该分次治疗时如按照原计划执行,将出现治疗脱靶,而OART计划能够保证靶区覆盖;病例2,54岁,宫颈鳞癌,FIGO ⅢC1期,行根治性同步放化疗,治疗后期靶区缩小,OART计划靶区覆盖更好,膀胱和直肠剂量均低于IGRT计划。
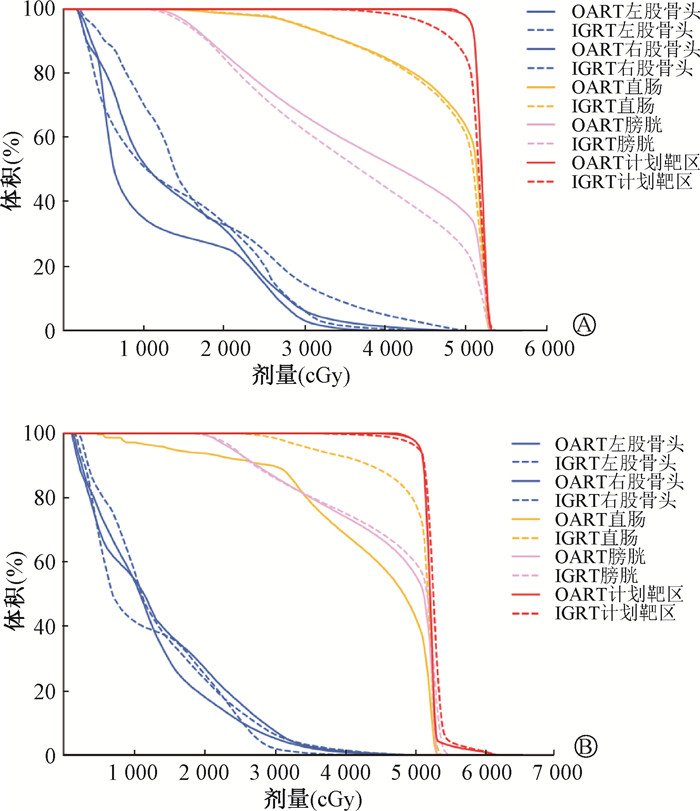
|
注:OART. 在线自适应放疗; IGRT. 图像引导放疗; DVH. 剂量体积直方图 图 1 宫颈癌患者OART计划与IGRT计划比较的DVH图 A. 病例1;B. 病例2 Figure 1 Dose-volume histograms showing the comparison between OART and IGRT plans for cervical cancer cases A. Case 1; B. Case 2 |
4、OART流程时效性评估
OART流程平均总时长为18.97 min,OART调整平均时长为15.87 min,人均启动OART 7.4次。不同流程模块中,ROI修改及审核、OART计划优化、OART计划评估、出束治疗时长的平均时长分别为3.42、3.37、1.33和3.10 min。
5、ROI形变观察结果列于表 4。由表 4可知,分次间靶区体积变化情况:CTV体积变化范围较小,与定位CT中初始体积相比,不同分次的CTV体积相对误差主要集中在±5%的范围内,最大值不超过25%。但第5例患者在放疗中因膀胱体积缩小显著,导致分次CTV与定位CT中CTV体积的相对误差减少百分比达到15%~25%,累计5个放疗分次。此外,随着靶区剂量施予,GTVnd体积有退缩趋势。此外,分次间OAR体积变化情况:不同分次间,膀胱、直肠、脊髓、结肠、乙状结肠、小肠的体积变化范围波动较大,且无明显规律。其中,不同分次内直肠体积的相对误差主要集中在±50%的范围,但最大值超过150%,即位定位CT中直肠体积的2.5倍以上;对于膀胱,不同分次内体积的相对误差主要集中在±100%,最大值接近100%,即定位CT中膀胱体积的2倍。
|
|
表 4 宫颈癌患者OART过程中ROI体积与定位CT中对应器官体积的相对误差(%) Table 4 Relative errors between the volumes of ROIs during OART and those of corresponding organs in the CT images for positioning for cervical cancer patients (%) |
6、OART触发因素分析
以膀胱为触发主因的分次中,膀胱体积减小均值为43.21%,减小变化阈值为11.82%,增大均值为33.37%,增大变化阈值为12.35%。以肠道体积为触发主因的分次中,直肠与CTV重叠区域增大的均值为96.94%,增大体积阈值为18.15%。小肠+结肠与CTV重叠区域增大的均值为123.69%,增大体积阈值为40.65%。
因此,宫颈癌OART触发判断思路:优先考虑膀胱变化,当膀胱变化幅度超过12%,考虑触发OART流程;当膀胱变化 < 12%时,满足以下任意一点便可考虑触发OART流程:直肠与CTV重叠区域增加超过18%,或小肠+结肠与CTV重叠区域增加超过40%。
7、OART急性不良反应11例宫颈癌患者在OART过程中,造血系统急性不良反应以白细胞计数减少、中性粒细胞计数减少和贫血为主,消化系统急性不良反应以腹泻症状为主,泌尿系统急性不良反应以尿频、尿急、非感染性膀胱炎为主。发生急性不良反应均为PRO-CTCAE 1~2级,未见3级及以上的不良反应发生。OART患者在放疗开始后第3周起不良反应发生率增加,在放疗结束时不良反应发生率达到峰值。出现急性不良反应的患者,临床予粒细胞集落刺激因子、纠正贫血、止泻、调整肠道菌群、碱化尿液等对症处理后,相关不良反应缓解。
讨论Yan等[19]提出了自适应放射治疗的概念,用以定制患者的个体化放疗方案。自适应放疗在提高PTV覆盖率的同时能减少OAR的受照剂量。在妇科肿瘤外照射放疗中,自适应放疗的启用可以增加靶区的适形性,同时提高对OAR的剂量控制[20]。在宫颈癌放疗领域,膀胱与直肠的充盈程度以及解剖位移等器官动态变化对常规外照射带来挑战,而自适应放疗可以解决上述问题[21]。
现阶段ART在临床的应用仍处于起步阶段,按计划制定的时效性可分为离线ART[22]、在线计划库选择[23]与OART[24] 3种类型,其中OART更贴近临床实际需求而成为今后ART的发展方向。本研究选择的自适应放疗方案为基于FBCT引导的每日计划(PotD)[25]OART。该治疗策略充分考虑了肿瘤体积变化以及靶区与OAR的每日解剖变化。uCT-ART为宫颈癌OART提供了全流程技术平台,该平台细化OART流程模块,主要分为ROI修改及审核、OART计划优化、OART计划评估、出束治疗4个模块。在ROI修改及审核模块,高年资放疗医师可选择AI自动分割每日FBCT上靶区及OAR轮廓,也可选择刚性或弹性配准复制ROI。此外,不同于常规CBCT引导PotD带来的每日触发OART,本试验流程将OART触发权交予高年资放疗医师,一方面扩充了高年资放疗医师的勾画选择,另一方面弹性配置了临床治疗时长,缓解了放疗设备资源紧张的局面。
在OART实施策略中,首先要解决的轮廓分割问题,目前解决方案首选靶区和OAR的自动分割。Rigaud等[26]比较了两种基于深度学习(DL)方法的轮廓自动分割技术,并在255例接受局部晚期宫颈癌放疗的定位CT上进行了验证,结果显示临床医生和AI轮廓之间具有良好的一致性。本研究前期开发了一款基于VB-Net的宫颈癌靶区自动勾画DL工具,用以勾画根治性放疗及术后辅助放疗患者的CTV,结果表明,基于深度学习的宫颈癌靶区自动分割勾画准确性与高级医师手动勾画相当,应用于临床中将有助于大幅提高工作效率[27]。故在uCT-ART中,本研究继续使用上述轮廓自动分割工具,基于定位CT的CTV的DSC为0.85 ± 0.04,不劣于前期模型构建的DSC 0.89 ± 0.02 (P>0.05),HD95%为(5.64 ± 1.60)mm,优于前期模型构建HD95%的(6.28 ± 2.31)mm(P<0.05),表明自动分割工具具有提高勾画一致性和准确性的潜能。也是基于基线ROI勾画质量的满意程度,OART触发的ROI分割协议中优先选择CTV刚性拷贝/OAR自动分割+高年资放疗医师修改。
从离线计划和PotD的方法中可知,为单个患者制定多个计划的要求可能是实施ART的阻碍因素。放疗计划过程自动化是进行ART的关键,也是OART的先决条件。Sharfo等[28]比较了34名宫颈癌患者的手动生成和自动VMAT和IMRT计划,结果显示相似的PTV覆盖所有4个计划,并通过自动计划改善了小肠的V45 Gy。Shelley等[29]纳入5名局部晚期宫颈癌患者触发了132次基于CBCT的OART计划。治疗过程中,OART平均PTV D98%为96.7%,显著优于手动计划的平均PTV D98%为94.9%,而OART中肠道、膀胱和直肠的D2 cm3较手动计划分别明显减少了0.07、0.04和0.04 Gy,证实了OART在宫颈癌日常放疗的可行性。在本研究中,11例宫颈癌患者共计81个OART计划的质量与手动IGRT计划相当:PTV剂量分布更为紧凑,且剂量整体更接近处方剂量;OART计划中OAR剂量控制更贴近临床要求,OAR受照剂量显著低于IGRT计划;而CI与HI更优于IGRT计划。这表明随着放射治疗过程中技术和计算的进步,OART正在成为一种临床可能性。
OART的治疗潜力常常受到占用大量人力、设备、时间等资源的限制,尤其是OART调整时长影响患者体位固定、分次内器官解剖位移等客观因素挑战,如何有效控制时间成本是OART成功执行的关键。Sibolt等[30]在5例CBCT引导的盆腔恶性肿瘤(3名膀胱癌、1名直肠癌和1名肉瘤)OART治疗中,调整后的OART自动计划效果满意,中位OART调整时长为17.6 min。而在Shelley等[15]实际操作中,5名局部晚期宫颈癌患者从CBCT采集到开始放射的平均OART时间即OART调整时长为(29 ± 5)min(21~44 min)。而在本研究中,基于FBCT引导的平均OART调整时长为15.87 min,平均总时长为18.97 min,在压缩时间成本的过程中保障OART计划高质量完成。同时,患者依从性与耐受度较高,高年资放疗医师/物理师/技术员团队对OART流程较满意,这为今后规模性临床应用奠定了基础。
OART过程中,OAR剂量减少将带来可能的临床获益,但需要更多前瞻性临床研究来支持。在一项1 433名宫颈癌放疗患者的临床研究中,3级及以上慢性胃肠道和泌尿生殖系统不良反应的发生率分别为2.3%和1.3%[31]。在本研究中,11例宫颈癌患者直肠与结肠的D2 cm3、V30 Gy、V40 Gy、V45 Gy均显著低于IGRT数,OART过程中未见3级及以上的急性消化系统、泌尿系统及造血系统不良反应,考虑系绝大部分OAR在IGRT计划下卷入的体积要大于OART计划,体现OART的剂量学优势。Avgousti等[32]头颈部恶性肿瘤的触发因素作了荟萃分析,发现体重变化>10%、外轮廓变化>1 cm、靶区包绕低于处方要求5%、ROI体积变化>25%为触发阈值。因此,本研究纳入基于11例宫颈癌患者OART简易触发机制的探讨,发现膀胱体积变化、直肠/小肠+结肠与CTV重叠区域体积增加比例可作为启动OART的临床阈值,进一步揭示了高年资放疗医师主导触发的OART模式的客观规律。
本研究在11名宫颈癌患者中实施了高年资放疗医师主导触发的OART,尽管研究样本数量相对较少,随访时间较短,但仍然观察到了一些鼓舞人心的趋势与结果。首先,观察到自动分割轮廓的质量在OART技术中起到了关键作用,这有助于确保精确的治疗计划实施。其次,自动放疗计划的应用极大地提高了临床效率,不仅节省医师和技术人员的时间,还降低潜在的人为误差。通过AI协助,放疗工作团队能更快地生成个性化治疗计划,有望进一步提高患者的治疗体验及疗效。此外,OART在线剂量学分析的引入能实时监测患者的治疗剂量,并及时调整治疗计划,以保障安全性及有效性,对于减少潜在的不良反应和并发症尤为重要。在本研究中,消化系统与造血系统未见3级及以上的急性放疗不良反应,说明OART在临床实践的安全性较好。但有关宫颈癌OART的临床研究还需更长时间随访与更大规模病例来验证最终的临床获益。另一方面,如何明确PTV外放缩小范围、确定OART适合患者人群还需进一步探讨。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未因进行该研究接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 马辰莺负责患者入组、靶区勾画、OART全流程执行及撰写论文;郭建及李治斌负责放疗计划及物理质量控制;蒋华负责放疗执行及技术质量控制;王世梅、李秉桓、贾乐成、曹然协助数据处理及统计分析;章卫负责设备质量控制与硬件保障;徐晓婷负责靶区质量控制;周菊英指导论文修改
| [1] |
Ahmad R, Hoogeman MS, Bondar M, et al. Increasing treatment accuracy for cervical cancer patients using correlations between bladder-filling change and cervix-uterus displacements: proof of principle[J]. Radiother Oncol, 2011, 98(3): 340-346. DOI:10.1016/j.radonc.2010.11.010 |
| [2] |
Taylor A, Powell ME. An assessment of interfractional uterine and cervical motion: implications for radiotherapy target volume definition in gynaecological cancer[J]. Radiother Oncol, 2008, 88(2): 250-257. DOI:10.1016/j.radonc.2008.04.016 |
| [3] |
Beadle BM, Jhingran A, Salehpour M, et al. Cervix regression and motion during the course of external beam chemoradiation for cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 73(1): 235-241. DOI:10.1016/j.ijrobp.2008.03.064 |
| [4] |
Eminowicz G, Motlib J, Khan S, et al. Pelvic organ motion during radiotherapy for cervical cancer: Understanding patterns and recommended patient preparation[J]. Clin Oncol (R Coll Radiol), 2016, 28(9): e85-91. DOI:10.1016/j.clon.2016.04.044 |
| [5] |
Chen W, Bai P, Pan J, et al. Changes in tumor volumes and spatial locations relative to normal tissues during cervical cancer radiotherapy assessed by cone beam computed tomography[J]. Technol Cancer Res Treat, 2017, 16(2): 246-252. DOI:10.1177/1533034616685942 |
| [6] |
Pötter R, Tanderup K, Kirisits C, et al. The EMBRACE Ⅱ study: The outcome and prospect of two decades of evolution within the GEC-ESTRO GYN working group and the EMBRACE studies[J]. Clin Transl Radiat Oncol, 2018, 9: 48-60. DOI:10.1016/j.ctro.2018.01.001 |
| [7] |
Klopp AH, Yeung AR, Deshmukh S, et al. Patient-reported toxicity during pelvic intensity-modulated radiation therapy: NRG Oncology-RTOG 1203[J]. J Clin Oncol, 2018, 36(24): 2538-2544. DOI:10.1200/JCO.2017.77.4273 |
| [8] |
Hunt A, Hansen VN, Oelfke U, et al. Adaptive radiotherapy enabled by MRI guidance[J]. Clin Oncol (R Coll Radiol), 2018, 30(11): 711-719. DOI:10.1016/j.clon.2018.08.001 |
| [9] |
Bertholet J, Anastasi G, Noble D, et al. Patterns of practice for adaptive and real-time radiation therapy (POP-ART RT) part Ⅱ: Offline and online plan adaption for interfractional changes[J]. Radiother Oncol, 2020, 153: 88-96. DOI:10.1016/j.radonc.2020.06.017 |
| [10] |
马辰莺, 周菊英, 徐晓婷, 等. 基于深度学习宫颈癌靶区自动分割勾画临床研究[J]. 中华放射肿瘤学杂志, 2020, 29(10): 859-865. Ma CY, Zhou JY, Xu XT, et al. Clinical evaluation of deep learning-based clinical target volume auto-segmentation algorithm for cervical cancer[J]. Chin J Radiat Oncol, 2020, 29(10): 859-865. DOI:10.3760/cma.j.cn113030-20191112-00475 |
| [11] |
Gong W, Yao Y, Ni J, et al. Deep learning-based low-dose CT for adaptive radiotherapy of abdominal and pelvic tumors[J]. Front Oncol, 2022, 12: 968537. DOI:10.3389/fonc.2022.968537 |
| [12] |
McCollough CH, Cody DD, Edyvean S, et al. The measurement, reporting, and management of radiation dose in CT[J]. AAPM Report (2008), 96: 1-34. DOI:10.37206/97 |
| [13] |
Konski A, Deshmukh S, Klopp AH, et al. Quality-adjusted survival in women with gynecologic malignancies receiving IMRT after surgery: A patient reported outcome study of NRG oncology's RTOG 1203[J]. Gynecol Oncol, 2023, 175: 176-181. DOI:10.1016/j.ygyno.2023.05.074 |
| [14] |
Varadhan R, Karangelis G, Krishnan K, et al. A framework for deformable image registration validation in radiotherapy clinical applications[J]. J Appl Clin Med Phys, 2013, 14(1): 4066. DOI:10.1120/jacmp.v14i1.4066 |
| [15] |
Shelley CE, Barraclough LH, Nelder CL, et al. Adaptive Radiotherapy in the Management of Cervical Cancer: Review of Strategies and Clinical Implementation[J]. Clin Oncol (R Coll Radiol), 2021, 33(9): 579-590. DOI:10.1016/j.clon.2021.06.007 |
| [16] |
Lomax NJ, Scheib SG. Quantifying the degree of conformity in radiosurgery treatment planning[J]. Int J Radiat Oncol Biol Phys, 2003, 55(5): 1409-1419. DOI:10.1016/s0360-3016(02)04599-6 |
| [17] |
Wu VW, Kwong DL, Sham JS. Target dose conformity in 3-dimensional conformal radiotherapy and intensity modulated radiotherapy[J]. Radiother Oncol, 2004, 71(2): 201-206. DOI:10.1016/j.radonc.2004.03.004 |
| [18] |
Ma CY, Zhou JY, Xu XT, et al. Clinical evaluation of deep learning-based clinical target volume three-channel auto-segmentation algorithm for adaptive radiotherapy in cervical cancer[J]. BMC Med Imaging, 2022, 22(1): 123. DOI:10.1186/s12880-022-00851-0 |
| [19] |
Yan D, Lockman D, Martinez A, et al. Computed tomography guided management of interfractional patient variation[J]. Semin Radiat Oncol, 2005, 15(3): 168-179. DOI:10.1016/j.semradonc.2005.01.007 |
| [20] |
Zhang Y, Wang G, Chang Y, et al. Prospects for daily online adaptive radiotherapy for cervical cancer: Auto-contouring evaluation and dosimetric outcomes[J]. Radiat Oncol, 2024, 19(1): 6. DOI:10.1186/s13014-024-02398-6 |
| [21] |
Beadle BM, Jhingran A, Salehpour M, et al. Cervix regression and motion during the course of external beam chemoradiation for cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 73(1): 235-241. DOI:10.1016/j.ijrobp.2008.03.064 |
| [22] |
Oh S, Stewart J, Moseley J, et al. Hybrid adaptive radiotherapy with on-line MRI in cervix cancer IMRT[J]. Radiother Oncol, 2014, 110(2): 323-328. DOI:10.1016/j.radonc.2013.11.006 |
| [23] |
de Boer P, Jürgenliemk-Schulz IM, Westerveld H, et al. Patterns of care survey: Radiotherapy for women with locally advanced cervical cancer[J]. Radiother Oncol, 2017, 123(2): 306-311. DOI:10.1016/j.radonc.2017.04.005 |
| [24] |
Fischer-Valuck BW, Henke L, Green O, et al. Two-and-a-half-year clinical experience with the world's first magnetic resonance image guided radiation therapy system[J]. Adv Radiat Oncol, 2017, 2(3): 485-493. DOI:10.1016/j.adro.2017.05.006 |
| [25] |
Webster A, Appelt AL, Eminowicz G. Image-guided radiotherapy forpelvic cancers: A review of current evidence and clinical utilisation[J]. Clin Oncol (R Coll Radiol), 2020, 32(12): 805-816. DOI:10.1016/j.clon.2020.09.010 |
| [26] |
Rigaud B, Anderson BM, Yu ZH, et al. Automatic segmentation using deep learning to enable online dose optimization during adaptive radiation therapy of cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2021, 109(4): 1096-1110. DOI:10.1016/j.ijrobp.2020.10.038 |
| [27] |
Ma CY, Zhou JY, Xu XT, et al. Deep learning-based auto-segmentation of clinical target volumes for radiotherapy treatment of cervical cancer[J]. J Appl Clin Med Phys, 2022, 23(2): e13470. DOI:10.1002/acm2.13470 |
| [28] |
Sharfo AW, Breedveld S, Voet PW, et al. Validation of fully automated VMAT plan generation for library-based plan-of-the-day cervical cancer radiotherapy[J]. PLoS One, 2016, 11(12): e0169202. DOI:10.1371/journal.pone.0169202 |
| [29] |
Shelley CE, Bolt MA, Hollingdale R, et al. Implementing cone-beam computed tomography-guided online adaptive radiotherapy in cervical cancer[J]. Clin Transl Radiat Oncol, 2023, 40: 100596. DOI:10.1016/j.ctro.2023.100596 |
| [30] |
Sibolt P, Andersson LM, Calmels L, et al. Clinical implementation of artificial intelligence-driven cone-beam computed tomography-guided online adaptive radiotherapy in the pelvic region[J]. Phys Imaging Radiat Oncol, 2021, 17: 1-7. DOI:10.1016/j.phro.2020.12.004 |
| [31] |
Wang W, Zhang F, Hu K, et al. Image-guided, intensity-modulated radiation therapy in definitive radiotherapy for 1433 patients with cervical cancer[J]. Gynecol Oncol, 2018, 151(3): 444-448. DOI:10.1016/j.ygyno.2018.09.024 |
| [32] |
Avgousti R, Antypas C, Armpilia C, et al. Adaptive radiation therapy: When, how and what are the benefits that literature provides?[J]. Cancer Radiother, 2022, 26(4): 622-636. DOI:10.1016/j.canrad.2021.08.023 |
 2024, Vol. 44
2024, Vol. 44


