2. 贵州医科大学附属肿瘤医院肿瘤科,贵阳 550004;
3. 贵州医科大学肿瘤学教研室,贵阳 550004
2. Department of Oncology, Affiliated Cancer Hospital of Guizhou Medical University, Guiyang 550004, China;
3. Department of Oncology, School of Clinical Medicine, Guizhou Medical University, Guiyang 550004, China
放射治疗联合程序性死亡受体1 (PD-1)抑制剂被证实可以增强抗肿瘤效果[1]。然而,胸部照射可能引发心脏损伤。局部晚期非小细胞肺癌患者放疗后两年内,≥3级的心脏不良事件发生率达11%~23%[2]。乳腺癌患者的心脏平均辐射剂量每增加1 Gy,重大冠状动脉事件的发生率升高7.4%,且这一风险可持续至放射治疗后30年[3]。PD-1抑制剂可能引发免疫性心肌炎,进而加剧放射性心脏损伤[4]。尽管近两年来,放射治疗联合PD-1抑制剂在肺癌、食管癌治疗中的应用日渐增多,但关于心脏损伤的相关临床数据却仍然匮乏[5]。
细胞焦亡通过介导细胞死亡及炎症参与各种心血管疾病[6]。然而,它在放射治疗联合PD-1抑制剂引起的心肌损伤中的作用及机制仍不清楚。本研究通过建立小鼠动物模型,探究PD-1抑制剂是否通过促进细胞焦亡加剧放射性心肌损伤,并期望为防治放射性心肌损伤提供新的治疗策略。
材料与方法 1、主要试剂与仪器抗小鼠PD-1(RMPI-14,美国Bio X Cell公司),抗消皮素D(GSDMD)抗体(EPR19828,英国Abcam公司),抗半胱氨酸天冬氨酸蛋白水解酶1(Caspase-1)抗体(M025280,上海艾比玛特公司),抗凋亡相关斑点样蛋白(ASC)抗体(AP68548,江苏百远生物公司),抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体(R1210-1,杭州华安生物公司),组织RNA提取试剂盒、快速反转录试剂盒、SYBR Green qPCR预混液(RN002plus、RT001、QP002,上海奕杉生物科技有限公司),小鼠白介素1β(IL-1β)、白介素18(IL-18)酶联免疫吸附实验试剂盒(MLB00C、DY7625-05,美国R&D SYSTEMS公司);直线加速器(Synergy,瑞典Elekta公司),实时荧光定量PCR仪(CFX96Toch,美国Bio-Rad Laboratories公司),便携式彩色多普勒超声仪(VINNO6LAB,苏州飞依诺科技有限公司)。
2、动物及分组SPF级雄性C57BL/6小鼠20只,6~8周龄,体质量20~25 g,购自长沙天勤生物技术有限公司[动物许可证号:SCXK(湘)2019-0014]。小鼠适应性喂养1周后按随机数字表法分为健康对照组、PD-1抑制剂组、单纯照射组、照射联合PD-1抑制剂组,每组5只。
3、照射及给药方法小鼠麻醉后仰卧位固定于直线加速器下,通过小鼠体表心脏搏动范围,使心脏置于射野中心,胸前垫0.5 cm蜡模,6 MV X射线20 Gy垂直照射,照射野2 cm × 2 cm,源皮距100 cm,剂量率6 Gy/min。分别于照射后第1、3、5、7、9天予PD-1抑制剂组及照射联合PD-1抑制剂组腹腔注射抗小鼠PD-1(5 μg/g)+0.5 ml磷酸盐缓冲液(PBS)[7];同时,健康对照组及单纯照射组注射等体积PBS。
4、超声心动检测采用VINNO6LAB多普勒超声,频率23 MHz经胸超声检查,每只小鼠至少记录10个连续且完整的心动周期图像。计算左室射血分数(LVEF)、每搏输出量(SV)、左室缩短率(FS)及左室后壁收缩期厚度(LVPWs)。
5、苏木精-伊红(HE)、Masson染色固定于10%多聚甲醛的心脏组织经脱水、石蜡包埋、切片(5 μm)制备病理切片,常规进行HE及Masson染色、封片,数字切片扫描仪对切片进行图像采集。HE染色后每张标本按简单随机抽样法选取3个不重复视野观察小鼠心肌组织病理变化;Masson染色后每张标本随机选取3个不重复视野,采用Image J软件进行半定量分析,计算心肌胶原容积分数(CVF)[8],
小鼠眼球摘除取血,血液室温静置30 min后,15 000 × g离心10 min,提取上清即得血清;30 mg心脏组织加入蛋白裂解液,冰浴下超声匀浆。分别将血清、心肌匀浆液及不同浓度的标准品加入已包被好检测抗体(IL-18、IL-1β)的酶标板,参照说明书进行检测抗体孵育、洗涤、二抗孵育和显色反应。酶标仪测定吸光度(A)值,A = A450 nm-A570 nm。用标准品浓度及对应吸光度A制定标准曲线,代入样本A计算样本浓度(pg/ml)。
7、蛋白免疫印迹20 mg心脏组织加入蛋白裂解液及蛋白酶抑制剂,冰浴下超声匀浆,冰上裂解后提取上清,二喹啉甲酸(BCA)法测蛋白浓度。将等量蛋白行凝胶电泳、转印、洗膜、封闭、一抗4℃孵育过夜、二抗孵育、洗膜,电化学发光法显影。以GAPDH为对照,采用Image J软件量化条带灰度值。一抗稀释比:Caspase-1(1∶2 000)、ASC(1∶2 000)、GSDMD(1∶1 000)、GAPDH(1∶10 000)。
8、实时荧光定量反转录聚合酶链式反应(RT-qPCR)取小鼠心脏组织10 mg,参照试剂盒说明书提取总RNA并反转录合成cDNA,以cDNA为模板依照条件(95℃预变性5 min;95℃变性15 s、60℃退火延伸30 s,循环40次。)在PCR仪上进行基因片段扩增;以GAPDH为内参,采用2-ΔΔCt法计算基因相对表达量。引物序列:GAPDH (正向:5′ GGTTGTTCTCCTGCGACTTCA3′;反向:5′ TGGTCCAGGGTTTCTTACTCC3′),Caspase-1(正向:5′ CAAGGTGATCATTATTCAGGC3′,反向:5′ GCATCCGTTAAGAAATCCTC3′),GSDMD(正向:5′ CGATGGGAACATTCAGGGCAGAG3′,反向:5′ ACACATTCATGGAGGCACTGGAAC3′);ASC(正向:5′ GTCCCTGCTCAGAGTACAGCC3′,反向:5′ ACGAACTGCCTGGTACTGTCC3′)。
9、流式细胞术检测采用双酶(0.1%Ⅱ型胶原酶、0.01%透明质酸酶)消化法消化30 mg心脏组织制备细胞悬液,加完全培养基中和消化酶,过细胞筛去除杂质,1 000 × g离心5 min后得细胞沉淀。加入红细胞裂解液裂解红细胞,用PBS清洗、1 000 × g离心5 min、重悬细胞。细胞悬液内加入CD45+、CD3+、CD8+、CD4+ T抗体避光孵育30 min后运用流式细胞仪检测。采用FlowJo_V10软件分析数据。
10、统计学处理采用SPSS 23.0软件进行数据分析,数据符合正态分布,以x±s表示。两组数据比较采用独立样本t检验,多组间比较方差齐采用单因素方差分析,Tukey检验进一步进行两两比较,方差不齐采用Dunnett的T3检验。P<0.05为差异有统计学意义。
结果 1、不同处理组小鼠心脏功能变化PD-1抑制剂组LVEF、FS、SV、LVPWs与健康对照组的差异均无统计学意义(P>0.05);与健康对照组比较,单纯照射组LVEF、SV降低,LVPWs增加(t =3.80、7.04、-5.92, P<0.05);与单纯照射组比较,照射联合PD-1抑制剂组的LVEF、FS、SV下降(t=4.50、27.93、3.11, P<0.05),LVPWs相似(P>0.05,表 1)。
|
|
表 1 小鼠左心功能改变情况(x±s) Table 1 Changes in the left ventricular function of mice (x±s) |
2、心肌组织的病理学改变
健康对照组心肌细胞呈长条状,排列整齐,边界清晰,胞质为红色,细胞核为深蓝色;PD-1抑制剂组心肌排列整齐,边界清晰,未见心肌纤维水肿、坏死;单纯照射组小鼠心肌细胞排列紊乱,局部可见部分心肌纤维水样变性,细胞肿胀,胞质疏松淡染;照射联合PD-1抑制剂组的心肌排列更加紊乱,心肌纤维水肿更重,心肌间质见淋巴细胞浸润(图 1)。
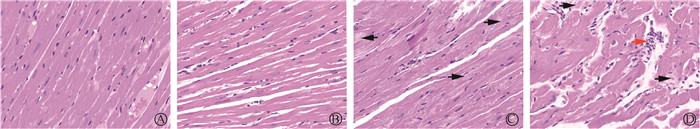
|
注:黑色箭头指示心肌细胞水肿、空泡化,红色箭头指示淋巴细胞浸润 图 1 照射1个月后小鼠心肌组织改变HE染色×400 A. 健康对照组;B. PD-1抑制剂组;C. 单纯照射组;D. 照射联合PD-1抑制剂组 Figure 1 Changes in myocardial tissue of mice after one month of radiation HE staining ×400 A. Control group; B. PD-1 inhibitor group; C. Radiation group; D. Combined group treated with both radiation and PD-1 inhibitor |
Masson染色显示,健康对照组及PD-1抑制剂组胶原纤维呈蓝色, 散在分布于心肌细胞间,未见异常胶原纤维堆积;单纯照射组可见心肌间质及血管周围分布蓝染纤维,较健康对照组增多;照射联合PD-1抑制剂组可见心肌结构排列紊乱,蓝色的胶原纤维沉积较单纯照射组更为明显(图 2)。心肌组织胶原蛋白半定量分析显示,健康对照组、PD-1抑制剂组、单纯照射组、照射联合PD-1抑制剂组的CVF值分别为(1.82±0.36)%、(2.11±0.20)%、(2.88±0.27)%、(3.81±0.57)%,组间比较发现PD-1抑制剂组与健康对照组CVF值差异无统计学意义(P>0.05),单纯照射组CVF较健康对照组增加(t=4.71,P<0.05)、照射联合PD-1抑制剂组CVF高于单纯照射组(t=2.9,P<0.05)。
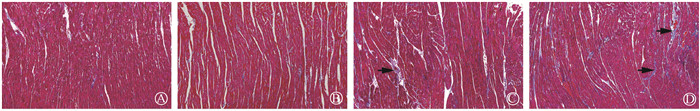
|
注:黑色箭头指示胶原纤维沉积 图 2 照射1个月后小鼠心肌组织纤维化情况Masson染色×100 A. 健康对照组;B. PD-1抑制剂组;C. 单纯照射组; Figure 2 Myocardial fibrosis in mice after one month of radiation Masson staining ×100 A. Control group; B. PD-1 inhibitor group; C. Radiation group; D. Combined group treated with both radiation and PD-1 inhibitor |
3、焦亡通路相关因子表达
如图 3所示,蛋白免疫印迹检测显示,单纯照射组Caspase-1、Caspase-1 p20、GSDMD、GSDMD-N、ASC蛋白表达量较健康对照组升高(t=9.04、11.05、4.23、9.20、6.14,P<0.05),照射联合PD-1抑制剂组上述蛋白表达量也比单纯照射组升高,差异具有统计学意义(t=3.14、3.22、8.83、20.29、2.79,P<0.05)。RT-qPCR显示照射联合PD-1抑制剂组的Caspase-1、GSDMD、ASC的mRNA表达水平均高于单纯照射组,差异具有统计学意义(t = 3.09、2.91、2.53,P<0.05,表 2)。
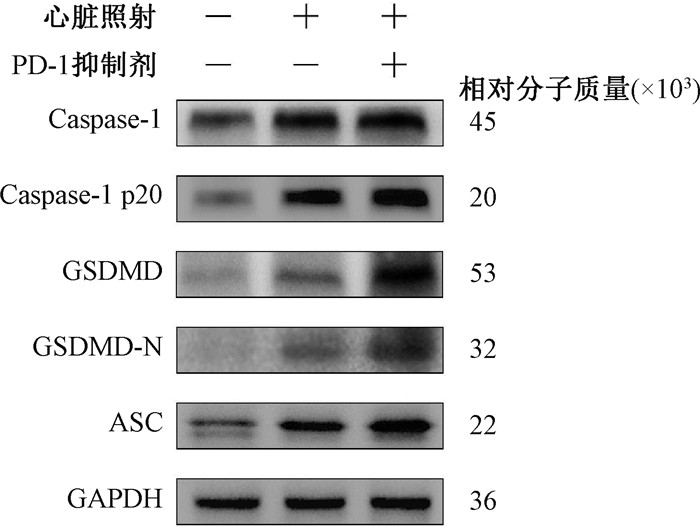
|
图 3 心肌组织焦亡相关蛋白表达 Figure 3 Expression of pyroptosis-related proteins in myocardial tissue |
|
|
表 2 小鼠心肌内焦亡相关蛋白mRNA表达(x ± s) Table 2 mRNA expression of pyroptosis-related proteins in myocardium of mice (x ± s) |
4、细胞因子表达水平
健康对照组、单纯照射组、照射联合PD-1抑制剂组血清及心肌组织中的IL-18、IL-1β的表达水平都逐渐升高。健康对照组与PD-1抑制剂组血清及心肌中的IL-18、IL-1β表达差异均无统计学意义(P>0.05);与健康对照组比较,单纯照射组血清中的IL-18、IL-1β表达均升高(t=4.24、7.24,P<0.05),心肌组织中的IL-18、IL-1β表达也升高(t=5.08、3.86,P<0.05);照射联合PD-1抑制剂组血清及心肌组织中的IL-18、IL-1β表达也都高于单纯照射组(t=7.58、3.46、8.24、3.75, P<0.05,表 3)。
|
|
表 3 小鼠血清及心肌组织内炎性因子表达(pg/ml,x ± s) Table 3 Expression of inflammatory factors in serum and myocardium of mice (pg/ml, x ± s) |
5、心肌组织中T淋巴细胞浸润情况
PD-1抑制剂组CD3+、CD8+ T淋巴细胞百分比与健康对照组间的差异无统计学意义(P>0.05);与健康对照组比较,单纯照射组的心肌中CD3+、CD8+T淋巴细胞百分比增加(t=5.71、3.94,P<0.05);照射联合PD-1抑制剂组与单纯照射组的CD3+T淋巴细胞百分相似(P>0.05),但照射联合PD-1抑制剂组的CD8+ T淋巴细胞百分比较单纯照射组显著增加(t=3.29,P<0.05),各组的CD4+ T淋巴细胞的差异无统计学意义(P>0.05,表 4)。
|
|
表 4 不同处理组小鼠心肌组织内不同T淋巴细胞浸润比例(%,x ± s) Table 4 Proportions of T lymphocyte infiltration in myocardium of mice in each group (%, x ± s) |
讨论
放射治疗联合PD-1抑制剂已在肺癌、食管癌等胸部肿瘤治疗中展现出良好的应用前景,是目前临床研究的热点。除疗效外,不良反应也是关注的焦点。目前,放射治疗联合PD-1抑制剂所致心脏不良反应的报道较少。本研究根据文献报道,采用20 Gy单次照射构建小鼠放射心肌损伤模型[9]。探讨PD-1抑制剂是否通过焦亡途径加重放射性心肌损伤。心肌损伤是动态变化的过程,多个时间点观察更有意义,前期研究发现PD-1抑制剂可加重心脏照射后1个月的急性炎症反应[10]。心肌焦亡是一种促炎性死亡,为此,本研究选择1个月作为观察时间点。同时,更佳的时间点仍需进一步探索。本研究发现,与健康对照组相比,单纯应用PD-1抑制剂并未造成明显心脏损伤;小鼠心脏20 Gy照射后1个月可出现心脏损伤,多普勒超声提示心脏功能减退,Masson染色可观察到心肌纤维化;照射联合PD-1抑制剂的心脏功能减退和心肌纤维化更为明显,表明PD-1抑制剂可以加重放射性心肌损伤。
PD-1抑制剂通过活化T淋巴细胞发挥抗肿瘤效应及介导免疫性损伤[11-12]。本研究发现,心脏照射联合PD-1抑制剂组小鼠心肌中CD8+T淋巴细胞百分比显著增加,然而CD4+T淋巴细胞变化不明显,表明PD-1抑制剂可能通过活化CD8+T淋巴细胞加重放射性心肌损伤。Du等[13]也发现CD8+T淋巴细胞而不是CD4+T淋巴细胞在放射治疗联合PD-1抑制剂所致心肌损伤中起关键作用。CD8+T淋巴细胞在抗肿瘤治疗中起着重要的作用,封闭CD8+T淋巴细胞虽可减轻心脏不良反应,但势必也会降低抗肿瘤治疗的疗效。
PD-1抑制剂可促进心肌免疫炎症反应,进而加重小鼠放射性心肌损伤[10]。细胞焦亡是一种促炎性死亡方式,与心血管疾病、自身免疫性疾病密切相关[14]。研究显示,PD-1抑制剂可通过经典焦亡途径介导小鼠心肌损伤;辐射可通过NLRP3/Caspase-1/GSDMD通路介导骨髓源性巨噬细胞焦亡[7, 15]。本研究结果显示,照射联合PD-1抑制剂组的Caspase-1、GSDMD及其活性剪接体Caspase-1 p20、GSDMD-N表达水平较单纯照射组显著升高。文献报道,藏红花素可抑制NLRP3/GSDMD通路,从而逆转免疫检查点抑制剂相关性心肌炎[7]。Jiang等[16]研究显示,在抑制PD-L1的同时抑制GSDMD,可增加荷瘤小鼠体内CD8+ T淋巴细胞浸润、增强PD-L1抑制剂的疗效。这些研究结果提示PD-1抑制剂可能通过Caspase-1/GSDMD通路介导细胞焦亡加重放射性心肌损伤,抑制焦亡可能为减轻放射性心肌损伤提供新的思路。
活化的Caspase-1能促进IL-1β和IL-18的切割成熟;同时Caspase-1也能切割GSDMD诱导膜孔开放,诱发细胞焦亡,释放IL-1β、IL-18等炎症因子,扩大免疫炎症反应。本研究发现,心脏照射联合PD-1抑制剂组血清及心肌内IL-18、IL-1β含量明显增加。IL-18、IL-1β作为强有力的炎症启动因子,对宿主的感染及损伤防御反应至关重要;此外,IL-1β通过加重慢性炎症、促进肿瘤血管生成及肿瘤细胞转移、诱导肿瘤微环境内的免疫抑制来推动肿瘤发展[17]。阻断IL-1β可逆转乳腺癌小鼠的免疫抑制、诱导肿瘤消退,并增强抗PD-1抗体的活性[18]。使用小干扰RNA抑制IL-18可降低小鼠的肿瘤负荷[19]。IL-18、IL-1β有可能成为不影响抗肿瘤效应的情况下减轻放射联合PD-1抑制剂所致心肌损伤的干预靶点。
综上所述,PD-1抑制剂可能通过Caspase-1/GSDMD促进细胞焦亡进而加重放射性心肌损伤,阻断GSDMD通路有助于减轻PD-1抑制剂联合放疗所致的心肌损伤。
利益冲突 无
作者贡献声明 赵沙沙负责实验操作、数据整理、起草论文;吴碧波负责实验操作及论文修改;柏杰负责数据分析;王刚、刘瑶、王羽协助部分实验操作;胡银祥指导实验;欧阳伟炜、卢冰指导论文修改;苏胜发负责课题设计,指导论文撰写
| [1] |
Spigel DR, Faivre-Finn C, Gray JE, et al. Five-year survival outcomes from the PACIFIC trial: durvalumab after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer[J]. J Clin Oncol, 2022, 40(12): 1301-1311. DOI:10.1200/JCO.21.01308 |
| [2] |
Atkins KM, Rawal B, Chaunzwa TL, et al. Cardiac radiation dose, cardiac disease, and mortality in patients with lung cancer[J]. J Am Coll Cardiol, 2019, 73(23): 2976-2987. DOI:10.1016/j.jacc.2019.03.500 |
| [3] |
Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer[J]. N Engl J Med, 2013, 368(11): 987-998. DOI:10.1056/NEJMoa1209825 |
| [4] |
Safi M, Ahmed H, Al-Azab M, et al. PD-1/PDL-1 Inhibitors and cardiotoxicity; molecular, etiological and management outlines[J]. J Adv Res, 2021, 29: 45-54. DOI:10.1016/j.jare.2020.09.006 |
| [5] |
Schoenfeld JD, Giobbie-Hurder A, Ranasinghe S, et al. Durvalumab plus tremelimumab alone or in combination with low-dose or hypofractionated radiotherapy in metastatic non-small-cell lung cancer refractory to previous PD(L)-1 therapy: an open-label, multicentre, randomised, phase 2 trial[J]. Lancet Oncol, 2022, 23(2): 279-291. DOI:10.1016/S1470-2045(21)00658-6 |
| [6] |
Zhaolin Z, Guohua L, Shiyuan W, et al. Role of pyroptosis in cardiovascular disease[J]. Cell Prolif, 2019, 52(2): e12563. DOI:10.1111/cpr.12563 |
| [7] |
Zhang H, Lin J, Shen Y, et al. Protective effect of crocin on immune checkpoint inhibitors-related myocarditis through inhibiting NLRP3 mediated pyroptosis in cardiomyocytes via NF-κB pathway[J]. J Inflamm Res, 2022, 15: 1653-1666. DOI:10.2147/JIR.S348464 |
| [8] |
Beaumont J, López B, Hermida N, et al. MicroRNA-122 down-regulation may play a role in severe myocardial fibrosis in human aortic stenosis through TGF-β1 up-regulation[J]. Clin Sci (Lond), 2014, 126(7): 497-506. DOI:10.1042/CS20130538 |
| [9] |
Myers CJ, Lu B. Decreased survival after combining thoracic irradiation and an anti-PD-1 antibody correlated with increased T-cell infiltration into cardiac and lung tissues[J]. Int J Radiat Oncol Biol Phys, 2017, 99(5): 1129-1136. DOI:10.1016/j.ijrobp.2017.06.2452 |
| [10] |
Bai J, Wu B, Zhao S, et al. The effect of PD-1 Inhibitor combined with irradiation on HMGB1-associated inflammatory cytokines and myocardial injury[J]. J Inflamm Res, 2022, 15: 6357-6371. DOI:10.2147/JIR.S384279 |
| [11] |
Tarrio ML, Grabie N, Bu DX, et al. PD-1 protects against inflammation and myocyte damage in T cell-mediated myocarditis[J]. J Immunol, 2012, 188(10): 4876-4884. DOI:10.4049/jimmunol.1200389 |
| [12] |
Park SS, Dong H, Liu X, et al. PD-1 restrains radiotherapy-induced abscopal effect[J]. Cancer Immunol Res, 2015, 3(6): 610-619. DOI:10.1158/2326-6066.CIR-14-0138 |
| [13] |
Du S, Zhou L, Alexander GS, et al. PD-1 modulates radiation-induced cardiac toxicity through cytotoxic T lymphocytes[J]. J Thorac Oncol, 2018, 13(4): 510-520. DOI:10.1016/j.jtho.2017.12.002 |
| [14] |
Yu P, Zhang X, Liu N, et al. Pyroptosis: mechanisms and diseases[J]. Signal Transduct Target Ther, 2021, 6(1): 128. DOI:10.1038/s41392-021-00507-5 |
| [15] |
Liu YG, Chen JK, Zhang ZT, et al. NLRP3 inflammasome activation mediates radiation-induced pyroptosis in bone marrow-derived macrophages[J]. Cell Death Dis, 2017, 8(2): e2579. DOI:10.1038/cddis.2016.460 |
| [16] |
Jiang Y, Yang Y, Hu Y, et al. Gasdermin D restricts anti-tumor immunity during PD-L1 checkpoint blockade[J]. Cell Rep, 2022, 41(4): 111553. DOI:10.1016/j.celrep.2022.111553 |
| [17] |
Laird BJ, McMillan D, Skipworth R, et al. The emerging role of interleukin 1β (IL-1β) in cancer cachexia[J]. Inflammation, 2021, 44(4): 1223-1228. DOI:10.1007/s10753-021-01429-8 |
| [18] |
Kaplanov I, Carmi Y, Kornetsky R, et al. Blocking IL-1β reverses the immunosuppression in mouse breast cancer and synergizes with anti-PD-1 for tumor abrogation[J]. Proc Natl Acad Sci USA, 2019, 116(4): 1361-1369. DOI:10.1073/pnas.1812266115 |
| [19] |
Nguyen PM, Putoczki TL. Could the inhibition of IL-17 or IL-18 be a potential therapeutic opportunity for gastric cancer?[J]. Cytokine, 2019, 118: 8-18. DOI:10.1016/j.cyto.2018.01.008 |
 2024, Vol. 44
2024, Vol. 44


