近年来,核能为生活和科学研究提供了很多便利,但核工作人员难以避免放射性污染的发生。在核污染途径中皮肤污染排名第二[1],当皮肤受损后,核素可能会通过伤口进入人体造成全身损伤[2]。因此,当皮肤伤口受到放射性核素污染后应立刻进行清洗[3-4]。目前国际标准对放射性核素污染推荐使用大量生理盐水或者1% 二乙烯三胺五乙酸(diethylenetriaminepentaacetic acid, DTPA) 溶液冲洗。但是液体洗消剂在核污染现场常因缺少水源不便使用。水凝胶是一种不依赖水源便于携带、去除的剂型,具有良好的组织相容性[5],利于辐射损伤组织的恢复和再生[6]。Cui等[7]合成一种水凝胶,能有效地净化皮肤伤口。Xu等[8]设计含双磷酸盐的超分子水凝胶,对铀有良好清除效果。这两款水凝胶清除核素的过程需要2~6 h,过于缓慢。成膜凝胶易于涂抹在伤口部位[9-10],可快速成膜。Kim等[11]研制的夫西酸钠成膜凝胶4 min可成膜。An等[12]开发的成膜软水凝胶应用2~3 min后可以形成薄膜。本研究计划利用成膜凝胶的快速凝固性能,复合具有强核素去除能力的螯合剂配方,研制一款适合核现场使用的可以快速清除核素污染的去污膜。前期研究已经筛选出复方洗消剂配方[13],海藻酸钠与壳聚糖可通过静电作用形成海藻酸钠-壳聚糖膜,膜的韧性好。以海藻酸钠-壳聚糖膜负载复方洗消剂配方,制备的去污膜具有成膜速度快、抗拉强度高和清除多种核素污染的特性。
材料与方法 1、实验动物及细胞雄性豚鼠210只,体重280~320 g;雄性Kunming (KM) 小鼠10只,体重18~20 g;雄性新西兰兔3只,体重2.5~3.5 kg,均购自北京科宇动物养殖中心[许可证号:SCXK(京)2018-0010]。小鼠上皮样成纤维(clone 929, L929) 细胞系由中国科学院细胞库提供。本研究通过军事医学研究院动物伦理委员会审批(IACU-DWZX-2020-503)。
2、仪器与材料电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry, ICP-MS),型号:7900,美国安捷伦科技有限公司生产。海藻酸钠购于国药集团化学试剂有限公司,壳聚糖(脱乙酰度>95,黏度100~200 mPa.s) 购于上海阿拉丁生化科技股份有限公司,羟乙膦酸钠(HEDP-2Na)、二乙烯三胺五乙酸五钠(DTPA-5Na)、羧甲基壳聚糖(取代度>90%)、氯化钴、氯化锶、硝酸铈均购于上海麦克林生化科技有限公司。氯化铯、硝酸铀酰六水合物均购于上海易恩化学技术有限公司。磷酸盐缓冲液(PBS),购自美国赛默飞世尔生物化学制品有限公司。
3、去污膜配方去污膜由复方络合剂与成膜液两部分组成。复方络合剂(0.30 g海藻酸钠、0.30 g壳聚糖、0.40 g DTPA-5Na、0.15 g HEDP-2Na、0.10 g羧甲基壳聚糖)溶于8.75 ml PBS溶液,搅拌过夜,放于4℃冰箱保存;成膜液为10% 的氯化钙水溶液。将0.20 ml复方络合剂涂抹到2 cm × 2 cm玻璃板上,覆盖上浸有成膜液的纱布,可在1.5 min后成膜。
4、去污膜断裂应力与应变测试在玻璃板上制备面积为3 cm × 3 cm去污膜与3% 浓度的海藻酸钠膜(厚度为0.6 mm),用于去污膜断裂应力与应变的测试。将去污膜置于拉力强度实验机上,记录去污膜断裂强力P与试样变形后的长度L,重复6次。断裂应力计算公式:
| $ \sigma=\frac{P}{A} $ | (1) |
式中,σ为断裂应力,Pa;P为断裂强力,N;A为截面面积,m2。
断裂应变的计算公式为:
| $ \varepsilon=\left(L-L_0\right) / L_0 $ | (2) |
式中,ε为断裂应变;L0为试样原始长度,m;L为试样变形后的长度,m。
5、去污膜溶胀系数测定精密称量筛网、去污膜、3% 浓度的海藻酸钠膜重量,将去污膜或海藻酸钠膜与筛网用生理盐水浸泡1 h后,称量筛网与去污膜的总重,重复3次。去污膜的溶胀率公式为:
| $ \text { 溶胀率 }=(B-C-D) / C \times 100 \% $ | (3) |
式中,B为筛网与去污膜的总重量,g;C为筛网重量,g;D为去污膜重量,g。
6、样品配制(1) 染毒剂的配制: 分别精确称取硝酸铀酰(238U)、氯化铯(133Cs)、氯化锶(88Sr)、氯化钴(59Co) 与硝酸铈(144Ce),溶于蒸馏水中,配置成浓度为1 g/L的5种染毒剂溶液,放于4℃冰箱保存。
(2) 各处理组去污膜配方: 依据目前国际上对放射性核素处理标准,以生理盐水组、基质膜组、1% DTPA-5Na基质膜组为对照组,去污膜组为实验组。各处理膜配方见表 1。
|
|
表 1 豚鼠皮肤核素清除实验各处理膜配方 Table 1 Chelating agent formulations for various groups in the radionuclide removal assay of guinea pigs′skin |
7、豚鼠伤口核素污染模型的建立
与大鼠、小鼠相比,豚鼠的皮肤结构在生理学与解剖学上与人类皮肤更为相似[14]。因此,本实验中以豚鼠皮肤模拟人皮肤建立伤口模型。实验前1 d剃除背部毛发,脱毛膏浸润10 min,用纱布除去脱毛膏,去离子水进行多次擦拭以确保无脱毛膏残留。12 h后采用3% 的戊巴比妥钠进行麻醉,在背部皮肤标记2 cm × 2 cm区域,记作目标区域。用手术刀片在目标区域做十字刀口,伤及筋膜层。取20 μl染毒剂对伤口均匀涂抹。
将0.20 ml复方络合剂均匀涂抹至背部目标区域,使核素与复方络合剂中螯合剂充分结合。将浸有成膜液的纱布覆盖到涂有复方络合剂的皮肤上,1.5 min后将去污膜从皮肤表面剥离掉。
8、洗消流程与核素去除效果研究本实验分为完整皮肤实验、伤口模型实验,每个实验包含模型组、生理盐水组、基质膜组、1% DTPA-5Na基质膜组、去污膜组,各实验组平行实验6次,取皮肤、全血样品用ICP-MS对其中核素的含量进行检测。在数据处理时以模型组中皮肤残留量的均值为这批实验中核素总量,首先计算模型组皮肤残留量的均值,用模型组皮肤残留量的均值减去各处理组皮肤残留量的值,再除以模型组皮肤残留量的均值,该比值为核素的清除率。
| $ \text { 清除率 }=\frac{E-F}{E} \times 100 \% $ | (4) |
式中,E为模型组皮肤残留量的均值,ng;F为各处理组皮肤残留量,ng。
(1) 完整皮肤实验: 取无伤口染毒后豚鼠30只,按随机数表法分为模型组、生理盐水组、基质膜组、1% DTPA-5Na基质膜组、去污膜组,每组6只。染毒5 min后进行不同的实验操作。完整皮肤实验染毒剂为硝酸铀酰或氯化铯,每种染毒剂为一次独立实验。模型组:将染毒后的豚鼠静置11.5 min后,取皮、取血;生理盐水组:将染毒后豚鼠静置5 min后,用10 ml生理盐水冲洗目标区域后静置6.5 min,取皮、取血;基质膜组:将染毒后豚鼠静置5 min后,取0.2 ml基质膜涂抹到目标区域,覆盖浸有成膜液的纱布等待1.5 min后去除去污膜,再等待5 min后取皮、取血;1% DTPA-5Na基质膜组:除将基质膜更换为1% DTPA-5Na基质膜外,其余与基质膜组相同;去污膜组:除将基质膜更换为去污膜外,其余与基质膜组相同。取血:心脏取血,加入3.8% (W/V) 枸橼酸钠1 ∶9比例抗凝待用。取皮:实验动物安乐死后将目标区域皮肤剪下,放于离心管中待用。硝化处理:将皮肤、全血样品按质量比1∶5加入浓硝酸,常温预消解30 min后,于98℃水浴中加热硝化2 h,将硝化后的样品冷却至室温,置于4℃冰箱保存。
(2) 伤口模型实验: 除去最主要的铀、铯之外,裂变产生多种放射性核素,如 90Sr、144Ce、60Co,同样也很容易导致皮肤与人体内环境放射性以及化学毒性损伤[15-16]。所以本研究在伤口模型上也考察去污膜对铈、钴、锶的清除效果。伤口模型实验动物分组同本研究中完整皮肤实验。伤口模型实验染毒剂为硝酸铀酰、氯化铯、氯化锶、氯化钴或硝酸铈,每种染毒剂为一次独立实验,除伤口造模外,具体操作同本研究中完整皮肤实验。
(3) 硝化样品的ICP-MS检测:检测皮肤、全血样品中铯(133Cs)、铀(238U)、锶(88Sr)、钴(59Co)和铈(144Ce)含量时,ICP-MS仪器条件为射频功率1 150 W, 射频匹配1.8 V,采样深度10 mm,同心雾化器,等离子流速15 L/min,采集模式TRA,Omega偏转电压105 V,Omega透镜电压13.6 V,积分时间1.0 s[17]。
9、安全性实验(1) 急性毒性试验: 采用腹腔注射方法,观察是否会导致小鼠的急性全身毒性反应。去污膜以3 cm2/ml的浸提比例用生理盐水浸提处理24 h,以生理盐水作为对照。10只昆明小鼠按随机数表法分成两组,实验组(注射浸提液)和对照组(注射生理盐水),腹腔注射剂量为50 ml/kg。给药后观察和记录所有小鼠的即时反应以及4 h、1 d、2 d、3~14 d全身毒性表现,实验开始前到实验结束每天称量体重,如动物大量死亡需要进行尸检[18]。
(2) 皮肤刺激实验: 采用皮肤刺激实验测试去污膜对新西兰兔的皮肤刺激情况。取3只健康新西兰兔,在实验前一天剃除兔子背部脊柱两侧被毛,作为实验和观察部位,注意动物皮肤无损伤[19]。实验当天将制备好的去污膜样品、阴性对照(生理盐水)和阳性对照(20 % 十二烷基硫酸钠, sodium dodecyl sulfate, SDS) 样品按照阴性对照组、去污膜组、阳性对照组的顺序依次贴到兔子皮肤表面,用医用封闭式胶带固定接触部位24 h。分别在除去敷贴片后1、24、48和72 h观察并记录各刺激部位皮肤情况。
(3) 细胞毒实验: 采用噻唑蓝比色法(methyl thiazolyl tetrazoliu, MTT) 测试去污膜的体外细胞毒性,细胞相对增殖度>75% 可认定材料无明显细胞毒性[20]。去污膜材料以浸提比3 cm2/ml加入高糖培养基(DMEM)37℃浸提24 h,吸取上清,以10% 体积比加入胎牛血清配制为100% 待测样品,用DMEM完全培养基稀释制备75%、50%、25% 待测样品。将浓度为1×105/ml生长旺盛的L929细胞以每孔100 μl加入到96孔培养板中,于37℃、5% CO2细胞培养箱中培养24 h;每孔加入100 μl上述4种不同浓度的待测样品作为实验组。阴性对照组每孔加入100 μl完全DMEM培养基,阳性对照组每孔加入100 μl含0.2% (W/V) 苯酚的完全DMEM培养基继续培养24 h (n=6)。取出后,每孔加入50 μl MTT溶液(1 mg/ml) 培养2 h,之后每孔加入100 μl异丙醇,摇床震荡10 min充分溶解。用酶标仪测定570 nm、650 nm (校准波长)波长处吸光度(A) 值,计算细胞相对增殖度(relative growth rate, RGR)。细胞相对增殖度公式为:
| $ R G R(\%)=\frac{G}{H} \times 100 \% $ | (5) |
式中,G和H分别为实验组和阴性对照组的吸光度值,L/(g·cm)。
10、统计学处理采用GraphPad Prism 8.0和SPSS 26软件制图和统计分析。定量数据以x ± s表示,采用单因素方差分析与t检验进行各项数据的比较。以P < 0.05为差异有统计学意义。
结果 1、去污膜物理性质(1) 去污膜断裂应力与应变测试: 通过实验测试去污膜断裂应力为(393.88 ± 53.53) kN/m2,断裂应变为(163.00 ± 35.29)%。海藻酸钠膜断裂应力为(160.32 ± 22.69) kN/m2,断裂应变为(300.00 ± 84.86)%。去污膜与海藻酸钠膜相比断裂应力有明显提高(t = 18.51,P < 0.001),断裂应变明显下降(t = 5.66,P < 0.001)。结果表明去污膜成分中海藻酸钠与壳聚糖分子通过静电作用力互相结合,赋予了去污膜强大的断裂应力,使去污膜更有韧性,不易断裂,同时也降低去污膜断裂应变,使其不易形变。
(2) 去污膜溶胀系数测定: 通过实验测试去污膜的溶胀率为(134.96 ± 3.49)%,海藻酸钠膜为(222.26 ± 4.13)%,去污膜与海藻酸钠膜相比溶胀性能有明显降低(t = 1 760.05,P < 0.001),这是由于去污膜中海藻酸钠与壳聚糖通过静电作用形成了丰富的刚性交联点,增加了去污膜的交联密度,抑制三维网络的溶胀,有效提高了水凝胶的抗溶胀性能。
2、去污膜对核素的清除效果(1) 去污膜在完整皮肤上对铀、铯的清除效果: 以生理盐水组、基质膜组、1% DTPA-5Na基质膜组为对照组,染毒5 min后实验,模拟核污染现场中人员放射性核素污染的及时治疗。各处理组在完整皮肤对铀、铯的清除率的结果见表 2。实验结果显示,与生理盐水组、基质膜组、1% DTPA-5Na基质膜组比较,去污膜组对铀、铯的清除率明显更高(t铀 = 19 791.14、477.38、368.12,P < 0.001;t铯 = 525.43、75.09、20.25,P < 0.001)。本研究还对全血中铀、铯的浓度进行检测,结果均低于定量下限,表明铀、铯在完整皮肤上入血量极少。通过定量下限对入血浓度进行估算,完整皮肤组全血中铀、铯浓度低于1.50 ng/g。综上,表明去污膜在完整皮肤上对铀和铯有着良好的清除效果。
|
|
表 2 不同洗消剂配方对豚鼠完整皮肤和伤口模型的核素清除率(%,x±s) Table 2 Radionuclide removal rates of various chelating agent formulations for the intact skin and skin wound model of guinea pigs(%, x±s) |
(2) 去污膜在伤口模型上对铀、铯、锶、钴和铈的清除效果: 伤口模型上考察了5种核素的清除效果,各处理组在伤口模型上对核素的清除率见表 2。各处理组在伤口模型处理后全血中核素浓度见表 3。核素清除率实验结果显示,与生理盐水组、基质膜组、1% DTPA-5Na基质膜组比较,去污膜组对铀、铯、锶、钴和铈的清除率明显更高(t铀 = 4 498.55、209.65、9.41,P < 0.001;t铯 = 70.87、8.07、3.81,P < 0.001;t锶 = 55.99、109.21、13.47,P < 0.001;t钴 = 122.99、83.30、20.93,P < 0.001;t铈 = 354.16、28.46、18.61,P < 0.001)。血中核素浓度检测结果显示,各处理组豚鼠全血中铀浓度以模型组最高,去污膜组最低;铯浓度以模型组最高,去污膜组最低;锶浓度以模型组与生理盐水组相近,去污膜组最低;钴浓度以模型组最高,去污膜组最低;铈浓度均低于定量下限,以定量下限进行估算,铈浓度低于1.50 ng/g。综上,表明去污膜在伤口模型上对铀、铯、锶、钴和铈有良好的清除效果。
|
|
表 3 不同洗消剂配方对豚鼠伤口模型处理后全血中核素浓度(ng/g, x±s) Table 3 Radionuclide concentrations in whole blood after treatment of the wound model with various chelating agent formulations (ng/g, x±s) |
3、安全性实验
(1) 急性毒性实验: 实验结果见图 1,与对照组相比,实验组小鼠腹腔注射去污膜浸提液后未见明显异常反应。两组小鼠体重增长趋势一致,均未出现运动迟缓、精神萎靡、食欲不振等情况,一般状况良好。实验结果表明,去污膜无明显急性毒性反应。
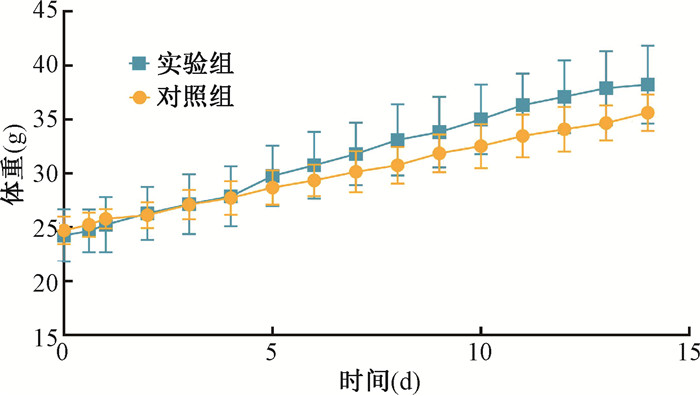
|
图 1 急性毒性实验小鼠给药后14 d体重 Figure 1 Body weight of Kunming mice 14 d after taking the medicine for acute toxicity tests |
(2) 皮肤刺激实验: 去污膜皮肤刺激实验结果见表 4。按照医疗器械生物学评价第10部分[21]反应类型对去污膜组皮肤反应计数,去污膜组新西兰兔皮肤反应与阴性对照组无明显差异,表明去污膜对新西兰兔无皮肤刺激。
|
|
表 4 新西兰兔各处理组在皮肤刺激后不同时间的皮肤反应 Table 4 Skin reactions at different time after irritation for various treatment groups of New Zealand rabbits |
(3) 体外细胞毒实验: 去污膜体外细胞毒性实验结果,以阴性对照组为100%,阳性对照组苯酚的细胞相对增殖率仅为6.62%,细胞毒性明显,表明模型成功。实验组100% 浸出液的相对细胞增殖率为76.23%,75% 浸出液的相对细胞增殖率为87.01%,50% 浸出液的相对细胞增殖率为94.82%,25% 浸出液的相对细胞增殖率为95.21%,实验组相对细胞增殖率均>75%,表明去污膜无潜在的细胞毒性。
讨论国际标准对放射性核素污染常建议使用大量生理盐水或者1% DTPA溶液冲洗伤口来最大限度抑制核素与人体体表的结合[21-22]。对于稀土核素、钚和超级钚污染,常用1% DTPA (pH 3~5) 或生理盐水来洗消,对于未知的放射性核素污染,可以使用5% 乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA) 或DTPA溶液来处理[23]。但传统洗消剂难以完全清除皮肤伤口沾染的放射性核素,因此研究者致力于开发对放射性核素清除效果更好的洗消剂。Sharma等[24]研制的对叔丁基芳烃纳米乳液对碘和铊有良好的清除效果。Rana等[25]测试EDTA-2Na溶液对放射性核素 131I、201Tl和 99Tcm的去污能力,结果证明EDTA-2Na对3种核素的去污能力较强,净化效果分别为(90 ± 5)%、(80 ± 2)% 和(85 ± 2)%。Griffiths等[26]在实验中比较水、DTPA、trait rouge(TR)、杯芳烃对钚、镅、铀核素的清除效果,TR对钚、镅、铀的清除率分别为(82±5)%、(88±3)%、(82±6)%,清除效果较为理想。但是液体洗消剂后续依赖纯净水冲洗,不适合核污染现场上恶劣的环境、也难在零污染水源缺乏或者密闭空间内使用。
水凝胶具有不依赖水源、方便携带和去除的优点,在皮肤敷料领域内应用广泛,Zhang等[27]报道一种具有抗炎和抗氧化特性的水凝胶可以治疗辐照引起的皮肤损伤。Nie等[28]研制的自组装肽水凝胶对辐射诱导的皮肤损伤具有治疗作用,可作为新型细胞治疗方法的基础。Cui等[7]利用聚丙烯酰胺(polyacrylic amide, PAM)、海藻酸钠(sodium alginate, SA) 和二乙烯三胺五乙酸(DTPA) 通过氢键进行物理交联,生成PAM-SA-DTPA (PASD) 水凝胶。这种PASD水凝胶表现出良好的粘附性和机械性能,与对照组相比,PASD水凝胶组小鼠皮肤创面放射性锶核素含量在6、24 h和7 d后显著减少,说明PASD水凝胶能有效去除和防止放射性锶在小鼠皮肤创面的吸附。Tazrart等[29]制备DTPA凝胶,结果证明DTPA凝胶能有效清除皮肤表面的Am、Pu以及磷酸三丁酯的络合物,需2 h方可清除80%~90% 钚核素。以上应用于核素清除领域的水凝胶需要2~6 h才能达到良好的清除效果,过于缓慢[7-8, 29],尚无法满足核污染现场的应急洗消需求,仍需要开发新型复方水凝胶以提高洗消速率并便于适应现场环境。
成膜系统在近年来多次迭代,将非固体剂型(如凝胶和溶液)原位转化为薄膜的能力已经得到了实质性的发展,促使成膜时间大幅缩短[10, 30],并且成膜凝胶更易于涂抹在伤口部位,尤其是不均匀伤口以及弯曲伤口[10]。Kim等[11]发现,含有夫西酸钠的成膜系统可显著促进感染伤口愈合。在该研究中,包含聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP) /聚乙烯醇(polyvinyl alcohol, PVA) /丙二醇/乙醇/水凝胶的成膜时间约为4 min,具有适当的粘附性、柔韧性和弹性。An等[12]开发了一种成膜软水凝胶,使用聚乙烯醇、皮肤渗透增强剂和粘合剂进行睾酮透皮递送,水凝胶在应用2~3 min后形成薄膜。因此,将成膜凝胶应用于核素污染洗消领域,开发一款可快速成膜的、核素清除效果良好的去污膜具有重要的现实意义和应用价值。
本研究利用成膜凝胶的快速凝固性能,复合具有强核素去除能力的螯合剂配方制备的去污膜仅需1.5 min便可成膜,并且采用多种螯合剂协同对核素进行清除,较单一螯合剂相比清除效果更佳。在核污染早期便可快速对污染皮肤进行清理,减少核素长期沾染导致的皮肤损伤以及核素透过皮肤屏障对人体内环境的毒害作用。在去污膜使用过程中,本研究设计了两种使复方络合剂成膜的方法。方法一是直接喷洒成膜液到复方络合剂表面;方法二是将浸有成膜液的纱布覆盖于复方络合剂上。在实验过程中,方法一喷洒的成膜液流动性高,难以集中到复方络合剂表面,尤其是增大单位面积使用量时,复方络合剂表面凝固成膜,但移除去污膜后豚鼠皮肤上仍有未成膜的复方络合剂残留。方法二则增大了成膜液与复方络合剂的接触时间,使复方络合剂在增大单位面积使用量后仍可以良好成膜。通过对成膜液的给药方式进行优化,用浸润有成膜液的纱布代替喷洒成膜液,从而减少了喷洒成膜液时液体飞溅、成膜液难以浸润到复方络合剂下层等问题。同时提高了复方络合剂的单位面积使用量,增加清除效率,且使用更加方便。在完整皮肤上,对于铀、铯核素,去污膜组螯合吸附的核素含量均最多,1% DTPA-5Na基质膜组次之,基质膜组螯合吸附的核素含量最少。在伤口模型上,对于铀、铯、锶、钴和铈核素,去污膜组螯合吸附的核素含量均多于1% DTPA-5Na基质膜组和基质膜组。去污膜组与生理盐水组、基质膜组、1% DTPA-5Na基质膜组比较,去污膜组核素的皮肤残留量最少、处理膜螯合吸附的核素含量最多及全血中浓度最低,表明本论文研究的去污膜对铀、铯、锶、钴和铈具有良好的清除效果。
本研究通过将螯合剂负载在海藻酸钠-壳聚糖膜上制备了一款适用于缺水、密闭等恶劣环境下使用的去污膜,对去污膜的去污效果、断裂应力、应变与溶胀性能进行测定,同时对成膜液的给药方式、单位面积使用量进行改善,结果证明去污膜对多种核素均有良好的清除效果,是一种安全有效的去污膜。
利益冲突 无
作者贡献声明 田庄负责实验操作、数据分析和论文撰写;何琪、乔璇、李林涛、胡瑄、全晓筱、叶彤、甘慧、吴卓娜、顾若兰、朱晓霞、孙云波、刘曙晨、窦桂芳协助实验;孟志云指导实验设计和论文修改
| [1] |
Spagnul A, Bouvier-Capely C, Phan G, et al. A new formulation containing calixarene molecules as an emergency treatment of uranium skin contamination[J]. Health Phys, 2010, 99(3): 430-434. DOI:10.1097/HP.0b013e3181d1a1b6 |
| [2] |
Mannis D, Brandl A. Efficacy of common decontamination methods for cleaning contaminated wounds[J]. Health Phys, 2015, 108(1 Suppl 1): S5-S12. DOI:10.1097/HP.0000000000000190 |
| [3] |
Zanzonico P. Management of persons contaminated with radionuclides: handbook[J]. Med Phys, 2010, 37(8): 4521-4522. DOI:10.1118/1.3468185 |
| [4] |
Petitot F, Moreels AM, Paquet F. In vitro evaluation of percutaneous diffusion of uranyl nitrate through intact or excoriated skin of rat and pig[J]. Can J Physiol Pharmacol, 2004, 82(2): 133-139. DOI:10.1139/y04-004 |
| [5] |
Dimatteo R, Darling NJ, Segura T. In situ forming injectable hydrogels for drug delivery and wound repair[J]. Adv Drug Deliv Rev, 2018, 127: 167-184. DOI:10.1016/j.addr.2018.03.007 |
| [6] |
Dobrzyński P, Pamuła E. Polymeric scaffolds: design, processing, and biomedical application[J]. Int J Mol Sci, 2021, 22(9): 4552. DOI:10.3390/ijms22094552 |
| [7] |
Cui FM, Wu ZJ, Zhao R, et al. Development and characterization of a novel hydrogel for the decontaminating of radionuclide-contaminated skin wounds[J]. Macromol Biosci, 2021, 21(5): e2000399. DOI:10.1002/mabi.202000399 |
| [8] |
Xu K, Ge W, Liang G, et al. Bisphosphonate-containing supramolecular hydrogels for topical decorporation of uranium-contaminated wounds in mice[J]. Int J Radiat Biol, 2008, 84(5): 353-362. DOI:10.1080/09553000802029902 |
| [9] |
Esa N, Ansari M, Razak S, et al. A review on recent progress of stingless bee honey and its hydrogel-based compound for wound care management[J]. Molecules, 2022, 27(10): 3080. DOI:10.3390/molecules27103080 |
| [10] |
Kim HS, Sun X, Lee JH, et al. Advanced drug delivery systems and artificial skin grafts for skin wound healing[J]. Adv Drug Deliv Rev, 2019, 146: 209-239. DOI:10.1016/j.addr.2018.12.014 |
| [11] |
Kim DW, Kim KS, Seo YG, et al. Novel sodium fusidate-loaded film-forming hydrogel with easy application and excellent wound healing[J]. Int J Pharm, 2015, 495(1): 67-74. DOI:10.1016/j.ijpharm.2015.08.082 |
| [12] |
An NM, Kim DD, Shin YH, et al. Development of a novel soft hydrogel for the transdermal delivery of testosterone[J]. Drug Dev Ind Pharm, 2003, 29(1): 99-105. DOI:10.1081/ddc-120016688 |
| [13] |
王旭, 窦桂芳, 甘慧, 等. 放射性污染伤口洗消剂配方的设计及效果评价[J]. 军事医学, 2022, 46(5): 379-384. Wang X, Dou GF, Gan H, et al. Formulation design of a decontaminant for radioactive contamination wounds and evaluation of its effect[J]. Mil Med Sci, 2022, 46(5): 379-384. DOI:10.7644/j.issn.1674-9960.2022.05.011 |
| [14] |
Mofazzal Jahromi MA, Sahandi Zangabad P, Moosavi Basri SM, et al. Nanomedicine and advanced technologies for burns: Preventing infection and facilitating wound healing[J]. Adv Drug Deliv Rev, 2018, 123: 33-64. DOI:10.1016/j.addr.2017.08.001 |
| [15] |
刘郢. 乏燃料后处理工程工艺设计[D]. 衡阳: 南华大学, 2020. DOI: 10.27234/d.cnki.gnhuu.2018.000097. Liu Y. Project process design research for spent fuel reprocessing plant[D]. Hengyang: Nanhua University, 2020. DOI: 10.27234/d.cnki.gnhuu.2018.000097. |
| [16] |
张琼, 陈金融, 张春明, 等. 土壤放射性核素铯污染修复研究进展[J]. 核农学报, 2014, 28(10): 1924-1931. Zhang Q, Chen JC, Zhang CM, et al. Research progress of remediation contaminated soil by radioactive Cs[J]. J Nucl Agric Sci, 2014, 28(10): 1924-1931. DOI:10.11869/j.issn.100-8551.2014.10.1924 |
| [17] |
王旭. 放射性核素伤口污染应急洗消剂的研究[D]. 北京: 军事科学院, 2021. DOI: 10.27193/d.cnki.gjsky.2021.000150. Wang X. Formulation design of wound dissolving agent for radioactive contamination[D]. Beijing: Academy of Military Sciences, 2021. DOI: 10.27193/d.cnki.gjsky.2021.000150. |
| [18] |
国家质量监督检验检疫总局. GB/T 16886.11-2021. 医疗器械生物学评价第11部分: 全身毒性实验[S]. 北京: 中国标准出版社, 2021. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 16886.11-2021 Biological evaluation of medical devices-Part 11: Tests for systemic toxicity[S]. Beijing: Standards Press of China, 2021. |
| [19] |
国家质量监督检验检疫总局. GB/T 16886.10-2017医疗器械生物学评价第10部分: 刺激与皮肤致敏实验[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 16886.10-2017 Biological evaluation of medical devices-Part 10: Tests for irritation and skin sensitization[S]. Beijing: Standards Press of China, 2017. |
| [20] |
国家质量监督检验检疫总局. GB/T 16886.5-2017医疗器械生物学评价第5部分: 体外细胞毒性实验[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 16886.5-2017 Biological evaluation of medical devices-Part 5: Tests for in vitro cytotoxicity[S]. Beijing: Standards Press of China, 2017. |
| [21] |
Coleman CN, Adams S, Adrianopoli C, et al. Medical planning and response for a nuclear detonation: a practical guide[J]. Biosecur Bioterror, 2012, 10(4): 346-371. DOI:10.1089/bsp.2012.1025 |
| [22] |
Sugarman SL, Findley WM, Toohey RE, et al. Rapid response, dose assessment, and clinical management of a plutonium-contaminated puncture wound[J]. Health Phys, 2018, 115(1): 57-64. DOI:10.1097/HP.0000000000000821 |
| [23] |
卫生部政策法规司. GBZ/T 216-2009人体体表放射性核素污染处理规范[S]. 北京: 中国标准出版社, 2009. Department of Health Policy and Regulation. GBZ/T 216-2009 Specification of decontamination for radionuclides contaminated human wound and skin[S]. Beijing: Standards Press of China, 2009. |
| [24] |
Sharma N, Ojha H, Pathak DP, et al. Ex-vivo complexation, skin permeation, interaction and cytodermal toxicity studies of p-tertbutylcalix[4]arene nanoemulsion for radiation decontamination[J]. Life Sci, 2017, 168: 65-76. DOI:10.1016/j.lfs.2016.11.007 |
| [25] |
Rana S, Bhatt S, Dutta M, et al. Radio-decontamination efficacy and safety studies on optimized decontamination lotion formulation[J]. Int J Pharm, 2012, 434(1-2): 43-48. DOI:10.1016/j.ijpharm.2012.05.003 |
| [26] |
Griffiths NM, Devilliers K, Laroche P, et al. A simple, rapid, comparative evaluation of multiple products for decontamination of actinide-contaminated rat skin ex vivo[J]. Health Phys, 2022, 122(3): 371-382. DOI:10.1097/HP.0000000000001506 |
| [27] |
Zhang J, Zhu Y, Zhang Y, et al. A balanced charged hydrogel with anti-biofouling and antioxidant properties for treatment of irradiation-induced skin injury[J]. Mater Sci Eng C Mater Biol Appl, 2021, 131: 112538. DOI:10.1016/j.msec.2021.112538 |
| [28] |
Nie S, Ren C, Liang X, et al. Supramolecular hydrogel-wrapped gingival mesenchymal stem cells in cutaneous radiation injury[J]. Cells, 2022, 11(19): 3089. DOI:10.3390/cells11193089 |
| [29] |
Tazrart A, Bolzinger MA, Lamart S, et al. Actinide-contaminated skin: comparing decontamination efficacy of water, cleansing gels, and DTPA gels[J]. Health Phys, 2018, 115(1): 12-20. DOI:10.1097/HP.0000000000000814 |
| [30] |
Misra A, Raghuvanshi RS, Ganga S, et al. Formulation of a transdermal system for biphasic delivery of testosterone[J]. J Control Release, 1996, 39(1): 1-7. |
 2024, Vol. 44
2024, Vol. 44


