辐射生物剂量计在辐射事故发生后受照个体分诊及后续治疗中发挥重要作用[1-2]。现有的用于辐射生物剂量计的剂量-效应曲线通常为线性模型[3],并假设照后时间是固定的。但实际受照后的辐射生物剂量计的效应趋势存在时间效应,包括双着丝粒染色体和γ-H2AX在内的辐射生物剂量计的效应指标值均随照后时间的延长而降低[4-5]。因此,建立包括时间因素在内的剂量估算三维模型可更方便准确地估算受照剂量[6]。大多数辐射事故是局部照射,已有研究证明,双着丝粒染色体和γ-H2AX可用于局部照射剂量估算[2, 7, 10]。针对辐射生物剂量计建立的曲线中仅可涉及2个因素问题,本研究提出了一种可用于辐射生物剂量估算的三维模型,照射剂量和照后时间作为自变量,辐射效应分子作为因变量,建立三维模型,来估算受照剂量。本研究以局部照射为例,将γ-H2AX平均焦点数作为因变量,对三维模型的可行性进行验证。
材料与方法1. 实验动物:将15只(20±1.5)g体重的8周龄雄性C57BL/6J小鼠[北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0006,合格证号:110011230106545931],采用随机数表法分为0、2、4、6、8 Gy组,每组3只。饲养于无特定病原体级动物房屏障环境内。
2. 主要试剂与仪器:KUBTEC XCELL 225生物辐照仪(美国KUBTEC公司);ZEISS LSM700激光共聚焦显微镜(德国Carl ZEISS公司);4’,6-二脒基-2-苯基吲哚(DAPI)购自西班牙Vector Laboratories公司;兔单克隆抗γ-H2AX抗体、Alexa Fluor-594标记的山羊抗兔IgG(H+L)二抗购自美国Cell Signaling公司。
3. 照射条件:小鼠腹腔注射2, 2, 2-三溴乙醇麻醉,用胶布将小鼠固定在塑料板上。对C57BL/6J小鼠进行不同剂量X射线全身照射,吸收剂量率为1 Gy/min,源皮距为50 cm。照射剂量分别为0、2、4、6、8 Gy,于照射后1、6、24 h收集小鼠胡须毛囊细胞进行检测。
4. 免疫荧光染色及分析:拔取照射后的小鼠胡须置于2 ml的离心管中,室温,2%的多聚甲醛(PFA)固定30 min。去除PFA,用1×磷酸盐缓冲液(PBS)洗涤样本1次。将样本置于预冷的70%乙醇中,于4℃下通透1周[11]。PBS洗涤样本5 min,5%牛血清白蛋白(BSA)溶液封闭30 min。PBS洗涤1次后,用兔单克隆抗γ-H2AX抗体(1∶400)孵育3 h。接着,用Alexa Fluor-594标记的山羊抗兔IgG(H+L)二抗(1∶500)避光孵育1.5 h。PBS洗涤样本2次,置于玻片上,将含毛囊的一端放在用免疫组织化学笔画成的疏水圈,并将另一端固定于载玻片上。滴加DAPI,37℃条件下孵育20 min。使用20 ×及63 ×物镜拍摄图像后,利用软件Image J分析荧光图像,其中每个样本中记录约200个毛囊细胞核。
5. 线性模型与三维模型准确性验证:将C57BL/6J小鼠按照随机数表法分2组,每组3只,对小鼠腹部分别照射2和6 Gy,于照后1、6、24 h收集小鼠胡须毛囊细胞进行检测,照射条件及样本制备及分析方法同前所述。使用拟合的线性模型与三维模型进行剂量估算。
6. Dolphin′s模型估算局部照射剂量方法:基于国际原子能机构(IAEA)报告[12]中的公式13(Dolphin′s模型)的变形,对γ-H2AX平均焦点数进行校正,如公式(1):
| $ {Y_F} = \frac{X}{{N \times F}} $ | (1) |
式中,YF为含有焦点的细胞中每个细胞的γ-H2AX平均焦点数,忽略无焦点的细胞;N为观察的毛囊细胞总数;X为观察的毛囊细胞中γ-H2AX焦点总数;F为含有γ-H2AX焦点的毛囊细胞的份额。
7. 统计学处理:利用SPSS 26.0软件进行统计学分析,γ-H2AX平均焦点数符合正态分布,用x±s表示。利用线性和非线性最小二乘法拟合线性和三维回归模型。利用软件R 4.3.1绘制三维模型图像。多组间数据差异的比较采用单因素方差分析,其后两两比较应用LSD检验。P<0.05为差异具有统计学意义。
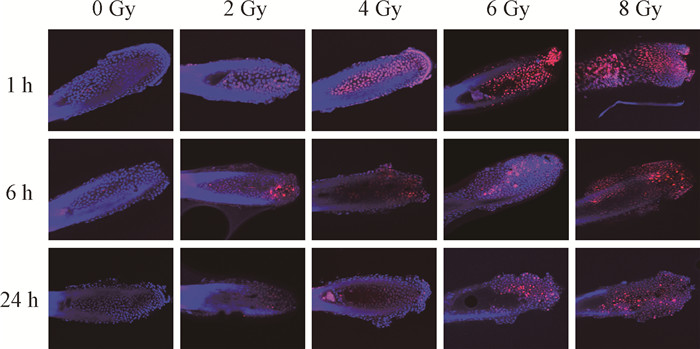
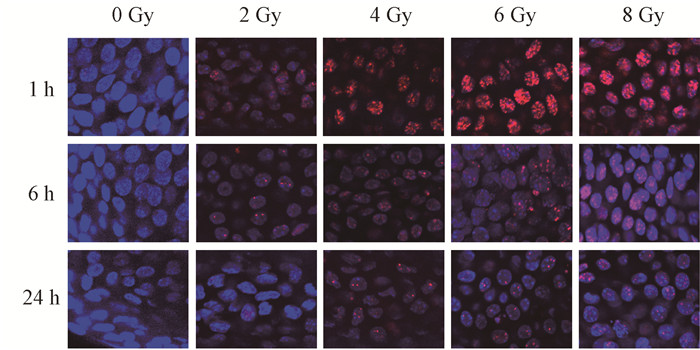
结果1. 观察γ-H2AX平均焦点数随时间变化趋势:用于建立校准曲线的γ-H2AX平均焦点数见表 1。在照后各时间点可以看到每个毛囊细胞的平均焦点数随剂量增加而增加,其中数值范围为未照射样本中观察到的每个毛囊细胞约0.1个焦点到8 Gy照射后1 h观察到的(29.11 ± 2.47)个焦点。图 1~2表明,不同剂量X射线照射毛囊细胞后,γ-H2AX平均焦点数随照后时间增加而减少。
|
|
表 1 不同剂量X射线照射后不同时间毛囊细胞的γ-H2AX平均焦点数(x±s) Table 1 Average numbers of γ-H2AX foci in hair follicle cells at different times after exposure to different doses of X-ray irradiation (x±s) |
|
图 1 不同剂量X射线照射后不同时间毛囊细胞的γ-H2AX焦点 免疫荧光染色×200 Figure 1 γ-H2AX foci in hair follicle cells at different time after exposure to different doses of X-ray irradiation Immunofluorescence staining ×200 |
|
图 2 不同剂量X射线照射后不同时间毛囊细胞的γ-H2AX焦点 免疫荧光染色×630 Figure 2 γ-H2AX foci in hair follicle cells at different time after exposure to different doses of X-ray irradiation Immunofluorescence staining ×630 |
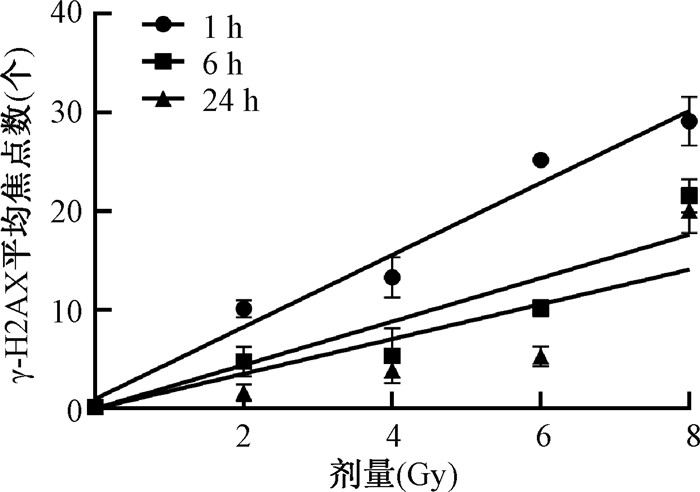
2. 基于γ-H2AX平均焦点数拟合全身照射剂量-效应曲线:将不同剂量X射线照射后1、6和24 h的毛囊细胞γ-H2AX平均焦点数拟合为线性方程Y = a + bD,Y为γ-H2AX平均焦点数;D为照射剂量,Gy(图 3)。照后1 h的线性方程拟合为Y = 0.961+3.65D,R2 = 0.957;照后6 h的线性方程拟合为Y = 2.203D,R2 = 0.927;照后24 h的线性方程拟合为Y = 1.76D,R2 = 0.814。其中,线性方程的斜率在照后较短的时间内较高,在1 h为3.65,然后该系数逐渐下降,在24 h达到最低值,为1.76。同时,不同剂量X射线照射后,毛囊细胞的γ-H2AX平均焦点数随照后剂量增加而增加。
|
图 3 不同剂量X射线照射后毛囊细胞的γ-H2AX平均焦点数 Figure 3 Average numbers of γ-H2AX foci in hair follicle cells after exposure to different doses of X-ray irradiation |
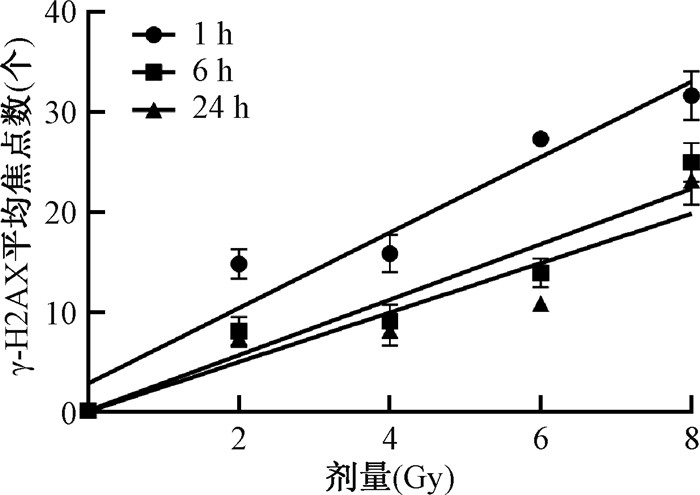
3. 基于γ-H2AX平均焦点数拟合局部照射剂量-效应曲线:将不同剂量X射线照射后毛囊细胞1、6和24 h的γ-H2AX平均焦点数经Dolphin′s模型校正后,拟合为线性方程YF = a + bD,YF为Dolphin′s模型校正后的γ-H2AX平均焦点数;D为照射剂量,Gy(图 4)。其中,照后1 h的线性方程拟合为YF = 2.853+3.775D,R2 = 0.928;照后6 h的线性方程拟合为YF = 0.144+2.775D,R2 = 0.903;照后24 h的线性方程拟合为YF = 0.066+2.472 D,R2 = 0.85。可以看出,线性方程的斜率在照后较短的时间内较高,在1 h为3.775,然后该系数逐渐下降,在24 h达到最低值,为2.472。
|
图 4 0~8 Gy X射线照射后毛囊细胞的γ-H2AX平均焦点数拟合局部照射剂量-效应曲线 Figure 4 Partial-body irradiation dose-response curves fitted based on the average numbers of γ-H2AX foci in hair follicle cells after 0-8 Gy X-ray irradiation |
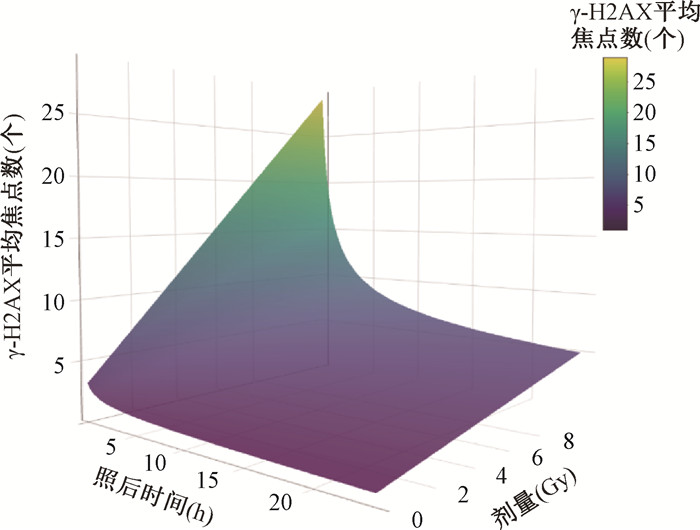
4. 基于γ-H2AX平均焦点数建立局部照射三维模型:将不同剂量X射线照射后1、6和24 h毛囊细胞的γ-H2AX平均焦点数拟合为三维模型YF = a · tu + b · tvD,YF为Dolphin′s模型校正后的γ-H2AX平均焦点数;t为照后时间,h;D为照射剂量,Gy。本研究建立的三维模型方程为YF = 6.837 t-1.728+3.113 t-0.071 D,R2 = 0.897。代入确定的照后时间,三维曲面模型呈现二维线性模型形式,建立的三维模型见图 5。
|
图 5 基于0~8 Gy X射线照射后毛囊细胞的γ-H2AX平均焦点数建立局部照射三维模型 Figure 5 A three-dimensional partial-body irradiation model established based on the average numbers of γ-H2AX foci in hair follicle cells after 0-8 Gy X-ray irradiation |
5. 验证线性模型及三维模型:观察2和6 Gy局部照射后的γ-H2AX平均焦点数。其中,照后1 h,γ-H2AX平均焦点数分别为11.46 ± 1.33、30.42 ± 1.40;照后6 h分别为7.37 ± 1.52、18.86 ± 1.57;照后24 h分别为6.31± 0.53、18.09 ± 3.45。利用拟合的线性模型以及三维模型,对2和6 Gy局部照射后的剂量进行估算,并对两种模型估算的剂量结果进行比较(表 2,3)。结果表明,γ-H2AX平均焦点数随照后时间增加而减少。使用线性模型和三维模型估算受照剂量时,各组估算受照剂量与实际照射剂量的相对偏差均不超过30%。在2 Gy X射线照射毛囊细胞后6 h,使用线性模型时观察到最大差异,估算剂量与实际受照剂量之间的相对偏差为30.20%,同时使用三维模型估算受照剂量与实际受照剂量之间的相对偏差为28.80%。
|
|
表 2 使用线性模型估算局部照射剂量 Table 2 Partial-body irradiation doses estimated using the linear model |
|
|
表 3 使用三维模型估算局部照射剂量 Table 3 Estimation of partial-body irradiation doses using the three-dimensional model |
讨论
目前用于辐射生物剂量估算的剂量-效应曲线,默认照射时间点是固定的,然而在准确的时间点取材是不容易实现的。本研究探索一种在辐射生物剂量计研究中拟合曲线的方法,利用照射后时间、剂量、效应分子构建三维剂量估算模型并拟合曲线,此方法适用于各种辐射生物剂量计,可实现曲线时间范围内任何时间点取材。同时,本研究以局部照射生物剂量计为例进行演示,并从适用性角度与传统的二维曲线模型进行比较。
本研究发现,γ-H2AX焦点数随照射剂量增加而增加,以X射线照射小鼠胡须毛囊细胞后1 h为例,γ-H2AX平均焦点数从2 Gy组的1.61 ± 0.84增加到8 Gy组的29.11 ± 2.47。已有研究表明,γ-H2AX焦点数在受到照射后的外周血淋巴细胞和粒细胞[13]、人肺上皮细胞和小鼠血管内皮细胞[14]中均显示随照射剂量增加而增加,本研究与以往研究结果一致。同时,由于照射后存在DNA修复,随照后时间的增加,γ-H2AX焦点数逐渐减少。Natale等[15]也报道10 Gy X射线照射宫颈癌HeLa细胞后,γ-H2AX荧光强度和蛋白表达水平在照后0.5 h最高,而后开始逐渐降低。因此,建立包括时间因素在内的剂量估算三维模型可更方便准确地估算受照剂量。
在局部照射中,将不同剂量X射线照射毛囊细胞后的γ-H2AX平均焦点数经Dolphin′s模型校正后,拟合为线性方程YF = a + bD。由于γ-H2AX焦点数在照后约30 min到达最大值并在照后随时间增加而逐渐减少[16],因此斜率随照射后时间增加而逐渐减小。在本研究中,线性方程的斜率范围为照射后1 h的3.775至24 h的2.472。本研究照射后24 h获得的方程斜率与Chaurasia等[17]的研究中获得的斜率类似,均在2左右。
利用γ-H2AX平均焦点数,对2和6 Gy局部照射后的剂量进行估算,结果表明,使用线性模型和三维模型估算受照剂量与实际受照剂量的相对偏差均不超过30%,说明三维模型用于剂量估算与常规的二维方程具有相同的适用性和稳定性。
本研究存在一定的局限性,例如只探索了照后1、6、24 h γ-H2AX焦点数,同时估算的受照剂量与实际受照剂量的相对偏差不超过30%。下一步可通过增加照后时间点、扩大实验动物样本量等方法,进一步完善受照后的剂量-效应关系曲线,从而更准确地估算受照剂量。
综上,本研究建立的三维模型和方程,与常规的二维线性模型估算受照剂量时有类似的准确度,可以实现估算受照剂量的目的。此外,该三维模型可实现照后处理曲线范围内的任一时间点的剂量估算,这是在二维模型基础上实现的新突破。
利益冲突 无
志谢 感谢北京中康博生物科技公司的李靖根据本研究需求开发出R语言程序,得以实现三维模型的数据分析和图表输出
作者贡献声明 陈婕负责实验操作、数据整理与分析、论文撰写;刘萌萌负责样本制备、拍片;高玲负责课题设计、指导实验及论文修改
| [1] |
Bucher M, Weiss T, Endesfelder D, et al. Dose variations using an X-ray cabinet to establish in vitro dose-response curves for biological dosimetry assays[J]. Front Public Health, 2022, 10: 903509. DOI:10.3389/fpubh.2022.903509 |
| [2] |
Mendes ME, Mendonca J, Barquinero JF, et al. Comparative study of micronucleus assays and dicentric plus ring chromosomes for dose assessment in particular cases of partial-body exposure[J]. Int J Radiat Biol, 2019, 95(8): 1058-1071. DOI:10.1080/09553002.2019.1607606 |
| [3] |
Lusiyanti Y, Syaifudin M, Budiantari T, et al. Development of dose-response calibration curve for dicentric chromosome induced by X-rays[J]. Genome Integr, 2019, 10: 2. DOI:10.4103/genint.genint_1_19 |
| [4] |
吕玉民, 田梅, 王平, 等. 医疗行业放射工作人员染色体畸变水平的影响因素分析[J]. 中华放射医学与防护杂志, 2020, 40(4): 278-283. Lyu YM, Tian M, Wang P, et al. Influence factors of chromosomal aberration levels in radiation workers in hospitals[J]. Chin J Radiol Med Prot, 2020, 40(4): 278-283. DOI:10.3760/cma.j.issn.0254-5098.2020.04.006 |
| [5] |
Sharma PM, Ponnaiya B, Taveras M, et al. High throughput measurement of γH2AX DSB repair kinetics in a healthy human population[J]. PLoS One, 2015, 10(3): e121083. DOI:10.1371/journal.pone.0121083 |
| [6] |
Lopez JS, Pujol-Canadell M, Puig P, et al. Establishment and validation of surface model for biodosimetry based on γ-H2AX foci detection[J]. Int J Radiat Biol, 2022, 98(1): 1-10. DOI:10.1080/09553002.2022.1998706 |
| [7] |
Prasanna PG, Moroni M, Pellmar TC. Triage dose assessment for partial-body exposure: dicentric analysis[J]. Health Phys, 2010, 98(2): 244-251. DOI:10.1097/01.HP.0000348020.14969.4 |
| [8] |
Redon CE, Nakamura AJ, Gouliaeva K, et al. Q(γ-H2AX), an analysis method for partial-body radiation exposure using γ-H2AX in nonhuman primate lymphocytes[J]. Radiat Meas, 2011, 46(9): 877-881. DOI:10.1016/j.radmeas.2011.02.017 |
| [9] |
Zahnreich S, Ebersberger A, Kaina B, et al. Biodosimetry based on γ-H2AX quantification and cytogenetics after partial- and total-body irradiation during fractionated radiotherapy[J]. Radiat Res, 2015, 183(4): 432-446. DOI:10.1667/RR13911.1 |
| [10] |
Bensimon EJ, Bouvet S, Bettencourt C, et al. DosiKit, a new immunoassay for fast radiation biodosimetry of hair and blood samples[J]. Radiat Res, 2018, 190(5): 473-482. DOI:10.1667/RR15136.1 |
| [11] |
Redon CE, Nakamura AJ, Gouliaeva K, et al. The use of gamma-H2AX as a biodosimeter for total-body radiation exposure in non-human primates[J]. PLoS One, 2010, 5(11): e15544. DOI:10.1371/journal.pone.0015544 |
| [12] |
International Atomic Energy Agency. Cytogenetic dosimetry: application in preparedness for and response to radiation emergencies[R]. Vienna: IAEA, 2011.
|
| [13] |
Wanotayan R, Wongsanit S, Boonsirichai K, et al. Quantification of histone H2AX phosphorylation in white blood cells induced by ex vivo gamma irradiation of whole blood by both flow cytometry and foci counting as a dose estimation in rapid triage[J]. PLoS One, 2022, 17(3): e265643. DOI:10.1371/journal.pone.0265643 |
| [14] |
Lee US, Lee DH, Kim EH. Characterization of γ-H2AX foci formation under alpha particle and X-ray exposures for dose estimation[J]. Sci Rep, 2022, 12(1): 3761. DOI:10.1038/s41598-022-07653-y |
| [15] |
Natale F, Rapp A, Yu W, et al. Identification of the elementary structural units of the DNA damage response[J]. Nat Commun, 2017, 8: 15760. DOI:10.1038/ncomms15760 |
| [16] |
Takano S, Shibamoto Y, Wang Z, et al. Optimal timing of a γH2AX analysis to predict cellular lethal damage in cultured tumor cell lines after exposure to diagnostic and therapeutic radiation doses[J]. J Radiat Res, 2023, 64(2): 317-327. DOI:10.1093/jrr/rrac096 |
| [17] |
Chaurasia RK, Bhat NN, Gaur N, et al. Establishment and multiparametric-cytogenetic validation of 60Co-gamma-ray induced, phospho-gamma-H2AX calibration curve for rapid biodosimetry and triage management during radiological emergencies[J]. Mutat Res Genet Toxicol Environ Mutagen, 2021, 866: 503354. DOI:10.1016/j.mrgentox.2021.503354 |
 2024, Vol. 44
2024, Vol. 44


