2. 成都医学院第二附属医院整形外科, 成都 610051;
3. 南通市第一人民医院烧伤整形科, 南通 226001;
4. 四川大学华西基础医学与法医学学院, 成都 610041;
5. 苏州大学苏州医学院放射医学与防护学院 放射医学与辐射防护国家重点实验室, 苏州 215123
2. Department of Plastic and Burn Surgery, the Second Affiliated Hospital of Chengdu Medical College, Chengdu 610051, China;
3. Department of Burn and Plastic Surgery, Nantong First People's Hospital, Nantong 226001, China;
4. West China School of Basic Medical Sciences & Forensic Medicine, Sichuan University, Chengdu 610041, China;
5. State Key Laboratory of Radiation Medicine and Protection, School of Radiation Medicine and Protection, Suzhou Medical College of Soochow University, Suzhou 215123, China
核技术在工业、医药、科技、军事等领域的广泛应用增加了核事故及核辐射损伤的潜在风险[1-2]。特别是近年来,与铱-192源接触相关的放射性皮肤损伤事件时有发生[3]。在放射治疗领域,患者会出现放射性皮肤损伤,从轻微的红斑到严重的皮肤坏死等[4]。尽管已对放射性皮肤损伤的发病机制进行了深入研究,但其临床治疗仍面临巨大挑战,缺乏理想的治疗方案[5-6]。脂肪血管基质组分(stromal vascular fraction,SVF)是一种去除成熟脂肪细胞后剩余的各类细胞和基质成分构成的复合物,包括脂肪来源干细胞(adipose derived stem cells,ADSCs)、内皮细胞、巨噬细胞等,来源丰富,获取方式便捷,在治疗放射性皮肤损伤方面潜力巨大[7-8]。课题组前期临床试验结果证实,将SVF移植到放射性皮肤损伤部位,能显著促进伤口愈合,改善外观,减轻疼痛[8]。课题组前期成功构建了一种动物模型,用于研究SVF在急性放射性皮肤损伤微环境中的转归[9],本研究利用荧光示踪和活体成像技术,在该动物模型上对移植后的SVF进行实时动态示踪,明确其药代动力学规律,探索SVF在体内的转归、驻留及不同辐射损伤微环境下的差异,并开展临床试验,以期为确定放射性皮肤损伤的干预时机及注射频次等治疗方案提供参考。
材料与方法1. 实验动物:6~8周龄、无特定病原体(SPF)级B6/JGpt-H11em1Cin (CAG-LoxP-ZsGreen-Stop-LoxP-tdTomato)/Gpt(B6-G/R)小鼠40只,雌雄各半,购自南京集萃药康生物科技公司(合格证号:202009805,202010865);6~8周龄、SPF级C57BL/6N小鼠100只,雌雄各半,购自北京维通利华实验动物技术有限公司(合格证号:20210317Abjj0619000438,20210317Abjj0619000429),均在苏州大学实验动物中心饲养。本研究已通过成都医学院第二附属医院医学伦理委员会审核批准。
2. 主要试剂与仪器:胶原酶购自上海乔源生物制药有限公司;胶原酶A购自瑞士Roche公司;磷酸盐缓冲溶液(PBS)购自美国Hyclone公司;Hoechst染液购自上海碧云天公司。生物学X射线辐照仪(RS-2000 Pro,美国Varian公司);小动物活体成像仪(IVIS Spectrum 125964,美国PerkinElmer公司);倒置荧光显微镜(IX73,日本Olympus公司);扫描型激光共聚焦显微镜(Leica TCS SP8,德国徕卡微系统公司)。
3. SVF治疗放射性皮肤损伤的动物模型构建及研究
(1) 鼠源SVF的制备:将小鼠安乐死,无菌操作下取出双侧腹股沟区皮下脂肪。剪碎脂肪组织,加入胶原酶A溶液(1 mg/ml),置于37℃恒温摇床孵育30~45 min。将消化完全的脂肪-胶原酶混合物经40 μm细胞滤网过滤、离心(1 000 × g,10 min),弃上层油脂、脂肪细胞、酶溶液,留取管底沉淀,加入生理盐水洗涤、离心(1 000 × g,5 min)2次以去除残留的胶原酶及破碎的细胞。留取管底沉淀, 加入0.5 ml 0.9%生理盐水(4℃)重悬、稀释至细胞密度为5×106/ml,完成SVF制备。
(2) 构建SVF治疗放射性皮肤损伤的动物模型:将C57BL/6N小鼠以随机数表法分为4组,每组25只。分组如下:急性损伤组:受照后当日接受局部SVF注射;慢性损伤组:受照后14 d接受局部SVF注射;空白对照组:受照后当日接受局部等量PBS注射;阴性对照组:小鼠未进行照射,接受局部等量SVF注射。
C57BL/6N小鼠以0.5%戊巴比妥钠溶液(0.5 g/100 g)腹腔注射麻醉后俯卧位固定于操作板上,剃除背部毛发范围约2 cm × 2 cm。用厚约2 mm的铅板覆盖小鼠,铅板孔径呈正方形,约1 cm × 1 cm大小,孔内露出小鼠背部剃毛区,在小鼠皮肤上用记号笔描绘出照射野用于后续观察。使用X射线辐照仪(剂量率175 cGy/min)对急性损伤组、慢性损伤组、空白对照组小鼠进行单次照射,总剂量15 Gy。
照射后当日,将新鲜提取的SVF局部注射于急性损伤组、阴性对照组小鼠照射野皮下,200 μl/ 只;空白对照组小鼠注射等量PBS。照射后14 d,再次提取SVF,对慢性损伤组小鼠进行治疗。
(3) SVF的荧光示踪:分别于注射后3、7、14、21 d采集急性损伤组、慢性损伤组、空白对照组小鼠照射野皮肤组织标本。制备切片后在标本表面滴加Hoechst 33342(1∶1 000)染液,室温下避光孵育5 min,PBS洗涤后以抗荧光淬灭剂封片,在激光扫描共聚焦显微镜(CLSM)下进行观察并记录。
(4) SVF的体内成像:分别于注射后1、3、7、14、21 d用活体成像仪对急性损伤组、慢性损伤组、阴性对照组小鼠进行观察并记录。
4. SVF在放射性皮肤损伤患者中的临床应用:本临床研究经成都医学院第二附属医院医学伦理委员会批准。共招募了5例患者,均签订了书面知情同意书。1例患者接受放射治疗后出现胸壁慢性放射性皮肤损伤,其他4例患者因职业暴露于192Ir后出现不同部位的急性放射性皮肤损伤。5例患者中,3例患者就诊时已出现深达筋膜层和(或)肌层的溃疡创面。
(1) SVF的制备:选取患者下腹部或大腿内侧部位进行抽脂。标记切口及抽吸范围,皮下注入适量肿胀液(生理盐水+肾上腺素+利多卡因)后,抽脂管连接20 ml注射器保持负压(250~300 mmHg)或水动力吸脂仪抽吸脂肪组织。收集脂肪组织,无菌生理盐水洗涤,离心(1 000 × g,3 min) 2次。取20 ml纯化的颗粒脂肪加入600 U胶原酶溶液,37℃消化45 min。将消化完全的脂肪-胶原酶混合物经40 μm细胞滤网过滤、离心(1 000 × g,10 min),弃上层油脂、脂肪细胞、酶溶液,留取离心管管底沉淀,加入生理盐水洗涤、离心(1 000 × g,5 min)2次。加入0.5 ml、生理盐水(4℃)重悬,完成SVF制备。
(2) 应用多针深度可控式电子注射系统进行SVF移植:应用多针深度可控式电子注射系统以精准递送SVF,注射前对创面进行彻底清创,注射深度根据皮肤损伤程度及创面深度不同进行个体化设计。将0.5 ml SVF与1.5 ml透明质酸混匀后装入注射器,使用32-G、5/9针的多针类型,微针刺入皮肤后,负压装置提拉皮肤,注射到创面的真皮或皮下组织中。
(3) SVF疗效评估:使用红外热像仪检测损伤部位的皮肤温度变化。观察并记录SVF移植后局部创面的大体外观、肤色、质地、弹性及毛发生长等一般情况变化。
5. 统计学处理:使用GraphPad Prism 8.0进行分析。荧光信号强度数据经正态性检验符合正态分布,均以 x±s表示。采样双因素重复测量的方差分析比较组内、组间差异。两两比较采用Tukey法。P<0.05为差异有统计学意义。
结果1. SVF治疗放射性皮肤损伤的动物模型构建:接受SVF注射后21 d,可见急性损伤组小鼠受照区域创面均愈合良好,慢性损伤组有部分小鼠创面仍表现为边缘隆起、基底糜烂的“火山口状”溃疡。
2. SVF在小鼠皮肤组织中的荧光示踪:通过CLSM扫描各组小鼠皮肤组织切片可见,注射后第3天,急性损伤组与慢性损伤组小鼠绿色荧光标记的SVF分布于皮肤组织切片的真皮层及皮下组织中,且分布相对集中;注射后第7、14天荧光信号强度随时间分布逐渐减弱;第21天仅在急性损伤组检测到散在分布的极微弱的荧光信号。此外,虽然急性损伤组、慢性损伤组局部注射SVF的细胞数量、浓度、注射方式等相同,但两组切片中SVF在皮肤及皮下组织中分布的深度、组织层次、驻留时间均表现不同:SVF局部注射后初期主要集中分布在皮下组织内,急性损伤组在注射后第3天可见SVF向真皮层浸润的趋势,后随时间变化SVF信号减弱,第21天注射部位残留的SVF信号零星分布于真皮层中;而慢性损伤组在注射后SVF多局限于皮下组织中,无明显向真皮层浸润的改变,且随时间增加局部SVF荧光信号的减弱速度高于急性损伤组,第21天几乎无荧光信号残留(图 1)。
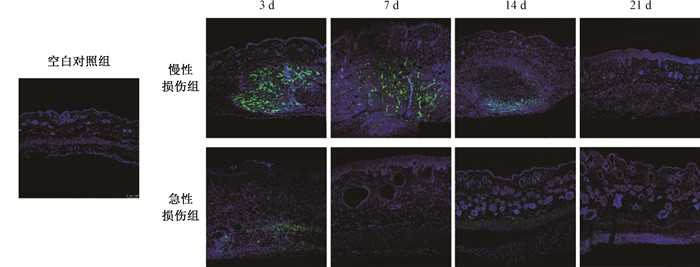
|
注:蓝色:Hoechst 33342,绿色:ZsGreen 图 1 注射脂肪血管基质组分(SVF)后不同时间两组小鼠皮肤组织切片示踪图 免疫荧光染色×10 Figure 1 Fluorescence-based tracing images of skin tissue slices from two groups of mice at different times after SVF injection Immunofluorescence staining ×10 |
3. SVF在小鼠皮肤组织中的活体成像:急性损伤组、慢性损伤组、阴性对照组在SVF注射后的第1、3、7、14、21天均可通过IVIS检测到局部组织中的SVF(图 2),组别与时间之间存在交互作用(F =6.500,P<0.001)。注射后1、3、7 d,SVF的荧光信号强度依次为阴性对照组>急性损伤组>慢性损伤组,急性损伤组与阴性对照组相比,差异无统计学意义(P>0.05),而慢性损伤组与阴性对照组相比,差异具有统计学意义(t=3.88~5.74,P<0.01)。注射后14 d,SVF的荧光信号强度依次为急性损伤组>阴性对照组>慢性损伤组,慢性损伤组与急性损伤组、阴性对照组相比,差异均具有统计学意义(t=4.12、5.59,P<0.05)。注射后21 d,各组SVF荧光信号强度极低,3组间差异均无统计学意义(P>0.05)。随后对3组荧光强度数据进行拟合分析显示,急性损伤组的拟合优度最佳(R2=0.82),其次为阴性对照组(R2=0.70),慢性损伤组最低(R2=0.61)。将SVF视作一种特殊的细胞类药物,计算其药物半衰期以进一步了解SVF在不同微环境中转归的差异,结果显示阴性对照组为6.336 d,急性损伤组为6.014 d,均明显长于慢性损伤组(2.163 d),见图 3。
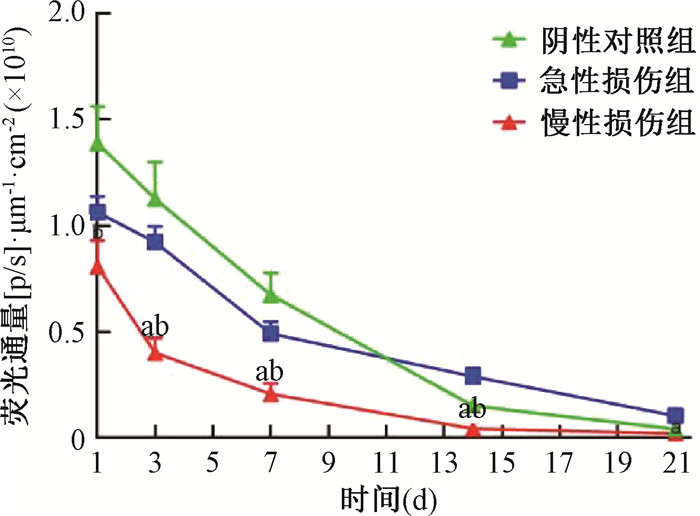
|
注:a与急性损伤组相比,t=4.73~8.38,P<0.05;b与阴性对照组相比,t=3.88~5.74,P<0.01;3组间比较,F =6.500,P<0.001 图 2 3组小鼠注射SVF后不同时间活体成像荧光信号强度分析 Figure 2 Fluorescence intensity of in vivo imaging for three groups of mice at different times after SVF injection |
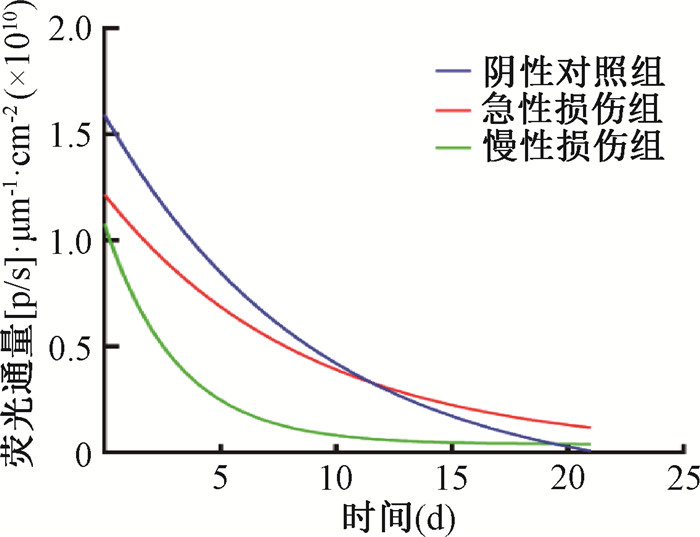
|
图 3 IVIS荧光强度模型拟合曲线 Figure 3 Fitting curves of IVIS fluorescence intensity model |
4. SVF在放射性皮肤损伤患者中的临床应用:如表 1所示,共5位受试者参与了SVF移植治疗放射性皮肤损伤的临床试验。双手均严重损伤的病例较为罕见,因此将第2位受试者作为典型病例介绍。该患者为青年男性,于2019年8月在作业途中接触铱-192放射源,活度为2.183×1012 Bq。9月出现双手红肿、水疱形成、疼痛、麻木伴关节活动受限。查体:双手拇指有直径约3 cm大小水疱,周围组织红肿,伴少量渗液,双手食指直径约5 cm大小水疱,右手拇指及食指肿胀较左侧明显,疼痛数字评分法(numerical rating scale,NRS)评分2分,右手中指及无名指轻度肿胀,余指及手掌见红斑、脱皮、色素沉着。入院诊断:双侧手指皮肤Ⅲ度放射性皮肤损伤。
|
|
表 1 临床试验共招募5例患者进行SVF移植治疗 Table 1 Five patients recruited for SVF transplantation therapy in a clinical trial |
该患者体型偏瘦,无法从皮下脂肪组织中获取足量的SVF,患者本人要求优先保障右手功能,经沟通后制定如下个体化治疗方案:双手手指均行切开减压、清创+VSD负压吸引,同时抽取双侧大腿脂肪制备SVF,右手创面清创后即刻进行局部SVF移植。术后对比双手创面愈合情况发现,右手创面愈合速度明显优于左手。红外测温结果显示术前温度最高点位于双手拇指食指创面,与皮肤水疱形成伴组织重度水肿相关;术后1个月右手创面已愈合,左手创面形成局部溃疡、炎症浸润,故红外测温结果显示温度最高点位于左手拇指创面。经综合治疗后患者体重稳定增加,双侧大腿可抽取脂肪量满足制备足量SVF,于第1次手术1个月后再次手术,对左手创面进行局部清创+皮片移植,同时对双手创面进行SVF移植。
该患者双手Ⅲ度放射性皮肤损伤创面以拇指及食指为主,右手创面较左侧创面肿胀更为明显。治疗分为两阶段,第1次手术对双手创面进行清创,右手创面行SVF移植;第2次手术对双手创面再次清创+SVF移植,左手创面行皮片移植。患者入院治疗3个月后,右手创面已完全愈合,除创面存在色素脱失异常外,无瘢痕增生、挛缩,无运动及感觉异常,指甲生长正常;左手拇指及食指指腹残留散在溃疡创面,伴肢端麻木,指甲增厚变形,无运动障碍,愈合创面同样存在创面色素脱失异常;红外测温结果显示温度最高点位于右手,左手温度较右手低,提示右手创面组织修复后血供优于左手创面。后期随访结果显示,患者创面愈合后未再次出现皮肤损伤,无疼痛不适,双手功能基本恢复,右手愈合后外观更佳。
讨论在辐射损伤后,皮肤立即出现组织损伤反应,炎症细胞在受损区域积聚,伴有功能性干细胞减少,内皮细胞损伤,炎症反应以及皮肤细胞坏死[10]。根据美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)标准,急性放射性皮肤损伤可分为5个等级[11]。在本研究中,参与临床试验的5位患者的损伤等级均在2级以上,这些患者在接受SVF移植治疗后,其创面愈合速度明显增快,外观恢复大幅改善,远期并发症风险降低,总体疗效令人满意。在此次临床试验研究中,出于对受试者的安全、健康和权益的最大保护,没有采用动物实验的标准进行严格的分组对照研究。在典型病例分析中,第2位受试者因自身脂肪量不足,无法获取足量SVF。根据患者的治疗意愿,一期手术对左手创面采用传统清创治疗,右手创面在传统治疗基础上应用了SVF移植的新手段。术后1个月显示左手创面组织再生反应差,表皮爬行不良,需移植皮片,而右手创面明显缩小,表皮爬行良好,有自愈倾向。上述的一期手术的临床观察结果显示,SVF移植有明确的促进创面修复作用,为二期的手术方案改进打下了基础。二期手术对左手创面采用传统皮片移植修复+ SVF移植,右手创面二次移植SVF。综上,在治疗过程中的不同时间点观察双手的愈合情况,自身对照结果显示,SVF移植能够促进创面修复,且移植越早越有利于创面愈合,治疗效果与治疗频次呈正相关。
SVF是多种细胞群的混合物,可分泌多种细胞因子,促进细胞增殖、血管生成,在放射性皮肤损伤的救治中疗效显著[12-13]。传统免疫荧光染料易淬灭、假阳性结果多,无法对SVF进行长期标记与精确示踪。因此,迫切需要一种安全、稳定、高效、特异的标记方法及合适的动物模型,研究SVF在体内的转归、作用机制以进一步指导临床应用。本研究构建了SVF治疗放射性皮肤损伤的小鼠模型,利用荧光示踪和活体成像技术实时动态监测SVF体内移植。选取B6-G/R小鼠作为工具鼠,皮肤、脂肪等组织器官中高表达的报告基因ZsGreen在子代中亦持续、稳定表达[14]。动物实验结果显示,SVF移植早期集中分布在注射部位皮下组织中且荧光信号极强,随时间变化逐渐减弱;在急性放射性皮肤损伤与正常组织微环境中具有大致相同的时空变化趋势,SVF信号衰减至50%为注射后1周,而慢性放射性皮肤损伤微环境中为注射后第3天。第14天局部注射部位仍可见SVF荧光信号,提示根据创面情况至少每两周注射一次SVF直至创面愈合,对放射性皮肤损伤的修复可能更为有利。第21天SVF荧光信号几乎消失,说明大部分SVF细胞群已被吞噬或死亡,并未进一步分化为成熟的局部组织细胞,提示SVF主要通过自分泌或旁分泌的各种调控因子改善局部微环境,以促进伤口愈合。慢性损伤组中SVF信号衰减明显先于急性损伤组,进一步提示当急性放射性皮肤损伤病程进展迁延为慢性时,组织灌注和氧供不足等造成局部微环境的紊乱,不但干扰自体修复进程,也不利于SVF移植存活,故应尽早进行干预,损伤早期进行SVF移植的治疗效果优于后期。通过对动物实验及前临床试验结果进行总结,在后期临床试验中优化了SVF治疗方案,以传统手术治疗手段为基础,在患者自身条件允许的情况下,对于急性放射性损伤的创面,进行每2周一次的SVF注射,对于慢性放射性损伤的创面,则增加注射频次,进行每周一次的注射,直至创面愈合。
综上,SVF作为一种细胞药物在放射性皮肤损伤的救治中具有十分广阔的发展前景,在临床应用中须注意如下几点:辐射损伤在受照后即刻发生,SVF移植应尽早实施,越早干预,效果越好。在辐射损伤后早期皮肤尚无变化时进行SVF移植,注射频次为每两周至少注射1次。在辐射损伤后晚期皮肤出现溃疡时进行SVF移植,注射频次为每两周至少注射1~2次为宜。同时,虽然SVF安全、量大、易获取,无需体外培养,临床推广应用简便易行,有临床推广应用的潜力,但反复多次进行吸脂术可能会增加医源性创伤及感染的概率,若将一次抽脂获取的脂肪组织或提取的SVF妥善保存以构建自体SVF细胞库,可大大减少患者的痛苦,减低多次手术带来的风险与费用等问题,有待进一步研究。
利益冲突 无
志谢 本研究得到了苏州大学放射医学与辐射防护国家重点实验室的协助
作者贡献声明 安璐负责实验操作、数据整理、论文书写;陈晓明、李灿负责临床数据收集及处理;姚建、张舒羽指导论文修改;曹建平、龚振华、余道江负责课题设计,指导论文撰写
临床试验注册:中国临床试验注册中心,ChiCTR NCT03557983
Clinical trial registration: Chinese Clinical Trial Registry, ChiCTR NCT03557983
| [1] |
Tsushima I. Behavior of radioactive materials and safety stock of contaminated sludge[J]. J Environ Sci Health A Tox Hazard Subst Environ Eng, 2017, 52(2): 158-165. DOI:10.1080/10934529.2016.1240486 |
| [2] |
Bernard D, Desruet MD, Wolf M, et al. Radioiodine therapy in benign thyroid disorders. Evaluation of French nuclear medicine practices[J]. Ann Endocrinol (Paris), 2014, 75(4): 241-246. DOI:10.1016/j.ando.2014.07.863 |
| [3] |
Wang YY, Yu DJ, Zhao TL, et al. Successful rescue of the victim exposed to a super high dose of iridium-192 during the Nanjing radiological accident in 2014[J]. Radiat Res, 2019, 191(6): 527-531. DOI:10.1667/RR15274.1 |
| [4] |
Hegedus F, Mathew LM, Schwartz RA. Radiation dermatitis: an overview[J]. Int J Dermatol, 2017, 56(9): 909-914. DOI:10.1111/ijd.13371 |
| [5] |
Yang X, Ren H, Guo X, et al. Radiation-induced skin injury: pathogenesis, treatment, and management[J]. Aging (Albany NY), 2020, 12(22): 23379-23393. DOI:10.18632/aging.103932 |
| [6] |
Trottier V, Marceau-Fortier G, Germain L, et al. IFATS collection: using human adipose-derived stem/stromal cells for the production of new skin substitutes[J]. Stem Cells, 2008, 26(10): 2713-2723. DOI:10.1634/stemcells.2008-0031 |
| [7] |
Bora P, Majumdar AS. Adipose tissue-derived stromal vascular fraction in regenerative medicine: a brief review on biology and translation[J]. Stem Cell Res Ther, 2017, 8(1): 145. DOI:10.1186/s13287-017-0598-y |
| [8] |
Yu D, Zhang S, Mo W, et al. Transplantation of the stromal vascular fraction (SVF) mitigates severe radiation-induced skin injury[J]. Radiat Res, 2021, 196(3): 250-260. DOI:10.1667/RADE-20-00156.1 |
| [9] |
安璐, 张舒羽, 曹建平, 等. 脂肪血管基质组分在急性放射性皮肤损伤微环境中转归的动物模型构建[J]. 中华实验外科杂志, 2022, 39(12): 2480-2484. An L, Zhang SY, Cao JP, et al. Development of an animal model for studying the conversion of stromal vascular fraction in the microenvironment of acute cutaneous radiation injury[J]. Chin J of Exp Surg, 2022, 39(12): 2480-2484. DOI:10.3760/cma.j.cn421213-20211223-01001 |
| [10] |
Hymes SR, Strom EA, Fife C. Radiation dermatitis: clinical presentation, pathophysiology, and treatment 2006[J]. J Am Acad Dermatol, 2006, 54(1): 28-46. DOI:10.1016/j.jaad.2005.08.054 |
| [11] |
Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. DOI:10.1016/0360-3016(95)00060-C |
| [12] |
陆蒋惠文, 张舒羽, 张杰, 等. 放射性皮肤损伤的治疗进展[J]. 国际放射医学核医学杂志, 2021, 45(7): 461-469. Lu JHW, Zhang SY, Zhang J, et al. A review of the literature on the treatment of radiation-induced skin injury[J]. Int J Radiat Med Nucl Med, 2021, 45(7): 461-469. DOI:10.3760/cma.j.cn121381-202005043-00030 |
| [13] |
Teng M, Huang Y, Zhang H. Application of stems cells in wound healing——an update[J]. Wound Repair Regen, 2014, 22(2): 151-160. DOI:10.1111/wrr.12152 |
| [14] |
Muzumdar MD, Tasic B, Miyamichi K, et al. A global double-fluorescent Cre reporter mouse[J]. Genesis, 2007, 45(9): 593-605. DOI:10.1002/dvg.20335 |
 2024, Vol. 44
2024, Vol. 44


