2. 山东第一医科大学 山东省医学科学院放射学院, 泰安 271021;
3. 郑州大学附属儿童医院, 郑州 450018
2. School of Radiology, Shandong First Medical University and Shandong Academy of Medical Sciences, Tai'an 271021, China;
3. Children's Hospital Affiliated of Zhengzhou University, Zhengzhou 450018, China
放射治疗是杀伤肿瘤的重要手段之一。常规剂量率放射治疗(简称“常规放疗”)在杀灭肿瘤组织的同时,不可避免地会造成正常组织损伤。严重的正常组织放射损伤会影响肿瘤的治愈率,并降低患者的生存质量[1]。为了减轻正常组织损伤,有学者提出了超高剂量率(FLASH)放疗[2]。多种动物模型表明,FLASH放疗在维持相同肿瘤杀伤效果的前提下,正常组织的放射损伤较常规放疗显著减轻。该现象又称为FLASH效应[3]。迄今为止,FLASH效应已经在电子束中得到了验证,在光子及质子束中也有了初步的研究[4-6]。瑞士洛桑大学附属医院和美国辛辛那提儿童医院质子中心陆续开展了FLASH放疗相关的临床试验,初步结果令人满意[7-8]。然而,FLASH效应的生物学机制尚不十分明确。
建立有效的正常组织放射损伤模型是阐明FLASH效应生物学机制的前提。斑马鱼是毒理学检测最常用的动物模型,其基因组与人类基因组具有较高的同源性[9]。作为第三大模式动物,斑马鱼体型小、胚胎透明、传代周期短、易饲养、繁殖率高,兼具动物和体外细胞实验的优点。世界范围内,斑马鱼胚胎、幼鱼及成年鱼被广泛用于放射损伤领域的研究,并展现出了独特的优势[10]。本研究基于斑马鱼胚胎模型,观察FLASH照射的正常组织保护效应,尝试揭示FLASH效应的生物学机制。
材料与方法1. 主要试剂:海盐购自德国Merck医药化工有限公司。DCFH-DA活性氧(ROS)荧光探针、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性检测试剂盒购自北京索莱宝生物科技有限公司。丙二醛(MDA)检测试剂盒购自英国Abcam公司。Amplex Red过氧化氢(H2O2)检测试剂盒购自美国赛默飞世尔科技有限公司。
2. 斑马鱼胚胎培养条件:AB野生型斑马鱼胚胎购自国家斑马鱼资源中心,采用自动光控曝气循环水系统[水温:(28±1)℃;光照周期:14 h/10 h(昼/夜)],予丰年虫饲养(2次/d)。体式显微镜下收集受精后4 h的健康胚胎,加入少量孵育液(纯水+ 60 mg/L海盐)清洗,移至6 cm培养皿,放置于生化培养箱。
3. 分组与照射条件:照射前,将斑马鱼胚胎转移到含有孵育液的2 ml的Eppendorf管中。随机分为3组:健康对照组(n=39)、常规照射组(n=39)和FLASH照射组(n=39)。常规照射组(剂量率0.01 Gy/s)采用美国Varian 23CX加速器,FLASH照射组(剂量率120 Gy/s)采用改造后的Varian 23CX加速器[11]。电子线均为9 MeV,剂量0~50 Gy,每个剂量点间隔2 Gy,具体照射参数见表 1。照射结束,将斑马鱼胚胎转移至6 cm培养皿中。在28℃下孵育至受精后120 h。
|
|
表 1 FLASH照射和常规照射参数 Table 1 Parameters for FLASH and conventional irradiation modes |
4. 斑马鱼胚胎的存活率、孵化率和形态学评估:受精后72 h,观察并统计斑马鱼胚胎的存活率(存活率=存活数/总胚胎数× 100%)及孵化率(孵化率=孵化数/总存活胚胎数× 100%),死亡以显微镜下斑马鱼心跳停止为准。受精后120 h,处死斑马鱼并固定在4%多聚甲醛溶液中。通过体式显微镜测量斑马鱼的体长来研究辐射诱导的斑马鱼形态变化。以Image J软件测量鱼体长度。
5. 孵育液ROS含量检测:收集照射后的孵育液样品,采用Amplex Red检测试剂盒按照说明书处理样品。首先,梯度制备H2O2溶液,用于建立标准曲线并推算函数方程(y=-0.355+0.143 4x, r2=0.993)。配置终浓度为50 μmol/L的Amplex Red,加入样品,用荧光分析仪(美国Bio-Rad公司)测量荧光强度(激发波长520 nm,发射波长580~640 nm)。根据所得到的函数方程计算孵育液样品中H2O2的浓度。
6. 斑马鱼体内ROS含量检测:采用DCFH-DA活性氧荧光探针检测斑马鱼体内ROS含量。具体步骤为:依据说明书配置25 μmol/L的探针溶液,将照射后的样本常温下避光染色40 min。以孵育液清洗3次。体式显微镜下拍照,Image J软件分析。
7. 氧化应激水平测定:收集常规照射和FLASH照射后96 h的幼鱼,置于1.5 ml的EP管中。加入适量生理盐水,匀浆10 min,离心(15 000 × g,4℃,20 min)后吸取上清液,制备样品。依据样品说明书,首先检测组织匀浆液蛋白浓度,然后,酶标仪分别检测SOD、CAT活性及MDA含量。
8. 统计学处理:所有实验均重复3次,采用GraphPad Prism 8.0软件进行分析。计量资料符合正态分布,以x±s表示,两组间比较采用独立样本t检验。P<0.05为差异具有统计学意义。
结果1. 照射对斑马鱼胚胎致死率、孵化率的影响:根据经济合作发展组织(OECD)制定的斑马鱼实验指导手册,斑马鱼胚胎培养环境,如温度、pH值等,以及自身因素导致其在生长发育时存在一定的死亡率,死亡率低于10%的斑马鱼是健康的[12]。将斑马鱼暴露于电离辐射后,观察到胚胎死亡的发生,且胚胎死亡率呈现出剂量依赖性(t=0.73~8.61,P > 0.05,图 1A)。进一步拟合胚胎致死率曲线,分析显示,常规照射组半数致死剂量为34.5 Gy,FLASH照射组半数致死剂量为41.6 Gy(图 1B)。
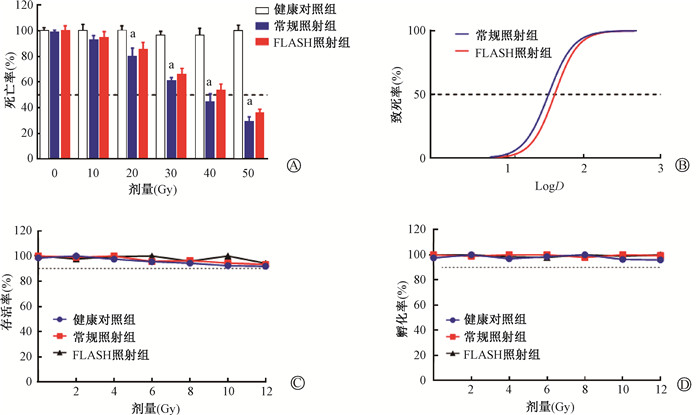
|
注:D.吸收剂量;a与健康对照组相比,t=0.73~8.61,P<0.05 图 1 不同剂量和剂量率对电子线照射后斑马鱼胚胎死亡率及孵化率的影响 A. 常规照射和FLASH照射后死亡率分析;B. 常规照射和FLASH照射后致死率效应曲线;C. 2~12 Gy常规照射和FLASH照射后存活率分析;D. 2~12 Gy常规照射和FLASH照射后孵化率分析 Figure 1 Effects of different doses and dose rates on the mortality and hatchability of zebrafish embryos exposed to electron beam irradiation A. Analysis of mortality after conventional and FLASH irradiation; B. Dose-response curves for mortality after conventional and FLASH irradiation; C. Analysis of survival rates after conventional and FLASH irradiation at doses of 2-12 Gy; D. Analysis of hatchability after conventional and FLASH irradiation at doses of 2-12 Gy |
FLASH照射的正常组织保护效应存在最佳剂量区间,否则不易区分FLASH照射与常规照射后的正常组织损伤程度[3]。因此,尝试选择合适的照射剂量范围以便于后续研究。如图 1C所示,2~12 Gy照射对斑马鱼胚胎存活率无显著影响(P>0.05),且FLASH照射组与常规照射组之间差异无统计学意义(P>0.05)。即在生命的早期阶段,2~12 Gy照射对斑马鱼胚胎不具有致死效应。
斑马鱼胚胎的孵化率是评价斑马鱼发育情况的重要指标之一。如图 1D所示,受精后72 h,斑马鱼的孵化率无明显变化(P>0.05)。因此,在孵化率方面2~12 Gy照射对斑马鱼胚胎的毒性不显著。
2. 照射对斑马鱼形态的影响:进一步分析不同照射对斑马鱼仔致畸性及体长的影响。如图 2A~C所示,≥6 Gy照射后,斑马鱼表现为卵黄囊延伸部异常、脊柱弯曲及尾部畸形(蜷缩)。这表明尾部是斑马鱼照射后放射损伤的主要部位。在受精后72 h,2~4 Gy照射对斑马鱼胚胎的体长无明显影响(P>0.05)。6~12 Gy照射后,斑马鱼体长发生显著改变,表现为尾部异常,且常规照射组尾部畸形较FLASH照射组更为显著(t=0.87~ 9.75,P<0.05,图 2D)。

|
注:a与同一剂量常规照射相比较,t=0.87~9.75,P<0.05 图 2 常规照射和FLASH照射后斑马鱼体长分析 A. 健康对照组;B. 8 Gy FLASH照射组;C. 8 Gy常规照射组;D.不同剂量常规照射和FLASH照射对斑马鱼体长的影响 Figure 2 Analysis of zebrafish lengths after conventional and FLASH irradiation A. Healthy control group; B. 8 Gy FLASH irradiation group; C. 8 Gy conventional irradiation group; D. Effects of conventional and FLASH irradiation at different doses on zebrafish lengths |
3. 照射对孵育液的电离化学效应:0~50 Gy,FLASH照射和常规照射后的自由基产量均随照射剂量的增加而线性增加;相同剂量的单次照射后,两组间自由基产量差异无统计学意义(P>0.05)。因此,FLASH照射和常规照射后孵育液自由基的生成量相似,孵育液水分子电离化学效应对斑马鱼形态无显著影响。
4. 斑马鱼体内ROS含量测定:本研究采用DCFH-DA活性氧荧光探针检测ROS含量,高亮绿色斑点即为ROS浓聚区。如图 3A~C所示,与健康对照组相比,照射组斑马鱼的ROS含量明显增加,主要集中在脊柱部分。受精后72 h,FLASH照射组的ROS含量低于常规照射组(t=0.76~15.19,P<0.05,图 3D)。
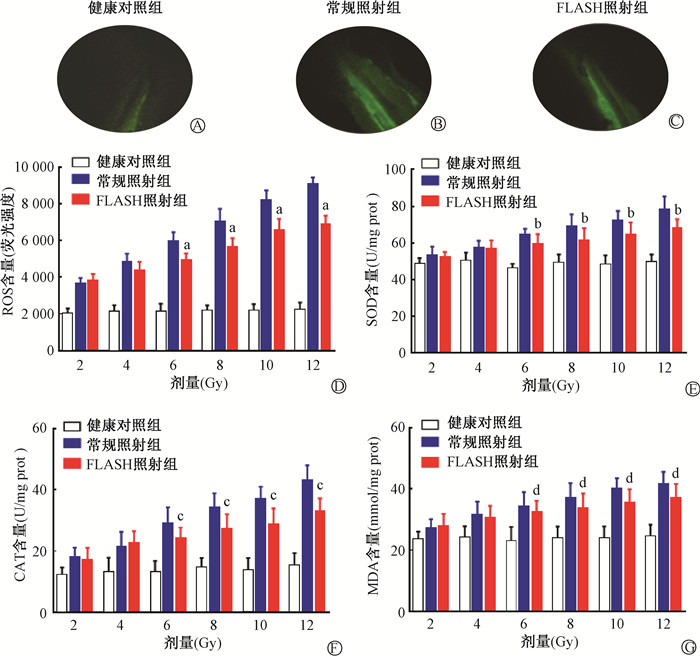
|
注:与同一剂量常规照射比较,at=0.76~15.19,P<0.05;bt=1.07~8.75,P<0.05;ct=0.42~12.53,P<0.05;dt=1.23~9.31,P<0.05 图 3 不同剂量常规照射和FLASH照射后斑马鱼体内氧化应激指标分析 A~C.ROS浓聚区;D.ROS含量;E.SOD含量;F.CAT含量;G.MDA含量 Figure 3 Analysis of oxidative stress indicators in zebrafish at different6 doses with conventional and FLASH irradiation A-C.ROS accumulation zone; D. ROS levels; E. SOD levels; F. CAT levels; G. MDA levels |
5. 照射对斑马鱼氧化应激水平的影响:如图 3E~F所示,SOD及CAT活性随着照射剂量的增加而增加,呈现出浓度-剂量效应,表明照射可诱导氧化应激的产生,并且在6~12 Gy常规照射后,SOD及CAT的活性均较FLASH照射显著增加(t=0.42~12.53,P<0.05)。
如图 3G所示,常规照射后斑马鱼体内MDA含量明显升高,且随着照射剂量的增加呈线性增加;FLASH照射后MDA水平较健康对照组亦显著增加。当照射剂量≥6 Gy,常规照射后的MDA生成量显著高于FLASH照射(t=1.23~9.31,P<0.05)。这表明常规照射可诱导脂质氧化应激,导致脂膜氧化损伤。
讨论本研究通过斑马鱼模型系统地比较了常规照射和FLASH照射后正常组织的放射损伤效应。尽管2~12 Gy常规照射和FLASH照射后斑马鱼的存活率、孵化率无显著差异,但常规照射后斑马鱼体长较FLASH照射显著缩短,伴随尾部蜷缩等。进一步研究表明,常规照射诱导SOD活性随着照射剂量的增加而显著增加,大剂量的常规照射可诱导过量的ROS蓄积于体内,导致脂质膜氧化损伤,MDA水平升高。而FLASH照射后,活性氧自由基的产量明显低于常规照射。因此,FLASH效应可能与射线的间接作用有关,即照射后生物体内水分子电离激发,诱导氧化应激,脂质过氧化,破坏膜的结构,进而引发DNA断裂、酶蛋白失活,导致生物大分子损伤,甚至死亡。
斑马鱼胚胎是放射生物学领域中相对较新的模型,其发育迅速,对环境变化十分敏感。因此,可作为一个短期模型用于电离辐射的生物学效应研究[10]。在胚胎及幼鱼阶段,斑马鱼细胞分裂迅速,容易受到射线的影响,可用于模拟急性放射损伤[13-14]。常规γ射线照射后,斑马鱼胚胎表现为脊柱弯曲、卵黄囊肿胀及心包水肿等;脑组织HE染色可见神经细胞排列紊乱,间隙增大,细胞内部伴有空泡,细胞质浓缩,细胞器形态异常[15]。在斑马鱼早期生命阶段,常规照射后3 d幼鱼肝脏细胞的线粒体受损、粗面内质网排列紊乱,核膜间隙增大;照后5 d幼鱼肝脏体积缩小,细胞内含空泡,细胞核变形[16]。进一步研究发现,照射后幼鱼新陈代谢增加,基础ROS含量增加,细胞色素p450和髓质过氧化物酶基因表达量增加,发生细胞凋亡[17]。袁梦珍[18]构建了胚胎斑马鱼U87-MG脑胶质瘤模型,给予常规X射线照射后观察到放射性血管损伤,表现为局部水肿、尾静脉增粗,幼鱼肌肉纤维损伤导致尾部蜷曲。本研究中,电子束照射后,斑马鱼出现卵黄囊延伸部异常、脊柱弯曲、尾部畸形等放射性损伤。因此,斑马鱼的发育过程中出现的放射性损伤与射线产生的生物效应有关,受到照射剂量、时间、剂量率等的影响。
暴露于射线下的生物体可通过电离辐射的直接作用诱发DNA的损伤;此外,低传能线密度的电离辐射主要通过间接作用诱导生物体内产生大量的活性氧自由基,如H2O2,进而作用于生物大分子,导致细胞损伤甚至死亡[19]。pBR322质粒模型研究表明,FLASH效应与电离辐射的间接作用密切相关[20]。Wardman[21]尝试通过建立化学反应模型阐述水分子电离在FLASH效应中的重要地位。Kacem等[22]通过斑马鱼模型等证实了质子束和电子束FLASH均可产生正常组织保护效应,斑马鱼放射损伤的减轻与幼鱼体内凋亡信号通路激活不足有关。本研究中,常规电子束照射及FLASH电子束照射后斑马鱼体内ROS产量明显高于健康对照组,这是造成斑马鱼胚胎放射损伤的重要原因。照射后孵育液中的水分子可电离激发,产生辐射化学效应,极短时间产生活性氧自由基,然后在扩散期生成化学性质稳定的H2O2并进一步诱发生物学效应[23]。这些活性氧自由基可能对斑马鱼的形态有影响,因此,检测了孵育液照射后水分子辐射分解产生的活性氧水平,排除了照射后生物体外水分子的电离分解对斑马鱼胚胎放射损伤的影响。
电离辐射后的斑马鱼在新陈代谢过程中产生大量活性氧自由基等,生物体抗氧化与氧化作用稳态失衡;氧化应激系统启动,通过SOD、CAT等酶类物质和GSH等非酶类物质清除ROS,阻止进一步的氧化损伤,从而降低自由基对机体的损害作用[24]。斑马鱼体内SOD是一类金属酶,含Cu、Zn原子,Mn-SOD和Cu/Zn-SOD是编码SOD的基因,CAT为编码H2O2的基因[25]。其中,SOD负责将ROS转化为H2O2,CAT则负责将H2O2转化为水和氧;SOD、CAT主要负责清除氧化自由基,可用于评估体内氧化应激水平;因此,SOD和CAT的活性也可以用来评价电离辐射对生物体的影响[14]。ROS可诱发脂质过氧化并破环细胞膜磷脂双分子层结构,这会阻止膜结合受体和酶的活动,增加组织的渗透性;脂质过氧化物最终分解产物中有MDA,且MDA可以作为机体内脂质过氧化的标志性代谢产物,可反映细胞氧化损伤情况[26]。因此,氧化应激可由SOD、CAT、MDA等指标来衡量。本研究中,常规电子束照射后,SOD和CAT水平表达增加,这表明照射能诱导斑马鱼产生大量的ROS,体内的抗氧化系统不能及时清理,ROS的蓄积诱导氧化应激,造成生物大分子损伤。而FLASH照射后通过物理化学反应产生的活性氧自由基显著少于常规照射,脂质过氧化水平较低,故斑马鱼辐射损伤较常规照射减轻。
值得注意的是,本研究仅集中于电离辐射对胚胎-幼鱼生长发育影响的个体生物学效应,关于辐射对斑马鱼种群生物学效应的影响有待探索。而且,其他重要的物理学参数,如瞬时剂量率、频率和射线类型很可能在介导FLASH效应方面发挥一定的作用,这些需要进一步的实验验证。
总之,本实验对斑马鱼照射后的放射损伤及其生物学机制进行了初步研究。结果表明,电子束FLASH照射较常规照射对斑马鱼胚胎损伤更小,这与较低的氧化应激水平相关。本研究为FLASH效应的分子机制探索提供参考。
利益冲突 全体作者没有任何利益冲突,未接受任何不当的职务或财务利益
志谢 感谢瑞士洛桑大学附属医院放疗科全体成员对本文的指导与帮助,以及瑞士洛桑大学生物医学系的支持与建议
作者贡献声明 罗辉、马蕾杰、王雪楠、李娜、薛福敏、毛荣虎负责实验操作、数据整理分析、论文撰写;雷宏昌、宋帅负责部分数据及文献整理,协助论文撰写;葛红、杨成梁指导论文修改
| [1] |
McBride WH, Schaue D. Radiation-induced tissue damage and response[J]. J Pathol, 2020, 250(5): 647-655. DOI:10.1002/path.5389 |
| [2] |
Favaudon V, Caplier L, Monceau V, et al. Ultrahigh dose-rate FLASH irradiation increases the differential response between normal and tumor tissue in mice[J]. Sci Transl Med, 2014, 6(245): 245ra93. DOI:10.1126/scitranslmed.3008973 |
| [3] |
Vozenin MC, Bourhis J, Durante M. Towards clinical translation of FLASH radiotherapy[J]. Nat Rev Clin Oncol, 2022, 19(12): 791-803. DOI:10.1038/s41571-022-00697-z |
| [4] |
Rahman M, Trigilio A, Franciosini G, et al. FLASH radiotherapy treatment planning and models for electron beams[J]. Radiother Oncol, 2022, 175: 210-221. DOI:10.1016/j.radonc.2022.08.009 |
| [5] |
Montay-Gruel P, Corde S, Laissue JA, et al. FLASH radiotherapy with photon beams[J]. Med Phys, 2022, 49(3): 2055-2067. DOI:10.1002/mp.15222 |
| [6] |
Diffenderfer ES, Sørensen BS, Mazal A, et al. The current status of preclinical proton FLASH radiation and future directions[J]. Med Phys, 2022, 49(3): 2039-2054. DOI:10.1002/mp.15276 |
| [7] |
Mascia AE, Daugherty EC, Zhang Y, et al. Proton FLASH radiotherapy for the treatment of symptomatic bone metastases: the FAST-01 nonrandomized trial[J]. JAMA Oncol, 2023, 9(1): 62-69. DOI:10.1001/jamaoncol.2022.5843 |
| [8] |
Gaide O, Herrera F, Jeanneret Sozzi W, et al. Comparison of ultra-high versus conventional dose rate radiotherapy in a patient with cutaneous lymphoma[J]. Radiother Oncol, 2022, 174: 87-91. DOI:10.1016/j.radonc.2021.12.045 |
| [9] |
Huang W, Wu T, Wu K. Zebrafish (Danio rerio): a potential model to assess developmental toxicity of ketamine[J]. Chemosphere, 2022, 291(Pt 3): 133033. DOI:10.1016/j.chemosphere.2021.133033 |
| [10] |
Gagnaire B, Arcanjo C, Cavalié I, et al. Effects of gamma ionizing radiation exposure on Danio rerio embryo-larval stages-comparison with tritium exposure[J]. J Hazard Mater, 2021, 408: 124866. DOI:10.1016/j.jhazmat.2020.124866 |
| [11] |
马蕾杰, 毛荣虎, 雷宏昌, 等. 改造常规医用加速器实现FLASH-RT及物理性能测量[J]. 中华放射肿瘤学杂志, 2022, 31(11): 1022-1027. Ma LJ, Mao RH, Lei HC, et al. Transform routine medical accelerators to achieve FLASH-RT and physical performance measurements[J]. Chin J Radiat Oncol, 2022, 31(11): 1022-1027. DOI:10.3760/cma.j.cn113030-20210830-00325 |
| [12] |
Busquet F, Strecker R, Rawlings JM, et al. OECD validation study to assess intra- and inter-laboratory reproducibility of the zebrafish embryo toxicity test for acute aquatic toxicity testing[J]. Regul Toxicol Pharmacol, 2014, 69(3): 496-511. DOI:10.1016/j.yrtph.2014.05.018 |
| [13] |
Cahill T, da Silveira WA, Renaud L, et al. Investigating the effects of chronic low-dose radiation exposure in the liver of a hypothermic zebrafish model[J]. Sci Rep, 2023, 13(1): 918. DOI:10.1038/s41598-022-26976-4 |
| [14] |
Lemos J, Neuparth T, Trigo M, et al. Single low-dose ionizing radiation induces genotoxicity in adult zebrafish and its non-irradiated progeny[J]. Bull Environ Contam Toxicol, 2017, 98(2): 190-195. DOI:10.1007/s00128-016-2006-1 |
| [15] |
刘美娟, 龙鼎新. Hedgehog信号通路在胚胎发育过程中的调控作用[J]. 生命的化学, 2017, 37(2): 142-146. Liu MJ, Long DX. The regulation of Hedgehog signaling pathway in the embryonic development process[J]. Chem Life, 2017, 37(2): 142-146. DOI:10.13488/j.smhx.20170202 |
| [16] |
冯永富, 胡南, 丁德馨, 等. γ电离辐射对斑马鱼胚胎肝、脾和肾发育形态学的影响[J]. 原子能科学技术, 2017, 51(10): 1886-1892. Feng YF, Hu N, Ding DX, et al. Effect of γ-ray irradiation on developmental morphology of liver, spleen and pronephros in zebrafish embryo[J]. Atom Energy Sci Technol, 2017, 51(10): 1886-1892. DOI:10.7538/yzk.2017.youxian.0014 |
| [17] |
Hurem S, Martín LM, Brede DA, et al. Dose-dependent effects of gamma radiation on the early zebrafish development and gene expression[J]. PLoS One, 2017, 12(6): e0179259. DOI:10.1371/journal.pone.0179259 |
| [18] |
袁梦珍. 脉冲低剂量率放射治疗对斑马鱼原位脑胶质瘤模型治疗效果和放疗损伤的实验研究[D]. 南宁: 广西医科大学, 2016. Yuan MZ. Experimental study on the therapeutic effect and radiation injury of pulsed low dose rate radiotherapy on zebrafish orthotopic glioma model[D]. Nanning: Guangxi Medical University, 2016. |
| [19] |
Kong EY, Yeung WK, Chan TK, et al. Exogenous nitric oxide suppresses in vivo X-ray-induced targeted and non-targeted effects in zebrafish embryos[J]. Int J Mol Sci, 2016, 17(8): 1321. DOI:10.3390/ijms17081321 |
| [20] |
罗辉, 袁期刚, ZhangP, 等. 超高剂量率照射诱导质粒DNA链断裂损伤的研究[J]. 中华放射医学与防护杂志, 2023, 43(3): 161-167. Luo H, Yuan QG, Zhang P, et al. Ultra-high dose rate irradiation induced DNA strand break in plasmid DNA[J]. Chin J Radiat Med Prot, 2023, 43(3): 161-167. DOI:10.3760/cma.j.cn112271-20221122-00453 |
| [21] |
Wardman P. Approaches to modeling chemical reaction pathways in radiobiology[J]. Int J Radiat Biol, 2022, 98(9): 1399-1413. DOI:10.1080/09553002.2022.2033342 |
| [22] |
Kacem H, Psoroulas S, Boivin G, et al. Comparing radiolytic production of H2O2 and development of zebrafish embryos after ultra high dose rate exposure with electron and transmission proton beams[J]. Radiother Oncol, 2022, 175: 197-202. DOI:10.1016/j.radonc.2022.07.011 |
| [23] |
Kacem H, Almeida A, Cherbuin N, et al. Understanding the FLASH effect to unravel the potential of ultra-high dose rate irradiation[J]. Int J Radiat Biol, 2022, 98(3): 506-516. DOI:10.1080/09553002.2021.2004328 |
| [24] |
Cecerska-Heryć E, Surowska O, Heryć R, et al. Are antioxidant enzymes essential markers in the diagnosis and monitoring of cancer patients-a review[J]. Clin Biochem, 2021, 93: 1-8. DOI:10.1016/j.clinbiochem.2021.03.008 |
| [25] |
Jena AB, Samal RR, Bhol NK, et al. Cellular Red-Ox system in health and disease: The latest update[J]. Biomed Pharmacother, 2023, 162: 114606. DOI:10.1016/j.biopha.2023.114606 |
| [26] |
Luo H, Wang X, Song S, et al. Targeting stearoyl-coa desaturase enhances radiation induced ferroptosis and immunogenic cell death in esophageal squamous cell carcinoma[J]. Oncoimmunology, 2022, 11(1): 2101769. DOI:10.1080/2162402X.2022.2101769 |
 2024, Vol. 44
2024, Vol. 44


