我国是食管癌高发国家,2016年我国食管癌发病率及死亡率分别位居第6位及第5位。2020年食管癌新发病例约32.4万例,死亡病例约30.1万例,分别占全球食管癌发病及死亡人数的53.7%和55.4%[1]。
近年来,世界人口老龄化不断加剧,预计到2035年,中国≥60岁的老年人将超过30%[2]。老年食管癌患者的发病人数和死亡人数占全部食管癌患者的比例较高,如年龄>60岁及>75岁患者人数分别占全部食管癌发病人数的70%和20%[3];60~79岁和≥80岁患者人数分别占全部食管癌死亡人数的62%和21%[4]。我国老年食管癌发病率及死亡率均位居全部恶性肿瘤的第4位[5],食管癌对老年人群危害显著。
截至目前,无论是美国国立综合癌症网络(NCCN)指南、欧洲肿瘤内科学会(ESMO)指南、日本临床肿瘤研究组(JCOG)指南,还是中国食管癌放射治疗指南,针对老年食管癌尚未有明确的定义和评估方法。在治疗方面,高级别前瞻性随机研究、大宗病例的真实世界研究仍较少,国际上也未形成针对该部分患者治疗的共识性指南。老年食管癌患者因为高龄、营养状态欠佳或合并严重的内科基础疾病等,通常难以耐受手术或强度较大的全身化疗,故放射治疗(以下简称“放疗”)是老年食管癌患者的主要治疗手段,制定老年食管癌放疗专家共识可为该部分患者提供一定治疗依据。
一、老年食管癌定义专家共识一:绝大部分国内外指南和专家共识将年龄作为食管癌高危人群的因素之一,可见年龄因素在食管癌诊断治疗中的重要意义。目前,世界卫生组织(WHO)对老年人的定义:60~74岁为年轻老年人,75~89岁为老年人,90岁以上为长寿老年人。而涉及老年肿瘤的临床试验[6-9],入组患者一般为70岁以上。据此,一般认为老年食管癌患者为年龄70岁以上、经病理诊断为食管癌的患者(证据质量:高;共识水平:96%)。
二、身体状况评估与营养治疗1. 身体状况评估:老年食管癌患者为一类特殊人群,具有以下特点:①个体差异大,除了年龄因素,个体间身体机能状况存在较大差异[10]。②老年患者的临床试验少,大部分临床研究将老年食管癌患者排除在试验之外,临床治疗缺乏统一标准[11]。③由年龄因素导致多数老年人心肺功能储备降低,各器官代偿功能降低,造成病情变化迅速[12]。④老年患者与家属对标准的治疗方案接受度因人而异,个体间差异比较大。因此,对老年患者身心的综合和动态地功能性评估非常必要。在治疗方案的选择上,应充分结合各患者的评估结果,制定个体化治疗方案。治疗过程中,应做到动态监测评估老年食管癌患者的身体状况。
专家共识二:放疗前与放疗中需要对老年食管癌患者的身体状态进行评估,建议包括以下内容:①评估频率:除查尔森评分(Charlson comorbidity index,CCI)或老年累计疾病评分表(cumulative illness rating scale-geriatric,CIRS-G)[13]评估在放疗前进行,其他评估方法建议在放疗前、放疗过程中(完成放疗20次)、放疗后1个月动态进行。②评估内容:1)美国东部肿瘤协作组(ECOG)体力状况评分;2)欧洲癌症研究与治疗组织(EORTC)生命质量测定量表(QLQ-C30)(V3)评估;3)工具性日常生活活动能力量表(instrumental activity of daily living,IADL)评分;4)CCI;5)营养动态评估(证据质量:低;共识水平:100%)。
2. 营养治疗:食管癌患者营养不良发生率在所有恶性肿瘤中排名第一,高达67%~85%[14]。加强营养对老年食管癌患者组织修复、提高治疗效果、减轻不良反应等方面尤为重要[15]。规范化的营养评估与治疗应贯穿于老年食管癌患者的整个治疗过程,以达到改善患者营养状态、提高治疗耐受性和延长生存期的目的[16]。
专家共识三:老年食管癌患者接受根治性放疗,应全程进行营养干预,主要包括疗前营养评估、疗中营养治疗和疗后营养指导(证据质量:高;共识水平:100%)。
食管癌放疗患者在入院后24 h内,应由临床医生或护士完成营养风险筛查(营养风险评分量表NRS-2002),存在营养风险(NRS-2002≥3分)的患者需进行营养评估[17]。营养状况评估使用美国肠内肠外营养学会推荐的患者主观整体评价量表(PG-SGA)。对于评分为轻-中度营养不良(PG-SGA=2~8分)的患者,应给予口服营养补充剂或建立管路[18]。对于放疗前评估严重营养不良(PG-SGA≥9分)的患者,建议先进行7~10 d肠内营养,待营养状态改善后再接受治疗[19],在此期间应及时建立肠内营养路径,保证患者的能量与蛋白摄入。常用的肠内营养路径包括鼻胃管、鼻肠管、经皮内镜下胃造瘘(PEG)及胃造口[20]。欧洲临床营养和代谢学会(ESPEN)指南推荐对于吞咽困难或是放疗所致食管黏膜炎症的患者,建议进行PEG[21]。75岁以上或预计使用时间<4周的老年患者,首选鼻胃管。
食管癌患者放疗期间推荐每日总能量摄入量25~30 kcal·kg-1·d-1,推荐蛋白质摄入量1.2~1.5 g·kg-1·d-1 [22]。由于老年患者的吸收能力下降且放化疗对肠道功能的影响较大,除血常规外,还应定期监测肝肾功能、电解质等生化指标,避免低蛋白血症、低钾及低钠等导致的功能紊乱,并及时调整营养治疗方案。患者治疗结束时应再次进行PG-SGA营养状况评估和生活质量评估,放疗相关的不良反应可能会持续到患者治疗结束后的一段时间内,因此,家庭营养仍十分重要。营养管应保留至治疗后1个月复查时,根据复查情况决定拔除或继续保留营养管,并于治疗后1和3个月再次随访评估。
三、肿瘤治疗1. 总体原则
专家共识四:老年患者的身体素质相对较差,往往合并基础疾病,手术容易产生并发症,加之高龄所致的器官功能减退等,均不同程度地制约此类患者接受外科手术治疗的可能。因此,放疗通常作为老年食管癌患者的首选治疗方案[23]。放疗方案需要依据患者分期、体力评分、营养状况、是否合并内科基础疾病等因素综合制定。年龄一般不作为同步放化疗的主要限制因素。但是,年龄是确定放疗靶区、放疗剂量、化疗方案以及监测不良反应时需要考虑的重要因素[24](证据质量:中;共识水平:100%)。
根治性放疗适应证主要包括:①早期或临床分期可以行根治性手术,但因内科疾病,如心脏病、高血压、肺部疾病等不能手术或手术风险高的患者。②早期或临床分期可行手术切除但患者本人及家属拒绝手术者。③对于局部晚期可手术患者,需高选择性筛选术前放化疗人群。④对于不可手术切除的局部晚期老年食管癌患者,可行根治性放疗。⑤对于体力评分较好、经多学科团队(MDT)评估预后相对较好的老年食管癌患者,可考虑根治性同步放化疗方案,同时进行不良反应监测。
不能行根治性放疗的患者、发生转移的患者、心肺功能难以耐受根治性放疗者、一般状况较差者可考虑行姑息性放疗;对于食管穿孔(气管食管瘘、食管纵隔瘘或可能发生食管主动脉瘘)者、恶液质症状明显者及多发远处转移者,以对症支持治疗为主,放疗需慎重;对于营养不良或者严重进食梗阻的老年患者,建议在放疗前应用鼻饲饮食或胃造瘘。
2. 治疗模式
(1) 单纯放疗
专家共识五:不能手术切除的局部晚期老年食管癌患者,尤其是年龄≥75岁、经疗前CCI或CIRS-G评估体质状况差且合并有较多内科疾病的患者,单纯放疗可考虑作为一种安全且有效的局部治疗手段。单纯放疗推荐剂量为59.4~60 Gy,靶区采用累及野(证据质量:中;共识水平:94%)。
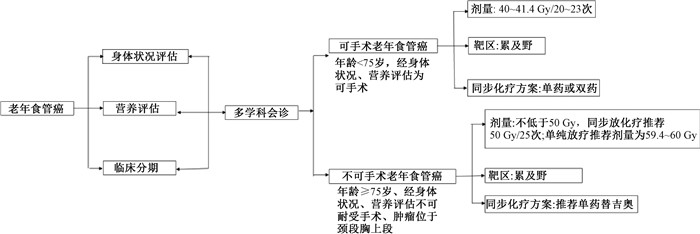
|
图 1 老年食管癌患者治疗流程图 Figure 1 Treatment flowchart for elderly patients with esophageal cancer |
回顾性研究显示,75岁以上老年食管癌患者接受单纯放疗的比例高达95.6%,多个研究也提示对于高龄患者,尤其是年龄≥80岁者,放化疗组的3年生存率未优于单纯放疗组,而单纯放疗组治疗相关的严重不良反应发生率更低[25-26]。因此,对于高龄患者,尤其一般状况较差的患者,单纯放疗是可以考虑的治疗方式。
(2) 放疗联合化疗
近期多项小样本研究均显示,同步放化疗与单纯放疗比较,可提高局部进展期食管癌患者生存期。对于老年食管癌患者,经高度选择后仍建议采用同步放化疗。
①放疗联合双药化疗
指南尚无专门针对老年食管癌同步放化疗中化疗方案的建议。NCCN指南2023年第3版食管和食管胃交界癌推荐:根治性同步放化疗Ⅰ类证据推荐的化疗方案为紫杉醇联合卡铂、5-氟尿嘧啶(5-FU)联合奥沙利铂、卡培他滨联合奥沙利铂、5-FU联合顺铂、卡培他滨联合顺铂、紫杉类药物联合顺铂。
专家共识六:对于身体状况较好的老年食管癌患者,在治疗前进行全面评估,对于年龄<75岁、糖尿病血糖控制良好、无慢性肺部或肺间质性改变等患者,可以考虑双药化疗,化疗方案以铂类联合紫杉醇、替吉奥或卡培他滨为主。具体方案:卡培他滨(825 mg/m2,2次/d,第1~14天)联合顺铂(60 mg/m2,第1天),或替吉奥(40 mg/m2,2次/d,第1~14天)联合顺铂(70 mg/m2,第8天)[9, 27](证据质量:中;共识水平:92%)。
既往回顾性分析发现,经过筛选的老年患者可耐受同步放化疗,并生存获益[28]。Xing等[29]将75例>65岁的老年食管癌患者分为同步放化疗组和序贯放化疗组,化疗方案采用卡培他滨联合顺铂方案。结果显示同步放化疗组中位总生存(OS)优于序贯放化疗组(33.6个月 vs. 15.7个月,P<0.05)。同步放化疗组白细胞降低及放射性食管炎发生率高于序贯放化疗组,但两组3~4级急性不良反应发生率无明显差异。Wang等[9]分析56例中位年龄为74岁(范围70~87岁)的老年食管癌患者,采用替吉奥联合顺铂同步放疗,全组患者淋巴细胞减少症和中性粒细胞减少症的发生率较高,且≥75岁以上患者的发生率明显高于<75岁患者。该研究每周对患者进行评估,根据不良反应对药物剂量进行调整,如果出现3级粒细胞减少伴感染,或者4级白细胞下降,或者3级及以上血小板减少,下一疗程替吉奥减量至60 mg·m-2·d-1(分为每日2次服用)。如果肌酐清除率≤ 50 ml/min, 顺铂减量至原剂量80%[9]。此外,针对老年患者,肾脏与听力方面的不良反应和评估也要关注。Tougeron等[7]在一项老年食管癌根治性放化疗疗效与安全性的研究中报道,89.9%(98/109)接受5-FU联合顺铂方案化疗,≥2级肾功能不全(肌酐清除率下降)发生率5.5%(6/109),未报道听力受损的不良事件。
根据上述研究结果,将5-FU静脉化疗更换为口服卡培他滨或替吉奥,疗效类似且安全性高,年龄>75岁患者接受双药同步放化疗不良反应增加较为明显,在临床中应用需慎重。
②放疗联合单药化疗
专家共识七:鉴于老年食管癌同步放疗联合双药化疗的治疗不良反应较高,对于老年食管癌患者,尤其是>75岁老年患者,放疗联合单药化疗耐受较好,治疗完成率高,取得和双药化疗相近的疗效。单药化疗推荐方案:替吉奥70 mg·m-2·d-1,第1~14天,第22~35天。有明显吞咽困难者,可考虑单药静脉化疗,药物考虑铂类、紫杉类药物或5-FU等(证据质量:中;共识水平:96%)。
Meta分析显示,对老年食管癌患者,行替吉奥单药联合放疗可取得较为满意的疗效且耐受性较好[27]。此外,一些研究还进行了单药/双药联合放疗的比较分析。Huang等[30]纳入271例≥65岁的老年食管癌患者,结果显示化疗联合放疗患者的中位生存时间明显优于单纯放疗者,但单药组与双药组的生存时间并无显著差别。在不良反应方面,双药联合放疗组分别有40.6%和17.9%的患者出现≥3级白细胞减少症和≥2级的体重减轻,明显高于单药联合放疗组。
近期,两项多中心Ⅲ期研究显示,老年食管癌替吉奥联合放疗疗效优于单纯放疗。Xu等[31]在中国的23个中心进行了一项随机、开放标签、Ⅲ期临床试验。该研究纳入298例年龄为70~85岁的局部晚期食管鳞癌患者,50.7%为Ⅲ期或Ⅳ期食管癌。接受放疗联合替吉奥组2年总生存率显著高于单纯放疗组(53.2% vs. 35.8%,P =0.002)。同步放化疗组发生3级及以上白细胞减少症的患者较单纯放疗组更多(9.5% vs. 2.7%,P =0.01)。Wang等[32]的随机Ⅲ期多中心临床研究共入组330例70岁及以上食管癌患者,结果显示接受同步加量放疗技术同时联合替吉奥者,3年总生存率明显优于接受单纯放疗者(46.2% vs. 33.9%,P =0.02)。总之,这两项Ⅲ期随机临床试验的结果表明,老年患者对替吉奥联合放疗是可以耐受的,与单独放疗相比具有生存获益,可作为老年食管癌根治性放化疗的标准治疗方案。
(3) 放疗联合免疫治疗
专家共识八:目前没有老年食管癌患者放疗或者放化疗联合免疫检查点抑制剂的高级别证据。2023年NCCN指南、2023年中国临床肿瘤学会(CSCO)指南均推荐晚期食管癌二线单药免疫治疗及一线化疗联合免疫治疗作为标准治疗。小样本研究显示,不能耐受同步放化疗的局部晚期食管癌患者可以行放疗联合免疫治疗(证据质量:低;共识水平:94%)。
免疫治疗及免疫联合化疗成为晚期食管癌二线治疗和一线治疗的标准治疗。由于同步放化疗难以进一步改善食管癌患者整体生存,治疗瓶颈难以突破,多个研究已经开始探索在同步放化疗期间加入免疫治疗或者巩固免疫治疗是否能进一步延长患者生存。
老年人作为特殊群体,也加入了免疫治疗临床研究中。Keynote-181研究全球数据显示,纳入≥65岁老年食管癌患者的比例为43.3%,ATTRACTION-3研究纳入≥65岁老年食管癌患者的比例更是高达53.0%。在非小细胞肺癌中,帕博利珠单抗治疗年龄≥75岁的老年患者,结果显示与化疗相比,帕博利珠单抗能够改善老年患者的生存,且安全性更佳[33]。
在局部晚期食管癌中,放疗联合免疫治疗、放化疗联合免疫治疗小样本的临床试验结果显示,患者在取得较好疗效的同时,放疗相关不良反应未明显增加[34-36]。目前,多个Ⅲ期多中心随机研究正在进行中,这些研究的结果可能会改变局部晚期食管癌治疗指南的相关内容,其中包括老年食管癌患者。对于特殊人群,ⅠB期临床研究显示,不能耐受同步放化疗的局部晚期食管癌患者对放疗联合免疫治疗耐受性较好[34]。因此,对于老年患者,放疗联合免疫治疗、放疗联合替吉奥和免疫治疗是非常值得探索的方向。
(4) 放疗联合靶向药物
专家共识九:老年患者身体机能较差,基础疾病多,相当一部分老年患者不能耐受同步放化疗。经治疗前CCI或CIRS-G详细评估患者的基本状态,不能耐受同步放化疗的患者,可个体化选择放疗联合靶向药物的治疗策略(证据质量:中;共识水平:94%)。
①表皮生长因子受体(EGFR)单克隆抗体:一项Ⅱ期研究纳入了46例局部晚期不可手术的老年食管癌患者,中位年龄为76.5岁。患者经评估不能耐受同步放化疗后入组,接受了胸部放疗,联合周方案尼妥珠单抗治疗。3~4级不良反应的发生率为17.4%,未发生5级不良反应。中位总生存期和无进展生存期分别为17和10个月[37]。
②EGFR酪氨酸激酶抑制剂:一项Ⅱ期随机研究(NCT02375581)纳入了127例≥ 70岁局部晚期不可切除的食管癌患者,经评估不能耐受同步放化疗或拒绝同步放化疗者,随机分为放疗联合埃克替尼组和单纯放疗组。研究结果表明,两组3级和4级不良反应差异无统计学意义,EGFR高表达的患者中,放疗联合埃克替尼组有更长的生存期(未达到中位值 vs. 16.3个月,P=0.03)[38]。
(5) 新辅助放化疗
专家共识十:对于老年食管癌患者,治疗前分期Ⅱ~ⅣA期,ECOG评分0~1分,心肺功能良好、骨髓、肝功能、肾功能良好,经外科医生评估为可手术的部分老年患者,可行术前新辅助放化疗。老年食管癌患者新辅助放疗的靶区一般采用累及野照射,靶区同根治性放疗靶区范围,应尽量避免吻合口照射(证据质量:中;共识水平:94%)。
在新辅助同步化疗方案的选择方面,NCCN和ESMO指南对于中晚期或不可手术食管癌,均推荐以紫杉醇联合卡铂、5-FU联合奥沙利铂、卡培他滨联合奥沙利铂、5-FU或卡培他滨联合顺铂等为基础的双药同步放化疗为其综合治疗方案。但该推荐所基于的临床试验纳入的病例为年龄≤75岁的患者,且该方案在>75岁老年患者中的临床推广应用存在困难。
CROSS研究对老年患者的亚组分析研究结果显示,与<70岁组相比,老年组(≥70岁)的ECOG评分更高(中位评分1 vs. 0,P=0.003),查尔森评分更高(中位评分6 vs. 4,P<0.001),并且更多的患者接受了开放性手术(20% vs. 8%,P=0.008)。结果显示,两组的总生存期及总体不良反应发生率相似,年龄不是并发症的独立预后因素[39]。该研究认为老年患者接受术前放化疗联合手术是可行的。然而,也有回顾性研究表明,对于75岁及以上的患者,含铂方案的双药化疗未延长生存期,倾向性评分匹配后,放化疗组的3年总生存率与单纯放疗组相比差异无统计学意义(P=0.876)。来自监测、流行病学和最终结果(SEER)数据库的回顾性研究也得到了类似的结果[26, 40-41]。因此,对于>70岁,尤其是>75岁老年食管癌患者,研究结论并不一致,使用双药同步化疗方案应谨慎评估。
3. 放疗方案
(1) 放疗技术
专家共识十一:调强放疗(IMRT)具有良好的靶区适形度,可降低心脏、肺等危及器官的受照剂量,在老年食管癌患者具有良好的生存率和局部控制率[42],推荐常规作为老年食管癌患者的首选放疗技术[43]。同步加量放疗技术未影响疗效,也未增加不良反应,但可缩短治疗时间,是老年食管癌患者可选择的放疗技术(证据质量:低;共识水平:96%)。
(2) 放疗靶区
专家共识十二:放疗靶区范围推荐采用个体化治疗模式。对淋巴引流区进行累及野照射的不良反应相对较轻,更适合老年食管癌患者[44-45]。新辅助放疗靶区同根治性放疗靶区,勾画靶区时需考虑后续食管切除术计划的吻合位置,应尽量避免吻合口位于射野内。姑息放疗靶区无标准推荐,可依据患者体力状态、预期生存、症状等因素个体化勾画(证据质量:中;共识水平:98%)。
①大体原发肿瘤靶区(GTVp)和大体淋巴结肿瘤靶区(GTVnd):结合各项检查,包括胸部强化CT、上消化道造影、胃镜或腔内超声内镜、PET-CT、磁共振等影像学检查,勾画可见的食管原发肿瘤为GTVp,确诊转移或不能除外转移的淋巴结为GTVnd。有条件的医院推荐内镜或超声下放置钛夹标记,GTVp以钛夹标记的上下界为准。
②临床原发肿瘤靶区(CTVp)和临床淋巴结肿瘤靶区(CTVnd):CTVp以GTV左右前后方向均匀外扩0.6 cm(根据解剖屏障进行调整),GTV上下方向各外扩2~3 cm。CTVnd以GTVnd轴向均匀外扩0.5~0.6 cm(根据解剖屏障进行调整)。
③计划靶区(PTV):在CTV的基础上外放0.5 cm或根据各中心质量控制数据外扩形成。
④计划大体肿瘤靶区(PGTV):(同步加量放疗时采用)GTVp和GTVnd均外扩0.5 cm(GTVp上下外放1 cm)。
(3) 放疗剂量
专家共识十三:老年食管癌患者放疗剂量推荐如下:
①新辅助放疗:经评估可耐受新辅助放疗联合手术的老年食管癌患者,新辅助放疗剂量推荐40~41.4 Gy/20~23次[48-49](证据质量:高;共识水平:100%)。
②根治性放疗:NCCN指南、日本食管癌指南、CSCO食管癌指南及多项临床研究对于老年食管癌患者根治性放疗/放化疗的放疗剂量无统一推荐[50-51]。多项随机研究及Meta分析显示,食管癌患者接受同步放化疗时应采用50 Gy/25次或50.4 Gy/28次作为标准剂量[6, 52-53]。单纯放疗时,经充分个体化评估后,可考虑剂量增加至60 Gy/30次或59.4 Gy/33次[52](证据质量:中;共识水平:94%)。
③姑息放疗:不能接受根治性放疗的患者,在充分考虑患者体力状态和预期生存等因素的前提下,可给予姑息放疗,照射剂量可考虑30 Gy/10次或20 Gy/5次或更高的照射剂量[54](证据质量:低;共识水平:87%)。
(4) 正常组织限量
专家共识十四:充分评估老年食管癌患者心肺功能和基础疾病等情况,平衡放疗策略和不良反应关系,尽量降低老年食管癌患者的正常组织受照剂量。根治性放疗正常器官限制剂量如下:双肺:Dmean≤14 Gy,V5≤63%,V20≤30%,V30≤20%,同步放化疗者V20≤25%;心脏:V30≤40%,V40≤30%,Dmean≤26 Gy;脊髓:Dmax≤45 Gy;胃:V40≤40%,Dmax≤52 Gy;肠道:V40≤40%,Dmax≤52 Gy;双肾:V20≤30%;肝:Dmean≤28 Gy[55-56](证据质量:高;共识水平:96%)。
4. 不良反应及处理
专家共识十五:老年患者身体机能下降,常合并心肺疾患,放疗反应耐受性较年轻患者差。不良反应主要包括:疲劳乏力,放射性食管炎,放射性肺炎,食管溃疡或穿孔,心脏损伤,骨髓抑制等。治疗前应仔细地评估放疗适应证和禁忌证,治疗中要细心观察不良反应的发生。一旦出现急性或慢性反应,应积极对症对因处理,酌情暂停放疗或降低放化疗强度(证据质量:低;共识水平:100%)。
放疗相关不良反应主要分为急性反应和慢性反应两类。急性反应主要表现为恶心、呕吐、口干、食欲减退、咽喉疼痛、吞咽困难等症状。主要的处理方法包括饮食调整、药物治疗等。
老年人由于免疫功能下降、器官功能减退等原因,更容易出现慢性反应。对于慢性反应,主要的处理方法包括食管扩张、吞咽训练、药物治疗等。具体包括:①全身放疗反应:放化疗过程中,高龄患者易出现乏力、食欲下降、恶心等症状,发生概率较<70岁的患者增加,放疗中应及时给予输液、支持治疗,以保证放疗顺利完成。②放射性食管炎:放疗至20 Gy以上,多数老年患者出现吞咽疼痛,部分患者可能出现进食困难加重,轻者建议进半流质或流质饮食。对症状明显的患者,建议疗中鼻饲营养或疗前预防性应用营养管。疼痛明显可予补液、止痛、激素抗炎治疗,症状可明显缓解。③放疗中食管溃疡或穿孔:多因肿瘤外侵造成,对于老年患者,同步放化疗前应仔细评估发生穿孔的可能性,进行预防性处理。治疗中出现穿孔,给予抗感染、鼻饲饮食或胃造瘘手术及对症、营养支持治疗。④心肺相关并发症:高龄患者心肺功能较差,发生心肺相关并发症概率较高,主要包括肺部感染、急性放射性肺炎、心律失常等。放疗过程中并发肺部感染、心脏并发症应进行多学科会诊,酌情停止放疗或降低放化疗强度。⑤骨髓抑制:高龄患者放疗过程中,尤其合并化疗,出现血红蛋白、白细胞以及血小板下降概率增加,建议继续相应对症治疗,同时加强营养。
四、随访专家共识十六:对各分期老年食管癌,均应规律随访,以期尽早发现复发和转移征象,并通过及时干预延长患者生存。同时,由于老年人身体机能下降,心肺合并症多,随访可以及时发现和处理放疗后的不良反应,提高生活质量(证据质量:低;共识水平:100%)。
1. 随访:内容应包括病史询问、症状评估、体格检查、放疗效果评估、实验室检查、并发症评估、生活质量评估和心理支持等。症状评估应包括恶心、呕吐、口干、食欲减退、咽喉疼痛、吞咽困难等症状,以及是否有新的不适症状。体格检查应包括体质量指数(BMI)、体重、身高、血压、心率、呼吸等常规检查,还包括颈部、胸部和腹部的体格检查,以寻找是否发生局部复发或转移的证据。放疗效果评估应包括影像学检查(如CT、MRI等)和内窥镜检查,以确定肿瘤退缩情况和是否复发。对已有或怀疑有复发及远处转移的患者,可考虑行PET-CT检查。实验室检查应包括血常规、肝功能、肾功能、肿瘤标志物等。并发症评估应包括食管狭窄、吞咽困难、胸痛、肺部感染等并发症的检查,以确定是否需要进一步治疗。生活质量评估应包括身体功能、精神状态和社会支持等方面的评估,以确定老年人的生活质量。老年患者的心理可能较为脆弱,需要提供必要的心理支持。
2. 随访频度:应根据老年人的具体情况而定。一般来说,放疗后2年内每3个月复查1次,放疗后第2~5年每3~6个月复查1次,5年后每年复查[28, 46]。
3. 处理措施:放疗后患者如有症状或通过影像学检查发现局部复发,建议行内镜检查以明确诊断[57]。如果上消化道造影发现食管狭窄,需要行内镜检查。目前,常用于食管癌预后判断的肿瘤标志物有细胞角蛋白19片段、癌胚抗原、鳞状上皮细胞癌抗原、糖类抗原19-9等,可提高随访观察的准确性。但对早期食管癌灵敏度较低,不推荐作为常规检查手段[58-59]。液体活检技术有望成为治疗监测和预后评估的新手段,主要包括循环肿瘤细胞、循环肿瘤DNA及其全基因组或全外显子组高通量测序分析,对于无法进行传统活检的患者,可以考虑行液体活检,但是仍需要更多高级别循证医学证据来支持其临床应用价值[60]。
五、总结以放疗为主的综合治疗是老年食管癌的主要治疗模式。本共识进一步明确了老年食管癌的定义、放疗的适应证、放疗同步药物治疗的方案、放疗靶区、剂量以及放疗过程中的营养管理。本共识将有利于老年食管癌治疗的规范化管理及相关临床试验的开展。另外,对于老年食管癌的分层治疗、营养治疗及分子层面疗效与治疗反应的预测有待进一步的研究。
审定专家组组长 于金明(山东第一医科大学附属肿瘤医院)、李宝生(山东第一医科大学附属肿瘤医院)、王俊杰(北京大学第三医院)、郭小毛(复旦大学肿瘤医院)、王绿化(中国医学科学院肿瘤医院深圳医院)、王平(天津医科大学肿瘤医院)、袁双虎(中国科学技术大学附属第一医院)、金晶(中国医学科学院肿瘤医院深圳医院)
审定委员会成员 (按姓氏笔画排序) 王军(河北医科大学第四医院)、王晖(湖南省肿瘤医院)、曲宝林(中国人民解放军第一医学中心)、孙新臣(江苏省人民医院)、李建成(福建省肿瘤医院)、李涛(四川省肿瘤医院)、肖泽芬(中国医学科学院肿瘤医院)、陈明(中山大学附属肿瘤医院)、庞青松(天津医科大学肿瘤医院)、赵快乐(复旦大学附属肿瘤医院)、葛红(河南省肿瘤医院)、韩春(河北医科大学第四医院)、傅小龙(上海交通大学医学院附属胸科医院)、惠周光(中国医学科学院肿瘤医院)
执笔专家组组长 章文成(天津医科大学肿瘤医院)、周志国(河北医科大学第四医院)、门玉(中国医学科学院肿瘤医院)、黄伟(山东第一医科大学附属肿瘤医院)、王奇峰(四川省肿瘤医院)
执笔专家组成员 (按姓氏笔画排序) 马红兵(西安交通大学第二附属医院)、王鑫(中国医学科学院肿瘤医院)、王琳琳(山东第一医科大学附属肿瘤医院)、邢力刚(山东第一医科大学附属肿瘤医院)、巩合义(山东第一医科大学附属中心医院)、刘俊(上海交通大学医学院附属胸科医院)、刘文扬(中国医学科学院肿瘤医院)、刘芳(中国人民解放军第一医学中心)、刘智华(江西省肿瘤医院)、吕家华(四川省肿瘤医院)、张耀文(河南省安阳市肿瘤医院)、张建东(山东省千佛山医院)、张天(天津医科大学肿瘤医院)、陈永顺(武汉大学人民医院)、陈伟霖(福建省漳州市医院)、杨从容(河北医科大学第四医院)、李杰(山西省肿瘤医院)、郑安平(河南省安阳市肿瘤医院)、周涛(山东第一医科大学附属肿瘤医院)、周伟(重庆市肿瘤医院)、武亚晶(河北医科大学第四医院)、祝淑钗(河北医科大学第四医院)、赵仁(宁夏医科大学总医院)、钱东(中国科学技术大学附属第一医院)、秦颂兵(苏州大学附属第一医院)、梁军(中国医学科学院肿瘤医院)、程云杰(河北医科大学第四医院)、董杰(天津医科大学肿瘤医院)、蔡旭伟(上海市胸科医院)、樊锐太(郑州大学第一附属医院)
利益冲突 无
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Vollset SE, Goren E, Yuan CW, et al. Fertility, mortality, migration, and population scenarios for 195 countries and territories from 2017 to 2100:a forecasting analysis for the global burden of disease study[J]. Lancet, 2020, 396(10258): 1285-1306. DOI:10.1016/S0140-6736(20)30677-2 |
| [3] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [4] |
Chen W, Sun K, Zheng R, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [5] |
陈万青, 郑荣寿, 张思维, 等. 2013年中国老年人群恶性肿瘤发病和死亡分析[J]. 中华肿瘤杂志, 2017, 39(1): 60-66. Chen WQ, Zheng RS, Zhang SW, et al. Analysis of cancer incidence and mortality in elderly population in China, 2013[J]. Chin J Oncol, 2017, 39(1): 60-66. DOI:10.3760/cma.j.issn.0253-3766.2017.01.012 |
| [6] |
Ji Y, Du X, Zhu W, et al. Efficacy of concurrent chemoradiotherapy with S-1 vs radiotherapy alone for older patients with esophageal cancer: a multicenter randomized phase 3 clinical trial[J]. JAMA Oncol, 2021, 7(10): 1459-1466. DOI:10.1001/jamaoncol.2021.2705 |
| [7] |
Tougeron D, Di Fiore F, Thureau S, et al. Safety and outcome of definitive chemoradiotherapy in elderly patients with oesophageal cancer[J]. Br J Cancer, 2008, 99(10): 1586-1592. DOI:10.1038/sj.bjc.6604749 |
| [8] |
Wang X, Ge X, Wang X, et al. S-1-based chemoradiotherapy followed by consolidation chemotherapy with S-1 in elderly patients with esophageal squamous cell carcinoma: a multicenter phase Ⅱ trial[J]. Front Oncol, 2020, 10: 1499. DOI:10.3389/fonc.2020.01499 |
| [9] |
Wang H, Li G, Chen L, et al. Definitive concurrent chemoradiotherapy with S-1 and cisplatin in elderly esophageal squamous cell carcinoma patients[J]. J Thorac Dis, 2017, 9(3): 646-654. DOI:10.21037/jtd.2017.03.105 |
| [10] |
Amaral Gomes ES, Ramsey KA, Rojer AGM, et al. The association of objectively measured physical activity and sedentary behavior with (instrumental) activities of daily living in community-dwelling older adults: a systematic review[J]. Clin Interv Aging, 2021, 16: 1877-1915. DOI:10.2147/CIA.S326686 |
| [11] |
Le-Rademacher J, Mohile S, Unger J, et al. Trial design considerations to increase older adult accrual to National Cancer Institute clinical trials[J]. J Natl Cancer Inst Monogr, 2022, 2022(60): 135-141. DOI:10.1093/jncimonographs/lgac023 |
| [12] |
Tracy EP, Hughes W, Beare JE, et al. Aging-induced impairment of vascular function: mitochondrial redox contributions and physiological/clinical implications[J]. Antioxid Redox Signal, 2021, 35(12): 974-1015. DOI:10.1089/ars.2021.0031 |
| [13] |
Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients[J]. J Am Geriatr Soc, 2008, 56(10): 1926-1931. DOI:10.1111/j.1532-5415.2008.01935.x |
| [14] |
Hébuterne X, Lemarié E, Michallet M, et al. Prevalence of malnutrition and current use of nutrition support in patients with cancer[J]. JPEN J Parenter Enteral Nutr, 2014, 38(2): 196-204. DOI:10.1177/0148607113502674 |
| [15] |
Cox S, Powell C, Carter B, et al. Role of nutritional status and intervention in oesophageal cancer treated with definitive chemoradiotherapy: outcomes from SCOPE1[J]. Br J Cancer, 2016, 115(2): 172-177. DOI:10.1038/bjc.2016.129 |
| [16] |
Cong MH, Li SL, Cheng GW, et al. An interdisciplinary nutrition support team improves clinical and hospitalized outcomes of esophageal cancer patients with concurrent chemoradiotherapy[J]. Chin Med J (Engl), 2015, 128(22): 3003-3007. DOI:10.4103/0366-6999.168963 |
| [17] |
Bozzetti F, SCRINIO Working Group. Screening the nutritional status in oncology: a preliminary report on 1, 000 outpatients[J]. Support Care Cancer, 2009, 17(3): 279-284. DOI:10.1007/s00520-008-0476-3 |
| [18] |
Jager-Wittenaar H, Ottery FD. Assessing nutritional status in cancer: role of the patient-generated subjective global assessment[J]. Curr Opin Clin Nutr Metab Care, 2017, 20(5): 322-329. DOI:10.1097/MCO.0000000000000389 |
| [19] |
Chen MJ, Wu IC, Chen YJ, et al. Nutrition therapy in esophageal cancer—consensus statement of the Gastroenterological Society of Taiwan[J]. Dis Esophagus, 2018, 31(8): ahead of print. DOI: 10.1093/dote/doy016.
|
| [20] |
Wang B, Jiang X, Tian D, et al. Enteral nutritional support in patients undergoing chemoradiotherapy for esophageal carcinoma[J]. Future Oncol, 2020, 16(35): 2949-2957. DOI:10.2217/fon-2020-0181 |
| [21] |
Arends J, Bodoky G, Bozzetti F, et al. ESPEN guidelines on enteral nutrition: non-surgical oncology[J]. Clin Nutr, 2006, 25(2): 245-259. DOI:10.1016/j.clnu.2006.01.020 |
| [22] |
Virizuela JA, Camblor-Álvarez M, Luengo-Pérez LM, et al. Nutritional support and parenteral nutrition in cancer patients: an expert consensus report[J]. Clin Transl Oncol, 2018, 20(5): 619-629. DOI:10.1007/s12094-017-1757-4 |
| [23] |
Han Y, Liu S, Guo W, et al. Clinical outcomes of oesophagectomy in elderly versus relatively younger patients: a meta-analysis[J]. Interact Cardiovasc Thorac Surg, 2019, 29(6): 897-905. DOI:10.1093/icvts/ivz208 |
| [24] |
Hamamoto Y, Murakami K, Kato K, et al. Management of elderly patients with esophageal squamous cell cancer[J]. Jpn J Clin Oncol, 2022, 52(8): 816-824. DOI:10.1093/jjco/hyac067 |
| [25] |
Zhou YC, Chen LL, Xu HB, et al. Aging-related prognosis analysis of definitive radiotherapy for very elderly esophageal cancer[J]. Cancer Med, 2018, 7(5): 1837-1844. DOI:10.1002/cam4.1456 |
| [26] |
Jingu K, Takahashi N, Murakami Y, et al. Is concurrent chemotherapy with radiotherapy for esophageal cancer beneficial in patients aged 80 years or older?[J]. Anticancer Res, 2019, 39(8): 4279-4283. DOI:10.21873/anticanres.13592 |
| [27] |
Song GM, Tian X, Liu XL, et al. Concurrent chemo-radiotherapy with S-1 as an alternative therapy for elderly Chinese patients with non-metastatic esophageal squamous cancer: evidence based on a systematic review and meta-analysis[J]. Oncotarget, 2017, 8(23): 37963-37973. DOI:10.18632/oncotarget.16302 |
| [28] |
Anderson SE, Minsky BD, Bains M, et al. Combined modality chemoradiation in elderly oesophageal cancer patients[J]. Br J Cancer, 2007, 96(12): 1823-1827. DOI:10.1038/sj.bjc.6603821 |
| [29] |
Xing L, Liang Y, Zhang J, et al. Definitive chemoradiotherapy with capecitabine and cisplatin for elder patients with locally advanced squamous cell esophageal cancer[J]. J Cancer Res Clin Oncol, 2014, 140(5): 867-872. DOI:10.1007/s00432-014-1615-5 |
| [30] |
Huang C, Zhu Y, Li Q, et al. Feasibility and efficiency of concurrent chemoradiotherapy with a single agent or double agents vs radiotherapy alone for elderly patients with esophageal squamous cell carcinoma: Experience of two centers[J]. Cancer Med, 2019, 8(1): 28-39. DOI:10.1002/cam4.1788 |
| [31] |
Xu Y, Dong B, Zhu W, et al. A phase Ⅲ multicenter randomized clinical trial of 60 Gy versus 50 Gy radiation dose in concurrent chemoradiotherapy for inoperable esophageal squamous cell carcinoma[J]. Clin Cancer Res, 2022, 28(9): 1792-1799. DOI:10.1158/1078-0432.CCR-21-3843 |
| [32] |
Wang X, Han W, Zhang W, et al. Effectiveness of S-1-based chemoradiotherapy in patients 70 years and older with esophageal squamous cell carcinoma: a randomized clinical trial[J]. JAMA Netw Open, 2023, 6(5): e2312625. DOI:10.1001/jamanetworkopen.2023.12625 |
| [33] |
Nosaki K, Saka H, Hosomi Y, et al. Safety and efficacy of pembrolizumab monotherapy in elderly patients with PD-L1-positive advanced non-small-cell lung cancer: Pooled analysis from the KEYNOTE-010, KEYNOTE-024, and KEYNOTE-042 studies[J]. Lung Cancer, 2019, 135: 188-195. DOI:10.1016/j.lungcan.2019.07.004 |
| [34] |
Zhang W, Yan C, Gao X, et al. Safety and feasibility of radiotherapy plus camrelizumab for locally advanced esophageal squamous cell carcinoma[J]. Oncologist, 2021, 26(7): e1110-e1124. DOI:10.1002/onco.13797 |
| [35] |
Zhang W, Yan C, Zhang T, et al. Addition of camrelizumab to docetaxel, cisplatin, and radiation therapy in patients with locally advanced esophageal squamous cell carcinoma: a phase Ⅰb study[J]. Oncoimmunology, 2021, 10(1): 1971418. DOI:10.1080/2162402X.2021.1971418 |
| [36] |
Zhu Y, Wen J, Li Q, et al. Toripalimab combined with definitive chemoradiotherapy in locally advanced oesophageal squamous cell carcinoma (EC-CRT-001): a single-arm, phase 2 trial[J]. Lancet Oncol, 2023, 24(4): 371-382. DOI:10.1016/S1470-2045(23)00060-8 |
| [37] |
Yang X, Zhai Y, Bi N, et al. Radiotherapy combined with nimotuzumab for elderly esophageal cancer patients: A phase Ⅱ clinical trial[J]. Chin J Cancer Res, 2021, 33(1): 53-60. DOI:10.21147/j.issn.1000-9604.2021.01.06 |
| [38] |
Luo H, Jiang W, Ma L, et al. Icotinib with concurrent radiotherapy vs radiotherapy alone in older adults with unresectable esophageal squamous cell carcinoma: a phase Ⅱ randomized clinical trial[J]. JAMA Netw Open, 2020, 3(10): e2019440. DOI:10.1001/jamanetworkopen.2020.19440 |
| [39] |
Cooper L, Dezube AR, De León LE, et al. Outcomes of trimodality CROSS regimen in older adults with locally advanced esophageal cancer[J]. Eur J Surg Oncol, 2021, 47(10): 2667-2674. DOI:10.1016/j.ejso.2021.04.013 |
| [40] |
Guttmann DM, Mitra N, Metz JM, et al. Neoadjuvant chemoradiation is associated with improved overall survival in older patients with esophageal cancer[J]. J Geriatr Oncol, 2018, 9(1): 40-46. DOI:10.1016/j.jgo.2017.08.010 |
| [41] |
Wu H, Yu Y, Zheng Q, et al. Benefit of chemotherapy based on platinum with definitive radiotherapy in older patients with locally advanced esophageal squamous cell carcinoma[J]. Radiat Oncol, 2021, 16(1): 207. DOI:10.1186/s13014-021-01931-1 |
| [42] |
Li CC, Chen CY, Chien CR. Comparison of intensity-modulated radiotherapy vs 3-dimensional conformal radiotherapy for patients with non-metastatic esophageal squamous cell carcinoma receiving definitive concurrent chemoradiotherapy: a population-based propensity-score-matched analysis[J]. Medicine (Baltimore), 2018, 97(22): e10928. DOI:10.1097/MD.0000000000010928 |
| [43] |
Kawashima M, Kagami Y, Toita T, et al. Prospective trial of radiotherapy for patients 80 years of age or older with squamous cell carcinoma of the thoracic esophagus[J]. Int J Radiat Oncol Biol Phys, 2006, 64(4): 1112-1121. DOI:10.1016/j.ijrobp.2005.09.027 |
| [44] |
Jing W, Zhu H, Guo H, et al. Feasibility of elective nodal irradiation (ENI) and involved field irradiation (IFI) in radiotherapy for the elderly patients (aged ≥ 70 years) with esophageal squamous cell cancer: a retrospective analysis from a single institute[J]. PLoS One, 2015, 10(12): e0143007. DOI:10.1371/journal.pone.0143007 |
| [45] |
Li C, Wang X, Wang X, et al. A multicenter phase Ⅲ study comparing simultaneous integrated boost (SIB) radiotherapy concurrent and consolidated with S-1 versus SIB alone in elderly patients with esophageal and esophagogastric cancer-the 3JECROG P-01 study protocol[J]. BMC Cancer, 2019, 19(1): 397. DOI:10.1186/s12885-019-5544-1 |
| [46] |
Suzuki G, Yamazaki H, Aibe N, et al. Definitive radiotherapy for older patients aged ≥ 75 years with localized esophageal Cancer[J]. In Vivo, 2019, 33(3): 925-932. DOI:10.21873/invivo.11560 |
| [47] |
Zhang P, Xi M, Zhao L, et al. Is there a benefit in receiving concurrent chemoradiotherapy for elderly patients with inoperable thoracic esophageal squamous cell carcinoma?[J]. PLoS One, 2014, 9(8): e105270. DOI:10.1371/journal.pone.0105270 |
| [48] |
Yang H, Liu H, Chen Y, et al. Neoadjuvant chemoradiotherapy followed by surgery versus surgery alone for locally advanced squamous cell carcinoma of the esophagus (NEOCRTEC5010): a phase Ⅲ multicenter, randomized, open-label clinical trial[J]. J Clin Oncol, 2018, 36(27): 2796-2803. DOI:10.1200/JCO.2018.79.1483 |
| [49] |
Eyck BM, van Lanschot J, Hulshof M, et al. Ten-year outcome of neoadjuvant chemoradiotherapy plus surgery for esophageal cancer: the randomized controlled CROSS trial[J]. J Clin Oncol, 2021, 39(18): 1995-2004. DOI:10.1200/JCO.20.03614 |
| [50] |
Suh YG, Lee IJ, Koom WS, et al. High-dose versus standard-dose radiotherapy with concurrent chemotherapy in stages Ⅱ-Ⅲ esophageal cancer[J]. Jpn J Clin Oncol, 2014, 44(6): 534-540. DOI:10.1093/jjco/hyu047 |
| [51] |
Kim HJ, Suh YG, Lee YC, et al. Dose-response relationship between radiation dose and loco-regional control in patients with stage Ⅱ-Ⅲ esophageal cancer treated with definitive chemoradiotherapy[J]. Cancer Res Treat, 2017, 49(3): 669-677. DOI:10.4143/crt.2016.354 |
| [52] |
Liu Y, Zheng Z, Li M, et al. Comparison of concurrent chemoradiotherapy with radiotherapy alone for locally advanced esophageal squamous cell cancer in elderly patients: A randomized, multicenter, phase Ⅱ clinical trial[J]. Int J Cancer, 2022, 151(4): 607-615. DOI:10.1002/ijc.34030 |
| [53] |
Wang X, Bai H, Li R, et al. High versus standard radiation dose of definitive concurrent chemoradiotherapy for esophageal cancer: A systematic review and meta-analysis of randomized clinical trials[J]. Radiother Oncol, 2023, 180: 109463. DOI:10.1016/j.radonc.2023.109463 |
| [54] |
Merchant SJ, Kong W, Mahmud A, et al. Palliative radiotherapy for esophageal and gastric cancer: population-based patterns of utilization and outcomes in Ontario, Canada[J]. J Palliat Care, 2023, 38(2): 157-166. DOI:10.1177/08258597211072946 |
| [55] |
Health Commission of the People's Republic of China. National guidelines for diagnosis and treatment of esophageal carcinoma 2022 in China (English version)[J]. Chin J Cancer Res, 2022, 34(4): 309-334. DOI:10.21147/j.issn.1000-9604.2022.04.01 |
| [56] |
中国医师协会放射肿瘤治疗医师分会, 中华医学会放射肿瘤治疗学分会, 中国抗癌协会肿瘤放射治疗专业委员会. 中国食管癌放射治疗指南(2022年版)[J]. 国际肿瘤学杂志, 2022, 49(11): 641-657. Radiation Oncology Physician Branch, Chinese Medical Doctor Association; Radiation Oncology Branch, Chinese Medical Association; Professional Committee of Radiation Oncology, China Anticancer Association. Guideline on radiotherapy for esophageal cancer in China(2022 edition)[J]. J Int Oncol, 2022, 49(11): 641-657. DOI:10.3760/cma.j.cn371439-20221011-00129 |
| [57] |
国家卫生健康委员会. 食管癌诊疗规范(2018年版)[J]. 中华消化病与影像杂志(电子版), 2019, 9(4): 158-192. National Health Commission of the People's Republic of China. Chinese guidelines for diagnosis and treatment of esophageal carcinoma 2018[J]. Chin J Digest Med Imageol (Electronic Edition), 2019, 9(4): 158-192. DOI:10.3877/cma.j.issn.2095-2015.2019.04.005 |
| [58] |
Bagaria B, Sood S, Sharma R, et al. Comparative study of CEA and CA19-9 in esophageal, gastric and colon cancers individually and in combination (ROC curve analysis)[J]. Cancer Biol Med, 2013, 10(3): 148-157. DOI:10.7497/j.issn.2095-3941.2013.03.005 |
| [59] |
中华医学会消化内镜学分会, 中国抗癌协会肿瘤内镜专业委员会. 中国早期食管癌筛查及内镜诊治专家共识意见(2014年, 北京)[J]. 中华消化内镜杂志, 2015, 32(4): 205-224. Branch of Digestive Endoscopy, Chinese Medical Association, Professional Committee of Tumor Endoscopy, China Anti-Cancer Association. Chinese expert consensus on screening and endoscopic management of early esophageal cancer (Beijing, 2014)[J]. Chin J Dig Endosc, 2015, 32(4): 205-224. DOI:10.3760/cma.j.issn.1007-5232.2015.04.001 |
| [60] |
Kato S, Okamura R, Baumgartner JM, et al. Analysis of circulating tumor DNA and clinical correlates in patients with esophageal, gastroesophageal junction, and gastric adenocarcinoma[J]. Clin Cancer Res, 2018, 24(24): 6248-6256. DOI:10.1158/1078-0432.CCR-18-1128 |
 2024, Vol. 44
2024, Vol. 44
