乳腺癌术后放疗可降低乳腺癌切除术后局部复发和远处转移[1-2]。乳腺癌放疗最常见的不良反应是急性放射性皮炎,95%以上的患者会出现红斑、水肿、干性脱皮和湿性脱皮等放射性皮肤炎症反应,显著降低患者的生活质量[3]。目前,放射性皮炎常用的分级标准有世界卫生组织(WHO)标准、美国肿瘤放射治疗协作组(RTOG)标准、常见不良反应术语评定标准(CTCAE)等,但多为主观的分级标准,临床缺乏准确的定量标准[4]。使用红外热成像技术获取放射区温度的上升作为放疗诱发的炎症的替代评估方法已取得一定的研究进展[5-6],前期研究显示,使用医用红外体温计测得的皮肤温度与放射性皮炎的程度呈正相关[7],但尚无应用红外体温计预测2级以上放射性皮炎的相关报道。本研究应用医用红外体温计监测皮肤温度变化来反映组织损伤过程,旨在发现预测2级以上放射性皮炎发生的指标,为临床防治提供依据。
资料与方法1. 样本量估算:根据既往研究,乳腺癌改良根治术后放疗50 Gy/25次时,2级及以上急性放射性皮炎的发生率为30%~56%[6-8],根据公式N=Z1-α/22P(1-P)/d2计算样本量。式中,N为样本量,Z为置信水平的统计量,P为发生率,d为固定精确度,结果应为81~95例,考虑到20%的样本量丢失,故需要97~115例,最终纳入120例。
2. 研究对象:连续收集河北医科大学第四医院2022年5月至11月接受放射治疗的乳腺癌改良根治术后女性患者120例。所有患者在入组前签署知情同意书,并得到医院伦理委员会的批准(审批号:2023KS021)。纳入标准:年龄≥18岁;经病理确诊为乳腺癌;乳腺癌改良根治术后需行胸壁放疗的女性;放疗处方剂量50 Gy/25次;放疗前照射野皮肤无活动期感染症状。排除标准:双侧乳腺癌;复发或转移;患者皮肤过敏等疾患;中途退出或放疗中断1周以上者。
3. 研究工具:自行设计调查表,包括两部分,第一部分为人口统计学资料,用于记录患者的年龄、身高、体重等。第二部分主要记录患者临床数据,包括疾病分期、化疗药物、内分泌药物、靶向药物的使用情况。医用红外体温计为深圳市家康科技有限公司生产,型号为FR870,出厂时检验合格。
4. 诊断标准:参考RTOG急性放射损伤分级标准[9]。0级:无变化;1级:滤泡样暗色红斑,脱发,干性脱皮,出汗减少;2级:触痛性或鲜色红斑,片状湿性脱皮,中度水肿;3级:皮肤皱褶以外部位的融合的湿性脱皮,凹陷性水肿;4级:溃疡,出血,坏死。
5. 放疗方式:所有患者仰卧位,三维适形放疗(瑞典Elekta synergy直线加速器,采用6 MVX射线),照射范围为胸壁+同侧锁骨上淋巴引流区±同侧内乳淋巴引流区,放疗均全程使用同一种5 mm厚的组织补偿物,由医生决定使用体膜(热塑膜)或体架固定体位,处方剂量50 Gy/25次,共放疗5周。
6. 资料收集方法:研究组中负责记录和测量的研究者均接受了如何使用量表和使用医用红外体温计的培训,由两名具有10年以上放疗临床经验的肿瘤专科护士进行放射性皮炎评估,该两名护士对温度测量不知情。
严格筛选出可参加本研究的患者,基线皮肤温度测量于开始放疗前,之后每周固定同一天(即每放疗5次)上午10时放疗前测量皮肤温度,并评估放射性皮炎的程度,共6次。每次均测量胸壁照射野设置的5个点、锁上照射野区1个点及相应健侧部位6个点,分别为:胸骨柄内侧第4肋间;锁骨中线第2肋间;腋中线第4肋间;锁骨中线第6肋间;锁骨中线第4肋间;锁骨上窝。为减少干扰因素(如身体测量部位和环境温度)影响温度测量的准确性[10-11],采用皮肤相对温差(DST)描述放射区皮肤温度的变化,DST=患侧皮肤温度-健侧皮肤温度。
测试室温度恒定25~26℃,湿度50%±10%,穿单衣在测试室休息10 min后,患者需要脱掉上衣,双手叉腰露出腋下,测量时医用红外体温计按照说明书要求距离皮肤0.5 cm,垂直对准皮肤拟测量部位测量3次,取平均值并记录,所有测量环节应避免进行影响测量结果的操作:测试前4 h不允许局部涂抹皮肤保护剂,其他时间遵医嘱应用射线防护喷剂。测量前1 h内禁止热敷、冷敷、活动、进食、洗漱、沐浴,禁止清洗消毒测量部位。测量时使用的仪器、部位、距离及观察人员固定不变。
7. 统计学处理:应用Excel建立数据库,计算出胸壁5点的最大值和平均值,及胸壁DST平均值、胸壁DST最大值、锁骨上DST。采用SPSS 25.0软件对数据进行分析处理,计数资料以频数或百分比表示;正态分布的计量资料以x±s表示;等级资料或偏态分布应用非参数检验。应用配对样本t检验比较每周的DST和独立样本t检验比较不同程度放射性皮炎的DST。计算发生2级及以上放射性皮炎的最佳截断值并绘制受试者工作特征曲线(ROC)。应用二元logistic回归比较不同皮肤温度与放射性皮炎发生的风险,计算风险比(OR)及95%可信区间(95%CI)。P < 0.05为差异有统计学意义。
结果1. 一般资料:120例患者被纳入研究,中途退出患者10例,因疫情、个人原因放疗中断1周以上患者7例,最终共纳入103例。其中,5例(4.9%)未发生放射性皮炎,61例(59.2%)出现1级放射性皮炎,36例(35.0%)出现2级放射性皮炎,1例(0.9%)在放疗最后2次出现出现3级放射性皮炎,所有患者均未因皮肤损伤中止治疗。将0级和1级放射性皮炎归为2级以下放射性皮炎组,将2级和3级放射性皮炎归为2级及以上放射性皮炎组。2级以下和2级及以上放射性皮炎组患者的一般资料中,年龄分别为(51.20 ± 9.04)和(54.92±7.22)岁,差异有统计学意义(P < 0.05),体质量指数和其他项目差异均无统计学意义(P>0.05,表 1)。
|
|
表 1 研究对象的一般资料分析 Table 1 General data of the research objects |
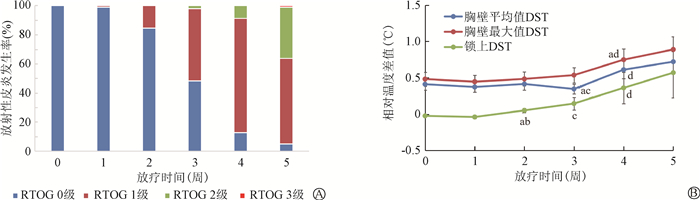
2. 不同时间段皮肤相对温差及放射性皮炎级别的变化:随着放疗剂量的增加,放射性皮炎级别随之加重,胸壁DST平均值、DST最大值、锁骨上DST 3个温度均呈现上升趋势。患者的胸壁DST平均值在第15次时出现与第10次及基线值差异有统计学意义(t=2.59、4.30,P<0.05),胸壁DST的最大值在第20次出现与第15次及基线值差异有统计学意义(t=7.72、2.52,P<0.05),锁上DST在第10次出现与第5次及基线值差异有统计学意义(t=2.79、2.37,P<0.05,图 1)。
|
注:DST.相对皮肤温差。a与基线的DST相比,t=2.37、4.30、2.52,P<0.05;b与第1周锁上DST相比,t=2.79,P=0.006;c与第2周胸壁DST平均值、锁上DST相比,t=2.59、3.08,P=0.011、0.003;d与第3周胸壁DST平均值、DST最大值、锁上DST相比,t=7.72、4.35、4.73,P<0.001 图 1 放射性皮炎发生率(A)及不同部位皮肤相对温差(B)与放疗时间相关性分析 Figure 1 Correlations of the incidence of radiodermatitis (A) and the relative temperature difference of skin in different parts (B) with radiotherapy time |
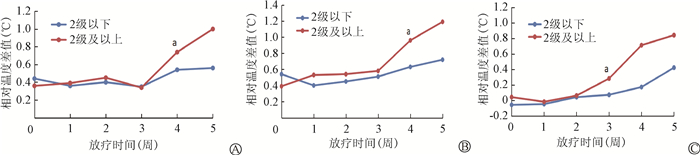
3. 不同级别放射性皮炎的皮肤温度变化:不同级别皮炎的胸壁DST平均值、DST最大值在20次时差异有统计学意义(t=3.31、3.40,P=0.001)锁骨上DST在第15次时差异有统计学意义(t=3.35,P=0.001),见图 2。
|
注:a与2级以下放射性皮炎相比,t=3.31、3.40、3.35,P=0.001 图 2 不同级别放射性皮炎随治疗时间相对皮肤温度的变化 A.胸壁DST平均值;B.胸壁DST最大值;C.锁骨上DST Figure 2 Skin temperature versus radiotherapy time for different grades of radiodermatitis A. Average relative skin temperature difference of chest wall; B. Maximum relative skin temperature difference of chest wall; C. Relative skin temperature difference of the supraclavicular block |
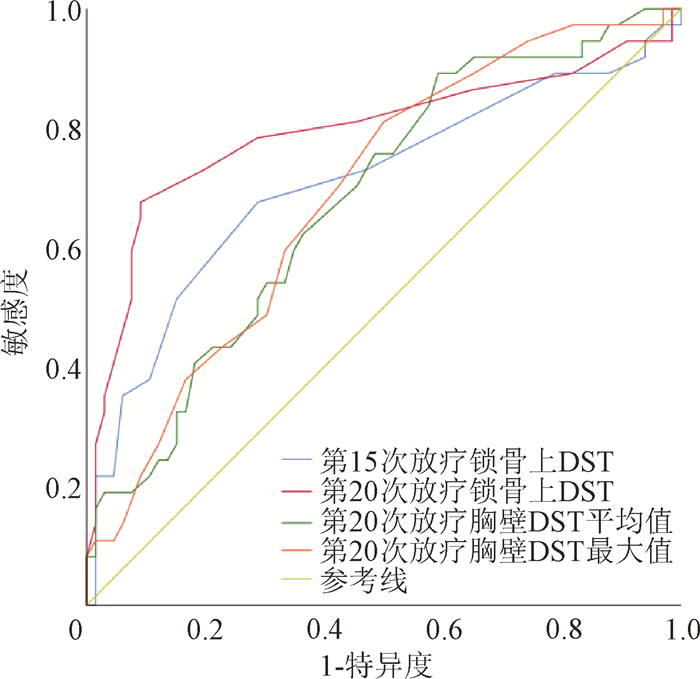
4. 皮肤相对温差预测放射性皮炎发生的最佳截断值及预测效果分析:在SPSS中将不同放疗次数的胸壁DST平均值、DST最大值、锁骨上DST应用ROC曲线预测DST对放射性皮炎,P < 0.05时被认为是最佳预测结果,发现胸壁第20次的DST平均值、胸壁第20次的DST最大值、锁骨上第15、20次的DST的预测差异有统计学意义,结果见表 2及图 3。
|
|
表 2 不同区域的皮肤相对温差预测2级及以上放射性皮炎的最佳截断值 Table 2 Optimal cut-off values for grade ≥ 2 radiodermatitis predicted using skin temperature differences of different parts |
|
注:DST. 皮肤相对温差;ROC. 受试者工作特征曲线 图 3 不同部位皮肤相对温差预测2级及以上放射性皮炎的ROC曲线 Figure 3 ROC curves of ≥ 2 radiodermatitis predicted using skin temperature differences of different parts |
5. 不同皮肤相对温差与2级及以上放射性皮炎发生的风险:分别将最佳截断值第20次胸壁DST平均值的0.45℃、胸壁DST最大值0.55℃、第15次锁上DST值0.15℃将受试者分为低、高危风险组,二元logistic回归显示,高危风险组发生二级及以上放射性皮炎的风险分别是低危风险组的5.71、4.29、5.15倍(95%CI 1.81~17.99,P=0.003;95%CI 1.65~11.12,P=0.003;95%CI 2.16~12.31,P<0.001)。
讨论本研究发现照射区皮肤温度升高时放射性皮炎发生风险增加。皮肤是控制体温的功能器官。局部皮肤温度升高表明血液灌注增加,可反映代谢活动或炎症的变化[12-13]。放射性皮炎动物模型的数据显示,照射区血管周围炎性细胞浸润在扩张的血管周围,并伴有细胞内皮肿胀的炎症表现[14-15]。皮肤温度监测作为一种简便灵敏、客观准确、无创的监测方法,广泛应用于肿瘤、压疮等温度相关性疾病诊断和疗效观察当中[16-17]。目前已有研究应用热成像显示皮肤温度升高与放射性皮炎有关[5-6],放疗期间观察皮肤温度可作为放射性皮炎的客观评价标准和预测方法。
本研究结果表明,随着放疗剂量的增加,胸壁DST平均值、DST最大值、锁上DST基本呈现增加趋势,均在放疗剂量达到50 Gy/25次时达到最高值,并与放疗前的基线值差异有统计学意义,其中2级以下放射性皮炎和2级及以上组的皮肤温度锁上DST在30 Gy/15次时差异出现统计学意义,胸壁DST平均值、DST最大值在40 Gy/20次时差异出现统计学意义。Maillot等[5]选取64例乳房切除术后和保乳术后的患者,应用热成像仪发现被照射的乳房或胸壁与对侧区域之间的温度有差异,并且在放疗过程中温度升高,2级或以上放射性皮炎患者的照射区温度高于没有或轻度皮炎的患者。Zhu等[6]选取41例单侧乳房切除术后患者,应用热成像仪测量锁骨上区域健侧和患侧的温度,得出与基线相比,放疗期间的温度平均值和最大值随时间显著增加,其中第2周的平均值>1.233℃可以预测晚期较高级别的皮炎。与Saednia等[18]应用热成像监测放射性皮炎的研究结果,CTCAE评分为2的患者在治疗期间比CTCAE评分为1的患者表现出更高的皮肤表面温度值结果一致,但观察的患者组间的温度差异在放疗第10次时最为明显,患者接受的是全乳或胸壁辅助大分割放疗(4 250 cGy/16次),相当于本研究26 Gy/13次时温度差异明显。本研究应用医用红外体温计测得的皮肤温度与红外热成像仪测得的皮肤温度基本一致,随着放疗剂量的增加皮肤温度呈现上升趋势,且2级以上组患者的温度差高于2级以下患者的温度差,但预测温度较红外热成像仪出现的稍晚。
本研究发现,放射区皮肤温度监测对放射性皮炎的发生具有较好的预警效果,为进一步验证该指标临床应用的可行性,以ROC曲线评价皮肤相对温差对放射性皮炎的预测效果,本研究胸壁DST平均值第20次、DST最大值第20次、锁上DST值第15、20次的ROC曲线下面积分别为0.681、0.689、0.709、0.793,说明该指标具有较好的预测效果,但是第15次的DST锁上值0.15℃由于温差较小,临床上可能不容易获得。
以最佳截断值将受试者分为低、高危风险组,二元logistic回归显示高危风险组二级及以上放射性皮炎的发生是低危风险组的数倍,表明高级别放射性皮炎与皮肤温度呈正相关,此结果与已有的研究结果一致[5-6, 18]。将预警理念应用于放射性皮炎的管理,利用监测的皮肤温度筛选出发生放射性皮炎的高、低风险的人群,能够做到预防重点突出,针对性强。
本研究的局限性是样本为单中心选择患者;为避免生理和环境的影响,选择在上午10点测量体温,给患者造成一些不便;另外本研究测量对放疗的相对时间与皮肤温度的相关性考虑不足,可在后续的研究中对放疗相对时间对皮肤温度的影响进行研究;最后应用医用红外体温计进行温度监测在临床易操作,但是需要多点采集,重复测量来保证测量的准确性。
应用医用红外体温计测得的皮肤温度能够较好地预测2级及以上放射性皮炎的发生,需关注患者放疗期间皮肤温度变化,当胸壁平均值/最大值/锁上值的相对温差超过0.45、0.55和0.45℃时,应警惕胸壁2级及以上放射性皮炎的发生。本研究结论可为未来要开展的皮肤温度对放射性皮炎发生影响进行的干预性研究提供参考。
利益冲突 无
作者贡献声明 周严红负责研究实施及论文撰写;耿文慧负责设计研究方案,提出研究思路,修改论文;李萌萌、李磊负责收集临床数据;高阳、尹俊普负责文献查找及数据分析;刘志坤负责数据分析指导
| [1] |
Darby S, McGale P, Correa C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: Meta-analysis of individual patient data for 10801 women in 17 randomized trials[J]. Lancet, 2011, 378(9804): 1707-1716. DOI:10.1016/S0140-6736(11)61629-2 |
| [2] |
McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: Meta-analysis of individual patient data for 8135 women in 22 randomized trials[J]. Lancet, 2014, 383(9935): 2127-2135. DOI:10.1016/S0140-6736(14)60488-8 |
| [3] |
Kondziołka J, Wilczyński S, Michalecki Ł. Potential use of novel image and signal processing methods to develop a quantitative assessment of the severity of acute radiation dermatitis in breast cancer radiotherapy[J]. Clin Cosmet Investig Dermatol, 2022, 15: 725-733. DOI:10.2147/CCID.S354320 |
| [4] |
Lopez E, Nunez MI, Guerrero MR, et al. Breast cancer acute radio-therapy morbidity evaluated by different scoring systems[J]. Breast Cancer Res Treat, 2002, 73(2): 127-134. DOI:10.1023/a:1015296607061 |
| [5] |
Maillot O, Leduc N, Atallah V, et al. Evaluation of acute skin toxicity of breast radiotherapy using thermography: results of a prospective single-centre trial[J]. Cancer Radiothér, 2018, 22(3): 205-210. DOI:10.1016/j.canrad.2017.10.007 |
| [6] |
Zhu WQ, Jia L, Chen GX, et al. Relationships between the changes of skin temperature and radiation skin injury[J]. Int J Hyperthermia, 2019, 36(1): 1160-1167. DOI:10.1080/02656736.2019.1685685 |
| [7] |
耿文慧, 周严红, 卢霄蒙, 等. 乳腺癌术后放疗患者放射区皮肤温度与放射性皮炎程度的相关性分析[J]. 现代中西医结合杂志, 2023, 32(2): 257-260. Geng WH, Zhou YH, Lu XM, et al. Correlation analysis of skin temperature in radiation zone and degree of radiation dermatitis in patients with postoperative radiotherapy for breast cancer[J]. Mod J Intergat Tradit Chin West Med, 2023, 32(2): 257-260. |
| [8] |
张媛媛, 张婷婷, 唐玉, 等. 乳腺癌改良根治术后内乳电子线分割照射剂量学评估和急性不良反应、近期疗效[J]. 中华放射肿瘤学杂志, 2021, 30(11): 1122-1128. Zhang YY, Zhang TT, Tang Y, et al. Dosimetric evaluation, acute toxicity and short-term efficacy of postmastectomy hypofractionated internal mammary chain irradiation with electronsr[J]. Chin J Radiat Oncol, 2021, 30(11): 1122-1128. DOI:10.3760/cma.j.cn113030-20210401-00136 |
| [9] |
殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 4版. 北京: 中国协和医科大学出版社, 2008: 1050-1090. Yin WB, Yu ZH, Xu GZ, et al. Radiation oncology[M]. 4th ed. Beijing: Peking Union Medical College Press, 2008: 1050-1090. |
| [10] |
Chanmugam A, Langemo D, Thomason K, et al. Relative temperature maximum in wound infection and inflammation as compared with a control subject using long-wave infrared thermography[J]. Adv Skin Wound Care, 2017, 30(9): 406-414. DOI:10.1097/01.ASW.0000522161.13573.62 |
| [11] |
Kanazawa T, Kitamura A, Nakagami G, et al. Lower temperature at the wound edge detected by thermography predicts under- mining development in pressure ulcers: a pilot study[J]. Int Wound J, 2016, 13(4): 454-460. DOI:10.1111/iwj.12454 |
| [12] |
Xue EY, Chandler LK, Viviano SL, et al. Use of FLIR ONE smartphone thermography in burn wound assessment[J]. Ann Plast Surg, 2018, 80(4 Suppl 4): S236-S238. DOI:10.1097/SAP.0000000000001363 |
| [13] |
Wu Y, Nieuwenhoff MD, Huygen FJ, et al. Characterizing human skin blood flow regulation in response to different local skin temperature perturbations[J]. Microvasc Res, 2017, 111: 96-102. DOI:10.1016/j.mvr.2016.12.007 |
| [14] |
LeBoit PE. Subacute radiation dermatitis: a histologic imitator of acute cutaneous graft-versus-host disease[J]. J Am Acad Dermatol, 1989, 20(2 Pt 1): 236-241. DOI:10.1016/s0190-9622(89)70028-1 |
| [15] |
Schmuth M, Sztankay A, Weinlich G, et al. Permeability barrier function of skin exposed to ionizing radiation[J]. Arch Dermatol, 2001, 137(8): 1019-1023. |
| [16] |
江小琼, 蔡福满, 侯祥庆, 等. 皮肤温度监测在压力性损伤风险预警中的应用研究[J]. 中华护理杂志, 2020, 55(1): 32-38. Jiang XQ, Cai FM, Hou XQ, et al. Application research of skin temperature monitoring in early warning of pressure injury[J]. Chin J Nursing, 2020, 55(1): 32-38. DOI:10.3761/j.issn.0254-1769.2020.01.005 |
| [17] |
王云. 监测足部皮肤温度预测糖尿病足溃疡的价值分析[J]. 安徽医药, 2018, 22(11): 2203-2205. Wang Y. Value analysis of monitoring skin temperaturein predicting diabetic foot ulcer[J]. Anhui Med Pharm J, 2018, 22(11): 2203-2205. |
| [18] |
Saednia K, Tabbarah S, Lagree A, et al. Quantitative thermal imaging biomarkers to detect acute skin toxicity from breast radiation therapy using supervised machine learning[J]. Int J Radiat Oncol Biol Phys, 2020, 106(5): 1071-1083. DOI:10.1016/j.ijrobp.2019.12.032 |
 2024, Vol. 44
2024, Vol. 44


