高通气功能肺避让(high ventilation functional lung avoided,HVFLA)放疗可以有效降低胸部肿瘤患者放射性肺炎的发生几率[1-5],而目前临床获取肺通气功能图像的方法[如单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)、正电子发射计算机断层扫描(PET)等]存在增加患者额外费用和剂量、分辨率低等问题。Guerrero等[6]提出利用四维计算机体层成像(four dimensional computed tomography,4D-CT)技术生成肺通气功能图像,即通过提取4D-CT图像不同时相上肺各部分通气量的变化信息得到肺通气功能图像。4D-CT已广泛应用于胸部肿瘤患者放疗模拟定位,因此,获取4D-CT肺通气功能图像(ventilation imaging based on 4D-CT,CTVI)可以解决上述问题。近几年,Liu等[7]利用深度学习方法显著提高了获取CTVI的准确性和效率,本研究目的是建立基于CTVI的胸部肿瘤HVFLA的放疗计划设计流程,确定HVFLA放疗计划策略,为胸部肿瘤患者开展基于CTVI的HVFLA放疗提供支持。
资料与方法1. 数据:对中国医学科学院肿瘤医院2018年收治的10例胸部肿瘤患者进行回顾性分析,中位年龄62.5岁(40 ~ 69岁),男性患者7例、女性患者3例,6例是肺癌患者、4例是食管癌患者,肿瘤分期集中在Ⅱ~Ⅳ期,Ⅱ期患者1例、Ⅲ患者8例、Ⅳ患者1例。放射治疗前在荷兰飞利浦公司大孔径Brilliance CT模拟机采集每位患者的4D-CT图像,图像层内像素维度512 × 512,层厚3 mm,实时位置管理系统(real-time positioning management,RPM)收集患者呼吸信号,商用滤波反投影算法重建CT图像,基于相空间的排序算法将CT图像分为10个时相(T00 ~ T90)的4D-CT图像,吸气末和呼气末图像记为T00和T50,利用4D-CT 10个时相重建得到平均CT图像,由高年资物理师确认每位患者4D-CT的图像质量,即最小的运动伪影、能满足靶区勾画和计划设计要求,最后,将4D-CT图像导入Pinnacle3治疗计划系统。
2. 基于CTVI的高功能肺避让计划流程:项目组前期利用50例胸部肿瘤患者的4D-CT和SPECT图像数据,建立了基于深度学习方法的4D-CT肺通气功能图像生成模型[7],与密度改变模型[1, 8]和Jacobian行列式法[9]相比,4D-CT和SPECT高通气功能肺组织结构的相似性指数(dice similarity coefficient,DSC)从0.48和0.29提高到0.83,对于新患者,将4D-CT吸气末和呼气末时相的图像和肺组织结构输入模型即可以合成该患者的CTVI图像,为开展基于CTVI的HVFLA放疗提供保障。
与常规流程不同,避让高功能肺的计划设计基本流程增加了与肺通气功能图像生成系统服务器(Dell,Precision T5600,Intel Xeon® CPU E5-2620 2.0 GHz × 12,GTX GPU 1080Ti)的交互,用于获取功能肺结构,具体包括:①在Pinnacle3治疗计划系统,由放疗科医生在T00和T50图像勾画肺组织,并传输到服务器。②利用Python的程序包pydicom等工具编写数据预处理程序,将DICOM-RT格式数据转化为深度学习网络模型需要的格式;利用Tensorflow和Keras框架构建的深度学习网络模型,将预处理数据输入已经训练好的模型生成4D-CT肺通气功能图像;对生成的图像数据进行数据后处理,即根据肺通气量相对值高低自动将全肺三等分为高、中和低通气功能肺[10](图 1),并转化为DICOM-RT格式数据。③将自动分割的功能肺结构导入Pinnacle3治疗计划系统,在平均CT图像上设计避让高功能肺(high functional lung,HFL)的放疗计划。

|
图 1 4D-CT肺通气功能图像三等分为高、中、低通气功能肺 Figure 1 The 4D-CT ventilation images were divided into three equal regions of high, medium and low ventilation |
3. 计划方案:对于每位患者,由主管医生勾画计划靶区(PGTV和PTV)和危及器官(OARs),OARs包括双肺、脊髓、心脏、气管和食管。2例肺癌靶区PGTV处方剂量60.2 Gy,2.15 Gy/次,共28次、PTV处方剂量50.4 Gy,1.8 Gy/次,共28次,4例肺癌和1例食管癌靶区PTV处方剂量60 Gy,2 Gy/次,共30次,3例食管癌靶区PGTV处方剂量59.92 Gy,2.14 Gy/次,共28次、PTV处方剂量50.4 Gy,1.8 Gy/次,共28次。危及器官的剂量限值包括:双肺至少受到5、20和30 Gy相对体积的限值(V5 < 60%、V20 < 28%、V30 < 20%)、平均剂量Dmean < 20 Gy,心脏至少受到30和40 Gy的相对体积的限值(V30 < 40%、V40 < 30%),脊髓的最大剂量Dmax < 40 Gy,脊髓+5 mm的最大剂量Dmax < 45 Gy,气管的最大剂量Dmax < 80 Gy,食管至少受到50 Gy相对体积的限值(V50 < 40%),肺癌和食管癌靶区处方剂量模式不同,危及器官剂量限值要求参考正常组织临床效应定量分析(quantitative analysis of normal tissue effects in the clinic,QUANTEC)[11]和科室标准。
根据靶区处方剂量和危及器官的剂量限值要求,采用容积旋转调强(volumetric modulated radiotherapy,VMAT)技术,分别设计临床计划和HVFLA计划,两个计划VMAT射野的数量和参数(起始范围、控制点间隔、最大投照时间、最大迭代次数、卷积迭代次数和容差)均相同,而HVFLA计划增加限制高功能肺剂量的优化条件(V5、V10、V20、V30和平均剂量Dmean),要求每个计划均满足靶临床要求,计划设计完成后,导出每个计划的剂量体积直方图(dose volume histogram,DVH)。
4. 计划评价指标和统计学:通过比较靶区、危及器官(双肺,心脏,脊髓)和高功能肺的剂量学参数评价计划。靶区的评价指标包括D2、D98和Dmean,即包围靶区体积的2%、98%的最小剂量和平均剂量。OARs和高功能肺的评价指标参考国际辐射单位与测量委员会(ICRU)83号报告[12],包括双肺和高功能肺至少受到5、10、20和30 Gy的相对体积(V5、V10、V20和V30)和平均剂量Dmean,脊髓和脊髓PRV的最大剂量D1 cm3,心脏至少受到30和40 Gy的体积(V30和V40)和平均剂量Dmean。
5. 统计学处理:数据用x±s表示。采用SPSS 23软件进行统计学分析。利用双侧配对t检验的方法对两组计划的剂量学差异。P < 0.05为差异有统计学意义。
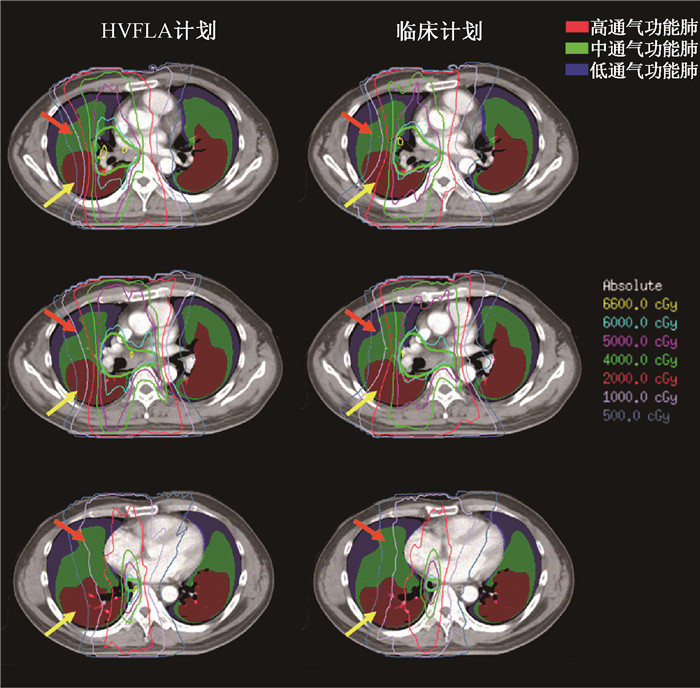
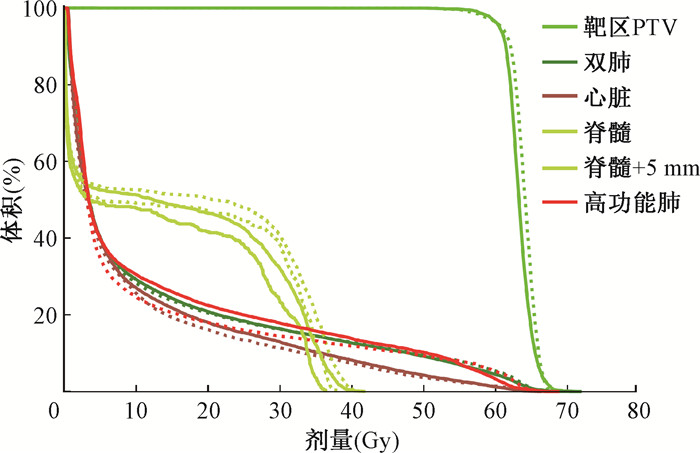
结果1. HVFLA计划剂量分布和DVH的比较:图 2和图 3是1例临床计划和HVFLA计划剂量分布和DVH的比较,可以看出HVFLA计划的高功能肺保护的更好(图 2中黄色箭头指示区域),中低功能肺区域受照剂量要略高(图 2中橙色箭头指示区域),双肺受照剂量两者相当。
|
注:黄色箭头示意高功能肺区域剂量对比,红色箭头示意中、低功能肺区域剂量对比 图 2 典型病例的临床计划和HVFLA计划剂量分布比较 Figure 2 Comparison of dose distributions between clinical plan and HVFLA plan for a case |
|
注:实线为临床计划;虚线为高通气功能肺避让(HVFLA)计划 图 3 典型病例的临床计划和HVFLA计划DVH比较 Figure 3 Comparison of dose-volume histogram (DVH) between clinical plan and HVFLA plan for a typical case |
2. 临床计划和HVFLA计划靶区和危及器官结果:表 1是临床计划和HVFLA计划靶区和危及器官统计分析结果,10例患者靶区处方剂量和危及器官剂量限值均满足临床要求。与临床计划相比,HVFLA计划的靶区PGTV的D2、D98和Dmean,靶区PTV的D2和Dmean差异具有统计学意义(t=5.30、-2.57、3.60、3.95、2.29,P < 0.05),平均分别增加0.5、-0.2、0.2、0.5和0.1 Gy。与临床计划相比,HVFLA计划的高功能肺V5、V10、V20、V30和Dmean均显著降低(t=-4.02、-6.02、-7.06、-6.77、-8.07,P < 0.05),平均分别减少5.9%,4.2%,2.6%,2.3%和1.2 Gy;双肺V5、V10、V20、V30和Dmean差异无统计学意义(P>0.05);心脏V30、V40和Dmean差异无统计学意义(P>0.05);脊髓D1 cm3差异无统计学意义(P>0.05);脊髓PRV的D1 cm3显著增加(t=2.54,P < 0.05),平均增加0.7 Gy。
|
|
表 1 临床计划和HVFLA计划靶区和危及器官统计结果(x±s) Table 1 Statistical results of PTV and OARs for clinical plans and HVFLA plans(x±s) |
讨论
功能肺避让临床试验的基本思路是降低功能肺的受照剂量,这可以降低放射性肺炎的发生概率[1-5]。本研究可以为胸部肿瘤患者开展保护功能肺的放疗临床试验提供技术支持,在前瞻性试验中,生成4D-CT肺通气功能图像的准确性和效率至关重要,本研究利用深度学习方法生成的4D-CT肺通气功能图像为精准高效设计HVFLA计划提供保障。
在临床计划与HVFLA计划均采用相同的照射技术、射野参数和优化参数的情况下,HVFLA计划增加对高功能肺的保护(即增加V5、V10、V20、V30和平均剂量的优化条件),实验结果表明:①临床计划和HVFLA计划均可以满足靶区和危及器官剂量限制要求。②HVFLA计划可以显著降低高功能肺的受照剂量。③双肺、心脏和脊髓受照剂量均无显著变化。④由于双肺的受照剂量无显著差别,说明HVFLA计划主要改变的是双肺内的剂量分布,即高功能区剂量降低了,而中、低功能区的剂量增加了。
以往研究均采用的是解析法,如密度改变模型[1, 8]和Jacobian行列式法[9]生成4D-CT肺通气功能图像并融入放疗流程[13],本研究是利用深度学习方法生成4D-CT肺通气功能图像并融入放疗流程,与解析法相比,深度学习方法具有两个方面的优势:①不依赖于变形配准算法,准确性显著提高,如前所述4D-CT和金标准SPECT高通气功能肺结构的DSC值从0.48和0.29提高到0.83[7]。②获取肺通气功能图像的时间明显缩短,时间从15~145 s缩短到不到1 s[7, 14]。因此,为精确高效开展HVFLA放疗提供保障。
将肺通气功能融入放疗计划设计的方法主要包括两种:①基于结构的方法(structure-based approach,SBA)[13, 15]。②基于图像的方法(image-based approach,IBA)[16]。SBA方法是基于肺通气功能图像生成一个功能避让的结构,通过增加功能避让结构的约束条件实现计划设计,它适用于任何商用计划系统、可以忽略图像像素强度的小波动而主要关注一个区域(如高功能区);IBA方法是直接将肺通气功能图像融入优化算法实现计划设计,它依赖计划系统、要求更高的编程基础、考虑图像像素强度的全部信息。由于4D-CT肺通气功能图像与金标准之间的像素级相关性无法做到完全相同,本研究采用的是SBA方法实现HVFLA计划,即通过从肺通气功能图像中自动生成高功能肺避让结构,增加高功能肺避让结构的约束条件实现计划设计。
进一步,从计划质量角度看,本研究中HVFLA计划的HFL结构平均剂量显著减少1.2 Gy,V5~V30平均显著减少2.3% ~ 5.9%。Waxweiler等[13]报道的HFL结构平均剂量显著减少2.8 Gy,V5~V30平均显著减少1.6%~14.9%。与此相比,本研究结果平均减少的幅度偏小,差别主要来源可能包括:①生成4D-CT肺通气功能图像的方法不同。②高功能肺避让结构的生成方法不同。本研究是参考Yamamoto等[10]的方法,即根据肺通气量相对值高低进行三等分,自动提取大于1/3最大通气值的区域作为高通气功能区域;而Waxweiler等[13]采用15%最大通气值作为阈值生成高通气功能区域,阈值的选择更加依赖未来临床试验的结果。③肿瘤类型和处方剂量不同。本研究既包括肺癌也包括食管癌,处方剂量分布在50 ~ 60 Gy;Waxweiler等[13]的研究只包括Ⅲ期的肺癌,中位处方剂量40 Gy。④临床计划中对双肺的限制程度不同。但是,本研究和以往文献报道的HFL结构受照剂量显著降低的整体趋势相同,HVFLA放疗计划设计的策略是可行的,尽管最终的放疗计划临床策略还是要依据危及器官的副反应研究,但HFL结构受照剂量的显著降低预期可以为胸部肿瘤患者开展HVFLA放疗提供有价值的指导。
HVFLA计划也存在一定的局限性:一方面,靶区的D2和Dmean有增加,D98有降低,说明靶区均匀性变差了;另一方面,有可能增加靶区周边其他危及器官的受照剂量,比如本研究的脊髓PRV的D1 cm3显著增加了0.7 Gy。但是,本研究的设计思路是要求HVFLA计划的靶区和危及器官均满足临床处方剂量和剂量限制要求,以此为前提,尽量限制HFL结构的剂量,可以很大程度上避免对其他危及器官增加不必要的剂量,比如本研究中双肺、心脏和脊髓的受照剂量并没有看到有显著的变化。
综上,本研究建立了基于4D-CT肺通气功能图像的胸部肿瘤高功能避让的放疗计划设计流程,可自动化获取功能肺结构,实现HVFLA放疗计划设计,计划质量可以满足临床要求并且显著降低高功能肺的受照剂量,HVFLA放疗计划策略可行,为胸部肿瘤开展HVFLA计划提供了保障。
利益冲突 无
作者贡献声明 刘志强负责数据收集和整理、数据分析和论文撰写;田源负责数据收集、实验设计、论文修改;门阔负责实验指导、论文修改;戴建荣负责实验设计和指导、论文修改
| [1] |
Vinogradskiy Y, Castillo R, Castillo E, et al. Use of 4-dimensional computed tomography-based ventilation imaging to correlate lung dose and function with clinical outcomes[J]. Int J Radiat Oncol Biol Phys, 2013, 86(2): 366-371. DOI:10.1016/j.ijrobp.2013.01.004 |
| [2] |
Faught AM, Miyasaka Y, Kadoya N, et al. Evaluating the toxicity reduction with computed tomographic ventilation functional avoidance radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2017, 99(2): 325-333. DOI:10.1016/j.ijrobp.2017.04.024 |
| [3] |
Lind PA, Marks LB, Hollis D, et al. Receiver operating characteristic curves to assess predictors of radiation-induced symptomatic lung injury[J]. Int J Radiat Oncol Biol Phys, 2002, 54(2): 340-347. DOI:10.1016/s0360-3016(02)02932-2 |
| [4] |
Lan F, Jeudy J, Senan S, et al. Should regional ventilation function be considered during radiation treatment planning to prevent radiation-induced complications?[J]. Med Phys, 2016, 43(9): 5072. DOI:10.1118/1.4960367 |
| [5] |
Abratt RP, Willcox PA, Smith JA. Lung cancer in patients with borderline lung functions——zonal lung perfusion scans at presentation and lung function after high dose irradiation[J]. Radiother Oncol, 1990, 19(4): 317-322. DOI:10.1016/0167-8140(90)90031-q |
| [6] |
Guerrero T, Sanders K, Castillo E, et al. Dynamic ventilation imaging from four-dimensional computed tomography[J]. Phys Med Biol, 2006, 51(4): 777-791. DOI:10.1088/0031-9155/51/4/002 |
| [7] |
Liu Z, Miao J, Huang P, et al. A deep learning method for producing ventilation images from 4DCT: First comparison with technegas SPECT ventilation[J]. Med Phys, 2020, 47(3): 1249-1257. DOI:10.1002/mp.14004 |
| [8] |
Castillo R, Castillo E, Martinez J, et al. Ventilation from four-dimensional computed tomography: density versus Jacobian methods[J]. Phys Med Biol, 2010, 55(16): 4661-4685. DOI:10.1088/0031-9155/55/16/004 |
| [9] |
Reinhardt JM, Ding K, Cao K, et al. Registration-based estimates of local lung tissue expansion compared to xenon CT measures of specific ventilation[J]. Med Image Anal, 2008, 12(6): 752-763. DOI:10.1016/j.media.2008.03.007 |
| [10] |
Yamamoto T, Kabus S, von Berg J, et al. Reproducibility of four-dimensional computed tomography-based lung ventilation imaging[J]. Acad Radiol, 2012, 19(12): 1554-1565. DOI:10.1016/j.acra.2012.07.006 |
| [11] |
Marks LB, Yorke ED, Jackson A, et al. Use of normal tissue complication probability models in the clinic[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S10-19. DOI:10.1016/j.ijrobp.2009.07.1754 |
| [12] |
International Commission on Radiation Units & Measurements. Prescribing, recording, and reporting photon-beam intensity-modulated radiation therapy (IMRT): contents[J]. J ICRU, 2010, 10(1): 1-3. DOI:10.1093/jicru_ndq002 |
| [13] |
Waxweiler T, Schubert L, Diot Q, et al. A complete 4DCT-ventilation functional avoidance virtual trial: Developing strategies for prospective clinical trials[J]. J Appl Clin Med Phys, 2017, 18(3): 144-152. DOI:10.1002/acm2.12086 |
| [14] |
Tian Y, Miao J, Liu Z, et al. Availability of a simplified lung ventilation imaging algorithm based on four-dimensional computed tomography[J]. Phys Med, 2019, 65: 53-58. DOI:10.1016/j.ejmp.2019.08.006 |
| [15] |
Yamamoto T, Kabus S, von Berg J, et al. Impact of four-dimensional computed tomography pulmonary ventilation imaging-based functional avoidance for lung cancer radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2011, 79(1): 279-288. DOI:10.1016/j.ijrobp.2010.02.008 |
| [16] |
St-Hilaire J, Lavoie C, Dagnault A, et al. Functional avoidance of lung in plan optimization with an aperture-based inverse planning system[J]. Radiother Oncol, 2011, 100(3): 390-395. DOI:10.1016/j.radonc.2011.09.003 |
 2024, Vol. 44
2024, Vol. 44


