电离辐射(IR)杀伤肿瘤细胞是肿瘤治疗的常规方法之一[1]。当辐射剂量超过生物组织的耐受限度时,正常组织也会受到损伤,而骨髓对此尤为敏感[2]。骨髓中的造血干细胞(HSC)是机体造血的“种子细胞”,辐照后的HSC损伤是骨髓造血功能障碍发生的根本原因[3]。睡眠作为人体的重要生理过程,是机体修复受损组织并恢复其功能的重要时期[4]。约70%的放疗患者会经历由生理或心理症状引发的睡眠障碍(SD)[5]。然而,关于SD对IR后HSC影响的研究目前还非常有限。本研究通过建立小鼠IR损伤后的SD模型,分析了SD对照后HSC损伤与恢复的作用并探讨具体机制,旨在提供关于SD与IR后HSC损伤与恢复之间关系的科学依据。
材料与方法1. 主要仪器和试剂:外周血细胞分析液购自日本Sysmex公司;多功能酶标仪购自瑞士Mannedorf公司;qRT-PCR仪购自美国Bio-Rad公司;小鼠Lineage、Sca-1、c-kit、CD150、CD48、NOX2流式抗体及固定破膜缓冲液试剂盒购自美国赛默飞世尔公司;活性氧探针(DCHF-DA)、线粒体活氧探计(MitoSOX)、磷脂结合蛋白V(Annexin V)凋亡试剂盒、烟酰胺腺嘌呤二核苷酸磷酸(NADP+/NADPH)检测试剂盒、谷胱甘肽(GSSG/GSH)检测试剂盒均购于上海碧云天公司;微量RNA抽提试剂盒购自德国Qiagen公司;反转录试剂盒、qRT-PCR试剂盒购自日本TaKaRa公司;PCR引物购自北京擎科生物科技公司;N-乙酰半胱氨酸(NAC)、烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NOX2)抑制剂(GSK2795039)购买自美国MCE公司;半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)试剂盒购自美国ImmunoChemistry生物科技公司。
2. 动物照射条件、分组及模型建立:本实验中小鼠电离辐射采用陆军军医大学辐照实验中心,60Co放射源γ射线全身一次性照射小鼠,吸收剂量率50 cGy/min,源皮距1 m;C57BL/6J背景小鼠购于重庆恩斯维尔公司,选用6~8周龄、体重22~24 g的雄性小鼠56只,所有小鼠均饲养于陆军军医大学复合伤研究所无特定病原体(SPF)动物房[动物许可证编号:SCXK(渝)2022-0011],给予洁净垫料、饲料和水维持。由定时开关定时控制房间照明,保证小鼠昼夜正常节律。选用同批小鼠进行耳标编号,根据实验需求,使用随机数表法,将小鼠分为对照组(Con)组、单纯照射组(IR)组、睡眠障碍组(SD)组、照+睡眠障碍组(IR+SD)组、照后睡眠障碍+磷酸盐缓冲液(PBS)组(IR+SD+PBS)组、照后睡眠障碍+ GSK2795039组(IR+SD+GSK)组、照后睡眠障碍+ N-乙酰半胱氨酸组(IR+SD+NAC)组,共7组,每组8只。IR+SD组小鼠在照后立刻放置于睡眠剥夺仪中(南京卡尔文生物科技有限公司),通过仪器底部的自动旋转金属杆干扰小鼠睡眠,金属杆每30 s旋转一圈(旋转间隔时间为1 min),SD过程中小鼠可自由获取食物和水,共计24 h完全睡眠剥夺。IR组在照后也置于仪器内保证相同环境,但不转动金属杆,小鼠能正常休息。IR+SD+GSK组小鼠照后进行GSK2795039腹腔注射(100 mg/kg)1次;IR+SD+NAC组小鼠在照后每天腹腔注射NAC(100 mg/kg);IR+SD+PBS组小鼠同时进行PBS腹腔注射。SD组小鼠在检测前24 h进行完全睡眠剥夺。所有小鼠在实验开始前1周每日接受总共2 h金属杆旋转适应性训练,防止后续SD过程中应激情况发生。
3. 外周血细胞检测:固定鼠尾并消毒,用手术剪剪去鼠尾尖端,用毛细采血管吸取鼠尾静脉血20 μl用280 μl血细胞分析液稀释,在1 h内在血细胞分析仪上检测外周血白细胞(WBC)、红细胞(RBC)、血小板(PLT)等指标。
4. 苏木精和伊红(HE)染色:断颈处死后,分离小鼠的胫骨和股骨并清洗干净,使用10 %甲醛溶液固定72 h。骨骼通过15%乙二胺四乙酸(EDTA)脱钙液脱钙14 d,最后进行脱水。在二甲苯中清洗后浸入石蜡中包埋、切片厚度4 μm。切片在48℃烘箱中烘干,然后用HE进行骨组织染色。
5. 小鼠骨髓单个有核细胞获取:将小鼠脱颈处死后,用外科手术剪和手术镊将小鼠胫骨、股骨和髂骨分离,用1 ml注射器吸取RPMI 1640培养基冲洗至骨髓腔发白,收集含有骨髓细胞的培养基,加入1 ml红细胞裂解液重悬骨髓混合物,3 min后使用3 ml RPMI 1640培养基终止反应,细胞通过70 μm细胞筛进行筛选后,1 ml PBS重悬获得骨髓单细胞悬液。
6. 流式检测及分选:使用100 μl PBS重悬骨髓细胞,分别加入Lineage、Sca-1、c-kit、CD150、CD48等表面分子抗体,分别标记造血祖细胞(MP, Lineage-c-kit-Sca1+),造血干细胞(LSK,Lineage-c-kit+Sca1+),长期造血干细胞(HSC,CD150+CD48-LSK),室温避光孵育30 min,染色结束后使用PBS终止染色,随后使用Sony-ID7000全光谱流式细胞检测仪(日本索尼公司)分析,数据采用Flowjo 10.0分析。DCHF-DA、MitoSOX、NOX2流式检测在上述表明抗体染色后,加入相应探针37℃孵育30 min后PBS终止染色,上机检测。流式细胞分选采用Sony-SH800流式分选仪(日本索尼公司),细胞染色后上机,用含有10%胎牛血清(FBS)的RPMI 1640培养基接受分选得到的细胞。
7. 细胞凋亡、Caspase-1染色检测:骨髓细胞经过上述表面抗体染色后,用100 μl结合液重悬细胞,加入相应浓度磷脂结合蛋白V(Annexin V)、7氨基放线菌素D(7AAD)染色30 min,加入100 μl结合液终止后上机检测。Caspase-1染色在经过表面染色后加入290 μl Caspase-1抑制剂避光孵育1 h,而后使用洗液洗涤细胞,加入碘化丙啶(PI)染色30 min后使用PBS终止,随后上机检测。
8. 细胞周期检测:骨髓细胞经过上述LSK表面抗体染色后,用固定/破膜缓冲液固定30 min,1 ×破膜液洗涤后加入0.25 μl ki67和3 μl Hoechst 33342,避光孵育30 min,1 ×破膜液洗涤3次上机检测。
9. NADP+/NADPH和GSSG/GSH检测:流式分选LSK细胞PBS清洗1次,加入200 μl冰浴预冷的NADP+/NADPH提取液,轻轻吹打使细胞充分裂解,随后12 000 r/min,离心半径8.0 cm,4℃离心10 min,获得NADP+和NADPH总量,取上清60℃水浴30 min分解NADP+,加入G6PDH工作液37℃避光孵育10 min获得NADPH,加入显色液后放入酶标仪检测,在450 nm处测得样本吸光度。NADP+/NADPH=(NADP+和NADPH总量-NADPH)/NADPH。流式分选LSK细胞冰上加入蛋白去除剂得到总的谷胱甘肽,加入GSH清除剂后,得到GSSG,在420 nm处测得样本总的谷胱甘肽和GSSG吸光度(A)值。GSSG/GSH=GSSG/(总的谷胱甘肽-GSSG×2)。
10. 聚合酶链式反应(qRT-PCR)检测:将分选的LSK细胞进行RNA抽提,采用微量RNA抽提试剂盒提取总RNA,反转录试剂盒反转录RNA为cDNA,以cDNA为模板加入对应引物后上机并获得CT值,按照2-ΔΔCt检测方法检测细胞中mRNA表达。引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequence |
11. 统计学处理:使用SPSS 22.0软件对数据进行统计学分析。每组数据均用Shapiro-Wilk进行正态性检验,Levene进行方差齐性检验,两组比较采用独立样本t检验。生存分析采用Kaplan-Meier曲线,两组比较采用Log-rank检验。P<0.05为差异有统计学意义。
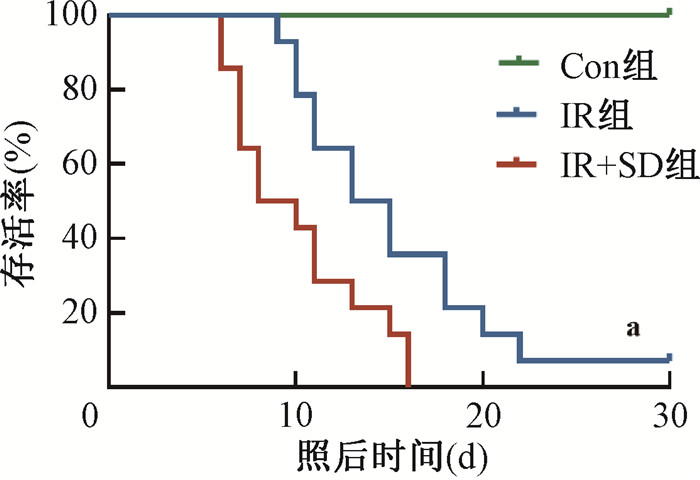
结果1. SD加重IR引发的造血功能障碍:如图 1所示,使用5.0 Gy照射小鼠后发现,IR+SD组小鼠外周血WBC在照后9、12、15、18、21 d恢复速度显著慢于IR组(t=4.66、6.08、6.60、4.46、4.34,P<0.05),PLT在照后恢复速度也显著减慢(t=2.29、6.20、6.37、3.75,P<0.05),但RBC变化不明显(P>0.05)。对骨髓切片HE染色结果显示,照后第15天IR+SD组骨髓细胞数显著减少。当使用7.5 Gy照射小鼠第30天后,IR+ SD组生存率也显著低于IR组(χ2=10.23,P<0.05),见图 2。

|
注:Con组. 对照组;IR组. 单纯照射组;IR+SD组. 照射+睡眠障碍组。a与IR组比较,t=4.66、6.08、6.60、4.46、4.34、2.29、6.20、6.37、3.75,P<0.05 图 1 睡眠障碍对5.0 Gy照后小鼠外周血和骨髓的影响 A. 照后白细胞数;B. 照后红细胞数;C. 照后血小板细胞数;D. 各组骨髓HE染色×20 Figure 1 Effects of sleep disorders on peripheral blood and bone marrow in 5.0 Gy irradiated mice A. WBC count; B. RBC count; C. Platelet count; D. HE stained bone marrow × 20 |
|
注:Con组. 对照组;IR组. 单纯照射组;IR+SD组. 照射+睡眠障碍组。a与IR组同时间比较,χ2=10.23,P<0.05 图 2 7.5 Gy照后小鼠生存曲线 Figure 2 Survival curves of mice after 7.5 Gy irradiation |
2. SD延缓放射损伤造血干祖细胞损伤恢复:选择照后第15天(外周血差异最大)为时间点,检测Con组、IR组和IR+SD组骨髓造血干祖细胞稳态变化。结果显示,相比于IR组,IR+SD组全骨髓细胞数量由(2.14±0.38)×107降至(3.59±0.29)×107(t=8.55,P<0.05)。MP、LSK、HSC的细胞数量也显著降低(t=7.7、11.82、9.08,P<0.05),见表 2。
|
|
表 2 5.0 Gy照后小鼠骨髓造血干祖细胞数量变化(x±s) Table 2 Changes in the number of mouse bone marrow hematopoietic stem/progenitor cells after 5.0 Gy irradiation(x±s) |
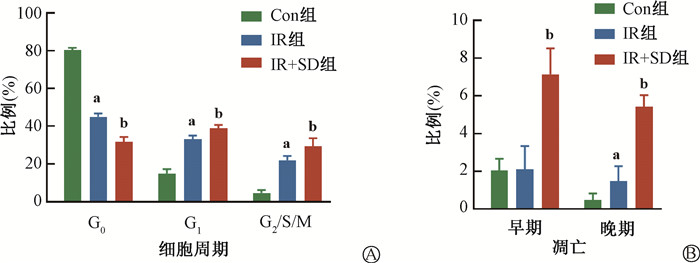
3. SD加重IR后LSK稳态破坏和凋亡:为了进一步揭示SD加重照后LSK损伤恢复的发生原因,流式细胞术检测IR组和IR+SD组的LSK细胞周期。由图 3可见,SD导致照后HSC的G0期比例进一步降低,而G1和G2/S/M期比例进一步上升(t=11.86、6.02、4.47,P<0.05),表明SD进一步破坏了照后LSK静止状态。接下来检测SD对照后LSK凋亡的影响,结果表明,LSK早期凋亡(Annexin V-7AAD+)比例与晚期凋亡(Annexin V+7AAD+)比例在IR+SD组均显著增加(t=7.71、11.02,P<0.05)。
|
注:Con组. 对照组;IR组. 单纯照射组;IR+SD组. 照射+睡眠障碍组。a与Con组比较,t=45.15、16.53、18.42、3.16,P<0.05;b与IR组比较,t=11.86、6.02、4.47、7.71、11.02,P<0.05 图 3 照射后第15天骨髓造血干细胞的细胞周期和凋亡 A. LSK细胞周期;B. LSK早期和晚期凋亡比例 Figure 3 Cell cycle and apoptosis of hematopoietic stem cells in bone marrow 15 days after irradiation A.Cell cycle of LSK cells; B. Proportion of early and late apoptosis in LSK cells |
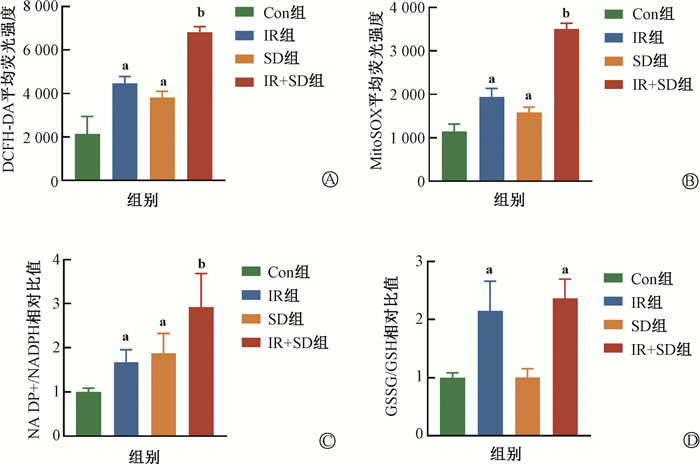
4. SD通过诱导线粒体ROS产生而加重LSK损伤:使用DCFH-DA检测LSK内ROS水平,结果示于图 4,与IR组相比,IR+SD组DCFH-DA平均荧光强度显著增加(6 827±250 vs. 4 472±313, t=16.62,P<0.05)。使用MitoSOX检测LSK内线粒体ROS变化,发现IR+SD组MitoSOX平均荧光强度进一步增加(3 510±125 vs. 1 944±194, t=19.19,P<0.05)。介导线粒体氧化应激关键酶烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和谷胱甘肽(GSH)系统检测结果显示,IR+SD组NADP+/HADPH值进一步升高(2.92±0.29 vs. 1.67±0.76, t=3.77,P<0.05)而GSSG/GSH值差异无统计学意义(P>0.05)。
|
注:Con组. 对照组;IR组. 单纯照射组;IR+SD组. 照射+睡眠障碍组。a与Con组比较,t=7.68、5.64、8.77、5.99、5.40、4.62、5.47、9.81,P<0.05;b与IR组比较,t=16.62、19.19、3.77,P<0.05 图 4 照射后骨髓造血干细胞氧化应激相关指标 A. DCFH-DA平均荧光强度;B. MitoSOX平均荧光强度;C. NADP+/NADPH相对比值;D. GSSG/GSH相对比值 Figure 4 Post-irradiation oxidative stress-related indices of hematopoietic stem cells in bone marrow A. Average fluorescence intensity of DCFH-DA; B. Average fluorescence intensity of MitoSOX; C. NADP+/NADPH ratio; D. GSSG/GSH ratio |
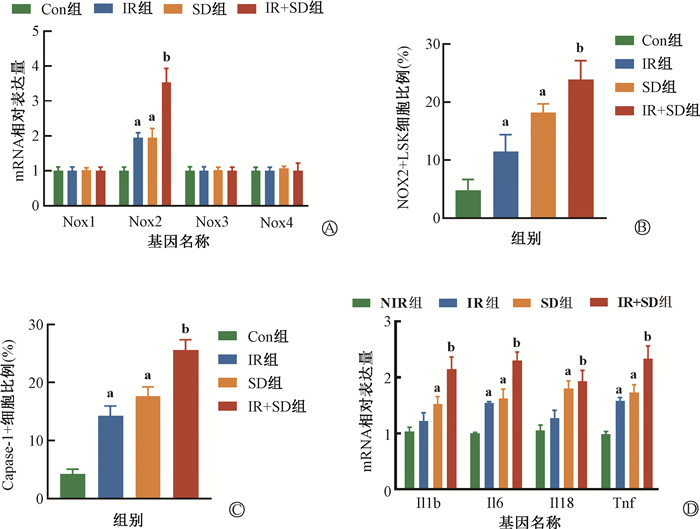
5. SD诱导照后造血干细胞NOX2上调增加ROS水平:IR+SD组LSK中NOX2表达进一步升高(t=6.43,P<0.05),而NOX1、NOX3、NOX4差异无统计学意义(P>0.05)。流式检测结果进一步证实,LSK内NOX2在IR+SD组进一步升高(23.87%±3.23% vs. 11.48%±2.93%, t=6.95,P<0.05),提示NOX2可能是SD诱导照后LSK线粒体ROS生成增多的主要原因。采用Caspase-1染色结果表明,IR+SD组中Caspase-1+LSK比例显著增加(25.60%±1.77% vs. 14.25%±1.70%, t=11.33,P<0.05);检测Caspase-1下游IL-1β、IL-6、IL-18、TNF-α等炎症因子mRNA表达水平,结果显示,IR+SD组上述炎症因子表达均显著上调(t=6.01、8.39、4.91、5.56,P<0.05),见图 5。
|
注:Con组. 对照组;IR组. 单纯照射组;IR+SD组. 照射+睡眠障碍组。a与Con组比较,t=9.11、5.74、4.68、13.47、12.89、18.21、27.82、14.07、5.47、6.43、7.84、9.03、P<0.05;b与IR组比较,t==6.43、6.95、11.33、6.01、8.39、4.91、5.56,P<0.05 图 5 照射后骨髓造血干细胞NOX2及炎症通路检测 A. NOX1-4的mRNA相对表达量;B. NOX2的表达水平;C. LSK中Caspase-1+细胞比例;D. LSK细胞炎症因子mRNA相对表达量 Figure 5 Detection of NOX2 and inflammatory pathways in hematopoietic stem cells in bone marrow after irradiation A. Relative mRNA expression of NOX1-4 in LSK cells; B. Expression level of NOX2 in LSK cells; C. Proportion of Caspase-1+ cells in LSK cells; D. Relative expression of mRNA inflammatory factor in LSK cells |
6. 抑制NOX2-ROS可以缓解SD对照后加重LSK损伤的影响作用:结果示于图 6,与IR+SD+PBS组相比,IR+SD+GSK组NOX2表达显著降低(t=15.82,P<0.05);IR+SD+GSK组ROS和线粒体ROS水平显著下降(t=16.15、10.86,P<0.05);IL-1β、IL-6、IL-18、TNF-α的mRNA水平显著下调(t=6.69、9.30、5.45、6.94,P<0.05);Caspase-1+细胞比例在IR+SD+GSK组中显著降低(t=9.24,P<0.05)。进一步对骨髓LSK细胞数量检测结果表明,骨髓LSK细胞数量显著上升(0.27±0.06)×105 vs. (0.15±0.04)×105, t=3.92,P<0.05)。此外,使用抗氧化剂NAC清除细胞内ROS,结果显示清除ROS可以抑制下游炎症凋亡通路促进骨髓造血恢复。
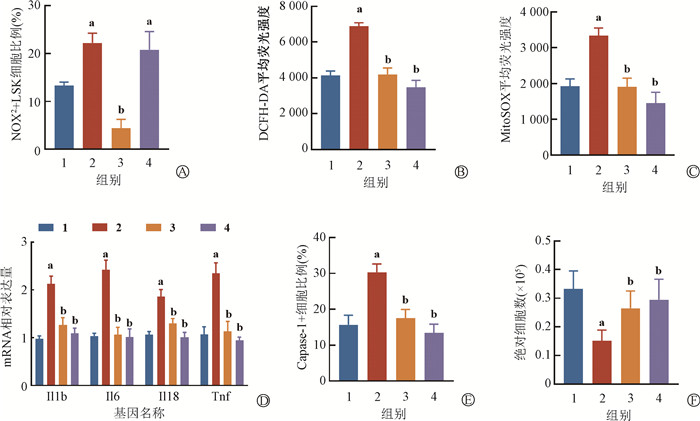
|
注:1. IR组;2. IR+SD+PBS组;3. IR+SD+GSK组;4. IR+SD+NAC组。a与IR组比较,t=10.16、4.74、21.32、12.04、11.53、11.48、8.52、8.19、10.06、5.98,P<0.05;b与IR+SD+PBS组比较,t=15.82、16.15、18.95、10.86、12.61、6.69、9.30、5.45、6.94、9.25、9.29、8.12、10.55、9.24、12.33、3.92、4.37,P<0.05 图 6 GSK和NAC对照射后SD小鼠的治疗效果 A. NOX2表达水平;B. DCFH-DA平均荧光强度;C. MitoSOX平均荧光强度;D.LSK细胞炎症因子mRNA相对表达量;E. Caspase-1+细胞比例;F. LSK细胞数量 Figure 6 Efficacy of GSK and NAC for mice post-irradiation SD A. Expression level of NOX2; B. Average fluorescence intensity of DCFH-DA; C. Average fluorescence intensity of MitoSOX; D. Relative mRNA expression of inflammatory factor in LSK cells; E. Propertion of Caspase-1+ cells; F. Number of LSK cells |
讨论
IR引发骨髓造血损伤是患者死亡的重要原因之一,也是临床放疗患者面临的造血系统主要并发症[6]。而随着社会进步和生活习惯的变化,睡眠障碍的问题日益突出,特别是放疗后的肿瘤患者常因机体疼痛和环境心理因素等原因出现睡眠障碍[7-8]。Rolls等[9]在小鼠SD模型中观察到HSC移植后嵌合率显著降低,提示睡眠可能是影响HSC损伤与修复的重要因素之一。为此,本研究建立了小鼠IR后的SD模型,观察到小鼠外周血白细胞和血小板的恢复速度明显下降。同时,小鼠全骨髓细胞数量以及骨髓中HSC数量也显著下降,表明SD会影响照后的造血恢复。目前,对肿瘤患者而言,在提高放疗疗效的同时,解决由于放疗后睡眠障碍带来的造血损伤是保证患者预后的关键问题。
IR诱导产生的大量活性氧(ROS)是细胞损伤的主要效应分子[10]。在本研究中,IR后小鼠骨髓HSC的ROS显著增加,这与报道一致。稳态条件下,HSC处在骨髓“龛”内并维持相对较低的ROS水平,IR后高水平的ROS是促进HSC损伤的重要因素[11-12]。另一方面,Vaccaro等[13]观察到果蝇SD后在肠道内产生大量ROS会导致机体死亡。本研究发现SD也导致HSC中的ROS水平增加,在IR介导的骨髓损伤中,大量氧自由基增多会进一步加重IR诱导的损伤。同时,本研究发现HSC内线粒体来源的ROS大量增加,说明线粒体氧化应激导致ROS生成增加是IR情况下SD诱导ROS升高的重要原因。这些线粒体来源的ROS进一步导致细胞代谢水平的改变,最终导致细胞损伤或死亡。Xian等[14]研究发现,ROS会增加线粒体DNA(mtDNA)的大量释放,而mtDNA会通过线粒体膜通透性转换孔(mPTP)进入胞质激活NOD样受体热蛋白结构域相关蛋白3(NLRP3)和环状GMP-AMP合成酶(cGAS),从而引发细胞炎症因子释放以及细胞死亡。表明升高的ROS以及其他炎症因子的激活是照后SD损伤HSC的关键。
在HSC能量代谢的过程中,NADPH和GSH系统发挥着重要的作用[15-16]。本研究发现SD引起照后HSC内NADP+大量产生而不是GSSG,表明ROS的主要源自NADPH的氧化。NADPH的氧化过程将产生NADP+和ROS,这一过程主要依赖于NADPH氧化酶(NOX)的参与[17]。事实上,NADPH氧化酶是胞内催化产生ROS的氧化还原酶,也是线粒体ROS产生的重要靶点,其家族成员包括NOX1-5、DUOX1和DUOX2等[18]。研究表明,HSC表达以NOX2为主的NOX家族基因,并且可以催化产生线粒体ROS[19],这与本研究的结果一致。此外,Kröller-schön等[20]发现SD可以进一步激活NOX2,并增加血管和大脑的ROS水平,引发心血管功能障碍,提示SD诱导的细胞损伤与NOX产生的ROS关系密切。本研究结果也证实,SD显著上调了IR后小鼠HSC内的NOX2,在使用NOX2特异性抑制剂后,SD产生的ROS显著减少,HSC数量也显著恢复。
Caspase-1是炎症小体对下游招募活化过程中最主要的半胱氨酸蛋白酶之一,不同的内源性或外源性信号可以激活不同的炎症小体,引发下游连锁反应最终导致细胞损伤[21]。本研究中,SD可以通过NOX2-ROS的上调激活Caspase-1,促进成熟的IL-1β和IL-18释放,从而促进炎症反应和细胞损伤,这与Abdelbaset-Ismail等[22]报道一致。值得注意的是,当使用NOX2抑制剂GSK2795039后,小鼠造血系统中的IL-1β、IL-6、IL-18、TNF-α等炎性指标的表达水平均显著下降,ROS和线粒体来源ROS水平均降低,HSC的数量也得到恢复。为了进一步验证ROS的来源及损伤作用,本研究使用抗氧化剂NAC挽救HSC损伤,结果表明NAC能抑制HSC下游炎症水平并恢复细胞数量,这与之前的报道一致[23]。然而,本研究观察到使用NAC并不能抑制NOX2的激活,这表明NOX2/ROS/Caspase-1轴激活可能是IR后SD导致HSC损伤加重的关键。尽管本研究结果提示SD后Caspase-1升高,但根据目前报道,Caspase家族的其他成员也能响应损伤应激的激活[24]。目前,Caspase-1激活的具体机制还有待进一步的研究,同时小鼠HSC中的NOX2通过何种原因表达上调也还需要进一步探索。
综上,本研究通过建立小鼠IR后的SD模型,发现了SD可以加重IR诱导的骨髓造血干细胞损伤,显著抑制IR后的造血系统恢复。同时,进一步发现SD可能通过激活NOX2-ROS-Caspase-1轴使细胞内炎症因子水平和ROS水平升高,从而促进细胞损伤,最终抑制骨髓造血恢复。本研究为放疗患者因睡眠障碍引起的造血损伤提供了潜在的治疗靶点。
利益冲突 无
作者贡献声明 孙康傅负责研究设计、实验操作与论文撰写;杨礼璟参与实验操作及统计分析;付泽宇、徐百川参与实验操作;陈石磊指导论文修改;王军平提供研究思路及指导论文修改
| [1] |
Lei G, Zhang Y, Koppula P, et al. The role of ferroptosis in ionizing radiation-induced cell death and tumor suppression[J]. Cell Res, 2020, 30(2): 146-162. DOI:10.1038/s41422-019-0263-3 |
| [2] |
高雅萌, 赵珂, 赵雄伟, 等. 胎肝及骨髓来源造血干/祖细胞电离辐射敏感性的比较研究[J]. 中华放射医学与防护杂志, 2023, 43(8): 588-594. Gao YM, Zhao K, Zhao XW, et al. Comparative study on ionizing radiation sensitivity of hematopoietic stem/progenitor cells derived from fetal liver and bone marrow[J]. Chin J Radiol Prot, 2023, 43(8): 588-594. DOI:10.3760/cma.j.cn112271-20230427-00132 |
| [3] |
Hu M, Lu Y, Qi Y, et al. SRC-3 functions as a coactivator of t-bet by regulating the maturation and antitumor activity of natural killer cells[J]. Cancer Immunol Res, 2020, 8(9): 1150-1162. DOI:10.1158/2326-6066.CIR-20-0181 |
| [4] |
McAlpine CS, Kiss MG, Rattik S, et al. Sleep modulates haematopoiesis and protects against atherosclerosis[J]. Nature, 2019, 566(7744): 383-387. DOI:10.1038/s41586-019-0948-2 |
| [5] |
Anafi RC, Kayser MS, Raizen DM. Exploring phylogeny to find the function of sleep[J]. Nat Rev Neurosci, 2019, 20(2): 109-116. DOI:10.1038/s41583-018-0098-9 |
| [6] |
李蓉, 李百龙, 谢向东, 等. 核与辐射应急情况下人员体表放射性污染控制水平应用探讨[J]. 中华放射医学与防护杂志, 2023, 43(3): 222-227. Li R, Li BL, Xie XD, et al. Exploration of the application of radioactive pollution control level on personnel surface in nuclear and radiation emergency situations[J]. Chin J Radiol Prot, 2023, 43(3): 222-227. DOI:10.3760/cma.j.cn112271-20221025-00419 |
| [7] |
Enferadi M. Can nocturnal sleep after radiation therapy enhance treatment efficiency?[J]. Med Hypotheses, 2023, 176: 111083. DOI:10.1016/j.mehy.2023.111083 |
| [8] |
Mogavero MP, DelRosso LM, Fanfulla F, et al. Sleep disorders and cancer: State of the art and future perspectives[J]. Sleep Med Rev, 2021, 56: 101409. DOI:10.1016/j.smrv.2020.101409 |
| [9] |
Rolls A, Pang WW, Ibarra I, et al. Sleep disruption impairs haematopoietic stem cell transplantation in mice[J]. Nat Commun, 2015, 6: 8516. DOI:10.1038/ncomms9516 |
| [10] |
Hayman TJ, Baro M, MacNeil T, et al. STING enhances cell death through regulation of reactive oxygen species and DNA damage[J]. Nat Commun, 2021, 12(1): 2327. DOI:10.1038/s41467-021-22572-8 |
| [11] |
Lu Y, Yang L, Shen M, et al. Tespa1 facilitates hematopoietic and leukemic stem cell maintenance by restricting c-Myc degradation[J]. Leukemia, 2023, 37(5): 1039-1047. DOI:10.1038/s41375-023-01880-6 |
| [12] |
Hu M, Chen N, Chen M, et al. Transcription factor Nkx2-3 maintains the self-renewal of hematopoietic stem cells by regulating mitophagy[J]. Leukemia, 2023, 37(6): 1361-1374. DOI:10.1038/s41375-023-01907-y |
| [13] |
Vaccaro A, Kaplan Dor Y, Nambara K, et al. Sleep loss can cause death through accumulation of reactive oxygen species in the gut[J]. Cell, 2020, 181(6): 1307-1328.e15. DOI:10.1016/j.cell.2020.04.049 |
| [14] |
Xian H, Watari K, Sanchez-Lopez E, et al. Oxidized DNA fragments exit mitochondria via mPTP- and VDAC-dependent channels to activate NLRP3 inflammasome and interferon signaling[J]. Immunity, 2022, 55(8): 1370-1385. DOI:10.1016/j.immuni.2022.06.007 |
| [15] |
Prieto-Bermejo R, Romo-González M, Pérez-Fernández A, et al. Cyba-deficient mice display an increase in hematopoietic stem cells and an overproduction of immunoglobulins[J]. Haematologica, 2021, 106(1): 142-153. DOI:10.3324/haematol.2019.233064 |
| [16] |
Liu C, Liao W, Chen J, et al. Cholesterol confers ferroptosis resistance onto myeloid-biased hematopoietic stem cells and prevents irradiation-induced myelosuppression[J]. Redox Biol, 2023, 62: 102661. DOI:10.1016/j.redox.2023.102661 |
| [17] |
Adane B, Ye H, Khan N, et al. The hematopoietic oxidase NOX2 regulates self-renewal of leukemic stem cells[J]. Cell Rep, 2019, 27(1): 238-254. DOI:10.1016/j.redox.2023.102661 |
| [18] |
Prieto-Bermejo R, Romo-González M, Pérez-Fernández A, et al. Reactive oxygen species in haematopoiesis: leukaemic cells take a walk on the wild side[J]. J Exp Clin Cancer Res, 2018, 37(1): 125. DOI:10.1186/s13046-018-0797-0 |
| [19] |
Kamila bujko MAAA. Novel evidence that NADPH oxidase 2(Nox-2) enhances trafficking of hematopoietic stem progenitor cells (HSPCs) by involving ROS mediated activation of NLRP3 inflammasome.[J]. Blood, 2022, 140: 11397. DOI:10.1182/blood-2022-159672 |
| [20] |
Kröller-Schön S, Daiber A, Steven S, et al. Crucial role for Nox2 and sleep deprivation in aircraft noise-induced vascular and cerebral oxidative stress, inflammation, and gene regulation[J]. Eur Heart J, 2018, 39(38): 3528-3539. DOI:10.1093/eurheartj/ehy333 |
| [21] |
Zhao N, Chen QG, Chen X, et al. Intestinal dysbiosis mediates cognitive impairment via the intestine and brain NLRP3 inflammasome activation in chronic sleep deprivation[J]. Brain Behav Immun, 2023, 108: 98-117. DOI:10.1016/j.bbi.2022.11.013 |
| [22] |
Abdelbaset-Ismail A, Ciechanowicz AK, Bujko K, et al. The Nox2-ROS-Nlrp3 inflammasome signaling stimulates in the hematopoietic stem/progenitor cells lipogenesis to facilitate membrane lipid raft formation[J]. Stem Cell Rev Rep, 2023, 19(1): 92-103. DOI:10.1007/s12015-022-10481-2 |
| [23] |
Sang D, Lin K, Yang Y, et al. Prolonged sleep deprivation induces a cytokine-storm-like syndrome in mammals[J]. Cell, 2023, 186(25): 5500-5516.e21. DOI:10.1016/j.cell.2023.10.025 |
| [24] |
Rahmanian N, Hosseinimehr SJ, Khalaj A. The paradox role of caspase cascade in ionizing radiation therapy[J]. J Biomed Sci, 2016, 23(1): 88. DOI:10.1186/s12929-016-0306-8 |
 2024, Vol. 44
2024, Vol. 44


