2. 浙南放射医学与核技术应用研究院, 温州 325035
2. Southern Zhejiang Institute of Radiological Medicine and Nuclear Technology Application, Wenzhou Medical University, Wenzhou 325035, China
乳腺癌(breast cancer,BC)是女性最常见的恶性肿瘤类型之一,是女性癌症死亡的一个主要原因。在中国,乳腺癌的发病率以每年3%~4%的速度迅速攀升,显著超过了全球平均水平。以雌激素受体阳性(estrogen receptor-positive,ER+)的乳腺癌类型最为常见。针对ER的内分泌治疗已成为乳腺癌的基础治疗方法[1]。研究表明,乳腺癌细胞自噬水平与乳腺癌细胞的耐药性密切相关[2-5]。已有结果表明,雌二醇(E2)通过与雌激素受体(ESR1)结合抑制ERK信号通路磷酸化,促进自噬和凋亡的发生,并对细胞增殖进行多靶点调控[6]。但ESR1编码的雌激素受体蛋白如何调控自噬过程,以及它在乳腺癌细胞辐射抗性中的作用仍不明确。本研究旨在通过探讨雌激素受体ESR1在电离辐射诱导乳腺癌细胞自噬中的作用及潜在机制,为提高ER+乳腺癌的放疗敏感性和疗效提供新的策略。
材料与方法1. 主要材料与仪器:乳腺癌细胞系ZR75、MDA-MB-231均购自中国科学院细胞库。ESR1、ATG5、ATG12、LC3A/B、ATG7、P62、GAPDH抗体购自美国CST公司。DMEM(美国GIBCO公司)、Tyran Blue(美国GIBCO公司)、结晶紫染色液(中国Beyotime公司)、TRIzol(日本TaKaRa公司)、TB Green Premix Ex Taq II(日本TaKaRa公司)、Polybrene(北京Solarbio公司)、RIPA缓冲液(美国Thermo公司)。X射线发生器(X-RAD 320IX,美国PXI公司)、CO2细胞恒温培养箱(美国Thermo公司)、梯度PCR仪(美国ABI公司)、实时荧光定量PCR仪(美国Bio-Rad公司)、全自动酶标仪(美国Thermo公司)、荧光定量酶标仪(美国Thermo公司)、电泳仪及电泳槽(英国Cleaver Scientific公司)。
2.细胞培养、受照条件及分组:细胞在Eagle′s混合液中培养,添加10%胎牛血清,100 U/ml青霉素和100 μg/ml链霉素配制成完全培养基,在37℃、5% CO2的加湿培养箱中培养。使用X射线辐照仪,设置10 cm × 10 cm照射野,源靶距50 cm,以3 Gy/min的剂量率将细胞暴露于8 Gy X射线照射,每组重复3次。实验分组:ZR75细胞未照射(sham):敲低对照shNC组和siNC组、敲低shESR1组和siATG5组、过表达对照vector组、过表达ATG5 OE组、敲低对照加过表达对照shNC+vector组、敲低加过表达对照shESR1+vector组、敲低加过表达shESR1+ATG5 OE组、他莫昔芬未处理(TAM-)组、他莫昔芬处理(TAM+)组;照射(IR):shNC+IR/siNC+IR组、shESR1+IR/siATG5+IR组、shNC+vector+IR组、shESR1+vector+IR组、shESR1+ATG5 OE+IR组、(TAM-)+IR组、(TAM+)+IR组。MDA-MB-231细胞未照射(sham):过表达对照vector组、过表达ESR1 OE组;照射(IR):vector+IR组、ESR1 OE+IR组。集落形成实验分组情况:未照射sham组、照射IR组、电离辐射联合铁死亡抑制剂处理Fer-1+IR组、电离辐射联合凋亡抑制剂处理Z-VAD+IR组、电离辐射联合自噬抑制剂处理CQ+IR组。
3. 流式细胞术检测:细胞接种于6孔板(8×104个/孔),照射24 h后收集细胞培养液,1 000 r/min离心5 min,离心半径85 mm,弃除上清液,收集死细胞;磷酸缓冲盐溶液(PBS)洗涤两次,1 min/次,加入1 ml胰蛋白酶于37℃培养箱中消化2~3 min,1 ml完全培养基终止消化,1 000 r/min离心5 min,离心半径85 mm,收集细胞;弃上清液,200 μl PBS重悬细胞,20 μl台盼蓝染色液染色3 min,流式细胞仪按照每次上样20 000个细胞/20 μl,采用SSC-H/FSC-H通道检测细胞死亡率。
4. shRNA的慢病毒感染及细胞转染:将ESR1 shRNA构建在pLKO.1慢病毒载体上,用293 T细胞进行慢病毒包装,后感染ZR75细胞,并辅以1 μg/μl的聚凝胺(polybrene)助染剂,混匀。病毒感染8 h后换液,换液后24 h加入0.8 μg/μl的杀稻瘟菌素(blasticidin)进行筛选,每两天换液加药,筛选至少3次后,将稳定细胞系传代进行后续实验。
5. 实时定量PCR:用TRIzol提取细胞总RNA,基因组DNA清除试剂(5× gDNA Clean Reaction Mix日本TaKaRa公司),反转录预混试剂(5×Evo M-MLV RT Reaction Mix日本TaKaRa公司)进行反转录。使用荧光染料预混液(TB Green Premix Ex Taq II日本TaKaRa公司)在荧光定量PCR仪上进行实时荧光定量PCR(qPCR)。热循环条件如下:95℃ 30 s,95℃ 5 s和60℃ 30 s,共35次,引物如表 1所示,利用2-ΔΔCt计算相对表达水平。
|
|
表 1 不同基因的RT-PCR引物序列 Table 1 RT-PCR primer sequences |
6.蛋白免疫印迹法:使用刮刀收集细胞后,根据细胞沉淀量加入RIPA组织细胞裂解液4℃裂解30 min。总蛋白经12% 十二烷基硫酸钠-PAGE胶(SDS-PAGE) 分离后转移到聚偏二氟乙烯(PVDF) 膜上。在室温下用6%脱脂牛奶在Tris-buffer生理盐水-吐温(TBST) 中封闭1 h后,在4℃下与一抗孵育过夜(1∶5 000), TBST洗涤5 min × 3次,然后在室温下与二抗孵育1 h (1 ∶10 000)。
7. 集落形成实验:取适当数量细胞接种到培养皿中以生成50~200个克隆。细胞培养14 d后。4%多聚甲醛在室温固定30 min。随后,弃固定液,加入PBS清洗后,室温下用0.5%结晶紫溶液染色,拍照。用Image J图片处理软件统计≥50个细胞的集落。
8. 统计学处理:独立实验重复了3次。采用SPSS 18.0软件进行统计分析,用Graphpad Prism 8.0软件作图,对所有数据进行正态性检验,符合正态分布,方差齐,以x±s表示,两组间比较采用独立样本t检验,多个样本均数间比较采用单因素方差分析后,采用LSD-t法进行组间的两两比较。P < 0.05为差异有统计学意义。
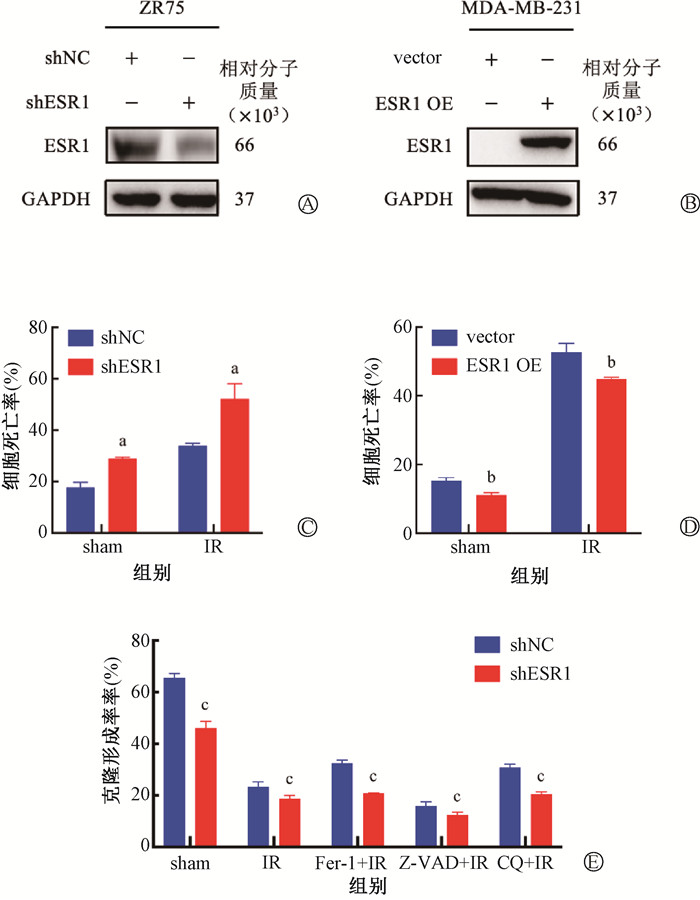
结果1. ESR1抑制电离辐射诱导的乳腺癌细胞死亡:如图 1A-B,在ZR75细胞中敲低及MDA-MB-231中过表达ESR1的效率均>50%,可用于后续实验。与对照组相比敲低ESR1能够显著增加细胞死亡率[ZR75 shESR1组vs. shNC组=(28.98± 0.50)% vs.(17.7±2.02)%,t=3.49,P < 0.05];在电离辐射的作用下这种效果更加明显[ZR75 shESR1+ IR组vs.shNC+IR组=(52.25±5.86)% vs. (33.98±0.91)%,t=3.13,P < 0.05],而过表达ESR1则导致相反的结果[MDA-MB-231 ESR1 OE组vs.vector组=(11.17±0.63)% vs.(15.35±0.83)%,t=4.16,P < 0.05],[MDA-MB-231 ESR1 OE+IR组vs.vector+IR组=(44.93±0.46)% vs.(52.74±2.54)%,t=7.48,P < 0.05](图 1C-D)。对ER+乳腺癌细胞ZR75在电离辐射的情况下分别使用了25、20和10 μmol/L的铁死亡抑制剂Fer-1、凋亡抑制剂Z-VAD和自噬抑制剂氯喹CQ处理后,结果表明,不同处理组的ZR75细胞集落形成率差异有统计学意义(F = 698.40, P < 0.0001),进一步分析表明,铁死亡抑制剂Fer-1和自噬抑制剂CQ可以使ZR75细胞集落形成率明显增加[ZR75 shNC Fer-1+IR,ZR75 shNC CQ+IR组vs.shNC IR组=(32.74±1.27)%,(30.77±1.36)% vs.(23.37±1.85)%,t=7.03、5.59,P < 0.05],在敲低ESR1后,细胞集落形成率显著下降[ZR75 shESR1组vs.shNC组=(46.10±2.59)% vs.(65.60±1.60)%,t=16.13,P < 0.05],但是在使用铁死亡抑制剂Fer-1和自噬抑制剂CQ处理后,可以明显挽救由于电离辐射所导致的细胞死亡[ZR75 shESR1 Fer-1+IR组,ZR75 shESR1 CQ+IR组vs.shESR1 IR组:(20.80 ±0.26)%,(20.50±0.85)% vs.(18.05 ±0.78)%,t=6.05、3.24,P < 0.05] (图 1E)。
|
注:a与shNC相比, t=3.49、3.13,P < 0.05;b与vector比较,t=4.16,7.48,P < 0.05;c与shNC比较,t=16.13、3.86、9.65、2.87、8.49,P < 0.05 图 1 ESR1抑制IR诱导的ZR75和MDA-MB-231细胞死亡 A~B.Western blot检测ESR1蛋白表达;C~D.台盼蓝流式细胞术检测细胞死亡情况;E.集落形成法检测细胞的克隆形成率 Figure 1 ESR1 inhibiting IR-induced death of ZR75 and MDA-MB-231 cells A-B. Expression of ESR1 protein detected using Western blot; C-D. Cell death detected using trypan blue staining and flow cytometry; E. Clonal formation rate of cells detected using colony formation method |
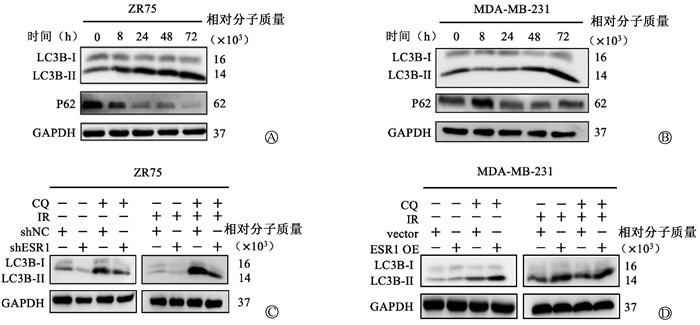
2. ESR1促进细胞的保护性自噬,抑制辐射诱导的乳腺癌细胞死亡:如图 2A~B,8 Gy X射线后ZR75细胞LC3B的表达水平在24 h显著增强,而MDA-MB-231细胞在48 h显著增强。按此条件进行后续实验。
|
注:使用氯喹(20 μM CQ)阻断溶酶体降解 图 2 ESR1促进乳腺癌细胞的保护性自噬 A~B. Western blot检测电离辐射处理下不同时间点自噬标志蛋白LC3B的表达;C~D. Western blot检测电离辐射联合CQ处理下自噬标志蛋白LC3B的表达 Figure 2 ESR1 promoting protective autophagy in breast cancer cells A-B. Expression of autophagy marker LC3B at different time points under treatment with ionizing radiation detected using Western blot; C-D. Western blot analysis was performed to detect the expression of autophagy marker LC3B under ionizing radiation combined with CQ |
对敲低和过表达ESR1的乳腺癌细胞进行照射以诱导细胞发生自噬。在CQ处理细胞后,相比于对照组,在ZR75细胞中ESR1的敲低导致了LC3B-II蛋白水平明显降低,在MDA-MB-231细胞中ESR1的过表达则导致了相反的结果(图 2C~D)。
3. ESR1通过ATG5抑制电离辐射诱导的ER阳性乳腺癌细胞死亡:如图 3A,与vector组相比,在MDA-MB-231细胞过表达ESR1时,FIP200、ULK1、Beclin1、ATG5和ATG12的蛋白表达水平显著增加;ATG5的mRNA水平也表现出了相同的变化[MDA-MB-231 ESR1 OE组vs.vector组=(1.61±0.37)vs.(1.00±0.08)%,t=2.79,P < 0.05](图 3B)。在ZR75细胞中敲低ESR1时,这些自噬蛋白的表达水平明显减少(图 3A)。因此,ESR1可能上调自噬蛋白的表达,从而促进细胞保护性自噬的发生。接下来在ZR75中敲低了ATG5,并验证了其敲低效率(图 3C)。结果显示,ATG5的敲低,抑制了ZR75细胞自噬的基础水平以及电离辐射诱导的自噬(图 3D)。检测了自噬相关基因ATG5的表达对于电离辐射诱导的细胞自噬及死亡的影响,ZR75中敲低自噬相关基因ATG5会导致电离辐射诱导的细胞死亡增加[ZR75 siATG5组vs. siNC组=(15.62±2.12)% vs.(8.29±1.46)%,t=4.19,P < 0.05];[ZR75 siATG5+IR组vs.siNC+IR组=(35.21±3.16)% vs.(24.03±2.21)%,t=6.39,P < 0.05](图 3E)。在ZR75中过表达ATG5可以逆转因敲低ESR1所导致的细胞死亡增加及自噬水平降低[ZR75 shESR1+ATG5 OE组vs.shESR1+vector组=(13.58±1.17)% vs.(18.94±1.46)%,t=1.70,P < 0.05],[ZR75 shESR1+ATG5 OE+IR组vs.shESR1+vector+IR组= (37.28± 0.23)% vs.(47.04±5.30)%,t=4.65,P < 0.05](图 3F~J)。

|
注:a与vector相比,t=2.79, P < 0.05;b与siNC相比, t=4.19、6.39,P < 0.05;c与shNC+vector比较,t=3.61、6.40,P < 0.05;d与shESR1+vector比较,t=1.70、4.65,P < 0.05 图 3 ESR1通过ATG5抑制电离辐射诱导的ER阳性乳腺癌细胞死亡 A. Western blot检测自噬相关蛋白表达;B. qRT-PCR检测ATG5基因的相对表达量;C. Western blot检测ATG5蛋白敲低效率;D. Western blot检测LC3B蛋白表达;E. 台盼蓝流式细胞术检测细胞死亡情况;F. Western blot检测挽救实验自噬相关蛋白表达;G. 台盼蓝流式细胞术检测挽救实验细胞死亡情况 Figure 3 ESR1 inhibiting ionizing radiation-induced death of ER-positive breast cancer cells mainly through ATG5 A. Expression of autophagy related protein detected using Western blot; B. Rlative expression level of the ATG5 gene detected using qRT-PCR; C. Knockdown efficiency of ATG5 protein detected using Western blot; D. Expression of LC3B protein detected using Western blot; E. Cell death detected using trypan blue staining and flow cytometry; F. Autophagy-related protein expression in rescue experiments detected using Western blot; G. Cell death in rescue experiments detected using trypan blue staining and flow cytometry |
4. 他莫昔芬(Tamoxifen,TAM)增加癌细胞的辐射敏感性:在用Tamoxifen处理ZR75细胞24 h后,无论是否通过电离辐射处理,ESR1的蛋白水平明显降低,表明TAM可通过促进ER蛋白的降解从而治疗ER阳性乳腺癌细胞,同时,ATG5及ATG12的蛋白水平均降低,即ESR1通过ATG5促进细胞的保护性自噬(图 4A)。为研究Tamoxifen对于电离辐射诱导的ER阳性乳腺癌细胞自噬性细胞死亡的影响,使用免疫印迹法检测了ZR75细胞用他莫昔芬处理后的自噬通量。如图 4B,用雌激素受体抑制剂TAM处理使ZR75细胞内基础、电离辐射诱导的自噬水平均显著降低,但在24 h内,TAM和电离辐射的联合治疗会导致ZR75细胞死亡率明显增加[ZR75(TAM+)组vs.(TAM-)组=(16.96±0.73)% vs.(7.26±0.51)%,t=18.70,P < 0.05],[ZR75 (TAM+)+IR组vs.(TAM-)+IR组=(30.84±1.00)% vs.(22.77±0.18)%,t=16.82,P < 0.05](图 4C)。

|
注:a与TAM-相比, t=18.70、16.82,P < 0.05 图 4 Tamoxifen增加ER阳性乳腺癌细胞的辐射敏感性 A.Western blot检测ESR1、ATG5、ATG12蛋白表达;B.Western blot检测LC3B蛋白表达;C.台盼蓝流式细胞术检测细胞死亡情况 Figure 4 Tamoxifen increasing the radiation sensitivity of ER-positive breast cancer cells A. Expressions of ESR1, ATG5, and ATG12 protein detected using Western blot; B. Expressions of LC3B protein detected using Western blot; C. Cell death detected using trypan blue staining and flow cytometry |
讨论
前期研究表明,电离辐射能够导致ER+乳腺癌细胞中ESR1蛋白表达水平升高,说明ESR1可能在电离辐射诱导的ER+乳腺癌细胞生物学中扮演重要角色。本研究发现ESR1抑制电离辐射诱导的乳腺癌细胞死亡可能通过细胞自噬途径,因此本研究主要探讨了ESR1在乳腺癌细胞自噬中的作用。
自噬是真核生物对细胞内受损蛋白和细胞器进行自我降解的过程,是细胞内的再循环系统,可以维持机体和细胞内环境稳定。细胞在自噬过程中会将损伤的内部成分被自噬囊泡包裹,并运输到溶酶体降解,分解后释放的氨基酸及其他小分子物质可被再次利用,从而维持细胞的基本生命活动[7]。自噬可分为起始、延伸、融合、降解4个阶段。自噬在乳腺癌中具有双重作用,不仅能够阻断受损细胞器和蛋白质的积累,从而发挥抑制肿瘤的效果;同时也能作为一种细胞存活机制,促进已经形成的肿瘤细胞生长[8-9]。鉴于自噬在乳腺癌进展中的关键作用,调节自噬的治疗方法已成为临床治疗乳腺癌的一个重要策略[4, 10-12]。本研究发现,沉默ESR1抑制自噬,促进细胞死亡,增加了ER+细胞辐射敏感性;而在ESR1阴性细胞里,过表达ESR1促进了细胞的保护性自噬,降低了电离辐射所诱导的细胞死亡率增加,提高了辐射抗性。进一步证实了ESR1的表达增加了ATG5的mRNA和蛋白水平,有助于自噬的增加。因此,可以得出结论,ESR1增加自噬至少部分是由于其上调ATG5所导致的。
在药物治疗等应激条件下,癌细胞中自噬水平的增加可促进细胞存活或细胞死亡,具体取决于环境[13-14]。有研究表明,自噬的促细胞生存作用会导致癌症的治疗耐药性[13, 15]。ESR1的表达可导致乳腺癌的化疗耐药和放射抵抗[16-18]。本研究证明了ESR1表达促进自噬可以保护乳腺癌细胞免受化疗药物和电离辐射治疗等应激引起的细胞死亡。这可能是ESR1阳性乳腺癌治疗效果不佳、导致ER阳性乳腺癌患者生存率更低的部分机制。在本研究中,ESR1的过表达导致三阴性乳腺癌细胞(HER2-、ER-和PR-)的保护性自噬和对细胞死亡的抵抗,进一步证实了既往研究中发现的自噬水平与癌症治疗抵抗性之间的相关性。因此,ESR1为ER阳性乳腺癌细胞的治疗提供了一个潜在靶点,即通过调节乳腺癌细胞的自噬来调节细胞的死亡。鉴于三阴性乳腺癌中自噬基础水平较低,这一现象可能是其具有更高侵袭性和治疗抵抗性的乳腺癌亚型难以治疗的潜在机制之一。未来研究中,深入探索这一领域将是十分必要的。
乳腺癌是一种典型的激素依赖性肿瘤,雌激素受体与乳腺癌的发生发展密切相关[19]。选择性雌激素受体调节剂(selective estrogen receptor modulators,SERM),如他莫昔芬,通过与ER竞争性结合,可以阻断雌激素对ER的激动作用,从而抑制乳腺癌的增殖。然而,在实际临床治疗中,很多患者对他莫昔芬产生了耐药性,这表明单一阻断ER并不能完全消除雌激素对肿瘤的影响。目前研究的内分泌抵抗机制主要包括两个方面:ER表达下调和逃逸信号通路活化。逃逸信号通路主要指受体酪氨酸激酶(EGFR、HER2、IGF-1R)活化调控ER信号通路,以及生长因子下游PI3K/AKT/mTOR和MAPK通路活化参与ER磷酸化。除了这些主要的内分泌耐药机制,临床前研究也发现了其他耐药机制,如转录因子FOXM1和支架/接头蛋白14-3-3过表达(这两种蛋白在lumnial B乳腺癌十分常见)可以促进肿瘤细胞增殖,而抑制FOXM1活性或下调14-3-3蛋白表达可以增加乳腺癌细胞对内分泌治疗的敏感性[20]。鉴于肿瘤内分泌耐药机制的复杂性,亟需开展更多的临床前和临床研究去深入探索和验证这些发现。在本研究中,采用他莫昔芬和电离辐射的方式联合处理ER+乳腺癌细胞,相较于单一内分泌药物治疗,这种方法显著降低了细胞的存活率,这一结果为解决乳腺癌内分泌治疗耐药提供了新的策略和思路。
综上所述,本研究证明了ESR1通过上调ATG5以及其他自噬相关(ATG)蛋白(包括ATG12、FIP200和ATG7)来促进ER+乳腺癌细胞的保护性自噬,导致乳腺癌患者的治疗和辐射抵抗。目前用雌激素受体抑制剂他莫昔芬(TAM)临床治疗ER+乳腺癌的一种可能的机制是由于Tamoxifen诱导的ESR1蛋白降解和ATG5下调,从而导致细胞自身保护性自噬的抑制,促进细胞死亡,为靶向ESR1阳性乳腺癌的自噬治疗及辐射抵抗提供了潜在参考价值。尽管如此,本研究仍有一些局限性。为了验证这些发现的实际应用性,需要在更广泛的临床实践和动物模型中进一步进行验证。此外,ESR1如何具体调节ATG5的分子机制,还需要进行更深入的研究。
利益冲突 无
作者贡献声明 杨天鹏、张诗楠负责实验设计、实验操作、数据整理、起草论文;纪慧琳、朱霖徽、张钰杰、黄进、文映人负责协助部分实验和论文整理;马淑梅和刘晓冬指导实验设计和论文修改
| [1] |
Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies-improving the management of early breast cancer: St Gallen international expert consensus on the primary therapy of early breast cancer 2015[J]. Ann Oncol, 2015, 26(8): 1533-1546. DOI:10.1093/annonc/mdv221 |
| [2] |
Luo J, Chen J, He L. miR-129-5p attenuates irradiation-induced autophagy and decreases radioresistance of breast cancer cells by targeting HMGB1[J]. Med Sci Monit, 2015, 21: 4122-4129. DOI:10.12659/msm.896661 |
| [3] |
Das CK, Mandal M, Kögel D. Pro-survival autophagy and cancer cell resistance to therapy[J]. Cancer Metastasis Rev, 2018, 37(4): 749-766. DOI:10.1007/s10555-018-9727-z |
| [4] |
Han Y, Fan S, Qin T, et al. Role of autophagy in breast cancer and breast cancer stem cells (Review)[J]. Int J Oncol, 2018, 52(4): 1057-1070. DOI:10.3892/ijo.2018.4270 |
| [5] |
Chen Y, Klionsky DJ. The regulation of autophagy-unanswered questions[J]. J Cell Sci, 2011, 124(Pt 2): 161-170. DOI:10.1242/jcs.064576 |
| [6] |
刘敏, 谢巍伟, 郑维, 等. 雌二醇与ESR1靶向结合通过ERK信号通路调控软骨细胞的增殖[J]. 南方医科大学学报, 2019, 39(2): 134-143. Liu M, Xie WW, Zheng W, et al. Estradiol and ESR1 target binding regulate chondrocyte proliferation through ERK signaling pathway[J]. J South Med Univ, 2019, 39(2): 134-143. DOI:10.12122/j.issn.1673-4254.2019.09.02 |
| [7] |
Mizushima N, Levine B. Autophagy in human diseases[J]. N Engl J Med, 2020, 383(16): 1564-1576. DOI:10.1056/NEJMra2022774 |
| [8] |
Ferro F, Servais S, Besson P, et al. Autophagy and mitophagy in cancer metabolic remodelling[J]. Semin Cell Dev Biol, 2020, 98: 129-138. DOI:10.1016/j.semcdb.2019.05.029 |
| [9] |
Romero MA, BayraktarEkmekcigil O, Bagca BG, et al. Role of autophagy in breast cancer development and progression: Opposite sides of the same coin[J]. Adv Exp Med Biol, 2019, 1152: 65-73. DOI:10.1007/978-3-030-20301-6_5 |
| [10] |
Lisiak N, Toton E, Rybczynska M. Autophagy as a potential therapeutic target in breast cancer treatment[J]. Curr Cancer Drug Targets, 2018, 18(7): 629-639. DOI:10.2174/1568009617666171114143330 |
| [11] |
Niklaus NJ, Tokarchuk I, Zbinden M, et al. The multifaceted functions of autophagy in breast cancer development and treatment[J]. Cells, 2021, 10(6): 1447. DOI:10.3390/cells10061447 |
| [12] |
Tyutyunyk-Massey L, Gewirtz DA. Roles of autophagy in breast cancer treatment: Target, bystander or benefactor[J]. Semin Cancer Biol, 2020, 66: 155-162. DOI:10.1016/j.semcancer.2019.11.008 |
| [13] |
Chaachouay H, Ohneseit P, Toulany M, et al. Autophagy contributes to resistance of tumor cells to ionizing radiation[J]. Radiother Oncol, 2011, 99(3): 287-292. DOI:10.1016/j.radonc.2011.06.002 |
| [14] |
Shintani T, Klionsky DJ. Autophagy in health and disease: a double-edged sword[J]. Science, 2004, 306(5698): 990-995. DOI:10.1126/science.1099993 |
| [15] |
Sui X, Chen R, Wang Z, et al. Autophagy and chemotherapy resistance: a promising therapeutic target for cancer treatment[J]. Cell Death Dis, 2013, 4(10): e838. DOI:10.1038/cddis.2013.350 |
| [16] |
Cao N, Li S, Wang Z, et al. NF-κB-mediated HER2 overexpression in radiation-adaptive resistance[J]. Radiat Res, 2009, 171(1): 9-21. DOI:10.1667/RR1472.1 |
| [17] |
Tan M, Yu D. Molecular mechanisms of erbB2-mediated breast cancer chemoresistance[J]. Adv Exp Med Biol, 2007, 608: 119-129. DOI:10.1007/978-0-387-74039-3_9 |
| [18] |
Yu D, Hung MC. Overexpression of ErbB2 in cancer and ErbB2-targeting strategies[J]. Oncogene, 2000, 19(53): 6115-6121. DOI:10.1038/sj.onc.1203972 |
| [19] |
刘瑞霞, 郑爱秋. 乳腺癌术后测定雌激素受体水平的意义探讨[J]. 吉林医学, 2011, 32(3): 546-547. Liu RX, Zheng AQ. Significance of detecting estrogen receptor level after breast cancer surgery[J]. Jilin Med, 2011, 32(3): 546-547. DOI:10.3969/j.issn.1004-0412.2011.03.115 |
| [20] |
Olayioye MA, Neve RM, Lane HA, et al. The ErbB signaling network: receptor heterodimerization in development and cancer[J]. EMBO J, 2000, 19(13): 3159-3167. DOI:10.1093/emboj/19.13.3159 |
 2024, Vol. 44
2024, Vol. 44


