2. 四川省肿瘤医院放射肿瘤科 成都 610041
2. Department of Radiation Oncology, Sichuan Cancer Hospital, Chengdu 610041, China
p53作为一种转录因子,在DNA损伤过程中具有促凋亡功能和一系列细胞代谢过程:包括有氧糖酵解、OXPHOS和抗氧化反应[1],此外还表现出丰富的动态特性。当细胞暴露于DNA损伤、缺氧和营养缺乏等各种应激时,p53识别和整合上游信号并进一步激活下游效应物,引导细胞周期阻滞、衰老或凋亡[2]。40多年来,p53作为抑癌分子从未获得肿瘤治疗的真正突破。传统思维上,人们常把p53引起的凋亡、衰老或修复作为细胞应激的结局,期望籍此来解决肿瘤控制和组织保护问题,然而,这种策略一直未能生效。近来,关于p53在炎症/免疫领域的新发现,强烈提示免疫调控或许是p53抗癌研究的新方向。本文围绕p53动力学及其对细胞命运和辐射敏感性的影响和免疫调控机制做简要综述,旨在回顾该领域的最新进展,并展望未来p53研究的挑战和机遇。
一、p53动力学决定细胞命运1. p53的动力学模式:细胞通过分子信号传递信息,这些信号通常表现出复杂的动力学模式。在细胞应激反应中,p53主要作为转录因子诱导大量靶基因维持基因组完整性[3]。在非应激细胞中,p53由于其快速降解而保持在低水平。在多种应激条件下,已经观察到不同的p53动态模式,包括脉冲、持续平台、单调增加和两相动态(脉冲后持续高水平)。由p53及其负调节因子Mdm2组成的负反馈回路已被确定为调节p53动力学的核心拓扑结构:ATM激酶构成DNA损伤的主要调节中心,可以与p53 mRNA相互作用并引导DNA损伤反应通路[4]。p53和Mdm2的交替激活是电离辐射下p53振荡的原因(图 1)。当细胞暴露于各种应激时,细胞内p53表达动力学呈现两种模式:①由p53-Mdm2和p53-Wip1-ATM两个负反馈环路所致的自然脉冲p53,这种p53动力学模式可引起p21等下游分子表达增加,致细胞周期阻滞和基因修复,细胞得以存活。②由p53-PTEN-Akt-Mdm2正反馈环路所致的持续p53表达,这种p53动力学模式则诱导PUMA等表达增强,引导细胞走向凋亡或衰老。

|
注:↓促进;⊥抑制 图 1 当细胞暴露于各种应激时,细胞内p53表达的两种动力学模式 Figure 1 Two dynamic patterns of intracellular p53 expressions when cells are exposed to various stress types |
2. p53动力学的变化导致不同的细胞命运:持续的p53会引发不可逆的命运,如凋亡或衰老,而脉冲p53则允许细胞恢复和生长。p53的动力学行为随刺激而变化;在响应双链DNA断裂时,它显示出一系列重复的脉冲。Purvis等[5]使用计算模型,通过添加一系列精确定时的药物诱导p53脉冲或产生持续的p53表达,从而导致一组不同的下游基因的表达,并且改变了细胞的命运:经历p53脉冲的细胞从DNA损伤中恢复,而暴露于持续p53信号的细胞走向衰老和凋亡。近年来,人们利用延时显微镜成像技术发现了许多细胞信号分子表现出复杂的动力学行为,且生物脉冲振荡频率或持续时间可以改变基因表达或控制细胞分化。不同的外界应激可引起p53脉冲的不同动态模式。对γ辐射引起的DNA断裂的响应,p53水平表现出一系列具有固定幅度和频率的生物脉冲,提高辐射剂量可增加脉冲的数量,而不影响其幅度或持续时间。目前,对p53生物脉冲的分子机制有了一定了解,但其对下游响应分子的影响尚有待深入研究。p53脉冲选择性激活参与对DNA损伤的瞬时反应的基因,而持续的p53表达诱导与终末命运相关的基因。
3. p53动力学决定细胞命运的机制:动力学编码信息(而不是信号分子的绝对浓度)在细胞功能调控中发挥关键作用。而诱导细胞衰老的并非DNA损伤的程度,而是p53信号传导的动力学。参与细胞周期停滞和p53依赖性衰老的CDKN 1A在持续的p53信号传导下能最显著地增加表达。因此,持续的p53信号似乎加速衰老基因的表达,而脉冲p53延迟基因表达,从而保护细胞免于过早地陷入不可逆的命运。然而,到细胞开始衰老时,在持续条件下随时间积累的p53总量比脉冲细胞高得多。为了探明细胞命运的这种变化是由于p53动力学还是仅仅由于累积p53的增加,在累积p53的相等水平下,对脉冲和持续p53表达之间衰老基因的表达进行比较。持续的p53信号导致其靶基因的表达高于脉冲p53,这表明控制基因表达的是p53的动力学模式而不是其累积水平。阐明p53信号动力学是如何调节的,以及如何影响细胞反应,这将为以可控的方式调控它们提供新的理论基础。有针对性的蛋白质动力学扰动,有望成为疾病治疗的新策略。
二、p53动力学与辐射敏感性1. p53影响辐射敏感性:众所周知,p53介导了细胞对辐射的反应。然而,p53蛋白的丰度与组织间的辐射敏感性程度并不相关。那么,p53动力学是否影响辐射敏感性?研究发现,放射敏感组织显示了辐射后延长的p53表达,而更多的抵抗组织显示了短暂的p53激活[6]。使用Mdm2抑制小分子(NMI 801)维持p53高表达,可降低培养肿瘤细胞的活力并抑制肿瘤生长。p53是辐射引起的细胞凋亡所必需的,在不同组织对辐射不同敏感性中起着关键作用。p53及其靶基因是由DNA损伤诱导的,并驱动对辐射的反应,但对辐射敏感性明显不同的组织,如肠道和淋巴器官,其p53的水平相似。p53蛋白在每个细胞中表现出一系列的振荡,这是由于p53的靶基因和抑制物E3-连接酶Mdm2与p53的靶基因的负反馈环所致。p53蛋白水平通过MDM2(p53的主要抑制剂)指导的组成型蛋白酶体降解而保持较低水平[7]。研究发现,p53的瞬时和振荡激活与DNA修复和增殖相适应,持续的p53水平通过使用MDM2抑制剂对p53-MDM2反馈环进行化学操作而获得,导致细胞凋亡或衰老。p53动力学与辐射敏感性有关,人工调控这些动力学模式能否影响肿瘤或正常组织对辐射的敏感性?胃肠道和淋巴组织尽管p53的水平相似,但它们对辐射的敏感性不同,这两种组织类型在照射后立即显示出p53蛋白的诱导;在胃肠中,p53水平在2~3 h达到峰值后下降,而在脾和胸腺中,p53水平和活性保持不变。MDM2抑制剂(MDM2i)可调控p53动力学,与放疗相结合延长了p53表达信号,改善了肿瘤局部控制率。机体所有组织和多数肿瘤都表达功能性p53蛋白,但不同组织中的细胞对DNA损伤和p53激活的反应不同;淋巴器官显示出持续的p53表达水平,胃肠则显示出p53的更多瞬时激活,及其靶基因的相应瞬时表达。
2. 药物诱导的p53动力学与细胞周期停滞和凋亡的相关性:导致组织间p53动力学差异的机制尚不清楚,Mdm2在多种组织中被诱导,提示淋巴器官组织中持续的p53激活不是因为未能激活p53/Mdm2负反馈;通过翻译后修饰或DNA损伤信号通路的差异反馈控制,Mdm2活性的修饰仍然可引起p53动力学差异。组织感知或修复损伤的能力可能与p53动力学有关,持续的未修复DNA损伤可能导致持续的p53表达,而有效和完全的修复允许p53下降到基础水平。用小分子修饰p53动力学可望成为有效的肿瘤手段,即通过抑制p53信号传导直接杀死肿瘤细胞并使正常细胞的毒性最小化。p53抑制剂可能提供一种机制,使敏感的正常组织免受化疗的影响。许多临床试验已经观察了单一药物MDM2拮抗剂的安全性,DNA损伤剂和MDM2拮抗剂的组合试验已经启动,这些试验依赖于持续的MDM2抑制和放射或化疗之间的协同作用。在肿瘤放射治疗后不久给予单剂量的MDM2抑制剂可改善肿瘤控制。因此,可以通过操纵p53动力学提高肿瘤治疗的特异性。一般来说,p53的动力学取决于应激刺激的类型、细胞、组织和物种。在不同的细胞系中,p53在暴露于特定药物(时表现出不同的动态敏感性。这一发现提示在治疗肿瘤时应根据细胞类型选择合适的抗肿瘤药物。p53脉冲的波动可诱导p53转向持续高表达,但其潜在机制尚不清楚。此外,包括翻译后修饰在内的多层调控可以调控p53的动力学,并有助于识别不同的靶基因。从通过增加p53表达来杀死癌细胞的角度来看,更精细地调控p53/mdm2环路可以提高癌症治疗的效率。
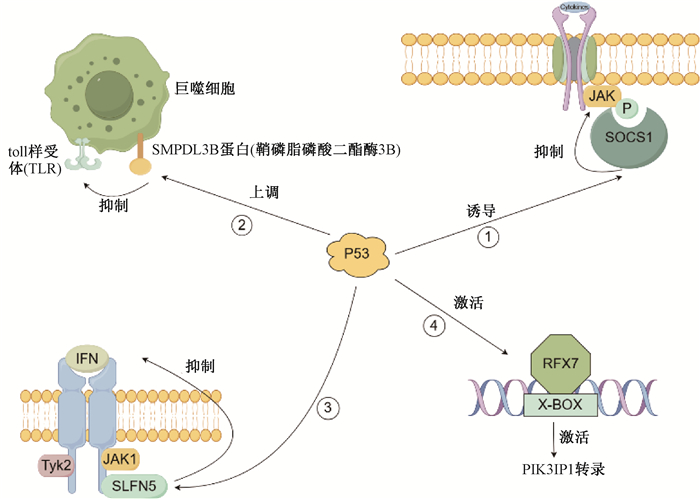
三、p53参与免疫反馈环路的调控p53蛋白在固有免疫系统的调节和适应性免疫反应中发挥重要作用。在过去的45年里,p53领域一直走在癌症研究的道路上。现在癌症治疗正在转向免疫治疗,有许多迹象表明p53蛋白在固有免疫系统的调节和适应性免疫反应中发挥重要作用。研究发现,p53参与多种免疫环路的反馈调控[8](图 2):在这些反馈回路中,正向反馈有助于放大初始信号,负向反馈有助于终止信号。①细胞因子信号传导抑制因子1(SOCS1)蛋白在γ干扰素信号传导途径中起负调节作用,可以抑制几乎所有依赖Janus激酶(JAK)的信号传导。SOCS1的表达可由p53和多种细胞因子诱导,包括各种白细胞介素、干扰素(Ⅰ型和Ⅱ型)和肿瘤坏死因子α(TNF-α)。②p53参与了SMPDL3B蛋白(鞘磷脂磷酸二酯酶3B)与Toll样受体(TLR)的反馈调控机制,SMPDL3B是TLR信号传导的负调节剂,并可被p53表达上调。③干扰素信号传导中负反馈环的关键元件是SLFN5蛋白,其是p53下游的靶基因。SLFN 5既是一种刺激的应答基因,也是干扰素(IFN)激活基因转录的阻遏物。④PIK3IP1是淋巴细胞中磷脂酰肌醇3激酶(PI3K)活性的新型调节剂,而p53可以上调PIK3IP1表达。Coronel等[9]发现p53直接激活RFX7转录因子,进一步激活PIK3IP1基因的转录。
|
注:①p53可诱导SOCS1(细胞因子信号传导抑制因子1),其可通过抑制JAK(Janus激酶)来负反馈调节γ干扰素信号传导途径;②p53上调SMPDL3B(鞘磷脂磷酸二酯酶3B),其是TLR(toll样受体)信号传导的负调节剂;③p53作用于SLFN5蛋白,其是干扰素信号传导中负反馈环的关键元件;④p53直接激活RFX7转录因子,进一步激活PIK3IP1(磷脂酰肌醇-3激酶相互作用蛋白1)基因的转录,PIK3IP1可调节淋巴细胞中的PI3K(磷脂酰肌醇3激酶)。这些免疫环路可导致肿瘤免疫逃逸的发生 图 2 p53参与的多种免疫环路的反馈调控 Figure 2 p53 involved in the feedback regulation of multiple immune circuits |
P53可能参与了肿瘤免疫逃逸机制。免疫应答通常由B7家族的蛋白质严格控制,包含共刺激和共抑制分子,对于保持免疫效力和自身免疫抑制之间的平衡至关重要。PD-L1有效抑制T细胞并参与靶向抗癌免疫治疗,属于B7家族。该家族还包含由ILDR2基因编码的含Ig样结构域的受体2,显示出强大的T细胞抑制活性。ILDR2可被p53激活,其启动子区含有p53结合位点,根据ChIP-Seq数据,该位点不被野生型p53占据,而是被p53突变体占据。因此,p53的“常规”活化似乎不足以刺激ILDR2的表达。假设p53真的激活了这个基因的表达,那么为什么这个肿瘤抑制因子会促进一个强有力的T细胞抑制因子的表达?p53基因的改变可以通过影响肿瘤免疫细胞募集、TME细胞因子分泌和炎症信号通路来促进免疫逃避。在某些情况下,p53突变增加了新抗原负荷,从而改善了对免疫检查点抑制的反应。治疗性恢复突变p53可恢复抗肿瘤免疫细胞浸润,诱导肿瘤消退。事实上,有临床证据表明,恢复p53可以诱导免疫冷肿瘤的抗癌免疫反应。野生型p53的肿瘤抑制功能或其癌症相关突变体的致癌活性仍未完全了解[10],有研究表明,在p53突变型癌症和一些p53野生型癌症中,监测有丝分裂延伸的能力丧失[11]。野生型p53蛋白是先天免疫反应的一部分,即使p53蛋白含有突变而不起作用,细胞中DNA的转录也会触发先天免疫反应。因此,p53突变蛋白即使失去转录因子活性,也能发挥作用,因为它无法与DNA结合并抑制转录。通过与MDM-2的自我调节循环,突变p53蛋白在细胞内的浓度增加,降解突变p53的肽通过巨噬细胞和Ⅱ类受体呈递给B细胞和CD4 Th2辅助性T细胞,激活抗体反应并使其成熟,对IgG类抗体产生反应。p53应激系统和NFK-β免疫系统的某些方面是拮抗的,高水平的p53会降低NFK-β活性,而高水平的NFK β活性会降低p53的功能。然而,p53需要NFK-β来发挥先天和适应性免疫反应。目前还不知道这两种转录因子的相互作用是如何被调节的,也不知道这两个系统在应激下是如何休战和合作的。没有免疫系统,抗生素就无法真正发挥作用,而没有免疫系统,癌症放化疗很可能不会成功。这些问题的答案与传染病、自身免疫、癌症免疫治疗研究密切相关。
四、问题与展望p53最为人所知的生物学作用是防治肿瘤疾病,这一结论得到了人类癌症中TP53突变的频繁存在以及其种系突变携带者的极高癌症风险的支持。因此,p53成为了开发新抗癌药物的极具吸引力的研究方向:通过代谢底物如葡糖糖控制p53活性以控制细胞的结局[12];用模拟选择性自噬体受体的仿生纳米受体的合成促进突变型p53降解从而治疗疾病[13];丙氨酰-tRNA合成酶1乳酸化其靶标p53并促肿瘤发生[14]。然而,p53是一种转录因子,因此长期以来一直被认为是不可成药的[15]。而免疫调控或许是p53发挥调节作用的关键机制。然而p53强烈激活某些免疫抑制基因表达的观察结果似乎与p53的免疫激活作用不一致。在某些应激条件下,p53是否为一种多功能转录因子,以致免疫基因的激活仅仅是一种副作用,或者只是还不了解p53和免疫系统的各种组成部分之间的复杂联系。另外,p53在免疫调控上的诸多矛盾或反常结果,是否与p53动力学有千丝万缕的关系,或许不是取决于绝对的p53累积浓度,而是受控于p53的动力学模式等等,为了回答这些问题和其他关于p53的问题,需要更多的工作和更好的体内实验模型。
利益冲突 无
作者贡献声明 杨益言负责论文撰写及修改;王卫东负责指导论文修改
| [1] |
Jiang J, Chen HN, Jin P, et al. Targeting PSAT1 to mitigate metastasis in tumors with p53-72Pro variant[J]. Signal Transduct Target Ther, 2023, 8(1): 65. DOI:10.1038/s41392-022-01266-7 |
| [2] |
Flores ER, Tsai KY, Crowley D, et al. Editorial Expression of Concern: p63 and p73 are required for p53-dependent apoptosis in response to DNA damage[J]. Nature, 2024, 627(8004): E10. DOI:10.1038/s41586-024-07223-4 |
| [3] |
Levine AJ. p53:800 million years of evolution and 40 years of discovery[J]. Nat Rev Cancer, 2020, 20(8): 471-480. DOI:10.1038/s41568-020-0262-1 |
| [4] |
Karakostis K, Malbert-Colas L, Thermou A, et al. The DNA damage sensor ATM kinase interacts with the p53 mRNA and guides the DNA damage response pathway[J]. Mol Cancer, 2024, 23(1): 21. DOI:10.1186/s12943-024-01933-z |
| [5] |
Purvis JE, Karhohs KW, Mock C, et al. p53 dynamics control cell fate[J]. Science, 2012, 336(6087): 1440-1444. DOI:10.1126/science.1218351 |
| [6] |
Stewart-Ornstein J, Iwamoto Y, Miller MA, et al. p53 dynamics vary between tissues and are linked with radiation sensitivity[J]. Nat Commun, 2021, 12(1): 898. DOI:10.1038/s41467-021-21145-z |
| [7] |
Hassin O, Oren M. Drugging p53 in cancer: one protein, many targets[J]. Nat Rev Drug Discov, 2023, 22(2): 127-144. DOI:10.1038/s41573-022-00571-8 |
| [8] |
Łasut-Szyszka B, Rusin M. The Wheel of p53 Helps to Drive the Immune System[J]. Int J Mol Sci, 2023, 24(8): 7645. DOI:10.3390/ijms24087645 |
| [9] |
Coronel L, Riege K, Schwab K, et al. Transcription factor RFX7 governs a tumor suppressor network in response to p53 and stress[J]. Nucleic Acids Res, 2021, 49(13): 7437-7456. DOI:10.1093/nar/gkab575 |
| [10] |
Oren M, Prives C. p53:A tale of complexity and context[J]. Cell, 2024, 187(7): 1569-1573. DOI:10.1016/j.cell.2024.02.043 |
| [11] |
Meitinger F, Belal H, Davis RL, et al. Control of cell proliferation by memories of mitosis[J]. Science, 2024, 383(6690): 1441-1448. DOI:10.1126/science.add9528 |
| [12] |
Wu YQ, Zhang CS, Xiong J, et al. Low glucose metabolite 3-phosphoglycerate switches PHGDH from serine synthesis to p53 activation to control cell fate[J]. Cell Res, 2023, 33(11): 835-850. DOI:10.1038/s41422-023-00874-4 |
| [13] |
Huang X, Cao Z, Qian J, et al. Nanoreceptors promote mutant p53 protein degradation by mimicking selective autophagy receptors[J]. Nat Nanotechnol, 2024, 19(4): 545-553. DOI:10.1038/s41565-023-01562-5 |
| [14] |
Zong Z, Xie F, Wang S, et al. Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis[J]. Cell, 2024, 187(10): 2375-2392.e33. DOI:10.1016/j.cell.2024.04.002 |
| [15] |
Peuget S, Zhou X, Selivanova G. Translating p53-based therapies for cancer into the clinic[J]. Nat Rev Cancer, 2024, 24(3): 192-215. DOI:10.1038/s41568-023-00658-3 |
 2024, Vol. 44
2024, Vol. 44


