2. 广西壮族自治区人民医院康复医学科 广西中医药大学联合培养基地, 南宁 530021;
3. 广西医学科学院, 南宁 530021
2. Joint Training Base of Guangxi University of Chinese Medical, Department of Rehabilitation, People's Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China;
3. Guangxi Academy of Medical Sciences, Nanning 530021, China
放射治疗后引起的肌纤维化(radiation-induced muscle fibrosis,RIMF)是患者接受放疗后的一种严重的长期并发症,通常是由放射治疗导致肌肉组织的损伤和异常修复所引发的病理过程。在此过程中,肌肉组织的正常结构被过度生长的纤维组织所取代,导致肌肉硬化,弹性降低,不仅会导致患者疼痛,还会导致严重的功能障碍,例如吞咽障碍、关节僵硬和活动范围受限,从而影响患者的生活质量。此外,肌肉纤维化可能与肿瘤复发有关,影响癌症患者的预后和生存[1]。本文就放疗后肌肉纤维化的发病机制及康复治疗策略研究进展进行综述。
一、放疗后肌肉纤维化的发病机制1.关键环节:放疗后肌肉纤维化的发病机制目前尚未明确,涉及多个生物学过程。主要包括以下几个关键环节:
(1) 电离辐射的直接和间接作用。直接作用:电离辐射直接作用于肌肉细胞的DNA,引起DNA断裂和突变。这种DNA损伤可能导致基因表达的变化,特别是影响那些控制细胞周期和细胞凋亡的基因。如果DNA损伤得不到有效修复,可能导致细胞死亡或程序化细胞死亡(细胞凋亡),进而导致组织损伤和炎症反应。间接作用:电离辐射通过活性氧自由基(reactive oxygen Species,ROS)的水解间接损害细胞膜、蛋白质和DNA。ROS的过量产生会导致细胞内氧化应激,激活炎症反应,促进纤维化的进程[2]。
(2) 转化生长因子(transforming growth factor-beta,TGF-β)在纤维化中的核心作用:TGF-β是RIMF的关键因素。肌成纤维细胞是肌肉纤维化的主要效应细胞,而TGF-β通过促进肌成纤维细胞的分化和活化发挥病理作用。而且,TGF-β刺激胶原蛋白和其他细胞外基质蛋白的合成,加剧软组织硬化,同时抑制胶原降解,导致细胞外基质的积累。另外,TGF-β还可能通过抑制细胞凋亡或调节免疫反应来加剧肌肉的纤维化[3]。
(3) 肌成纤维细胞的活化和细胞外基质的变化:暴露于电离辐射后,肌成纤维细胞可能被激活并转化为纤维化表型,增强胶原蛋白和其他细胞外基质成分的合成。这些活化的细胞会引起组织结构和功能的变化,细胞外基质的过度沉积和改变则使肌肉组织弹性降低,并可能影响细胞间信号的传导。
(4) ROS的产生和微血管损伤对肌肉纤维化的影响:ROS在纤维化过程中起着关键作用,其不仅直接破坏细胞结构,还激活多种信号通路,促进纤维化的进展。微血管损伤导致肌肉组织局部缺血缺氧,从而进一步刺激纤维化进程。而缺氧可能会增加HIF-1α的表达,进而影响纤维化相关因子(例如TGF-β)的活性。有研究表明,慢性肾脏疾病发生肾纤维化时,在缺氧或损伤条件下,肾脏细胞倾向于通过糖酵解产生能量,称为“Warburg效应”。而HIF-1α作为肾纤维化中的关键因子,在低氧环境中起到了调控细胞代谢、炎症、EMT和血管重构的作用[4-6]。
(5) 炎症反应:辐射诱导的细胞损伤引发炎症反应,包括免疫细胞(如巨噬细胞)的激活和炎症因子(如肿瘤坏死因子α和白细胞介素)的释放[7]。这些炎症因子进一步促进肌成纤维细胞的活化和增殖,导致大量胶原蛋白和其他细胞外基质成分的产生,从而加剧纤维组织的积累。
(6) 细胞外基质(extracellular matrix,ECM)重塑的影响:胶原蛋白等细胞外基质成分的积累导致肌肉组织结构发生变化,导致其僵硬和失去弹性。这些变化不仅影响组织的机械性能,还可能影响细胞信号传导和组织修复。
(7) 微环境变化:纤维化过程影响肌肉组织的微环境,如血管生成减少、氧合不足等,将进一步加剧肌肉组织损伤和纤维化。
(8) 持续的损伤和修复:放疗后,肌肉组织可能会经历持续的损伤和修复过程,导致纤维化进一步恶化。
(9) 结缔组织生长因子(connective tissue growth factor,CTGF):是另一种重要的纤维化介质,CTGF在心脏中可以促进心肌细胞和心纤维细胞的功能,影响炎症、组织修复和纤维化过程。CTGF的转录可以被TGF-β激活,并且是调节TGF-β、促进纤维化作用的重要下游调节因子[8]。
2.进展过程:放疗后肌肉纤维化的进展过程可分为以下3个阶段。①急性期:主要涉及电离辐射的直接和间接作用。放疗初期,电离辐射直接破坏肌肉细胞DNA,引起DNA断裂和突变。同时可通过活性氧自由基(ROS)的产生,间接损伤细胞膜、蛋白质和DNA,导致细胞内氧化应激,激活因细胞损伤而迅速触发的炎症反应(包括免疫细胞激活和炎症因子的释放)。②演进期:TGF-β起到的核心作用。随着炎症的持续,TGF-β的活化促进肌成纤维细胞的分化和活化,增强胶原蛋白和细胞外基质蛋白的合成,加剧组织硬化。肌成纤维细胞暴露于电离辐射后,肌成纤维细胞被激活并转化为纤维化表型,导致组织结构和功能的变化。③慢性期:因辐射诱导的细胞损伤引发炎症反应。激活的免疫细胞和释放的炎症因子进一步促进肌成纤维细胞的活化和增殖,导致大量胶原蛋白和其他细胞外基质成分的产生,从而加剧纤维组织的积累。长期的纤维化过程导致细胞外基质成分的积累和组织结构的僵硬。同时,纤维化影响肌肉组织的微环境,如血管生成减少和氧合不足,进一步加剧肌肉组织的损伤和纤维化。放疗后的肌肉组织可能会经历持续的损伤和修复过程,导致纤维化进一步恶化。
3.放疗、TGF-β和CAFs三者之间的相互作用:见图 1。放疗、TGF-β、肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)之间存在复杂的相互作用。放疗可以激活TGF-β信号通路,导致纤维化和炎症反应。这种相互作用似乎在癌症治疗、组织修复和免疫调节的几个方面尤为重要。TGF-β在肿瘤微环境中起着关键作用,包括促进肿瘤细胞增殖、侵袭和转移。放疗改变肿瘤微环境,影响TGF-β的表达和活性[7, 9]。T细胞在放射治疗中具有复杂的作用,它们表现出一定程度的放射抗性[10]。CAFs在肿瘤微环境(tumor micro-environment,TME)中起着至关重要的作用,对肿瘤细胞迁移、细胞外基质重塑和免疫调节具有重要作用。CAFs和TGF-β之间关系的主要点包括:①细胞外基质(ECM)重塑和代谢调节:CAFs通过重塑ECM和代谢调节来影响肿瘤微环境,包括血管生成,这是肿瘤生长和转移的关键因素。从免疫学角度看,ECM还包含各种分泌蛋白,包括细胞因子、趋化因子和生长因子,潜在参与免疫细胞调节[11]。TGF-β通过促进成纤维细胞活化和分化在这些过程中发挥作用,从而增强ECM重塑[12-13]。虽然成纤维细胞和CAFs都能合成ECM蛋白,但CAFs在肿瘤微环境中表现出更加活跃的行为。故TGF-β通过调节CAFs的功能,如促进细胞增殖和迁移,从而促进肿瘤进展,在这一过程中发挥关键作用[12, 14-15]。②CAFs的异质性和研究重点如下:CAFs表现出功能和表型的异质性,这在一定程度上受到微环境中不同信号的调控,包括TGF-β。TGF-β的不同浓度和活性状态会影响CAFs的不同亚型和功能[15]。特异性标志物和促分泌剂:CAFs特异性标志物(如TGF-β)在癌症的不同阶段以特定方式表达,其作为调控CAFs活性的关键分子,影响CAFs在肿瘤微环境中的重要功能[16-18]。
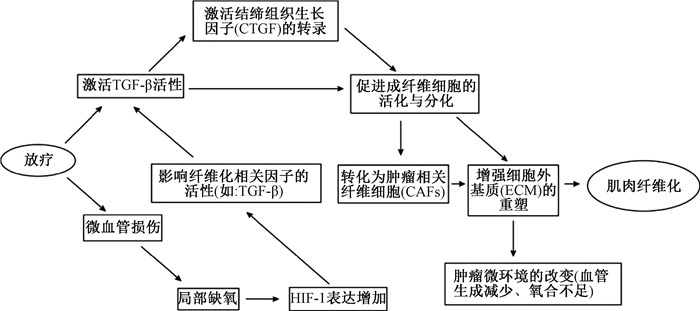
|
图 1 放疗后肌肉纤维化病理生理过程示意图 Figure 1 Schematic diagram of the pathophysiological process of muscle fibrosis after radiotherapy |
二、放疗后肌肉纤维化的诊断和评估
1.临床评估:病史,如患者的放疗史、剂量、照射面积和任何既往并发症。症状,如疼痛、肿胀、活动受限、肌肉硬度等。体征,包括皮肤变化(例如颜色、温度、质地)、肌肉和周围组织压痛以及活动范围受限。
2.影像学:CT扫描可以评估肌肉和周围软组织的密度变化,以确定纤维化的位置和程度。磁共振成像(MRI)能提供细节丰富的软组织图像,可以更准确地确定肌肉纤维化的程度和影响的深度。超声检查有助于实时评估通过肌肉组织的血流和纤维化的动力学,同时可以测量肌肉的厚度,观察肌肉的回声变化及弹性变化。PET扫描用于评估组织恶变程度,特别是在纤维化的早期检测和监测方面。
3.生物标志物检测:血清分析可检测与纤维化相关的细胞因子和生长因子,如TGF-β、CTGF、血小板衍生生长因子(platelet-derived growth factor,PDGF)、白细胞介素等。尿液分析可检测可能由纤维化引起的肾脏损伤标志物。分子生物学技术,如基因表达分析可以揭示纤维化的分子机制和个体对治疗的反应、个体差异和疗效评估等。
4.其他:遗传因素可能会影响个体对放疗的反应和纤维化的风险;糖尿病、心血管疾病等合并症可能会加剧纤维化过程;治疗参数、放疗总剂量、分割方式和放疗类型等指标是肌肉纤维化的重要影响因素[2]。
三、放疗后肌肉纤维化的治疗策略1.传统疗法:抗炎药,包括非甾体抗炎药(NSAIDs)和皮质类固醇,用于减少炎症和纤维化过程。抗氧化剂,如维生素C、维生素E等天然抗氧化剂,旨在中和自由基,减少氧化应激。
2.靶向分子治疗:①TGF-β1抑制剂:TGF-β抑制剂主要包括超氧化物歧化酶、TGFβⅡ型受体、靶向药物、己酮可可碱与维生素E等。由于TGF-β1在纤维化过程中起关键作用,使用其抑制剂可以减少纤维化组织的形成[9]。②CTGF抑制剂:CTGF(结缔组织生长因子)是另一种重要的纤维化介质,CTGF在心脏中可以促进心肌细胞和心纤维细胞的功能,涉及炎症、组织修复和纤维化过程。已有研究表明,抑制CTGF可减少纤维化[19-21]。比如目前正处于临床前研究阶段的FG-1039就是一种针对CTGF的单克隆抗体。③PDGF抑制剂:PDGF(血小板衍生生长因子)在纤维化中也起着重要作用,抑制其信号传导可以减少纤维化[2, 22]。④HIF-1/2抑制剂:HIF-1a是关键的转录因子,响应低氧环境,调控细胞代谢、炎症、EMT和血管重构。HIF-1a的激活可导致增强糖酵解,改变了肾细胞的能量代谢,促进肾纤维化,故针对HIF-1a介导的糖酵解途径的治疗策略可能是改善肾纤维化的有效方法[6]。
3.干细胞疗法:干细胞移植,利用干细胞,如间充质干细胞(mesenchymal stem cells, MSCs),促进受损组织的修复和再生。干细胞可以分化成多种类型的细胞,并通过分泌生长因子和其他分子来帮助组织修复[21]。
4.新兴治疗策略:①小分子药物:正在开发新的小分子药物,以靶向特定分子,更精确地干预肌肉纤维化过程。②抗体疗法:使用针对纤维化过程中关键分子的单克隆抗体。③高压氧治疗:利用高压氧环境改善细胞氧合和修复[23]。④联合治疗:探索不同治疗方法的组合,例如靶向药物与抗炎疗法的组合。⑤新药临床试验:测试新开发药物的安全性和有效性。有多种潜在的治疗方法正在研究中,例如内皮抑素,一种抗癌药物,也对成纤维细胞有效。小窝蛋白1、Toll样受体3和4的研究为特定的纤维化疾病提供了新的治疗靶点[24]。放射治疗后肌肉纤维化是一个复杂的病理过程,需要综合使用治疗策略:传统的抗炎和抗氧化疗法提供基础支持,而靶向分子疗法、干细胞疗法以及小分子药物和抗体疗法等新兴治疗策略则可以提供更精准的干预。
5.综合康复治疗:康复治疗在患者放疗后肌肉纤维化的治疗中也显示了明显的优势。放射治疗是鼻咽癌等头颈部恶性肿瘤的重要治疗手段,而头面部放射治疗会导致颈部、面部肌肉纤维化,严重影响患者的言语、吞咽、头颈部活动等,是头颈部肿瘤放疗后影响患者生活质量的重要原因。现已知的一些康复治疗手段被证实可有效改善患者的症状。例如,针灸联合低温休克治疗联合康复训练,米字运动训练的预防治疗(颈部运动、模仿书写米字运动)等可显著降低颈部肌肉纤维化程度,提高鼻咽癌(NPC)放疗患者的生活质量。有研究显示,鼻咽癌功能性运动健康运动,包括敲牙、张嘴、鼓起脸颊和吸吮、按摩和舌肌锻炼,可有效降低放疗后肌肉纤维化等并发症的发生率,说明综合康复治疗研究组患者在预防和减少颈肌纤维化方面效果显著,优于仅接受常规治疗的对照组[25]。临床上,超声引导下筋膜间隙注射治疗,通过在纤维化的肌肉筋膜间隙注射消炎镇痛药物,也可减轻肌肉炎症,减缓肌肉纤维化进程,可能对肌肉纤维化有较好的疗效。
6.物理康复治疗手段:现有的一些常规的物理治疗手段可部分改善患者因放疗后肌肉纤维化导致的功能障碍。①按摩疗法:通过专业的按摩技术,如按、揉、摩等手法作用于受影响的肌肉和周围组织,可以帮助改善血液循环,促进代谢废物的排除,减轻肌肉纤维化导致的硬化和疼痛,同时通过松解粘连的肌肉和皮肤改善功能障碍[26-27]。②超声波治疗:是一种非侵入式治疗手段,通过超声波产生的微振动和热效应,促进受影响区域的血液循环和组织修复,有助于软化肌肉纤维化区域,减轻痛感和改善功能[28-29]。③电刺激疗法:如使用高压脉冲电刺激或低频神经肌肉电刺激,改善硬化的肌肉,增强肌肉收缩功能,预防肌肉萎缩,对于改善肌肉纤维化有一定的积极作用。④音频电治疗:这是一种利用特定频率的电流刺激肌肉或神经组织,以达到促进血液循环、缓解疼痛、减轻炎症和软化瘢痕组织的效果。音频电治疗可以帮助激活肌肉,防止肌肉萎缩,并通过电刺激改善组织的修复和再生[29]。⑤运动疗法:包括被动、主动和抗阻力运动,旨在恢复和提升肌肉强度、灵活性和整体功能。运动疗法还可以帮助减轻疼痛、提高患者的生活质量。⑥蜡疗:通过蜡的热效应,促进血液循环、消除炎症、镇痛、消除肿胀,软化肌肉纤维化区域,减轻硬化感。⑦矫形器使用:对于肌肉纤维化导致的关节功能障碍或畸形,矫形器可以提供必要的支撑和保护,帮助维持关节的正常位置和功能,预防进一步的功能损害。⑧磁振热治疗:磁振热治疗是一种利用磁场和振动能量产生热效应的治疗方式,通过提高受影响区域的温度,帮助放松肌肉,减轻疼痛,改善血液循环,促进受损组织的修复。它特别适用于深层组织的治疗,因为磁场能够深入皮下组织,直达受损部位[28]。⑨光疗法:光疗法包括使用不同波长的光源,如红外线、激光、LED光等,来治疗各种软组织问题。光疗法可以促进血液循环,加速细胞的修复和再生,减轻炎症和疼痛。特别是红外线治疗,它通过温和的热效应深入肌肉和关节,帮助缓解疼痛,减少肌肉紧张和僵硬。
7.耐力运动对心肌纤维化患者康复的影响:有研究发现,一些耐力运动员表现出心肌纤维化和较高的冠状动脉钙化(CAC)评分。耐力运动与心肌纤维化之间可能存在一种剂量-反应关系,提示了过度的耐力运动可能对心脏有害。而更明确的相关性则需要更多的研究来验证及探讨,并确定适当的运动量,以优化对于放疗后肌肉纤维化患者的运动康复策略的制定[30]。放疗后肌肉纤维化的物理康复手段应结合患者的具体情况和需求,采取个性化的康复计划。这可能包括上述一种或多种治疗方法的组合,以达到最佳的治疗效果。
8.目前治疗策略的有效性和局限性:①药物治疗:现有药物,如血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体拮抗剂和盐皮质激素受体拮抗剂等,在减少胶原沉积和改善心脏功能方面已显示出一定的疗效[31-34]。这些药物可以通过降低前胶原C蛋白酶(procollagen C proteinase,PCP)活化和赖氨酰氧化酶(lysyl oxidase, LOX)表达来减少纤维化, 但是目前这些药物主要针对已经发生的症状和纤维化,而不是阻止纤维化过程[35]。②分子靶向治疗:靶向关键分子的药物,如靶向TGFβ1信号传导的pamrevlumab、靶向miR-21的抗miR策略和利用miRNA-29a模拟物的Remlarsen,已显示出减弱纤维化过程的潜力,特别是在放射性核素纤维化中[9]。但这些治疗方法是仍处于开发和测试阶段,长期疗效和安全性需要额外的临床数据支持。③新兴疗法:在一些初步研究中,高压氧疗法和干细胞疗法显示出减少纤维化的潜力。它们可以通过改善组织中的缺氧条件或促进组织修复和再生来减少纤维化。但这些方法的有效性和安全性尚未在大规模临床试验中得到充分证明。此外,高成本和技术要求可能会限制它们的普及。患者个体化治疗需求:个体对肌肉纤维化的易感性和反应存在显著差异,这可能与遗传背景、合并症和治疗相关因素有关。治疗方案需要考虑个体疾病特征、遗传标志物和疾病分期,例如,根据个体的遗传标记选择特定的分子靶向疗法。④联合治疗方法:结合药理学、分子靶向和新兴治疗方法,为特定个体实现最佳疗效。
四、未来研究方向与挑战放射性纤维化(RIF)的详细分子机制仍有待深入研究,特别是肌成纤维细胞的活化过程和细胞外基质的沉积。随后深入探索RIF的病理过程,研究RIF在不同器官(如心脏、肺、皮肤等)的独特表现和病理过程[11]。其次进行遗传因素分析,探索影响个体对RIF发展反应的遗传背景和环境因素。再次,对于靶向治疗方法,还需要进一步优化和个性化,以开发针对TGF-β、CTGF和PDGF等关键分子的治疗策略[12]。最后,新药的开发和优化以及新兴治疗方法的评估,例如干细胞疗法、小分子药物、抗体疗法的安全性和有效性仍需进一步探索。
未来研究方向和潜在治疗方法有待创新。①深入的机制研究:研究纤维化过程的详细分子机制,特别是探究肌成纤维细胞活化、细胞外基质合成和重塑的机制。了解不同器官纤维化的具体机制,例如肺纤维化和心脏纤维化之间的区别。有研究发现在纤维化肺中观察到CTGF表达增加,并且在几种动物模型中显示抑制CTGF信号传导可抑制肺纤维化,故CTGF信号通路正在成为IPF(特发性肺纤维化)和其他肺纤维化疾病的潜在治疗靶点[24]。②开发新的治疗策略:开发新的分子靶向疗法,例如靶向特定信号通路的小分子药物、抗体疗法和RNA干扰策略。探索更直接影响细胞外基质的药物,例如抑制胶原交联的酶抑制剂。③改进诊断工具:开发更灵敏、非侵入性的诊断工具,如先进的成像技术和生物标志物检测[28]。使用人工智能和机器学习技术分析大数据进行预测纤维化风险和治疗反应。④个体化治疗优化:整合多种数据(如遗传、表型和临床数据),制定更精确的治疗方案。通过临床试验验证个体化治疗策略的有效性。⑤扩大临床试验:对不同类型的纤维化疾病进行更广泛的临床试验,以验证新药和治疗方法的有效性[10]。⑥探索多药联合疗法和综合治疗方法的潜力:未来的研究应侧重于对RIF的更深入的机制理解、靶向治疗的开发和优化、新诊断工具的临床应用以及治疗计划中的个体差异考虑。这些努力将有助于提高治疗效果,减轻与放射治疗相关的肌肉纤维化等不良反应,改善患者的生活质量。
RIMF是影响放射治疗患者长期健康和生活质量的重要并发症。病理生理机制包括电离辐射的直接DNA损伤、炎症反应的激活、肌成纤维细胞的过度激活和细胞外基质的异常沉积等。RIMF的诊断依赖于对临床症状、影像学检查和生物标志物监测的综合评估。治疗方案多种多样,包括传统的抗炎药、抗氧化剂和靶向TGF-β、CTGF、PDGF等分子的新型治疗策略。干细胞疗法和全面的康复训练也为患者康复提供了新的视角。展望未来,深入研究RIMF的分子机制,探索个性化治疗方案及其临床应用将是研究和临床工作的重点。
利益冲突 所有作者均声明本研究不存在利益冲突
作者贡献声明 黎芸综述,刘夕霞审校
| [1] |
López B, Ravassa S, Moreno MU, et al. Diffuse myocardial fibrosis: mechanisms, diagnosis and therapeutic approaches[J]. Nat Rev Cardiol, 2021, 18(7): 479-498. DOI:10.1038/s41569-020-00504-1 |
| [2] |
Wang B, Wei J, Meng L, et al. Advances in pathogenic mechanisms and management of radiation-induced fibrosis[J]. Biomed Pharmacother, 2020, 121: 109560. DOI:10.1016/j.biopha.2019.109560 |
| [3] |
Piper M, Mueller AC, Karam SD. The interplay between cancer associated fibroblasts and immune cells in the context of radiation therapy[J]. Mol Carcinog, 2020, 59(7): 754-765. DOI:10.1002/mc.23205 |
| [4] |
Taylor CT, Scholz CC. The effect of HIF on metabolism and immunity[J]. Nat Rev Nephrol, 2022, 18(9): 573-587. DOI:10.1038/s41581-022-00587-8 |
| [5] |
Albadari N, Deng S, Li W. The transcriptional factors HIF-1 and HIF-2 and their novel inhibitors in cancer therapy[J]. Expert Opin Drug Discov, 2019, 14(7): 667-682. DOI:10.1080/17460441.2019.1613370 |
| [6] |
Wei X, Hou Y, Long M, et al. Molecular mechanisms underlying the role of hypoxia-inducible factor-1α in metabolic reprogramming in renal fibrosis[J]. Front Endocrinol (Lausanne), 2022, 13: 927329. DOI:10.3389/fendo.2022.927329 |
| [7] |
Straub JM, New J, Hamilton CD, et al. Radiation-induced fibrosis: mechanisms and implications for therapy[J]. J Cancer Res Clin Oncol, 2015, 141(11): 1985-1994. DOI:10.1007/s00432-015-1974-6 |
| [8] |
Drabsch Y, ten Dijke P. TGF-β signalling and its role in cancer progression and metastasis[J]. Cancer Metastasis Rev, 2012, 31(3-4): 553-568. DOI:10.1007/s10555-012-9375-7 |
| [9] |
Distler J, Györfi AH, Ramanujam M, et al. Shared and distinct mechanisms of fibrosis[J]. Nat Rev Rheumatol, 2019, 15(12): 705-730. DOI:10.1038/s41584-019-0322-7 |
| [10] |
Arina A, Gutiontov SI, Weichselbaum RR. Radiotherapy and immunotherapy for cancer: from "systemic" to "multisite"[J]. Clin Cancer Res, 2020, 26(12): 2777-2782. DOI:10.1158/1078-0432.CCR-19-2034 |
| [11] |
Sutherland TE, Dyer DP, Allen JE. The extracellular matrix and the immune system: A mutually dependent relationship[J]. Science, 2023, 379(6633): eabp8964. DOI:10.1126/science.abp8964 |
| [12] |
Burley A, Rullan A, Wilkins A. A review of the biology and therapeutic implications of cancer-associated fibroblasts (CAFs) in muscle-invasive bladder cancer[J]. Front Oncol, 2022, 12: 1000888. DOI:10.3389/fonc.2022.1000888 |
| [13] |
Eskandari-Malayeri F, Rezaei M. Immune checkpoint inhibitors as mediators for immunosuppression by cancer-associated fibroblasts: A comprehensive review[J]. Front Immunol, 2022, 13: 996145. DOI:10.3389/fimmu.2022.996145 |
| [14] |
Martinez-Zubiaurre I, Hellevik T. Cancer-associated fibroblasts in radiotherapy: Bystanders or protagonists?[J]. Cell Commun Signal, 2023, 21(1): 108. DOI:10.1186/s12964-023-01093-5 |
| [15] |
Wang Z, Tang Y, Tan Y, et al. Cancer-associated fibroblasts in radiotherapy: challenges and new opportunities[J]. Cell Commun Signal, 2019, 17(1): 47. DOI:10.1186/s12964-019-0362-2 |
| [16] |
Feng B, Wu J, Shen B, et al. Cancer-associated fibroblasts and resistance to anticancer therapies: status, mechanisms, and countermeasures[J]. Cancer Cell Int, 2022, 22(1): 166. DOI:10.1186/s12935-022-02599-7 |
| [17] |
Joshi RS, Kanugula SS, Sudhir S, et al. The role of cancer-associated fibroblasts in tumor progression[J]. Cancers (Basel), 2021, 13(6): 1399. DOI:10.3390/cancers13061399 |
| [18] |
Mao X, Xu J, Wang W, et al. Crosstalk between cancer-associated fibroblasts and immune cells in the tumor microenvironment: new findings and future perspectives[J]. Mol Cancer, 2021, 20(1): 131. DOI:10.1186/s12943-021-01428-1 |
| [19] |
Yu Z, Xu C, Song B, et al. Tissue fibrosis induced by radiotherapy: current understanding of the molecular mechanisms, diagnosis and therapeutic advances[J]. J Transl Med, 2023, 21(1): 708. DOI:10.1186/s12967-023-04554-0 |
| [20] |
Spoladore R, Falasconi G, Fiore G, et al. Cardiac fibrosis: emerging agents in preclinical and clinical development[J]. Expert Opin Investig Drugs, 2021, 30(2): 153-166. DOI:10.1080/13543784.2021.1868432 |
| [21] |
Flores-Vergara R, Olmedo I, Aránguiz P, et al. Communication between cardiomyocytes and fibroblasts during cardiac ischemia/reperfusion and remodeling: roles of TGF-β, CTGF, the renin angiotensin axis, and non-coding RNA molecules[J]. Front Physiol, 2021, 12: 716721. DOI:10.3389/fphys.2021.716721 |
| [22] |
Klinkhammer BM, Floege J, Boor P. PDGF in organ fibrosis[J]. Mol Aspects Med, 2018, 62: 44-62. DOI:10.1016/j.mam.2017.11.008 |
| [23] |
林丽莉, CaiHong-yi. 放射性直肠炎内科治疗的研究进展[J]. 中国临床新医学, 2022, 15(5): 457-461. Lin LL, Cai H. Research progress in the medical therapy of radiation proctitis[J]. Chin J New Clin Med, 2022, 15(5): 457-461. DOI:10.3969/j.issn.1674-3806.2022.05.19 |
| [24] |
Kendall RT, Feghali-Bostwick CA. Fibroblasts in fibrosis: novel roles and mediators[J]. Front Pharmacol, 2014, 5: 123. DOI:10.3389/fphar.2014.00123 |
| [25] |
刘安娜, 陈秀英, 甘爱华, 等. 不同健康教育模式对提高鼻咽癌患者住院期间功能锻炼依从性的疗效观察[J]. 福建医药杂志, 2015, 37(4): 173-174. Liu AN, Chen XY, Gan AH, et al. Observation on the effect of different health education models on improving the compliance of functional exercise in patients with nasopharyngeal carcinoma during hospitalization[J]. Fujian Med J, 2015, 37(4): 173-174. DOI:10.3969/j.issn.1002-2600.2015.04.079 |
| [26] |
唐潇旖, 张曦元. 按摩治疗瘢痕的研究进展[J]. 中国实用医药, 2023, 18(9): 169-171. Tang XY, Zhang XY. Research progress of massage in the treatment of scar[J]. China Pract Med, 2023, 18(9): 169-171. DOI:10.14163/j.cnki.11-5547/r.2023.09.048 |
| [27] |
郭超南, 师红利, 任晓妍. 综合物理康复联合颈项肌肌力训练治疗颈椎病患者的临床效果观察[J]. 内科, 2021, 16(4): 433-435, 458. Guo CN, Shi HL, Ren XY. Clinical effect of comprehensive physical rehabilitation combined with cervical muscle strength training on patients with cervical spondylosis[J]. Internal Med, 2021, 16(4): 433-435, 458. DOI:10.16121/j.cnki.cn45-1347/r.2021.04.03 |
| [28] |
张福金. 高压脉冲电刺激疗法的原理及在疾病康复中的应用[J]. 现代康复, 1998, 2(5): 436-437. Zhang FJ. Principle and application of high voltage pulse electrical stimulation therapy in disease rehabilitation[J]. Modern Rehabil, 1998, 2(5): 436-437. DOI:10.3321/j.issn:1673-8225.1998.05.026 |
| [29] |
高高, 方祥. 烧伤后的康复治疗研究进展[J]. 中国医学创新, 2024, 21(3): 165-169. Gao G, Fang X. Research progress of rehabilitation treatment after burn injury[J]. Chin Med Innov, 2024, 21(3): 165-169. DOI:10.3969/j.issn.1674-4985.2024.03.039 |
| [30] |
Parry-Williams G, Sharma S. The effects of endurance exercise on the heart: panacea or poison?[J]. Nat Rev Cardiol, 2020, 17(7): 402-412. DOI:10.1038/s41569-020-0354-3 |
| [31] |
González A, Schelbert EB, Díez J, et al. Myocardial interstitial fibrosis in heart failure: biological and translational perspectives[J]. J Am Coll Cardiol, 2018, 71(15): 1696-1706. DOI:10.1016/j.jacc.2018.02.021 |
| [32] |
Zannad F, Radauceanu A. Effect of MR blockade on collagen formation and cardiovascular disease with a specific emphasis on heart failure[J]. Heart Fail Rev, 2005, 10(1): 71-78. DOI:10.1007/s10741-005-2351-3 |
| [33] |
Neff LS, Bradshaw AD. Cross your heart? Collagen cross-links in cardiac health and disease[J]. Cell Signal, 2021, 79: 109889. DOI:10.1016/j.cellsig.2020.109889 |
 2024, Vol. 44
2024, Vol. 44


