随着放射治疗技术的不断进步,精准放疗已逐渐成为研究和实践的焦点[1]。该技术的核心目标在于实现更为精确和高效的剂量投递,确保肿瘤受到足够治疗的同时,最大限度地减少对周围健康组织的损伤[2]。然而,在实际应用中,照射剂量的准确性常受到多种因素的影响。其中,呼吸引起的肿瘤运动[3]、器官体积变化导致的肿瘤形变[4]以及患者在放疗过程中的摆位误差[5],是最为突出的三大问题。特别是在胸腹部区域,呼吸运动被认为是导致照射剂量不准确的最主要因素[6]。
肺部肿瘤由于其位置的特殊性,受呼吸运动的影响尤为显著[7]。放射治疗过程中,为确保肿瘤受到充分照射,临床医生通常会扩大照射靶区,这不可避免地会对肿瘤周围的正常肺组织造成一定损伤[8-9]。这种损伤不仅可能引发一系列并发症,还可能影响患者的生存质量[10]。近些年,四维计算机体层成像(4DCT)定位与呼吸门控技术的出现,为提高肺癌患者放疗的精度和安全性提供了重要的支持。4DCT定位技术可以准确地模拟人体在生理运动下的组织运动情况,呼吸门控技术通过跟踪患者的呼吸频率和幅度,确保射线束在呼吸周期的最佳时相内对肿瘤进行照射,从而减少了正常肺组织的损伤[11]。但是呼吸门控技术需要在特定的呼吸时相内进行照射,这可能导致治疗时间的延长。技术员需要在模拟定位时界定呼吸阈值,只有当呼吸阈值达到触发区间时才触发加速器出束治疗,这增加了技术员的工作量和患者的治疗周期。因此,如何有效预测肺部肿瘤的运动轨迹,在精准放疗的基础上提升放疗效率,已成为当前研究的热点问题[12]。
目前,预测肺部肿瘤运动轨迹的方法主要分为有标记物预测和无标记物预测两大类(图 1)。前者通常依赖于植入或外部的标记物来追踪肿瘤的运动,而后者则利用医学影像技术直接分析肿瘤的运动。本综述旨在对近些年国内外在肺部肿瘤运动轨迹预测领域的研究成果进行全面回顾,以期为该领域的进一步研究提供有价值的参考。
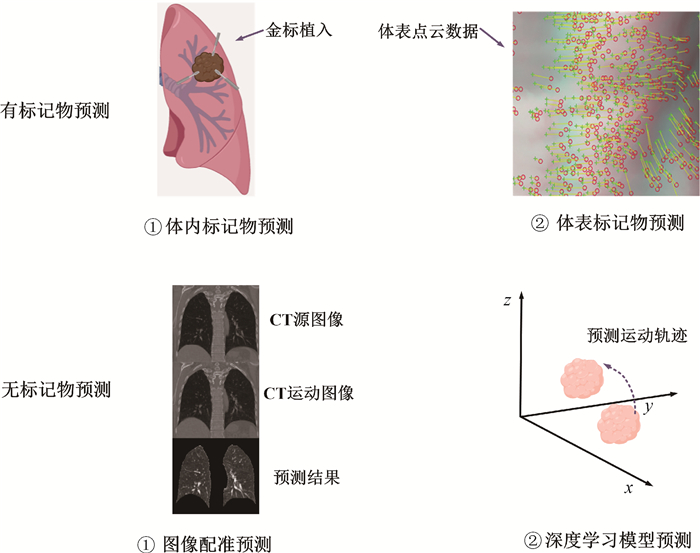
|
图 1 肿瘤运动轨迹预测方法 Figure 1 Prediction of the motion trajectories of lung tumors |
一、有标记物预测
基于标记物的肺部肿瘤运动轨迹预测是一种在放射治疗领域中具有重要应用价值的方法。通过在肿瘤周围精心放置标记物或使用外部替代品来保持与肿瘤的关联,该方法能够实时监测并预测肿瘤的运动路径。目前,常用的标记物主要分为体内标记物和体表标记物两类。
1.体内标记物预测:Shirato等[13]在2000年首次尝试在人体内植入直径为2 mm的金标记物。通过动态X射线影像技术,评估了标记物与肺部肿瘤在不同呼吸阶段的三维空间关系,实现了对肺部肿瘤运动轨迹的实时预测。然而,这种方法的有效性建立在一个关键假设之上,即金标记物在整个放疗过程中保持相对静止,但这一假设在实际应用中并不总是成立。随后,Vemprala等[14]采用了一种更先进的方法,使用相关滤波技术来跟踪金标记物的运动,并利用术前的CT图像来确定标记物的位置,进而预测肺部肿瘤的运动轨迹。这种方法不仅适用于不同部位的肿瘤预测,而且有效避免了金标记物形变所带来的干扰。除了金标记物外,Houde等[15]还探索了使用永磁体作为体内标记物的可能性。研究发现,植入永磁体不仅可以实现对直线加速器的自适应运动控制,还可以连续监测不同放疗周期之间肿瘤体积的缩小情况。
尽管体内标记物预测方法具有较高的准确性,但它们也存在一些明显的局限性。首先,植入标记物需要对患者进行有创操作,这不仅增加了患者的身体负担,还可能导致标记物在患者移动过程中发生移位或脱落。更重要的是,植入标记物可能会引发不同程度的不良反应,最高可达3级,从而对患者的安全构成潜在威胁[16]。
2.体表标记物预测:鉴于体内标记物预测方法的局限性和潜在风险,目前临床上通过捕捉体表标记物的运动信息来预测肺部肿瘤的运动轨迹[17-18]。在放疗过程中,患者只需穿上带有标记点的背心,标记点的运动变化即可通过照相机实时记录下来。根据这些标记点的运动信息,医生可以准确推测肺部肿瘤的运动变化,该方法主要依赖于建立一个反映体表标记物与体内肿瘤之间关系的模型[19]。然而,呼吸运动和放疗的进展可能会改变这种关系,导致预测精度低[20]。黄泰茗等[21]开发了一种基于体表标记物的预测方法,采用双目视觉表面成像技术获取体表点云数据,通过主成分分析提取特征信息,使用随机森林算法拟合特征信息差与肿瘤位置差,从而构建肺部肿瘤运动轨迹的在线预测模型。该模型在3个方向上的预测均方根误差均达到亚毫米级,为临床放疗提供了有价值的参考。
基于标记物的肺部肿瘤运动轨迹预测方法在临床应用中具有显著价值,能够帮助医生更深入地了解肿瘤的运动规律,从而提高治疗的准确性和效果。然而,该方法仍面临一些挑战和问题,如标记物的选择与制备、运动轨迹数据处理的复杂性以及标记物可能带来的不良反应等[22-24]。因此,未来的研究需要进一步优化和完善这一方法,以期在提高治疗效果的同时确保患者的安全。
二、无标记物预测在不使用标记物的情况下,预测肺部肿瘤在呼吸运动中的位移,一种行之有效的方法是利用医学影像技术,并结合计算机图像处理和深度学习模型。这种方法主要依赖于高精度的医学影像获取技术以及先进的图像分析和处理算法。
1.基于图像配准预测:Adler等[25]研发的CyberKnife系统是图像配准预测领域的早期代表之一。该系统通过结合X射线和光学成像技术,实现了对肺部肿瘤运动轨迹的预测。具体来说,CyberKnife系统采用了两个安装在天花板上的X射线管,其射线与垂直方向成45°角,从而提供了正交立体图像对。通过这些图像对,可以获取肿瘤的三维(three dimensions, 3D)位置信息。此外,新版CyberKnife系统还通过最接近肿瘤的脊椎来做CT图像和实时X光的配准,预估肿瘤所在位置,采集与肿瘤本身相关度高的图像做实时配准,进一步提高了预测精度[26]。然而,该系统价格昂贵,限制了其在临床实践中的广泛应用。
为了克服CyberKnife系统的局限性,Min等[27]提出了一种基于4DCT图像的贝叶斯配准和轨迹建模方法。该方法首先选择吸气末阶段捕获的CT图像作为源图像,其他阶段捕获的CT图像作为运动图像;然后,利用刚性配准方法将源图像与每个运动相位图像进行对齐,以消除图像之间的全局差异;接着,采用贝叶斯配准方法生成位移场,该位移场描述了从源图像到运动图像的局部变形;最后,通过连接离散相位的位移场,建立了一个基于连续时间相关位移场的肺部肿瘤运动轨迹模型。该模型可以在任何给定时间准确预测肺部肿瘤位置,为放疗计划制定提供了重要的参考信息。
与CyberKnife系统相比,基于4DCT图像的贝叶斯配准和轨迹建模方法具有较低的成本和更广泛的适用性。它不需要昂贵的硬件设备,只需要获取患者的4DCT图像数据即可进行分析和处理。此外,该方法还可以根据患者的具体情况进行个性化建模,提高了预测的准确性和可靠性。因此,该方法在肺部肿瘤运动轨迹预测领域具有广阔的应用前景。
2.基于深度学习模型预测:构建深度学习模型预测肿瘤运动轨迹是近些年的研究热点[28-31]。深度学习模型由多层非线性变换组成,具有强大的特征学习能力[32]。在图像引导放射治疗的背景下,3D医学成像因其丰富的解剖和结构信息而不可或缺。然而3D成像采集速度缓慢。相比之下,2D成像提供了更快的速度,尽管以牺牲详细的空间信息为代价。深度学习模型在2D与3D图像之间的转换已经得到了广泛的应用。Liu等[33]提出了一种全新的坐标神经网络表示方法,该方法结合了患者的4DCT图像和单千伏2D投影数据,预测特定呼吸相位的3D体积图像,将4DCT图像分解为模板图像和变形场,并利用两种基于坐标的神经网络进行预测,从而实现了肺部运动的亚毫米级预测精度。Shen等[34]训练深度神经网络学习2D投影和3DCT图像之间的特征空间转换,利用该训练模型从前后单投影图像中获取新的体CT图像。在此基础上,Lei等[35]提出了一种由感知监督的生成对抗网络,从单个投影生成体积图像,从而在肺部立体定向治疗期间获得更准确的3D肺部图像。Shao等[36]将图神经网络的深度学习与有限元建模相结合,构建了基于单角度投影的2D/3D对齐框架,完成了肝脏肿瘤的轨迹预测,但有限元的引入也给对齐时间带来了一些麻烦。因此,Dai等[37]基于利用混合数据增强,样式校正和swin-transformer网络创建从单角度2D X射线图像到相应3D肺部肿瘤的映射关系,这是一种实时、高精度、低剂量的单角度肿瘤轨迹预测方法,该方法虽然获得了良好的预测精度,但是在后续的研究中发现,咳嗽和打喷嚏等动态呼吸对预测结果有较大的影响。
在动态呼吸期间提供在线和最新的肿瘤体积信息可以改善预测结果。在这项工作中,Roeske等[38]提出一种基于肿瘤模板匹配的预测算法。该方法通过肿瘤的外观和形状来缩小模板匹配区域,并在预测过程中估计肿瘤的形变。然而,该方法需要准确的肿瘤形状作为先验知识,因此在实际应用中存在一定的局限性。同时,该方法也无法跟踪肺部大血管和大气管,不适用于所有肺部治疗手术。Romaguera等[39]则提出了一种基于种群的生成网络来解决放疗期间基于2D图像对3D目标肿瘤位置预测的问题。该模型以无监督的方式进行训练,从生成网络中学习各种3D变形群体的紧凑流形表示;该研究还提出了一种新的概率模型来解决放疗期间基于图像的替代物的可扩展预测视界的体积估计问题,从而更好地应对咳嗽和打喷嚏等动态呼吸带来的误差[40]。
当前的研究在基于图像配准技术和深度学习建模来预测肿瘤运动轨迹的领域已经取得了显著的进展。这一成果的取得,在很大程度上得益于大量计算机科学和其他工科领域的人才积极参与到肿瘤轨迹预测的研究中来,利用图像处理、深度学习、数据分析等领域的专业知识,结合临床医学的实际需求,共同推动该领域的发展。这种跨学科的合作不仅为临床医生提供了新的思路和方法,也为肿瘤治疗提供了更加精准和个性化的方案。医生可以根据预测的肿瘤运动轨迹,制定出更加合理的治疗计划,从而提高治疗效果,减少患者的痛苦和不良反应。
三、总结与展望尽管放射治疗是肺部肿瘤的有效治疗方法,但由于呼吸运动的影响,放射线难以精确照射肺部肿瘤。为了解决这一问题,肿瘤运动轨迹预测技术得到了广泛研究。本文对目前常用的肿瘤运动轨迹预测技术进行综述,并展望未来的研究方向。未来的研究可以从以下几个方面展开:①结合肿瘤位置设计特定预测模型:针对不同位置的肺部肿瘤,设计特定的预测模型,以提高预测的准确性。例如,当肿瘤靠近肋骨时,可以采用消除肋骨影响的模型来提高预测精度。②扩展预测模型适用范围:在放疗过程中,呼吸不仅会导致肺部肿瘤发生位移,还会导致其他器官发生偏移。因此,未来的研究可以进一步扩展预测模型的适用范围,将其应用于其他器官肿瘤轨迹的预测。③多模态影像协同引导精准放疗:通过结合不同模态的医学影像,可以更全面地观察放疗过程中肿瘤的变化,提高预测的准确性。此外,利用多模态影像还可以跟踪靶区和正常组织的运动,对治疗计划进行实时修正,确保实际治疗效果与预订计划一致,从而提高患者靶区精准照射效果。④优化数据处理和分析方法:改进现有的数据处理和分析方法,以提高肿瘤运动轨迹预测的精度和效率。例如,采用更先进的计算机图像处理技术、深度学习算法等手段,对采集的影像数据进行深入分析和挖掘。⑤临床验证和应用:将预测模型应用于临床实践,通过对照实验等方式评估其实际效果和价值。同时,根据临床反馈不断优化和改进模型,提高其在真实环境下的预测精度和可靠性。
总之,随着医学影像技术和计算机图像处理技术的不断发展,肿瘤运动轨迹预测技术有望在未来得到更广泛的应用和改进。通过不断优化和改进现有的方法和技术,有望为肺部肿瘤患者提供更加精准、有效的放疗方案,提高治疗效果和生活质量。
利益冲突 无
作者贡献声明 张宇涛负责论文撰写;倪昕晔指导论文修改
| [1] |
张晓智, 杨蕴一, 孙宇晨, 等. 精准放疗的现状与进展[J]. 西安交通大学学报(医学版), 2020, 41(5): 633-638. Zhang XZ, Yang YY, Sun YC, et al. Current status and progress of precision radiotherapy[J]. J Xi'an Jiaotong Univ(Med Sci), 2020, 41(5): 633-638. DOI:10.7652/jdyxb202005001 |
| [2] |
Bondesson D, Meijers A, Janssens G, et al. Anthropomorphic lung phantom based validation of in-room proton therapy 4D-CBCT image correction for dose calculation[J]. Z Med Phys, 2022, 32(1): 74-84. DOI:10.1016/j.zemedi.2020.09.004 |
| [3] |
景生华, 王振, 蒋长晨, 等. 三维实时腹部肿瘤追踪门控放疗技术研究[J]. 医疗卫生装备, 2021, 42(7): 35-39. Jing SH, Wang Z, Jiang CC, et al. Study on three-dimensional real-time tracking and gated radiotherapy for abdominal tumors[J]. Chin Med Equip, 2021, 42(7): 35-39. DOI:10.19745/j.1003-8868.2021140 |
| [4] |
詹梦娜, 郭昌, 尹丽, 等. 放疗中肿瘤实时监测与追踪技术的研究进展[J]. 中华放射肿瘤学杂志, 2021, 30(6): 643-647. Zhan MN, Guo C, Yin L, et al. Research progress on real-time tumor monitoring and tracking technology in radiotherapy[J]. Chin J Radiat Oncol, 2021, 30(6): 643-647. DOI:10.3760/cma.j.cn113030-20210107-00011 |
| [5] |
王雯, 马隆波, 孙晓娟, 等. 肺癌立体定向放射治疗摆位误差分析[J]. 内蒙古医学杂志, 2022, 54(7): 870-873. Wang W, Ma LB, Sun XJ, et al. Analysis of setup errors in stereotactic body radiation therapy for lung cancer[J]. Inner Mongo Med J, 2022, 54(7): 870-873. DOI:10.16096/j.cnki.nmgyxzz.2022.54.07.032 |
| [6] |
Niepel K, Kamp F, Kurz C, et al. Feasibility of 4DCBCT-based proton dose calculation: An ex vivo porcine lung phantom study[J]. Z Med Phys, 2019, 29(3): 249-261. DOI:10.1016/j.zemedi.2018.10.005 |
| [7] |
Sarudis S, Karlsson A, Nyman J, et al. Dosimetric effects of respiratory motion during stereotactic body radiation therapy of lung tumors[J]. Acta Oncol, 2022, 61(8): 1004-1011. DOI:10.1080/0284186X.2022.2092420 |
| [8] |
Itonaga T, Sugahara S, Mikami R, et al. Evaluation of the relationship between the range of radiation-induced lung injury on CT images after IMRT for stage Ⅰ lung cancer and dosimetric parameters[J]. Ann Med, 2021, 53(1): 267-273. DOI:10.1080/07853890.2020.1869297 |
| [9] |
Liu G, Zhao L, Qin A, et al. Lung stereotactic body radiotherapy (SBRT) using spot-scanning proton arc(SPArc) therapy: a feasibility study[J]. Front Oncol, 2021, 11: 664455. DOI:10.3389/fonc.2021.664455 |
| [10] |
Machitori Y, Ito K, Kito S, et al. Local control of stereotactic body radiotherapy with dynamic tumor tracking for lung tumors: a propensity score-matched analysis[J]. Jpn J Clin Oncol, 2022, 52(6): 609-615. DOI:10.1093/jjco/hyac003 |
| [11] |
Høgsbjerg K, Maae E, Pedersen A, et al. OC-0766 Gain from respiratory gating in left-sided partial breast irradiation in the DBCG PBI trial[J]. Radiother Oncol, 2023, 182(S1): S632-S633. DOI:10.1016/S0167-8140(23)08707-8 |
| [12] |
Hiraoka M, Mizowaki T, Matsuo Y, et al. The gimbaled-head radiotherapy system: rise and downfall of a dedicated system for dynamic tumor tracking with real-time monitoring and dynamic wavearc[J]. Radiother Oncol, 2020, 153: 311-318. DOI:10.1016/j.radonc.2020.07.002 |
| [13] |
Shirato H, Shimizu S, Kitamura K, et al. Four-dimensional treatment planning and fluoroscopic real-time tumor tracking radiotherapy for moving tumor[J]. Int J Radiat Oncol Biol Phys, 2000, 48(2): 435-442. DOI:10.1016/s0360-3016(00)00625-8 |
| [14] |
Vemprala S, Saripalli S, Vargas C, et al. Real-time tumor tracking for pencil beam scanning proton therapy[C]. IEEE/RSJ Internatio Confere on IROS, 2018: 4434-4440. DOI: 10.1109/IROS.2018.8593861.
|
| [15] |
Houde D, Lifei D, Bowen L, et al. Feasibility study of permanent magnet-based tumor tracking technique for precise lung cancer radiotherapy[J]. IEEE Trans Instrum Meas, 2021, 70: 1-9. DOI:10.1109/TIM.2020.3039645 |
| [16] |
van der Voort van Zyp NC, Prévost JB, Hoogeman MS, et al. Stereotactic radiotherapy with real-time tumor tracking for non-small cell lung cancer: clinical outcome[J]. Radiother Oncol, 2009, 91(3): 296-300. DOI:10.1016/j.radonc.2009.02.011 |
| [17] |
Dhont J, Harden SV, Chee L, et al. Image-guided radiotherapy to manage respiratory motion: lung and liver[J]. Clin Oncol(R Coll Radiol), 2020, 32(12): 792-804. DOI:10.1016/j.clon.2020.09.008 |
| [18] |
Olick-Gibson J, Cai B, Zhou S, et al. Feasibility study of surface motion tracking with millimeter wave technology during radiotherapy[J]. Med Phys, 2020, 47(3): 1229-1237. DOI:10.1002/mp.13980 |
| [19] |
Freislederer P, Kügele M, Öllers M, et al. Recent advanced in surface guided radiation Therapy[J]. Radiat Oncol, 2020, 15(1): 187. DOI:10.1186/s13014-020-01629-w |
| [20] |
Sarudis S, Karlsson A, Bäck A. Surface guided frameless positioning for lung stereotactic body radiation therapy[J]. J Appl Clin Med Phys, 2021, 22(9): 215-226. DOI:10.1002/acm2.13370 |
| [21] |
黄泰茗, 管棋, 钟嘉健, 等. 基于体表运动监测预测肺部肿瘤靶区运动可行性研究[J]. 中华放射肿瘤学杂志, 2023, 32(2): 138-144. Huang TM, Guan Q, Zhong JJ, et al. Feasibility study of predicting lung tumor target movement based on body surface motion monitoring[J]. Chin J Radiat Oncol, 2023, 32(2): 138-144. DOI:10.3760/cma.j.cn113030-20211102-00449 |
| [22] |
Xu C, Sun J, Zhang W, et al. The safety and efficacy of Cyberknife® for thymic malignancy[J]. Cancer Radiother, 2021, 25(2): 119-125. DOI:10.1016/j.canrad.2020.06.026 |
| [23] |
于松茂, 周舜, 杜乙, 等. Catalyst HD和皮肤标记线肺癌SBRT摆位精度比较叮[J]. 中华放射肿瘤学杂志, 2019, 28(10): 772-775. Yu SM, Zhou S, Du Y, et al. Comparison of setup accuracy between Catalyst HD and skin markers in stereotactic body radiotherapy of lung cancer[J]. Chin J Radiat Oncol, 2019, 28(10): 772-775. DOI:10.3760/cma.j.issn.1004-4221.2019.10.012 |
| [24] |
Takahashi W, Oshikawa S, Mori S. Real-time markerless tumour tracking with patient-specific deep learning using a personalised data generation strategy: proof of concept by phantom study[J]. Br J Radiol, 2020, 93(1109): 20190420. DOI:10.1259/bjr.20190420 |
| [25] |
Adler JR Jr, Chang SD, Murphy MJ, et al. The Cyberknife: a frameless robotic system for radiosurgery[J]. Stereotact Funct Neurosurg, 1997, 69(1-4 Pt 2): 124-128. DOI:10.1159/000099863 |
| [26] |
Mochizuki Z, Saito M, Suzuki T, et al. Cycle-generative adversarial network-based bone suppression imaging for highly accurate markerless motion tracking of lung tumors for cyberknife irradiation therapy[J]. J Appl Clin Med Phys, 2024, 25(1): e14212. DOI:10.1002/acm2.14212 |
| [27] |
Min L, Xiang Z, Lian Z, et al. Prediction of lung motion from four-dimensional computer tomography (4DCT) images using bayesian registration and trajectory modelling[J]. IEEE Access, 2018, 6: 2803-2811. DOI:10.1109/ACCESS.2017.2785322 |
| [28] |
Kozuka T, Matsukubo Y, Kadoba T, et al. Efficiency of a computer-aided diagnosis (CAD) system with deep learning in detection of pulmonary nodules on 1-mm-thick images of computed tomography[J]. Jpn J Radiol, 2020, 38(11): 1052-1061. DOI:10.1007/s11604-020-01009-0 |
| [29] |
魏一娟, 潘宁, 陈岩, 等. 深度学习辅助诊断系统在胸片的应用研究: 气胸及肺结节检测[J]. 临床放射学杂志, 2021, 40(2): 252-257. Wei YJ, Pan N, Chen Y, et al. Application of deep learning-assisted diagnosis system in chest X-ray: detection of pneumothorax and pulmonary nodules[J]. J Clin Radiol, 2021, 40(2): 252-257. DOI:10.13437/j.cnki.jcr.2021.02.013 |
| [30] |
Wang YW, Chen CJ, Wang TC, et al. Multi-energy level fusion for nodal metastasis classification of primary lung tumor on dual energy CT using deep learning[J]. Comput Biol Med, 2022, 141: 105185. DOI:10.1016/j.compbiomed.2021.105185 |
| [31] |
李斌, 李科宇, 汤渝玲, 等. 基于深度学习的肺癌计算机辅助诊断[J]. 当代医学, 2021, 27(9): 89-93. Li B, Li KY, Tang YL, et al. Computer-aided diagnosis of lung cancer based on deep learning[J]. Contempor Medic, 2021, 27(9): 89-93. DOI:10.3969/j.issn.1009-4393.2021.09.035 |
| [32] |
Ladjial H, Beuve M, Giraud P, et al. Towards non invasive lung tumor tracking based on patient specific model of respiratory system[J]. IEEE Trans Biomed Eng, 2021, 68(9): 2730-2740. DOI:10.1109/TBME.2021.3053321 |
| [33] |
Liu C, Wang Q, Si W, et al. NuTracker: a coordinate-based neural network representation of lung motion for intrafraction tumor tracking with various surrogates in radiotherapy[J]. Phys Med Biol, 2022, 68(1): 015006. DOI:10.1088/1361-6560/aca873 |
| [34] |
Shen L, Zhao W, Xing L. Patient-specific reconstruction of volumetric computed tomography images from a single projection view via deep learning[J]. Nat Biomed Eng, 2019, 3(11): 880-888. DOI:10.1038/s41551-019-0466-4 |
| [35] |
Lei Y, Tian Z, Wang T, et al. Deep learning-based 3D image generation using a single 2D projection image[J]. SPIE-Int Soc Opt Eng Proc, 2021, 11596: 516-521. DOI:10.1117/12.2580796 |
| [36] |
Shao HC, Wang J, Bai T, et al. Real-time liver tumor localization via a single X-ray projection using deep graph neural network-assisted biomechanical modeling[J]. Phys Med Biol, 2022, 67(11): 115009-115016. DOI:10.1088/1361-6560/AC6B7B |
| [37] |
Dai J, Dong G, Zhang C, et al. Volumetric tumor tracking from a single cone-beam X-ray projection image enabled by deep learning[J]. Med Image Anal, 2024, 91: 102998. DOI:10.1016/j.media.2023.102998 |
| [38] |
Roeske J, Mostafavi H, Patel R, et al. Markerless tumor tracking using short arc digital tomosynthesis with fast-kV switching dual energy imaging[J]. Int J Radiat Oncol Biol Phys, 2020, 108(3): e291. DOI:10.1016/j.ijrobp.2020.07.696 |
| [39] |
Romaguera LV, Mezheritsky T, Mansour R, et al. Predictive online 3D target tracking with population-based generative networks for image-guided radiotherapy[J]. Int J Comput Assist Radiol Surg, 2021, 16(7): 1213-1225. DOI:10.1007/s11548-021-02425-x |
| [40] |
Romaguera LV, Mezheritsky T, Mansour R, et al. Probabilistic 4D predictive model from in-room surrogates using conditional generative networks for image-guided radiotherapy[J]. Med Image Anal, 2021, 74: 102250. DOI:10.1016/j.media.2021.102250 |
 2024, Vol. 44
2024, Vol. 44


