2. 广西医科大学第一附属医院放疗科, 南宁 530012
2. Department of Radiation Oncology, Frist Affiliated Hospital of Guangxi Medical University, Nanning 530012, China
旋转容积调强放疗(volumetric modulated arc therapy, VMAT)技术通过同步、连续地改变机架角度、多叶准直器(multi-leaf collimator, MLC)形状和剂量率,提高了靶区的剂量适形度并降低正常组织的受照剂量[1]。由于该技术复杂度较高,特别是加速器在不断出束的过程中,每一个控制点射野大小都是由MLC位置决定,MLC位置误差直接决定治疗剂量是否能正确分布。相关研究报道了MLC位置误差对鼻咽癌VMAT计划靶区和危及器官剂量学影响[2-4],然而很少报道相同的MLC位置误差是否对不同分期鼻咽癌靶区和正常器官剂量有不同影响。由于不同分期原发肿瘤位置和大小不相同,靠近危及器官距离不一样,这就导致在脑干和视交叉这些一类危及器官位置的剂量梯度有很大差异,使得计划之间的肿瘤和危及器官受照剂量和复杂度相差较大,相同方向和大小的MLC位置误差对这些计划可能会造成不同的影响。因此,本研究通过模拟不同大小的MLC位置系统误差,探讨不同分期鼻咽癌VMAT计划靶区和危及器官剂量差异程度,以期为临床精准化治疗提供参考。
资料与方法1. 病例选择:按照美国癌症联合委员会(AJCC)第8版分期原则[5],考虑到不同分期原发肿瘤对一类危及器官影响更大,本报道仅研究T1~4N1M0患者。回顾性收集广西医科大学第二附属医院放疗和广西医科大学第一附属医院放疗科在2019年5月至2023年3月上述分期鼻咽癌患者,T1、T2、T3、T4期各11例,共44例。患者年龄21~72岁,平均年龄48.8岁。T1和T2期患者鼻咽部计划原发肿瘤区(planning gross target volume, PGTV)为68~70 Gy/33次,T3和T4期患者PGTV为71 Gy/33次。颈部高危淋巴结计划靶区(planning target volume of node,PGTVnd)为68 Gy/33次,高危计划临床靶区(planning target volume 1,PTV1)为64 Gy/33次,预防计划临床靶区(planning target volume 2,PTV2)为54 Gy/33次。T1期PGTV大小为35~94 cm3(中位数56.8 cm3),T2期PGTV为42.6~105.3 cm3(中位数65.7 cm3),T3期PGTV为74.1~211 cm3 (中位数104.4 cm3),T4期PGTV大小为96~223 cm3(中位数157.4 cm3)。PGTVnd体积大小为32.4~98.63 cm3(中位数69.26 cm3)。
2. 计划设计:采用德国飞利浦Pinnacle Ver9.10计划系统。VMAT计划包含两条弧:一条弧机架角179°~181°,准直器角度为345°~355°;另一条弧机架角181°~179°,准直器角度为5°~15°。子野间隔3°,使用6 MV X射线,采用SmartArc优化方式。在美国Varian公司Vitalbeam上执行治疗,该加速器拥有60对叶片,中间40对叶片的宽度为0.5 cm,其余两侧叶片的宽度为1 cm。对于T1和T2期患者,正常器官剂量限制参考美国放射肿瘤治疗学组(RTOG)0615报告标准[6]。对于T3和T4期患者,为保证原发肿瘤覆盖(降低肿瘤复发率),根据文献[7-8] 以及结合本院临床经验(针对脑干等一类危及器官紧贴PGTV患者,1周需做2次锥形束CT),正常器官剂量限制可以相对放宽,本研究对T3和T4分期鼻咽癌患者的脑干、视交叉和脊髓的最大受照剂量限制分别为6 500、6 800和4 500 cGy,其余正常器官受照剂量尽量降低。所有计划都经高级医生确认审核,并最终批准。
3. 加速器运行误差模拟:将MLC位置误差分为随机误差和系统误差[3]。随机误差是指通过对高斯函数进行采样来确定增加或者减少MLC位置误差大小。系统误差是指所有叶片发生相同大小误差,这些误差又分为同向系统误差和异向系统误差。异向系统误差分为系统打开和系统闭合,系统打开和闭合是指两列MLC沿相反的方向移动相同误差,从而增大或者减少MLC间隙,导致子野增大或者减少。同向系统误差是指两列MLC沿相同的方向移动相同误差,MLC间隙没有变化,每个子野面积没有变化。研究发现,对于头颈部VMAT计划,同向系统误差和随机误差对靶区和危及器官剂量造成剂量差异远小于异向系统误差[3-4]。因此本报道仅研究异向系统误差对靶区和危及器官剂量影响。
提取每个初始计划的plan.Trial文件,使用Python3.6程序读取每个初始计划并修改每个控制点MLC叶片位置信息分别为以下两种形式:对初始计划的每个控制点分别引入两侧MLC叶片反向或相向运动误差,其幅度为±0.2、±0.5、±0.7和±1 mm。其中负号表示叶片内收,子野面积减少;正号表示叶片外扩,子野面积增大。考虑到Vitalbeam加速器MLC运动叶片间距至少为0.5 mm,当引入相向误差后,若某对叶片间距小于0.5 mm,则将该叶片间距改为0.5 mm,间距中心保持不变。新生成的误差文件替代原始plan文件,并重新进行剂量计算(调整MU与初始计划保持一致)。每个病例产生8个MLC位置误差计划,总计352个误差计划。
4. 评价指标:根据Lee等[9]在鼻咽癌放疗计划中剂量优先级和接受标准的国际指南中对脑干、脊髓和视交叉这3个危及器官列为1类权重,对GTV和GTVnd列为2类权重(其中37.5%认为应列为1类),所以本研究评价靶区指标仅为PGTV和PGTVnd的D98%(98%的体积所接受的照射剂,危及器官仅为脑干、脊髓和视交叉的D0.1 cm3(0.1 cm3体积受到照射剂量)。评估引入误差后的计划与原始计划两者之间的剂量偏差为%Ddiff:%Ddiff = (D引入误差-D初始)/D原始 ×100%,其中D引入误差为引入误差计划剂量,D初始为初始计划的剂量。表 1为本研究中所有患者初始剂量指标。
|
|
表 1 44例不同T分期鼻咽癌VMAT初始计划剂量指标(cGy,x±s) Table 1 Dose indices of the initial VMAT plan for 44 patients with different stages of nasopharyngeal carcinoma (cGy, x±s) |
5.统计学处理:采用SPSS 19.0软件对结果进行统计学处理,将上述评价指标剂量偏差随系统误差变化做线性回归分析,回归系数即该指标对MLC位置系统误差的敏感度,R2表示相关性强弱,R2越大则表示线性关系越强。采用Wilcoxon秩和检验评价MLC误差对不同T分期鼻咽癌各指标敏感度差异性。为了研究计划复杂度是否影响PGTV D98%敏感度,本研究使用MU/Gy(即计划机器跳数与单次PGTV处方剂量之间比值)作为一种简单的计划复杂度指标[10],这是因为MU/Gy这一指标可以减少单次剂量对MU的影响。使用Shapiro-Wilk检验所有误差计划的MU/Gy和PGTV D98%敏感度这两组变量数据是否符合正态分布。当两组数据符合正态分布时,使用Pearson相关系数评估这两组数据之间相关性,r>0.7表明两者关系呈强相关。P<0.05为差异有统计学意义。使用Origin 9.1软件对MU/Gy和PGTV D98%敏感度两组数据进行散点图绘制。
结果1. 剂量学偏差:表 2为44例不同T分期鼻咽癌患者引入不同大小MLC位置系统误差后的剂量偏差的平均值,其范围为-9.65%~11.64%。从表 2中可以看到,相同大小MLC位置内收系统误差大于MLC位置外扩系统误差对PGTV D98%和PGTVnd D98%的平均剂量偏差(除T4期0.2 mm误差)。而随着MLC位置误差增大,相同大小MLC位置外扩系统误差大于MLC位置内收系统误差对脊髓和脑干的D0.1 cm3平均剂量偏差。
|
|
表 2 44例TxN1M0期鼻咽癌患者VMAT计划引入MLC位置系统误差后的剂量偏差(%,x±s) Table 2 Dose deviations after introducing MLC positional errors in the VMAT plans for 44 nasopharyngeal carcinoma patients with TxN1M0 stages (%, x±s) |
2. 各指标敏感度大小:表 3为44例不同T分期鼻咽癌VMAT计划引入MLC位置系统误差后各剂量指标敏感度(%/mm),其范围为3.87~9.87(R2>0.9,P<0.01)。利用Wilcoxon秩和检验发现T4期PGTV D98%敏感度大于T1、T2和T3期(Z=-3.12、-2.86、-2.59,P<0.05),T3、T4期视交叉D0.1 cm3敏感度均小于T1和T2期(Z=-2.92、-2.72、-3.51、-3.25,P<0.05)。
|
|
表 3 44例不同T分期鼻咽癌VMAT计划引入MLC位置系统误差后各剂量指标敏感度(%/mm)和线性拟合方程 Table 3 Sensitivity (%/mm) and linear fitting-derived equations of dose indices after systematic errors induced by the positions of MLC leaves into VMAT plans for 44 patients with different T stages of NPC |
3. MU/Gy和PGTV D98%敏感度的关系:图 1为44例不同T分期鼻咽癌VMAT计划引入MLC位置系统误差后MU/Gy和PGTV D98%敏感度散点图。两者关系呈线性关系,其关系式为:y=-3.020+0.025x(r=0.80,P<0.05)。

|
图 1 MU/Gy和PGTV D98%敏感度散点图 Figure 1 Scatter plot of MU/Gy vs. the sensitivity of D98% of PGTV |
图 2,3分别显示1例T1期和1例T4期鼻咽癌VMAT初始计划以及分别引入1 mm MLC外扩位置和1 mm MLC内收位置系统误差横断面剂量图,这6幅图都为计划系统上显示第一层脊髓横断面图。图中紫色阴影部分为PGTV,棕色为脊髓,等剂量线是按照105%处方剂量开始,按照5%处方剂量进行递减直到50%处方剂量线结束。从图 2,3发现引入MLC位置系统误差后计划某等剂量线变化与初始计划其相邻两等剂量线(5%处方剂量)形状变化有关。例如引入1 mm外扩系统误差后计划的85%等剂量线与初始计划80%等剂量线形状相似,而引入1 mm内收系统误差后计划的75%等剂量线与初始计划80%等剂量线形状相似。
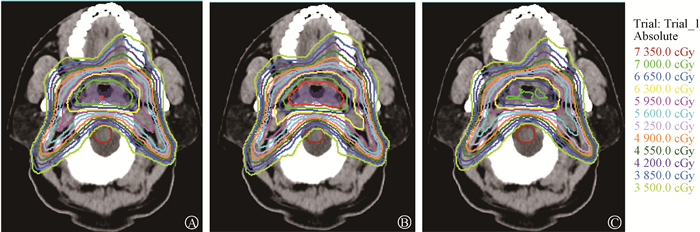
|
图 2 1例T1期鼻咽癌VMAT初始计划(A)以及分别引入1 mm ML C外扩位置系统误差计划(B)和1 mm MLC内收位置系统误差计划(C)的横断面剂量图 Figure 2 Cross-sections showing the dose distributions for one case of T1 stage NPC: initial VMAT plan (A), plan after the introduction of 1 mm of systematic error induced by the position of MLC leaf expansion (B), and plan after the introduction of 1 mm of systematic error induced by the position of MLC leaf contraction (C) |
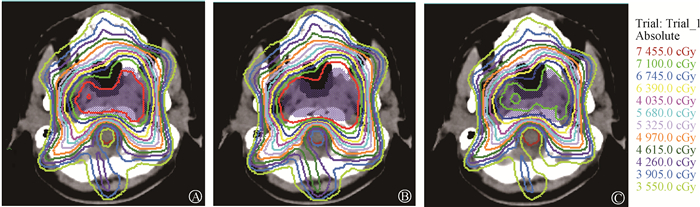
|
图 3 1例T4期鼻咽癌VMAT初始计划(A)以及分别引入1 mm MLC外扩位置系统误差计划(B)和1 mm MLC内收位置系统误差计划(C)的横断面剂量图 Figure 3 Cross-sections showing the dose distributions for one case of T4 stage NPC: initial VMAT plan (A), plan after the introduction of 1 mm of systematic error induced by the position of MLC leaf expansion (B), and plan after the introduction of 1 mm of systematic error induced by the position of MLC leaf contraction (C) |
讨论
根据AJCC第8版指南[5]对鼻咽癌进行不同分期划分,T1和T2期患者肿瘤位置相对远离一些重要正常器官例如脑干、脊髓和视交叉等,所以这类计划在正常器官能得到较好保护的同时,靶区的剂量也能受到很好的覆盖。然而,对于T3特别是T4期患者,其病灶向上侵犯颅底,肿瘤贴近或直接侵犯脑干、视交叉等危及器官,使得放疗计划设计十分复杂。为了尽可能保证PGTV剂量覆盖,就会要求靶区外剂量迅速跌落,计划系统为满足计划要求就会在脑干和视交叉等危及器官与靶区接近的区域进行更多的运算,导致在这些区域可能会形成更多小面积的控制点,并且这些小面积控制点的MU较大。这意味着实际治疗过程中如果MLC位置出现误差可能导致靶区和危及器官实际受量与计算剂量差距很大。所以本研究关注MLC位置系统误差是否对不同T分期鼻咽癌VMAT计划靶区和危及器官剂量造成不同差异。
TG-142[11]和最新的TG-198报告[12]对于MLC叶片位置误差要求在±1 mm以内,而对于叶片位置误差均方根(root mean square,RMS)值和第95百分位数(即误差小于此阈值的事例数占总事例数95%)值都应该小于0.35 mm。Lin等[13]报道了基于加速器日志文件发现Truebeam(T系列)平台下的VMAT计划的平均叶片位置误差RMS值为(0.03±0.01)mm。基于上述研究,本研究模拟±0.2、±0.5、±0.7和±1 mm的MLC位置系统误差。
本研究对44例不同T分期鼻咽癌VMAT计划引入MLC位置系统误差后,发现T4期PGTV D98%敏感度大于其他T期患者,而对于PGTVnd D98%敏感度值差异没有统计学意义,这可能与本研究中所有患者GTVnd都是N1期有关(其体积大小差异较小,处方剂量相同)。同时本研究发现,T1和T2期视交叉D0.1 cm3敏感度明显大于T3和T4期,这是因为当引入MLC位置相同系统误差后虽然T3期和T4期视交叉D0.1 cm3剂量差大于T1和T2期,但是T1和T2期视交叉初始D0.1 cm3剂量值远远小于T3和T4期,由于本研究中敏感度是跟剂量偏差有关,而剂量偏差公式中分母为剂量指标初始值。同样脑干和脊髓的D0.1 cm3剂量差也是一样趋势。这表明当MLC位置发生相同系统误差后,T4期患者受照剂量变化最大。根据相关研究报道3%~5%的剂量偏差会影响靶区控制率和危及器官并发症率[14],结合本研究初始计划各分期的靶区和危及器官受照剂量,把T4期的PGTV、PGTVnd D98%和脑干D0.1 cm3剂量偏差的阈值为3%,脊髓和视交叉D0.1 cm3剂量偏差阈值为5%,当超过上述任一指标的阈值则认为临床上不能接受该计划。通过表 3可知,得到MLC系统误差大于0.42 mm时(即脑干D0.1 cm3剂量偏差大于3%),临床上该计划不能接受。
Oliver等[3]基于Eclipse计划系统对8例头颈部患者进行VMAT计划(使用1个全弧)发现,引入MLC位置内收系统误差后PTV70 D99%和脊髓D0.03 cm3的敏感度分别为-4.81%/mm和-2.52%/mm, 而外扩的分别为2.34%/mm和6.93%/mm。Hu等[15]基于Eclipse计划系统对12例头颈部患者进行VMAT计划(使用两个全弧)发现MLC位置内收系统误差后(分别为-0.2、-0.6、-1和-1.5 mm)PGTV D98%、脊髓PRV(外扩3 mm)Dmax和脑干PRV Dmax的剂量偏差分别为-9.79%~-1.26%、-10.15%~-1.61%和-1.52%~10.67%,而外扩(与内收相同大小误差)的分别为1.25%~8.76%、1.78%~15.56%和1.59%~12.5%。本研究的结果与上述结果趋势相同,即相同大小MLC位置内收系统误差大于MLC位置外扩系统误差对PGTV剂量影响。而随着MLC位置误差增大,相同MLC位置外扩系统误差大于MLC位置内收系统误差对脊髓、脑干剂量偏差。本研究也发现各指标剂量偏差和敏感度与上述研究存在差异,这可能是由于加速器类型(MLC叶片大小、叶片移动速度)、计划系统和射野类型(子野数量、面积)、剂量指标(例如D95%和D98%)以及治疗部位(单次剂量)不同有关。同时相比较上述文献,本研究对鼻咽癌患者进行不同T分期研究发现,PGTV D98%和视交叉D0.1 cm3敏感度差异均存在统计学意义,如果没有分期研究可能也会影响数据结果。
基于上述不同T分期鼻咽癌VMAT计划引入MLC位置系统误差,PGTV D98%敏感度存在差异,引入计划机器跳数与单次PGTV处方剂量之间比值(MU/Gy)来评估是否计划复杂度影响上述差异。本研究发现,MU/Gy与PGTV D98%敏感度呈强线性正相关(r=0.80),这表明随着计划MU增大,PGTV D98%受MLC位置系统误差影响更大,计划鲁棒性更差。相比较于T1、T2和T3期患者,T4期患者PGTV体积较大且临近更多的危及器官,在使用相同方式的射野下MU明显大于其他T期患者,这也解释了T4期PGTV D98%敏感度与其他T期存在差异。其他研究也发现,剂量学指标随MLC位置系统误差变化的敏感度依赖于MU大小[4, 10, 16],这也提示在计划制定中应尽量降低MU大小。同时还发现一些MU/Gy较小的计划PGTV D98%敏感度大于MU/Gy较大的计划,这可能与复杂度其他指标例如孔径调制程度和光束孔径的不规则性相关[17]。后续将针对这些复杂度指标进行更深入研究。同时本研究仅针对N1期患者,是否适用于N0和N2患者还需后续研究。
综上所述,基于不同T分期鼻咽癌VMAT计划引入MLC位置系统误差后T4期受照剂量变化明显大于其他T期患者。因此,需对T4期鼻咽癌患者进行更严格的叶片质量控制,建议叶片系统误差小于0.42 mm。
利益冲突 无
作者贡献声明 朱志鹏负责论文撰写和数据处理;黎桂华、李相德审核论文;覃文提供病例;郑莲容指导论文撰写和修改
| [1] |
Otto K. Volumetric modulated arc therapy: IMRT in a singal gantry arc[J]. Med Phys, 2008, 35(1): 310-317. DOI:10.1118/1.2818738 |
| [2] |
程燕铭, 胡彩容, 阴晓娟, 等. 鼻咽癌IMRT和VMAT计划对机器跳数和MLC误差剂量学敏感度对比研究[J]. 中华放射肿瘤学杂志, 2017, 26(10): 1199-1203. Cheng YM, Hu CR, Yin XJ, et al. Dosimetric sensitivity with MU and MLC errors in IMRT versus VMAT plan for nasopharyngeal carcinoma[J]. Chin J Radiat Oncol, 2017, 26(10): 1199-1203. DOI:10.3760/cma.j.issn.1004-4221.2017.10.019 |
| [3] |
Oliver M, Gagne I, Bush K, et al. Clinical significance of multi-leaf collimator positional errors for volumetric modulated arc therapy[J]. Radiother Oncol, 2010, 97(3): 554-560. DOI:10.1016/j.radonc.2010.06.013 |
| [4] |
Pogson EM, Aruguman S, Hansen CR, et al. Multi-institutional comparison of simulated treatment delivery errors in ssIMRT, manually planned VMAT and autoplan-VMAT plans for nasopharyngeal radiotherapy[J]. Phys Med, 2017, 42: 55-66. DOI:10.1016/j.ejmp.2017.08.008 |
| [5] |
Amin MB, Edge SB, Greene FL, et al. American Joint Committee on Cancer Staging Manual. 8th ed[M]. New York: Springer, 2017.
|
| [6] |
Lee NY, Zhang Q, Pfister DG, et al. Addition of bevacizumab to standard chemoradiation for locoregionally advanced nasopharyngeal carcinoma (RTOG 0615): a phase 2 multi-institutional trial[J]. Lancet Oncol, 2012, 13(2): 172-180. DOI:10.1016/S1470-2045(11)70303-5 |
| [7] |
徐萌, 黄路路, 胡凯, 等. 局部晚期鼻咽癌IMRT下视神经及视交叉耐受剂量探讨[J]. 中华放射肿瘤学杂志, 2017, 26(11): 1248-1252. Xu M, Huang LL, Hu K, et al. Dose constraints of optic nerves and chiasm in locally advanced nasopharyngeal carcinoma patients treated with intensity-modulated radiotherapy[J]. Chin J Radiat Oncol, 2017, 26(11): 1248-1252. DOI:10.3760/cma.j.issn.1004-4221.2017.11.002 |
| [8] |
Huang XD, Li YC, Chen FP, et al. Evolution and dosimetric analysis of magnetic resonance imaging-detected brain stem injury after intensity modulated radiation therapy in nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2019, 105(1): 124-131. DOI:10.1016/j.ijrobp.2019.04.032 |
| [9] |
Lee AW, Ng WT, Pan JJ, et al. International guideline on dose prioritization and acceptance criteria in radiation therapy planning for nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2019, 105(3): 567-580. DOI:10.1016/j.ijrobp.2019.06.2540 |
| [10] |
Enomoto H, Fujita Y, Matsumoto S, et al. Dosimetric impact of MLC positional errors on dose distribution in IMRT[J]. J Appl Clin Med Phys, 2024, 25(2): e14158. DOI:10.1002/acm2.14158 |
| [11] |
Klein EE, Hanley J, Bayouth J, et al. Task Group 142 report: quality assurance of medical accelerators[J]. Med Phys, 2009, 36(9): 4197-4212. DOI:10.1118/1.3190392 |
| [12] |
Hanley J, Dresser S, Simon W, et al. AAPM Task Group 198 Report: An implementation guide for TG 142 quality assurance of medical accelerators[J]. Med Phys, 2021, 48(10): e830-e885. DOI:10.1002/mp.14992 |
| [13] |
Lin X, Sun T, Liu X, et al. Comparison of MLC positioning deviations using log files and establishment of specific assessment parameters for different accelerators with IMRT and VMAT[J]. Radiat Oncol, 2022, 17(1): 123. DOI:10.1186/s13014-022-02097-0 |
| [14] |
Siebers JV, Keall PJ, Wu Q, et al. Effect of patient setup errors on simultaneously integrated boost head and neck IMRT treatment plans[J]. Int J Radiat Oncol Biol Phys, 2005, 63(2): 422-433. DOI:10.1016/j.ijrobp.2005.02.029 |
| [15] |
Hu J, Gu S, Wang N, et al. Sensitivity of Three Patient-Specific Quality Assurance Systems to MLC Aperture Errors With Volumetric Modulated Arc Therapy[J]. Technol Cancer Res Treat, 2022, 21: 15330338221114499. DOI:10.1177/15330338221114499 |
| [16] |
Feng A, Chen H, Wang H, et al. Effect of MU-weighted multi-leaf collimator position error on dose distribution of SBRT radiotherapy in peripheral non-small cell lung cancer[J]. J Appl Clin Med Phys, 2020, 21(12): 74-83. DOI:10.1002/acm2.13061 |
| [17] |
Hernandez V, Hansen CR, Widesott L, et al. What is plan quality in radiotherapy? The importance of evaluating dose metrics, complexity, and robustness of treatment plans[J]. Radiother Oncol, 2020, 153: 26-33. DOI:10.1016/j.radonc.2020.09.038 |
 2024, Vol. 44
2024, Vol. 44


