2. 承德医学院附属医院肿瘤科, 承德 067020
2. Department of Oncology, Affiliated Hospital of Chengde Medical University, Chengde 067020, China
食管癌是我国最常见的恶性肿瘤之一,由于食管早期肿瘤隐匿,大多数患者就诊时已处于中晚期而失去手术切除机会。目前,根治性放化疗为非手术治疗食管癌患者的主要治疗方式,但其疗效并不能令人满意,主要失败原因是局部区域复发(locaregion recurrence,LRR) 或远处转移,其中LRR发生率达65%~80%[1]。复发后行手术切除者很少,且并发症较多。文献报道再程放化疗是食管癌放化疗后复发的重要治疗手段,在一定程度上可缓解进食梗阻或减轻转移淋巴结的压迫症状[2]。目前对于食管癌LRR并无再程治疗的统一标准,最佳再程治疗模式缺乏循证医学证据,尤其对于接受再程放疗患者的照射范围、照射剂量以及正常组织器官的耐受剂量等,各研究中心不尽相同。因此,为分析不同再程治疗模式的疗效及预后影响因素,对本中心85例食管癌根治性放化疗后LRR患者进行了全因性评估和不良反应分析。
资料与方法1. 临床资料:回顾分析2008年1月至2017年12月在河北医科大学第四医院放疗科接受根治性放化疗后出现局部区域复发的食管癌患者共85例。入选标准:复发时间距上次放疗间隔1年以上;无食管穿孔征象;无其他恶性肿瘤病史;无远处转移;再治疗前后血液学检查结果数据完整;有完整的临床及病理资料。所有患者均签署知情同意书。
2. 局部区域复发诊断标准和营养免疫相关指标定义:局部/区域复发主要指食管原发病灶部位和区域淋巴结复发。食管病变局部复发者经电子胃镜咬检病理证实,浅表淋巴结复发者经针吸活检细胞学证实,纵隔或腹腔淋巴结均经影像学证实(CT、MRI、PET/CT或超声检查)。区域淋巴结包括锁骨上区、纵隔和腹腔淋巴结。再程治疗前1周采集患者血常规和肝功能,再程放疗期间每周和放疗结束1个月内采集血常规,其他患者治疗结束1周内采集血常规。预后营养指数(prognostic nutrition index,PNI)为血清白蛋白(g/L)+ 5×淋巴细胞计数(×109/L),系统免疫炎症指数(systemic immune inflammation index,SII)为血小板计数(×109/L)×中性粒细胞计数(×109/L)/淋巴细胞计数(×109/L)。
3. 营养免疫指标风险评分标准:将外周血中检测到的再治疗前血红蛋白水平、白蛋白水平和PNI以及再治疗后的SII和近期疗效进行综合评估并给予风险评分,以营养免疫指标中位数为分界值(表 1),评分标准如下:①再治疗前血红蛋白水平和白蛋白水平均低者评为1分,血红蛋白水平和白蛋白水平均高者评为3分,二者一高一低评为2分。②再治疗前血红蛋白水平和PNI均低者评为1分,血红蛋白水平和PNI均高者评为3分,二者一高一低评为2分。③再治疗前血红蛋白水平低且再治疗后SII高者评为1分,血红蛋白水平高且SII低者评为3分,二者均低或均高者评为2分。④近期疗效为稳定(SD)+进展(PD)且SII高者评为1分,近期疗效为完全缓解(CR)+部分缓解(PR)且SII低者评为3分,近期疗效为SD+PD且SII低或者近期疗效为CR+PR且SII高者评为2分。
|
|
表 1 单因素分析85例食管癌放化后局部区域复发患者的预后影响因素 Table 1 Univariate analysis of prognostic factors in 85 patients with locoregional recurrence of esophageal cancer after chemoradiotherapy |
4. 根治性治疗方案:首次根治性放疗采用6 MV X射线三维适形放疗或调强放疗,全组单纯放疗者41例(48.2%),中位放疗剂量61.8 Gy(50.4~64.0 Gy);放疗联合化疗者44例(51.8%),中位放疗剂量61.2 Gy(50.0~66.0 Gy)。化疗采用放疗同步化疗或放疗后序贯化疗,方案为FP方案或TP方案。FP方案为氟尿嘧啶500 mg/m2第1~5天泵入,顺铂25 mg/m2第1~3天输注,3周方案;TP方案为紫杉醇135 mg/m2第1天,顺铂25 mg/m2第1~3天输注,3周方案。中位化疗周期数4(1~6)个。
5. 局部区域复发的治疗
(1) 放射治疗:85例患者中接受再程放疗者62例,均应用6 MV X射线三维调强放疗,仅用累及野照射,大体肿瘤体积(GTV)通过对比增强CT和/或PET/CT确定复发区域。62例患者GTV体积中位值为30.38 cm3(8.44~100.15 cm3)。放疗处方剂量50~64 Gy,中位剂量59.4 Gy。再程放疗时,根据与首程放疗间隔时间长短确定周围正常组织耐受量,再程放疗脊髓剂量根据2001年Ang等[3]研究结果,认为放疗1年后脊髓可再接受的剂量为第一次受照射剂量的30%。1年≤间隔时间<2年者脊髓剂量≤10~15 Gy,2年≤间隔时间<3年者脊髓剂量≤15~20 Gy,≥3年者脊髓剂量≤30 Gy即可。根据患者体质尽量降低肺V5、V20、V30及心脏所受平均剂量。
(2) 化疗:再程化疗方案均以铂类药物为基础,TP方案为紫杉醇135 mg/m2第1天,顺铂25 mg/m2第1~3天输注,3周方案;FP案为氟尿嘧啶500 mg/m2第1~5天泵入,顺铂25 mg/m2第1~3天输注,3周方案,中位化疗周期数2(1~5)个。
(3) 姑息治疗:对于拒绝或不能耐受放化疗者以及食管梗阻症状明显者给予经鼻空肠营养管置入,经营养管进流食,姑息对症治疗。
6. 不良反应及近期疗效判断标准:治疗相关不良反应参照常见不良反应评价标准(CTCAE 4.0)进行,评价时间为再程放疗开始至放疗结束后3个月内。近期疗效评价时间为治疗结束后1个月内,原发病灶检查手段为食管钡餐造影、胸和上腹部CT强化扫描和内镜检查。转移淋巴结评价按照实体瘤疗效评价标准(RECIST)1.1进行,检查手段为颈部超声、胸/上腹部强化CT/MRI或PET-CT检查。近期疗效评价分为CR、PR、SD及PD。
7. 统计学处理:采用SPSS 25.0软件进行统计分析,计数资料采用χ2检验,生存相关分析采用Kaplan-Meier生存分析和Log-rank检验,多因素分析应用Cox比例风险模型。P<0.05为差异有统计学意义。
结果1. 随访及治疗情况:随访截止2021年12月31日,失访6例,随访率93%,中位随访时间24.5个月(5.4 ~127.4个月)。全组患者男45例,女40例,中位年龄68岁(42~84岁)。原发病变位于颈段及胸上段21例,胸中段48例,胸下段16例。首次放化疗前采用2009年版中国食管癌非手术治疗临床分期标准,Ⅰ、Ⅱ、Ⅲ期分别为24、35、26例。
2. 全组患者复发情况:首次放化疗后中位复发时间为16个月(12~121.5个月)。单纯食管原发病变局部复发者44例(51.8%),单纯区域淋巴结转移者29例(34.1%),食管原发病变局部复发伴区域淋巴结转移者12例(14.1%)。其中照射野内复发者49例(57.6%),照射野外复发者36例(42.4%)。
3. 接受再程放疗患者复发、治疗及营养免疫情况
(1) 首次放化疗情况:62例患者接受了再程放疗,其中首次放疗采用累及野照射38例(61.3%),选择性淋巴引流区预照射24例(38.7%),中位放疗剂量60.5 Gy(50.0~66.0 Gy)。单纯放疗者31例(50.0%),中位放疗剂量60.9 Gy(59.4~66.0 Gy);放疗联合化疗者31例(50.0%),中位放疗剂量60.0 Gy(50.0~64.0 Gy),中位化疗周期数2个(1~5)。
(2) 复发情况:62例患者首次放化疗后中位复发时间为22个月(12.1~121.5个月)。其中单纯食管原发病变局部复发者34例(54.8%),单纯区域淋巴结转移者18例(29.0%),食管原发病变局部复发伴区域淋巴结转移者10例(16.1%)。其中照射野内复发者40例(64.5%),照射野外复发者22例(35.5%)。
(3) 再程放化疗:62例患者再程中位放疗剂量59.4 Gy(50.0~64.0 Gy)。其中单纯放疗者53例(85.5%),中位放疗剂量59.4 Gy(50.0~64.0 Gy);放疗联合化疗者9例(14.5%),中位放疗剂量59.4 Gy(54.0~64.0 Gy),中位化疗周期数2(1~3)个。
(4) 营养免疫情况:62例患者再治疗前中性粒细胞淋巴细胞比值(NLR)、血小板淋巴细胞比值(PLR)、单核细胞淋巴细胞比值(MLR)、PNI均高于再治疗后(P<0.05),而再治疗前SII显著低于再治疗后(P<0.001)。再治疗前后体质量指数(BMI)、血红蛋白、血清总蛋白、血清白蛋白差异均无统计学意义(P>0.05)。
4. 全组患者生存情况:全组患者再程治疗后1、2、3、5年总生存率分别为31.5%、18.6%、10.6%、6.6%,中位生存时间6.3个月(95%CI:4.7~7.9)。其中行放化疗者62例,1、2、3、5年生存率分别为36.8%、22.3%、13.0%、9.3%,中位生存时间7.1个月(95%CI:4.8~9.4)。行单纯化疗者9例,1、2、3、5年生存率分别为44.4%、22.2%、11.1%、0,中位生存时间8.8个月(95%CI:7.3~10.3)。对症支持治疗者14例,中位生存时间2.6个月(95%CI:1.7~3.5)。
5. 全因性评估和预后因素分析:单因素分析结果显示,患者首次治疗模式(χ2=6.66,P=0.010)、首次治疗至复发间隔时间(χ2=15.84,P<0.001)、复发后再治疗模式(χ2=29.57,P<0.001)、再程放疗剂量(χ2=9.82,P=0.002)、再治疗后近期疗效(χ2=6.34,P=0.012)、再治疗前血小板淋巴细胞比值(PLR)(χ2=5.89,P=0.015)、再治疗前血红蛋白水平(χ2=13.92,P<0.001)、总蛋白水平(χ2=24.73,P<0.001)、白蛋白水平(χ2=12.89,P<0.001)、再治疗前PNI(χ2=13.43,P<0.001)以及再治疗后SII(χ2=6.17,P=0.013)均显著影响再治疗后生存,见表 1。性别、年龄、病变部位、病理类型、病变长度、临床分期、复发部位、再放疗GTV体积、再治疗前NLR、再治疗前MLR、再治疗前SII对再治疗后生存均无显著影响(P>0.05)。将单因素分析有意义的指标纳入多因素COX比例风险模型,结果显示患者首次治疗至复发间隔时间≥16个月(P=0.018)、复发后放化疗(P=0.001)、再治疗前白蛋白水平≥40 g/L(P=0.014)和再治疗前PNI≥44.00(P=0.025)为其独立性预后影响因素,见表 2。
|
|
表 2 Cox模型多因素分析85例食管癌放化后局部区域复发患者再治疗后的生存 Table 2 Multivariable Cox regression analysis of survival after retreatment in 85 patients with local recurrence of esophageal cancer after chemoradiotherapy |
6. 再治疗前营养免疫指标对再治疗后生存的预测价值:按照营养免疫指标风险评分标准定义1、2、3分别对应高、中、低风险组,将复发后再程治疗的85例患者分组,各组生存差异均具有统计学意义(P<0.001),见图 1。进一步将复发后接受再程放化疗的62例患者按照同样风险评分标准分组,各组生存差异均具有统计学意义(P<0.001),见图 2。
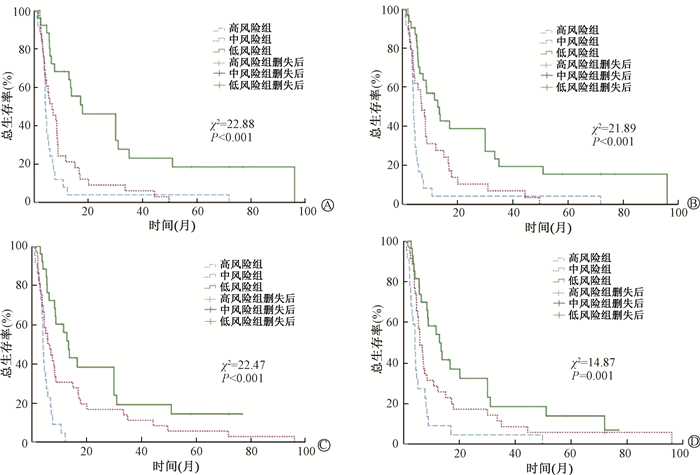
|
图 1 85例局部区域复发食管癌再治疗后不同风险分组患者的生存曲线 A.血红蛋白联合白蛋白;B.血红蛋白联合预后营养指数;C.血红蛋白联合系统免疫炎症指数;D.近期疗效联合系统免疫炎症指数 Figure 1 Survival curves of 85 patients with esophageal cancer retreated for locoregional recurrence stratified by different risk groups A. Hemoglobin combined with albumin; B. Hemoglobin combined with prognostic nutritional index; C. Hemoglobin combined with systemic immune inflammation index; D. Short-term curative effect combined with systemic immune inflammation index |
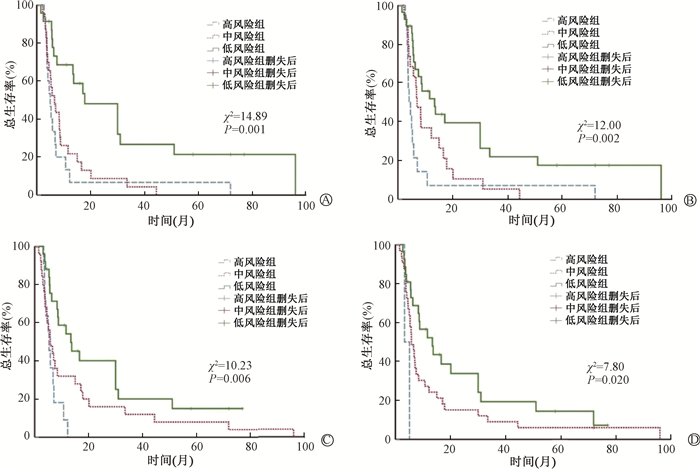
|
图 2 62例局部区域复发食管癌再程放化疗后不同风险分组患者的生存曲线 A.血红蛋白联合白蛋白;B.血红蛋白联合预后营养指数;C.血红蛋白联合系统免疫炎症指数;D.近期疗效联合系统免疫炎症指数 Figure 2 Survival curves of 62 patients with esophageal cancer retreated with radiotherapy and chemotherapy for locoregional recurrence stratified by different risk groups A. Hemoglobin combined with albumin; B. Hemoglobin combined with prognostic nutritional index; C. Hemoglobin combined with systemic immune inflammation index; D. Short-term curative effect combined with systemic immune inflammation index |
7. 综合预测模型对再治疗后生存的预测价值:将多因素分析筛选出的预后影响因素构建预测模型,对以下每个变量赋予风险评分为1分,即首次治疗至复发间隔时间<16个月、复发后未行放化疗、再治疗前白蛋白水平<40 g/L、再治疗前PNI<44.00。将85例患者分为两个不同风险组:低风险组:存在最多1个负面预后因素;高风险组:存在2~4个负面预后因素。两组中位生存时间分别为13.7和4.6个月。1、2、3、5年生存率分别为57.7%、38.0%、17.3%、13.8%和14.0%、6.0%、6.0%、2.0%,两组生存差异具有统计学意义(χ2=16.47,P<0.001)。
8. 不良反应:放射性食管炎和白细胞减少症是常见的急性不良反应。接受再程放化疗的62例患者中,10例(16.1%)出现3级以上放射性食管炎,9例(14.5%)出现1~2级放射性肺炎,4例(6.5%)出现3级以上放射性肺炎,经抗炎、激素对症治疗后症状缓解。7例(11.3%)发生食管瘘,均行经鼻空肠营养管置入,经营养管进流食。
讨论根治性放化疗是不可手术切除的局部晚期食管癌的主要治疗手段,但绝大部分患者在治疗后1~2年内出现复发。美国国立综合癌症网络(NCCN)指南建议放疗后局部复发的食管癌患者应首选手术治疗[4]。而复发患者因高龄、局部受侵严重或发生远处转移、首次放疗后组织纤维化影响血运等因素仍旧无手术机会,即使接受挽救性手术治疗,发生术后并发症如吻合口瘘、肺部感染或手术原因死亡的概率仍较高[5]。国内学者回顾分析了37例根治性放化疗后进行挽救性手术的食管癌患者,能够完全切除者仅18例,其中6例在1年内死亡,中位生存期为11.1个月[6]。因此,围手术期高死亡率和术后高并发症发生率限制了挽救性手术的应用。Zhao等[7]对252例放疗后复发食管癌患者再放疗的疗效进行了分析,发现接受再放疗的患者总生存明显延长,中位生存时间为13.0个月。吴迪[8]研究认为,对于放疗后LRR的食管癌患者,放化疗可延长患者生存时间。Chen等[9]分析了95例复发食管鳞癌患者接受不同再程治疗模式的生存情况,其中接受挽救性放化疗或手术患者的中位生存时间为11.2个月,而接受对症支持治疗患者的中位生存时间仅为6.2个月。许亚萍等[10]的研究结果显示,复发后的食管癌患者采用放化联合治疗、单纯放疗、单纯化疗、对症支持治疗的中位生存时间分别为13.0、7.0、6.0、3.0个月,这与本研究结果基本一致。
众所周知,化疗可以提高放疗的敏感性,进而提高治疗效果。美国肿瘤放射治疗协作组(RTOG)85-01号研究奠定了放化联合治疗在局部晚期不可手术切除食管癌患者中的治疗地位[11]。但是食管癌对化疗属于中低度敏感,单纯化疗并不能有效缓解患者病情,多数情况下化疗仅作为姑息治疗的选择[12]。Hong等[13]分析了87例复发食管鳞癌患者不同再程治疗模式的生存情况,发现接受放疗患者和未接受放疗患者的中位生存时间分别是21.0和8.0个月。Zhao等[7]研究发现,接受再放疗联合化疗的患者比未接受再放疗的患者能够获得更长的中位生存时间,因此建议对身体状态良好接受再放疗的患者进行化疗,还发现从初始治疗结束到复发诊断间隔时间>12个月比≤12个月的患者有更好的生存期。本研究结果显示积极完成治疗者(放疗、化疗、放化疗)较对症支持治疗者生存时间长,且有放疗参与者较无放疗参与者生存时间延长。复发间隔时间是再程放疗患者的独立预后因素,复发间隔时间≥16个月比<16个月的患者有更好的生存期。这可能与肿瘤对放疗的敏感性不同有关,复发间隔时间较长的患者可能对放疗更敏感。
复发食管癌接受再程放疗的剂量也是研究的热点之一。许亚萍等[10]研究显示再程放疗患者的预后与放疗剂量显著相关,放疗剂量>50 Gy时能明显延长患者生存期。Xu等[14]分析了47例接受再放疗复发食管癌患者放疗剂量与生存之间的关系,发现再放疗剂量是总生存的独立预后因素(P<0.001),再放疗总剂量>50 Gy可以改善患者生存,但由于严重并发症,>60 Gy放疗应谨慎应用。Zhou等[15]分析了114例根治性放化疗后复发食管鳞癌患者的预后因素,其中55例接受了挽救性放疗,剂量>50 Gy患者和≤50 Gy患者中位生存时间分别为7.0和4.0个月(P<0.05)。沈文斌等[16]认为食管癌放疗后复发行三维适形放疗的剂量应在50~60 Gy为宜。在本研究中,再放疗剂量≥54 Gy较<54 Gy治疗后生存时间明显延长,再治疗后中位生存时间分别为6.5、3.5个月,差异有统计学意义,这可能说明较高的放疗剂量能够在一定程度上抑制食管癌的复发。
围放化疗期的营养治疗可以预防食管癌患者体重下降,保持骨骼肌质量和功能,提高放化疗敏感性,减轻放化疗不良反应[17-18]。Cong等[19]分析了50例食管癌患者放化疗中使用管饲营养支持,可明显降低食管炎和骨髓抑制发生率,并提高患者营养状况。本组资料多因素分析显示,疗前白蛋白水平和PNI是食管癌患者再程治疗生存时间的独立预后因素。其中营养状态较好的患者中位生存时间明显延长。Wang等[20]分析了97例食管癌患者的预后营养因素及其与生存的关系,结果提示放化疗第3周时PNI是影响预后的独立危险因素。SII反映了机体的炎症状态和免疫功能,高SII表明患者全身炎症反应较强,免疫力降低,可能影响肿瘤患者的生存。本研究将患者再治疗前血红蛋白水平、白蛋白水平和PNI以及再治疗后的SII和近期疗效进行综合风险评分,结果显示评分越低的患者不良预后风险相应增加,该综合评分方法对食管癌再治疗患者的预后有一定的预测价值。食管癌患者LRR后营养状况可能较初次治疗前更差,尤其是梗阻症状严重者。对于中重度营养不良的患者建议先进行营养治疗,待营养状况好转后再开始放化疗。
再程放疗可缓解临床症状,提高生活质量,本研究中共62例患者放疗,7例患者出现食管气管瘘。行再程放疗时有必要结合症状及多种临床检查手段,尽可能注意、发现或预测食管瘘的发生,通过降低再程放疗的分次剂量减少食管瘘的发生。再程放疗在食管癌根治性放化疗LRR后仍是一种可行而且有效的治疗手段,可以在体质较好的患者中应用,放疗前需要注意潜在获益病例的筛选。
本研究为回顾性分析,且病例数较少,在病例选择方面存在其固有偏倚。复发食管癌患者的再程治疗除放疗外,化疗方案的选择和放化疗结合方式都可能影响患者的预后。关于再程治疗的研究文献较少,尤其是本研究缺乏挽救性手术病例对照,导致可提供参考的内容较少。
总之,放疗在食管癌局部区域复发后再程治疗中仍占有重要地位,患者的营养免疫状态对再治疗方案的选择具有指导作用,且对患者的预后有一定的预测价值。本研究需要更好的前瞻性试验及大样本数据进一步证实。
利益冲突 无
作者贡献声明 李曙光负责统计分析、撰写论文;吴迪负责采集数据;王晓斌、郭雪涵负责分析数据;沈文斌、祝淑钗负责提出研究思路,协助修改论文
| [1] |
Welsh J, Settle SH, Amini A, et al. Failure patterns in patients with esophageal cancer treated with definitive chemoradiation[J]. Cancer, 2012, 118(10): 2632-2640. DOI:10.1002/cncr.26586 |
| [2] |
Katano A, Yamashita H, Nakagawa K. Re-irradiation of locoregional esophageal cancer recurrence following definitive chemoradiotherapy: A report of 6 cases[J]. Mol Clin Oncol, 2017, 7(4): 681-686. DOI:10.3892/mco.2017.1384 |
| [3] |
Ang KK, Jiang GL, Feng Y, et al. Extent and kinetics of recovery of occult spinal cord injury[J]. Int J Radiat Oncol Biol Phys, 2001, 50(4): 1013-1020. DOI:10.1016/s0360-3016(01)01599-1 |
| [4] |
Ajani JA, D'Amico TA, Bentrem DJ, et al. Esophageal and Esophagogastric Junction Cancers, Version 2.2019, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2019, 17(7): 855-883. DOI:10.6004/jnccn.2019.0033 |
| [5] |
Kanamori J, Abe S, Kurita D, et al. Minimally invasive hybrid surgery: A salvage tumor enucleation for local recurrence of thoracic esophageal carcinoma after definitive chemoradiotherapy[J]. Asian J Endosc Surg, 2021, 14(1): 77-80. DOI:10.1111/ases.12830 |
| [6] |
务森, 陈明耀, 雒建超, 等. 食管癌根治性放化疗局部失败后挽救性手术的安全性和疗效[J]. 中华医学杂志, 2013, 93(37): 2976-2978. Wu S, Chen MY, Luo JC, et al. A retrospective study on salvage surgery after local failure of definitive chemoradiotherapy for esophageal carcinomas[J]. Natl Med J China, 2013, 93(37): 2976-2978. DOI:10.3760/cma.j.issn.0376-2491.2013.37.016 |
| [7] |
Zhao K, Si Y, Sun L, et al. Efficacy and toxicity of re-irradiation for esophageal cancer patients with locoregional recurrence: a retrospective analysis[J]. Radiat Oncol, 2020, 15(1): 243. DOI:10.1186/s13014-020-01685-2 |
| [8] |
吴迪. 食管癌根治性放疗后局部区域失败再治疗模式的分析[D]. 石家庄: 河北医科大学, 2018. DOI: 10.7666/d.D01514824. Wu D. The analysis of re-treatment pattern of local regional failure for esophageal carcinoma after definitive radiotherapy[D]. Shijiazhuang: Hebei Medical University, 2018. DOI: 10.7666/d.D01514824. |
| [9] |
Chen Y, Lu Y, Wang Y, et al. Comparison of salvage chemoradiation versus salvage surgery for recurrent esophageal squamous cell carcinoma after definitive radiochemotherapy or radiotherapy alone[J]. Dis Esophagus, 2014, 27(2): 134-140. DOI:10.1111/j.1442-2050.2012.01440.x |
| [10] |
许亚萍, 毛伟敏, 马胜林, 等. 食管癌根治性治疗后局部复发患者的预后因素分析[J]. 中华肿瘤杂志, 2011, 33(12): 925-928. Xu YP, Mao WM, Ma SL, et al. Analysis of prognostic factors in patients with locoregional recurrence of esophageal carcinoma after curative treatment[J]. Chin J Oncol, 2011, 33(12): 925-928. DOI:10.3760/cma.j.issn.0253-3766.2011.12.010 |
| [11] |
Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group[J]. JAMA, 1999, 281(17): 1623-1627. DOI:10.1001/jama.281.17.1623 |
| [12] |
Fakhrian K, Gamisch N, Schuster T, et al. Salvage radiotherapy in patients with recurrent esophageal carcinoma[J]. Strahlenther Onkol, 2012, 188(2): 136-142. DOI:10.1007/s00066-011-0023-x |
| [13] |
Hong L, Huang YX, Zhuang QY, et al. Survival benefit of re-irradiation in esophageal Cancer patients with Locoregional recurrence: a propensity score-matched analysis[J]. Radiat Oncol, 2018, 13(1): 171. DOI:10.1186/s13014-018-1122-y |
| [14] |
Xu X, Wang Z, Jiang S, et al. Evaluating the optimal re-irradiation dose for locally recurrent esophageal squamous cell carcinoma after definitive radiotherapy[J]. Radiat Oncol, 2019, 14(1): 191. DOI:10.1186/s13014-019-1402-1 |
| [15] |
Zhou ZG, Zhen CJ, Bai WW, et al. Salvage radiotherapy in patients with local recurrent esophageal cancer after radical radiochemotherapy[J]. Radiat Oncol, 2015, 10: 54. DOI:10.1186/s13014-015-0358-z |
| [16] |
沈文斌, 祝淑钗, 万钧, 等. 42例放疗后复发食管癌三维适形放疗的疗效分析[J]. 中华放射肿瘤学杂志, 2010, 19(2): 111-114. Shen WB, Zhu SC, Wan J, et al. Three-dimensional conformal radiotherapy for loco-regionally recurrent esophageal cancer after initial radiotherapy[J]. Chin J Radiat Oncol, 2010, 19(2): 111-114. DOI:10.3760/cma.j.issn.1004-4221.2010.02.007 |
| [17] |
Furuta M, Yokota T, Tsushima T, et al. Comparison of enteral nutrition with total parenteral nutrition for patients with locally advanced unresectable esophageal cancer harboring dysphagia in definitive chemoradiotherapy[J]. Jpn J Clin Oncol, 2019, 49(10): 910-918. DOI:10.1093/jjco/hyz089 |
| [18] |
吕家华, 李涛, 朱广迎, 等. 肠内营养对食管癌同步放化疗患者营养状况、不良反应和近期疗效影响—前瞻性、多中心、随机对照临床研究(NCT02399306)[J]. 中华放射肿瘤学杂志, 2018, 27(1): 44-48. Lyu JH, Li T, Zhu GY, et al. Influence of enteral nutrition on nutritional status, treatment toxicities, and short-term outcomes in esophageal carcinoma patients treated with concurrent chemoradiotherapy: a prospective, multicenter, randomized controlled study (NCT 02399306)[J]. Chin J Radiat Oncol, 2018, 27(1): 44-48. DOI:10.3760/cma.j.issn.1004-4221.2018.01.009 |
| [19] |
Cong MH, Li SL, Cheng GW, et al. An interdisciplinary nutrition support team improves clinical and hospitalized outcomes of esophageal cancer patients with concurrent chemoradiotherapy[J]. Chin Med J (Engl), 2015, 128(22): 3003-3007. DOI:10.4103/0366-6999.168963 |
| [20] |
Wang J, Yu B, Ye Y, et al. Predictive value of nutritional risk screening 2002 and prognostic nutritional index for esophageal cancer patients undergoing definitive radiochemotherapy[J]. Nutr Cancer, 2018, 70(6): 879-885. DOI:10.1080/01635581.2018.1470656 |
 2024, Vol. 44
2024, Vol. 44


