2. 解放军总医院第五医学中心肿瘤医学部放疗科, 北京 100039;
3. 中国人民武装警察部队特色医学中心放射科, 天津 300162;
4. 解放军总医院海南医院放疗科, 三亚 572000;
5. 解放军总医院第一医学中心放疗科, 北京 100853
2. Department of Radiation Oncology, Senior Department of Oncology, Fifth Medical Center of Chinese PLA General Hospital, Beijing 100039, China;
3. Department of Radiology, Characteristic Medical Center of Chinese People's Armed Police Force, Tianjin 300162, China;
4. Department of Radiation Oncology, Hainan Hospital of Chinese PLA General Hospital, Sanya 572000, China;
5. Department of Radiation Oncology, First Medical Center of Chinese PLA General Hospital, Beijing 100853, China
乳腺癌是全世界范围内最常见的女性恶性肿瘤,严重威胁着女性的健康[1]。手术、化疗、放疗、内分泌和靶向药物治疗是乳腺癌主要的治疗手段,放疗是多学科治疗的重要组成部分。多个前瞻性研究和荟萃分析证实局部区域进展期乳腺癌改良根治术后胸壁±区域淋巴结放疗显著提高肿瘤局部区域控制率,降低乳腺癌特异性死亡率[2-4]。乳腺癌放疗的传统分割模式为50 Gy/25次,其生物有效剂量(BED)约为70 Gy(α/β= 4 Gy)。数项研究已经证实具有相同或相近BED的乳腺癌保乳术后大分割放疗,其肿瘤局部区域控制率、乳腺癌特异性生存率和放疗相关的不良反应与常规分割放疗无明显差异[5-8]。
乳腺癌改良根治术后以胸壁和区域淋巴结为照射靶区的大分割放疗的研究很少开展,临床实施的可行性和理想的剂量分割方案尚未确立。基于乳腺癌保乳术后大分割放疗临床研究成功的背景以及我国大部分乳腺癌患者接受改良根治手术的临床现状,本中心开展了36.5 Gy/10次(EQD2≈ 46.5 Gy),疗程2周的乳腺癌改良根治术后大分割放疗Ⅱ期研究。
资料与方法1. 试验设计与病例收集:本研究为前瞻性、单中心、单臂Ⅱ期临床研究。临床试验经过解放军总医院伦理委员会批准(S2014-001-02),并在中国临床试验注册中心注册(ChiCTR-ONRC-14004391)。自2014年3月至2015年12月,共纳入85例局部区域进展期乳腺癌改良根治术后于解放军总医院放疗科接受胸壁±锁骨上区放疗的患者。临床试验纳入标准:①女性乳腺癌患者,年龄18~70岁。②患者自愿参加试验并签署知情同意书。③临床分期ⅡA(不包括T2N0)~ⅢC期乳腺癌改良根治术后患者,病理为浸润性癌。④患者按计划完成新辅助/辅助化疗。⑤患者病理确诊腋窝淋巴结转移,接受新辅助化疗后行改良根治手术。⑥患者一般状况好,卡氏评分≥70,预计生存期>12个月。⑦患者无严重心脏及肺的基础疾病。试验排除标准:①患者HER-2阳性,未规范接受曲妥珠靶向治疗。②患者雌激素或孕激素受体阳性,未规范接受内分泌治疗。③患者拟照射区域有既往放疗史。④患者放疗与手术的间隔时间超过8个月。
2. 模拟定位和放疗靶区、危及器官勾画
(1) 模拟定位:患者仰卧于放疗专用乳腺托架,医生和模拟定位技师根据需要照射的部位,在患者体表做定位标记。定位时患者胸壁和手术瘢痕区无需覆盖等效组织填充物。采用西门子大孔径模拟定位CT(德国西门子公司)进行CT定位图像扫描,扫描层厚5 mm。
(2) 靶区和危及器官勾画:临床靶区(clinical target volume, CTV)包括患侧胸壁±锁骨上区(锁骨上和腋窝Ⅱ/Ⅲ组淋巴结区)。CTV各方向均匀外扩5 mm构成计划靶区(plan target volume, PTV),PTV前缘调整至皮下3 mm,后界避免超过肺-胸界面。勾画的危及器官包括双侧肺、心脏、对侧乳腺、脊髓、甲状腺、食管等。
3. 放疗靶区和危及器官剂量要求放疗靶区处方剂量和危及器官剂量限制要求:PTV处方剂量36.5 Gy/10次,PTV剂量分布在90%~110%之间,并限制高剂量范围V105%~V107%<5%, V107%~V110%<2%。危及器官的剂量限制:患侧肺V16<20%,对侧肺V5<8%,心脏平均剂量<5 Gy(左侧乳腺癌)、心脏平均剂量<2.3 Gy(右侧乳腺癌),对侧乳腺Dmax<4.5 Gy,甲状腺Dmean<23 Gy,脊髓Dmax<30 Gy。
4. 随访:放疗期间每周检查照射野区域皮肤情况,并持续到放疗结束后4周(电话随访)。放疗结束后3年内,每6个月随访一次;3年后每年随访一次。主要研究终点为放疗相关不良反应,分级评估依据常见不良反应评价标准(CTCAE)4.0。次要研究终点包括无局部区域复发生存率(LRFFS),无病生存率(DFS)和总生存率(OS)。
5. 统计学处理:应用R project 4.1.0(http://www.r-project.org) 进行统计分析,Kaplan-Meier法计算患者LRFFS、DFS和OS。分类变量比较采用卡方检验或Fisher精确检验,连续变量采用独立样本t检验或Mann-Whitney U检验(依据数据的正态性)。P<0.05为差异有统计学意义。
结果1. 患者一般情况:患者中位年龄50(27~68)岁。8例患者接受新辅助化疗±辅助化疗,77例患者接受术后辅助化疗。根据雌激素(ER),孕激素(PR)和人表皮生长因子受体2(HER-2)情况,患者规范接受内分泌治疗和抗HER-2靶向治疗。患者一般情况见表 1。
|
|
表 1 85例乳腺癌患者一般情况 Table 1 General information of 85 patients with breast cancer |
2. 放疗相关不良反应:患者急性不良反应主要为1级(放射性皮炎45例,52.9%;放射性肺炎34例,40.0%),仅1例患者出现2级放射性皮炎,未发生3级及以上急性不良反应。患者晚期不良反应包括25例(29.4%)1级肺纤维化,9例(10.6%)1级晚期皮肤不良反应,18例(21.2%)1级淋巴水肿,2例(2.4%)1级缺血性心脏病以及1例2级放射性臂丛神经损伤(放疗结束后58个月出现)。患者放疗相关不良反应情况见表 2。
|
|
表 2 85例乳腺癌患者放疗相关不良反应 Table 2 Radiation-related adverse reactions in 85 patients with breast cancer |
3. 预后分析:患者中位随访98(94.0~109.0)个月,中位生存时间未达到。85例患者中仅1例(pT2N1,三阴性肿瘤,行胸壁照射)发生区域复发(同侧锁骨上区),9年无局部区域复发生存率为97.7%;6例发生远处转移(2例pT2N1,胸壁照射;1例ypT1N2,3例pT2N3胸壁+锁骨上照射),9年无病生存率为91.8%;6例患者死于乳腺癌,9年总生存率为92.8%。
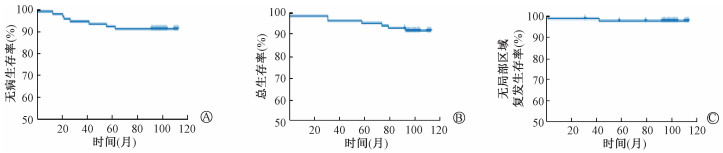
|
图 1 85例乳腺癌患者9年生存曲线 A. 无病生存率;B. 总生存率;C. 无局部区域复发生存率 Figure 1 Nine-year disease-free survival (A), overall survival (B) and locoregional failure free survival(C) curves of 85 patients with breast cancer |
讨论
本研究创新性采用36.5 Gy/10次,5次/周的剂量分割模式对乳腺癌改良根治术后患者胸壁±锁骨上区照射。该方案将乳腺癌术后辅助放疗的疗程缩短至2周,为当前国际范围内分割次数最少、疗程最短的针对乳腺癌改良根治术后患者胸壁及区域淋巴结照射的大分割放疗方案之一。与50 Gy/25次的常规分割放疗对比,本研究采用的方案不但放疗次数少、疗程短,时间、经济成本优势明显,而且不良反应轻微,临床疗效满意。
当前,乳腺癌改良根治术后大分割放疗研究采用的剂量分割模式多为39~43 Gy/15~16次,疗程3周。Koulis等[9]回顾性分析5 487例腋窝淋巴结病理阳性乳腺癌患者(4 006例大分割放疗,40~ 42.5 Gy/16次和1 481例常规分割放疗,45~50.4 Gy/25~28次),其中,3 152例接受乳房切除手术,术后行胸壁及区域淋巴引流区放疗,中位随访12.7年,大分割放疗组患者10年无局部区域复发生存率,无病生存率,乳腺癌特异性生存率以及放疗相关的不良反应与常规分割放疗组比较无明显差异。Wang等[10]报道了全球第一个Ⅲ期乳腺癌改良根治术后大分割放疗的随机对照临床研究,入组了820例伴有高危因素(pT3、≥4个腋窝淋巴结病理阳性)的局部区域进展期乳腺癌患者,随机分为大分割放疗组(43.5 Gy/15次)和常规分割放疗组(50 Gy/25次),中位随访58.5个月,大分割放疗组与常规分割放疗组患者5年肿瘤局部区域复发率分别为8.3%和8.1%、无病生存率分别为74%和70%、总生存率分别为84%和86%,组间比较差异无统计学意义。大分割组患者3级急性放射性皮炎发生率低于常规分割组(3% vs. 8%, P<0.001),两组患者急性放射性肺炎,晚期皮肤不良反应,肺纤维化,上肢淋巴水肿,缺血性心肌病发生率比较差异均无统计学意义。
本研究中患者急性放疗相关不良反应发生率和严重程度低于王淑莲等[10]的研究,晚期不良反应结果相似。本研究中1例患者发生了2级放射性臂丛神经病,表现为沿臂丛神经走行区的疼痛和患侧上肢抬举困难。回顾性分析该患者的放疗计划发现,该患者沿臂丛神经走行区域的最大照射剂量为37.6 Gy(0.2 cm3),远低于神经纤维组织的剂量限制阈值(EQD2,54~59 Gy),因而考虑该晚期不良反应为偶然性事件。Khan等[11]和本中心同时期开展了一项剂量分割模式与本研究非常接近的乳腺癌改良根治术后大分割放疗的Ⅱ期研究,69例乳腺癌改良根治术后患者接受胸壁或重建乳房+区域淋巴结引流区放疗,采用36.63 Gy/11次的剂量分割模式,中位随访32个月。结果显示16例(24%)患者出现2级急性放射性皮炎,患者3年无局部区域复发生存率为89.2%。该研究随访5年的临床结果显示放疗相关晚期不良反应未见进一步增加,患者5年肿瘤局部区域控制率为92%,5年总生存率为90%[12]。乳腺癌术后放疗分割次数最少,疗程最短的剂量分割模式为英国FAST-Forward多中心、随机试验中采用的27 Gy/5次和26 Gy/5次,疗程缩短至1周[13]。该研究中,4 096例乳腺癌患者被随机分配到27 Gy/5次、26 Gy/5次和40 Gy/15次共3个剂量组接受全乳腺或胸壁照射,中位随访71.5个月,结果显示3组患者肿瘤局部区域复发率(2.6%, 2.1%和3.2%)、无病生存率和总生存率差异无统计学意义,3组患者5年累计中等以上乳房或胸壁放疗相关不良事件发生率分别为15.4%、11.9%和9.9%。该研究中仅193例(6.4%)患者接受了乳腺癌改良根治术,术后行胸壁照射。目前,尚未见到其它与本研究剂量分割方案接近或疗程更短的,针对乳腺癌改良根治术后患者胸壁及区域淋巴结大分割放疗的临床研究报道。
鉴于乳腺癌改良根治术后大分割放疗满意的临床疗效和轻微的放疗相关不良反应的临床证据不断增多,中国医师协会放射肿瘤治疗医师分会2020年明确鼓励国内有经验和技术的放疗单位应用43.5 Gy/15次的大分割放疗方案于乳腺癌改良根治术后患者,或在临床研究中应用其他的大分割放疗方案[14]。同年发布的St Gallen乳腺癌国际专家共识,首次强烈推荐将中等剂量大分割放疗常规用于乳腺癌改良根治术后胸壁和/或区域淋巴结照射[15]。2022年,欧洲放射治疗学会(ESTRO)推荐将中等大分割放疗用于任何乳腺癌患者的全乳腺、胸壁及区域淋巴结引流区照射,而将超大分割放疗(5次,疗程1周)推荐用于单纯全乳腺或胸壁(无重建)的照射[16]。
总之,本Ⅱ期研究的长期随访结果显示,乳腺癌改良根治术后胸壁±锁骨上区36.5 Gy/10次大分割调强放疗的不良反应轻微,临床疗效好,临床可行,有必要进一步开展Ⅲ期研究,以确认该方案在乳腺癌改良根治术后患者中的疗效及安全性,从而最终确认其临床应用价值。
利益冲突 所有作者均保证不存在利益冲突
作者贡献声明 蒋华勇、孟玲玲负责设计实验、实施研究;赵大伟、罗燕容、戴向昆、俞伟负责采集数据、统计分析;马林负责解释数据、对文章的知识性内容作批评性审阅、行政、技术或材料支持、指导
| [1] |
International Agency for Research on Cancer (IARC). Latest global cancer data: Cancer burden rises to 19.3 million new cases and 10.0 million cancer deaths in 2020[EB/OL]. [2022-02-25]. https://www.iarc.who.int/fr/newsevents.
|
| [2] |
Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials[J]. Lancet, 2005, 366(9503): 2087-2106. DOI:10.1016/S0140-6736(05)67887-7 |
| [3] |
Nielsen HM, Overgaard M, Grau C, et al. Study of failure pattern among high-risk breast cancer patients with or without postmastectomy radiotherapy in addition to adjuvant systemic therapy: long-term results from the Danish Breast Cancer Cooperative Group DBCG 82 b and c randomized studies[J]. J Clin Oncol, 2006, 24(15): 2268-2275. DOI:10.1200/JCO.2005.02.8738 |
| [4] |
McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8135 women in 22 randomised trials[J]. Lancet, 2014, 383(9935): 2127-2135. DOI:10.1016/S0140-6736(14)60488-8 |
| [5] |
Bentzen SM, Agrawal RK, Aird EG, et al. The UK Standardisation of Breast Radiotherapy Trial(START) A of radiotherapy hypofractionation for treatment of early breast cancer: a randomised trial[J]. Lancet Oncol, 2008, 9(4): 331-341. DOI:10.1016/S1470-2045(08)70077-9 |
| [6] |
Whelan TJ, Pignol JP, Levine MN, et al. Long-term results of hypofractionated radiation therapy for breast cancer[J]. N Engl J Med, 2010, 362(6): 513-520. DOI:10.1056/NEJMoa0906260 |
| [7] |
Wang SL, Fang H, Hu C, et al. Hypofractionated versus conventional fractionated radiotherapy after breast-conserving surgery in the modern treatment era: A multicenter, randomized controlled trial from China[J]. J Clin Oncol, 2020, 38(31): 3604-3614. DOI:10.1200/JCO.20.01024 |
| [8] |
Offersen BV, Alsner J, Nielsen HM, et al. Hypofractionated versus standard fractionated radiotherapy in patients with early breast cancer or ductal carcinoma in situ in a randomized phase Ⅲ trial: the DBCG HYPO trial[J]. J Clin Oncol, 2020, 38(31): 3615-3625. DOI:10.1200/JCO.20.01363 |
| [9] |
Koulis TA, Nichol AM, Truong PT, et al. Hypofractionated adjuvant radiation therapy is effective for patients with lymph node-positive breast cancer: A population-based analysis[J]. Int J Radiat Oncol Biol Phys, 2020, 108(5): 1150-1158. DOI:10.1016/j.ijrobp.2020.07.2313 |
| [10] |
Wang SL, Fang H, Song YW, et al. Hypofractionated versus conventional fractionated postmastectomy radiotherapy for patients with high-risk breast cancer: a randomised, non-inferiority, open-label, phase 3 trial[J]. Lancet Oncol, 2019, 20(3): 352-360. DOI:10.1016/S1470-2045(18)30813-1 |
| [11] |
Khan AJ, Poppe MM, Goyal S, et al. Hypofractionated postmastectomy radiation therapy is safe and effective: first results from a prospective phase Ⅱ trial[J]. J Clin Oncol, 2017, 35(18): 2037-2043. DOI:10.1200/JCO.2016.70.7158 |
| [12] |
Poppe MM, Yehia ZA, Baker C, et al. 5-year update of a multi-institution, prospective phase 2 hypofractionated postmastectomy radiation therapy trial[J]. Int J Radiat Oncol Biol Phys, 2020, 107(4): 694-700. DOI:10.1016/j.ijrobp.2020.03.020 |
| [13] |
Murray Brunt A, Haviland JS, Wheatley DA, et al. Hypofractionated breast radiotherapy for 1 week versus 3 weeks (FAST-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, non-inferiority, randomised, phase 3 trial[J]. Lancet, 2020, 395(10237): 1613-1626. DOI:10.1016/S0140-6736(20)30932-6 |
| [14] |
中国医师协会放射肿瘤治疗医师分会. 乳腺癌放射治疗指南(中国医师协会2020版)[J]. 中华放射肿瘤学杂志, 2021, 30(4): 321-342. Radiation Oncology Physicians Branch of Chinese Medical Doctor Association. Guidelines for radiotherapy of breast cancer (Chinese Medical Doctor Association 2020 edition)[J]. Chin J Radiat Oncol, 2021, 30(4): 321-342. DOI:10.3760/cma.j.cn113030-20210107-00010 |
| [15] |
Burstein HJ, Curigliano G, Thürlimann B, et al. Customizing local and systemic therapies for women with early breast cancer: the St. Gallen International Consensus Guidelines for treatment of early breast cancer 2021[J]. Ann Oncol, 2021, 32(10): 1216-1235. DOI:10.1016/j.annonc.2021.06.023 |
| [16] |
Meattini I, Becherini C, Boersma L, et al. European Society for Radiotherapy and Oncology Advisory Committee in Radiation Oncology Practice consensus recommendations on patient selection and dose and fractionation for external beam radiotherapy in early breast cancer[J]. Lancet Oncol, 2022, 23(1): e21-e31. DOI:10.1016/S1470-2045(21)00539-8 |
 2024, Vol. 44
2024, Vol. 44


