2. 四川大学华西基础与法医学院, 成都 610041
2. West China School of Basic Medical Sciences & Forensic Medicine, Sichuan University, Chengdu 610041, China
瘢痕疙瘩是一种皮肤对创伤或刺激过度反应,伤口异常愈合引起的纤维化疾病,其表现为局部持续炎症,成纤维细胞异常增殖,并导致胶原蛋白过度沉积[1]。目前手术切除联合术后放疗是瘢痕疙瘩的一线治疗方案。放疗是瘢痕疙瘩的重要辅助治疗,其可减少瘢痕疙瘩局部微环境中免疫细胞和炎症介质的浸润,改善局部氧供和血供,阻止胶原合成和成纤维细胞的增殖等[2]。手术联合放疗可降低瘢痕疙瘩复发率,但仍有不少患者会出现放射抵抗,最终导致瘢痕疙瘩复发。本课题组前期采用二代测序结合分子生物学手段发现抑制FOXO1可以提高瘢痕疙瘩对放疗的敏感性[3],本研究采用scRNA-Seq技术,进一步从单细胞测序的角度阐释瘢痕疙瘩放疗增敏的可能机制。
目前已有对瘢痕疙瘩进行了单细胞测序分析的报道[4-7],然而,瘢痕疙瘩放疗抵抗或放疗增敏相关研究较少。因此,本研究针对放疗前后的瘢痕疙瘩以及其周围的正常皮肤组织样本进行研究,比较细胞组成差异,鉴别放疗后瘢痕疙瘩组织发生改变的细胞亚群及通路,为研究瘢痕疙瘩放疗增敏及潜在作用机制提供新的策略。
资料与方法1. 研究对象:本研究纳入了4例患者,收集了每例患者放疗前、放疗后的瘢痕疙瘩及瘢痕疙瘩周围未放疗的正常皮肤组织样本各1个,共12个样本。纳入标准:女性患者;年龄20~40岁;瘢痕疙瘩发病≤5年;位于胸部的瘢痕疙瘩;瘢痕疙瘩较为对称的分布于中线两侧;瘢痕疙瘩凸出厚度≤3 mm。排除标准:孕期及哺乳期的患者;术前接受过治疗如注射治疗及激光治疗等;瘢痕疙瘩继发于外科手术、外伤及烧伤等;术后复发的瘢痕疙瘩;瘢痕疙瘩存在感染征象;患者不接受研究设定的放疗方案;患者存在不适合手术切除的系统性疾病等。所有样本均由四川大学华西医院整形外科/烧伤科手术获取。入组的瘢痕疙瘩患者参与治疗前均未接受过任何类型的瘢痕疙瘩治疗,且签署受试者知情同意书及手术知情同意书。本研究经四川大学华西医院伦理委员会批准[2022审(1416)号]。
2. 放疗方案:本研究将胸部瘢痕疙瘩从中线处分为两部分,左右两侧为不同的放疗方案,采用常规电子线放疗(AccStar医用直线加速器系统,成都利尼科;5 MeV电子线,源靶距(SSD)=100 cm;照射野范围:距离手术切口或瘢痕疙瘩边缘1 cm;补偿厚度0.5 cm),每天一次;左侧放疗方案为瘢痕疙瘩切除术后当天开始第一次放疗,连续放疗4 d(单次5 Gy,共20 Gy);右侧为术前2 d(单次5 Gy,共10 Gy),术后2 d(单次5 Gy,共10 Gy),术前两次放疗后的第二天两侧瘢痕疙瘩一并切除并收集样本。
3. 样本制备:取材后立即将新鲜标本组织保存在冰上的组织保存溶液(南京新格元生物科技公司)中,样本分为放疗组(KR)、未放疗组(KC)及正常对照组(N)。将标本用汉克平衡盐溶液洗涤3次,切碎,用3 ml组织解离溶液(南京新格元生物科技公司)在37℃下消化15 min。将细胞悬液经40 μm无菌滤网过滤后,加入红细胞裂解液(南京新格元生物科技公司),混合液[细胞∶红细胞裂解缓冲液RCLB=1∶2(体积比)]在室温下静置5~8 min以去除红细胞。随后将混合液300×g,4℃离心5 min,除去上清液,用磷酸盐缓冲溶液(PBS)重悬细胞。
4. 文库构建:使用单细胞处理系统将带有PBS的单细胞悬液(2×105/ml)加载到微孔芯片上。从微孔芯片中收集条形码凝胶珠Barcoding Beads,然后对捕获的信使核糖核酸进行反转录获得互补脱氧核糖核酸(cDNA),并进行聚合酶链式反应(PCR)扩增;扩增的cDNA片段化后,用测序接头连接。单细胞RNA测序文库根据单细胞RNA文库试剂盒(南京新格元生物科技公司)方案构建。将单个文库稀释至4 nmol/L,合并后在Illumina NovaSeq 6000测序平台上以150 bp配对末端读数进行测序。
5. 原始读取数据分析:scRNA-Seq原始数据通过CeleScope(https://github.com/singleron-RD/CeleScope)v1.9.0 pipeline产生基因表达矩阵。用CeleScope去除低质量读数,用Cutadapt v 1.17修剪多聚A尾部和接头序列。提取细胞条形码和UMI。然后,使用STAR v2.6.1a将读数映射到参考基因组GRCh38(ensembl version 92 annotation)。使用featureCounts v2.0.1软件获取每个细胞的特异性分子标签UMI计数和基因计数,并用于生成表达矩阵文件以供后续分析。
6. 数据质量控制、降维和聚类:通过UMI计数将超过30 000、基因计数<200或>5 000、线粒体含量超过20%进行细胞过滤。保留瘢痕疙瘩细胞用于下游分析。本研究使用Seurat v3.1.2中的函数用于降维和聚类。使用NormalizeData和ScaleData函数对所有基因表达进行标准化和缩放,并使用FindVariableFeautres函数对基因进行主成分分析。使用FindClusters函数将细胞分成多个簇。Harmony函数消除样本之间的批次效应。应用降维流形学习算法对细胞数据进行降维展示。
7. 细胞类型注释:使用SynEcoSys数据库通过在DEG中发现的经典标记的表达来确定每个簇的细胞类型身份。显示用于识别每种细胞类型的标记基因表达的热图/点图/小提琴图由Seurat v3.1.2 DoHeatmap/DotPlot/Vlnplot函数生成。
8. 差异表达基因(DEG)分析:使用基于Wilcox似然比检验和默认参数的Seurat FindMarkers函数,选择表达超过10%的细胞簇且平均对数差异倍数log值>0.25的基因作为DEG。对于每个簇的细胞类型注释,本研究将在DEG中发现的经典标记基因的表达与文献知识相结合,并使用Seurat的DoHeatmap/DotPlot/Vlnplot函数生成的热图/点图/小提琴图来展示每种细胞类型标记的表达。双峰细胞被鉴定为不同细胞类型的表达标志物,并手动去除。
9. 通路富集分析:为了研究DEG的潜在功能,本研究使用了基因本体论/京都基因与基因组百科全书(GO/KEGG)分析与cluster Profiler R package 3.16.1。P<0.05的路径被认为是显着富集的,包括分子功能、生物过程和细胞成分类别的基因本体基因集被用作参考。对于基因集变异分析(GSVA),使用GSVA包将每种细胞类型的平均基因表达作为输入数据。每个簇中DEG的蛋白质之间的相互作用根据已知的基因与StringDB v1.22.0中相关GO术语的相互作用来预测。
10. 细胞通讯分析(CellPhoneDB):细胞通讯分析由CellPhoneDB v2.1.0基于两种细胞类型/亚型之间已知的受体-配体相互作用进行。所有细胞的簇标签随机排列1 000次,以计算相互作用簇的平均配体-受体表达水平的零分布。单个配体或受体表达以基于所有细胞类型中所有基因的平均对数基因表达分布的截止值作为阈值。显著的细胞间相互作用定义为P<0.05且平均对数表达>0.1,使用circlize v0.4.10 R软件包进行可视化。
11. 统计学处理:使用非配对两独立样本Student-t检验对两组细胞之间的分布比较、基因表达或基因特征进行比较。所有统计分析和呈现均使用R语言进行。P<0.05为差异有统计学意义。
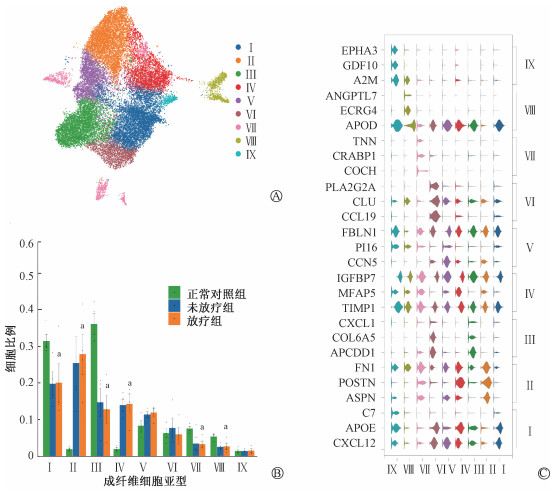
结果1. 单细胞测序展示放疗前后瘢痕疙瘩成纤维细胞的异质性:3个组12份样本成纤维细胞共计25 573个细胞,分为9个异质性亚群(图 1A)。Ⅱ及Ⅳ型成纤维细胞在正常皮肤中比例显著低于瘢痕疙瘩(t=4.70、4.87,P<0.05),而Ⅰ、Ⅲ、Ⅶ和Ⅷ型成纤维细胞在正常皮肤中的比例显著高于放疗后的瘢痕疙瘩样本(图 1B,t=3.11、4.96、4.02、2.62,P<0.05)。图 1C展示了9类成纤维细胞的标志性基因,如Ⅱ型成纤维细胞(ASPN、POSTN及FN1)。本研究发现Ⅱ型成纤维细胞比例在放疗后明显增加。
|
注:Ⅰ-Ⅸ依次代表Ⅰ~Ⅸ型成纤维细胞。a与正常对照组比较,t=3.11、4.70、4.96、4.87、4.02、2.62,P<0.05 图 1 单细胞测序提示放疗前后瘢痕疙瘩成纤维细胞的异质性 A. 成纤维细胞分群(1~9);B. 9类成纤维细胞在放疗组、未放疗组、正常组样本中分布情况的比较;C. 9类成纤维细胞的标志性基因 Figure 1 Single-cell sequencing showed the heterogeneity of keloid fibroblasts before and after radiotherapy A. Fibroblast subgroups 1-9; B. Comparison of the distribution of nine types of fibroblasts in the three groups; C. Signature genes of nine types of fibroblasts |
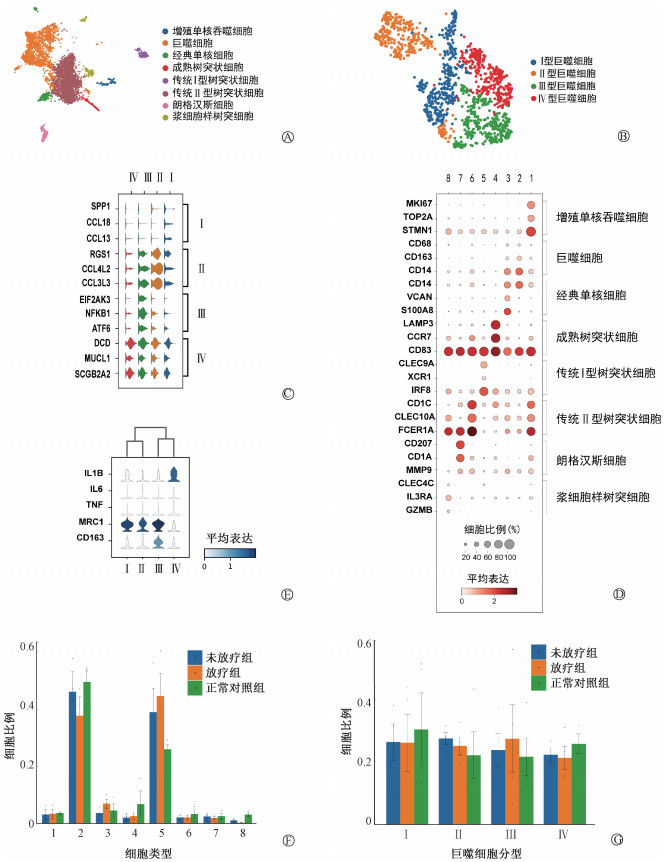
2. 放疗前后瘢痕疙瘩巨噬细胞的异质性:本研究进一步分析了MPs的变化情况。图 2A为无监督聚类结果,分为了8个异质性亚群(MPs共计4 723个细胞),包括增殖单核吞噬细胞(proliferating MPs)、巨噬细胞(macrophages)、经典单核细胞(classical mono)、成熟树突状细胞(mature DCs)、传统Ⅰ型树突状细胞(cDC1)、传统Ⅱ型树突状细胞(cDC2)、朗格汉斯细胞(Langerhans cells)、浆细胞样树突细胞(pDCs)。图 2B展示了巨噬细胞的进一步分群,本研究将其分为4类。图 2C展示了4类巨噬细胞的标志性基因。图 2D展示了不同单核吞噬细胞细胞表达水平最高的前3个标志性基因。图 2E为上述4类巨噬细胞与M1型(IL1B、IL6、TNF)及M2型(MRC1、CD163)巨噬细胞代表性基因的对应关系,可以看出本研究中的Ⅲ型巨噬细胞(EIF2AK3、NFKB1及ATF6)可能与M2型巨噬细胞具有部分重叠。从图 2F可见,放疗后经典单核细胞及巨噬细胞明显增加,放疗后瘢痕疙瘩内巨噬细胞浸润量较大,是比例最高的MPs。从图 2G中可以发现,Ⅲ型巨噬细胞即Macrophage-3放疗后数量增加。
|
注:1~8.依次为传统Ⅰ型树突状细胞、传统Ⅱ型树突状细胞、经典单核细胞、朗格汉斯细胞、巨噬细胞、成熟树突状细胞、浆细胞样树突细胞、增殖单核吞噬细胞;Ⅰ~Ⅳ.依次为Ⅰ~Ⅳ型巨噬细胞 图 2 放疗前后瘢痕疙瘩巨噬细胞的异质性 A. 对4 723个细胞的无偏聚类分析显示8类细胞的浸润;B. 巨噬细胞分为4个亚群;C. 4种类型巨噬细胞的标志性基因;D.不同细胞表达水平最高的3个标志性基因;E. 4类巨噬细胞与M1型(IL1B, IL6, TNF)及M2型(MRC1, CD163)巨噬细胞代表性基因的对应关系;F. 放疗后8类细胞比例比较;G. 4种类型巨噬细胞放疗后细胞比例 Figure 2 Heterogeneity of keloid macrophages before and after radiotherapy A. Unbiased clustering analysis of 4 723 cells showed infiltration of eight types of cells; B. Four macrophage subgroups; C. Signature genes of four macrophage subgroups; D. The top three landmark genes with the highest expression levels in different cells; E. Correspondence between four macrophage subgroups and M1 (IL1B, IL6, TNF) and M2 (MRC1, CD163) macrophages; F. Classical monocytes and macrophages significantly increased after radiotherapy; G. The proportion of cells after radiotherapy for four macrophage subgroups |
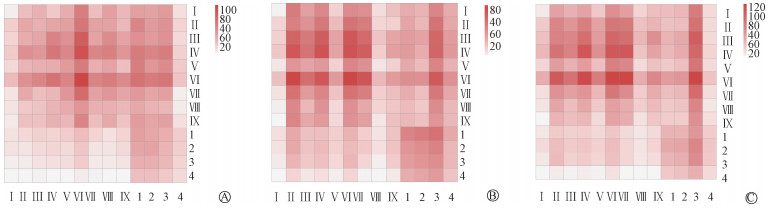
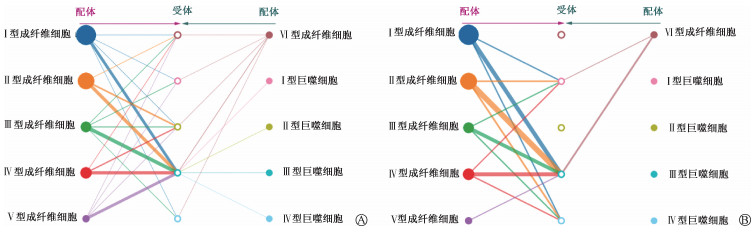
3. 巨噬细胞和成纤维细胞的相互作用:细胞通讯分析提示,在放射治疗后,相较于Ⅰ和Ⅱ型巨噬细胞,Ⅲ型巨噬细胞与各大类成纤维细胞的相互作用明显更为密切(图 3)。Ⅲ型巨噬细胞与各大类成纤维细胞(尤其是Ⅱ型)相互作用最主要的通路是Collagen信号通路(图 4A) 及Chemerin信号通路(图 4B)。这提示Ⅲ型巨噬细胞与成纤维细胞的相互作用可能是未来瘢痕疙瘩放疗增敏研究的一个重要切入点。
|
注:Ⅰ-Ⅸ. Ⅰ~Ⅸ型成纤维细胞;1~4. Ⅰ~Ⅳ型巨噬细胞 图 3 巨噬细胞和成纤维细胞的相互作用 A.正常对照组;B.未放疗组;C.放疗组 Figure 3 Interactions between macrophage and fibroblasts A. Normal control; B. Before radiotherapy; C. After radiotherapy |
|
图 4 Ⅲ型巨噬细胞与各大类成纤维细胞相互作用最主要的通路 A. Collagen信号通路;B. Chemerin信号通路 Figure 4 The major pathways through which type-3 macrophages interact with various types of fibroblasts A. Collagen signaling pathway; B. Chemerin signaling pathway |
讨论
虽然瘢痕疙瘩为良性皮肤真皮疾病,但其具有细胞过度增殖、凋亡抵抗和局部浸润等生物学特征。瘢痕疙瘩会超出原伤口的边界,引发疼痛、瘙痒和挛缩,给患者带来严重的身体和心理负担[8]。尽管目前有许多治疗方法,但瘢痕疙瘩的易复发和难根治始终是未攻克的难点[9]。故深入了解瘢痕疙瘩的发病细胞和分子机制,提高其放疗敏感性,对治疗的改进具有重要意义[10]。
单细胞测序技术可以检测数以万计单个细胞的转录组。与整个样本mRNA测序获得的混合细胞群的基因平均表达相比,单细胞测序技术精确评估细胞的多样性和调控网络[11]。因此,单细胞测序正在成为了解各种疾病的细胞和分子机制的强大工具,如肺纤维化和狼疮性肾炎等疾病[12-13]。有研究使用mRNA-seq或芯片分析来探究瘢痕疙瘩组织中的转录组变化情况以及瘢痕疙瘩的细胞多样性和调控变化[6-7, 11, 14-16]。然而,尚无利用单细胞测序分析放疗对瘢痕疙瘩成纤维细胞等的影响。
成纤维细胞是多种纤维化疾病的关键细胞[6, 17],既往研究将其分为4个亚群:分泌-乳头状成纤维细胞、分泌-网状成纤维细胞、间充质成纤维细胞和促炎性成纤维细胞[6]。本研究发现Ⅱ型成纤维细胞在放疗后明显增加。瘢痕疙瘩中,间充质成纤维细胞的特点之一是高表达分泌蛋白,如POSTN、COMP、COL11A1、ASPN和COL5A2[6],其中POSTN的增加可能促进了瘢痕疙瘩中胶原的产生[6]。本研究中的Ⅱ型成纤维细胞有相似的分子标志物,故属于间充质成纤维细胞。间充质成纤维细胞亚群在多种皮肤纤维化疾病中可能起着重要作用,并可能作为纤维化治疗的靶细胞[11]。本研究发现,Ⅱ型成纤维细胞在瘢痕疙瘩中数量显著高于正常皮肤,同时在放疗后的瘢痕疙瘩中数量增加。这说明Ⅱ型成纤维细胞在瘢痕疙瘩进展及治疗抵抗中可能发挥了重要作用。
巨噬细胞在不同环境下可以极化成两种类型:M1型和M2型[17]。肿瘤相关巨噬细胞通常表现为M2型,具有免疫抑制特性,是肿瘤微环境的重要组成部分,并分泌与肿瘤生长、扩散和预后相关的细胞因子,与成纤维细胞协同促进肿瘤的进展[18]。Ⅲ型巨噬细胞MRC1表达量高,属于M2型巨噬细胞的亚型。本研究发现,Ⅲ型巨噬细胞与成纤维细胞作用十分密切,细胞通讯分析提示巨噬细胞和成纤维细胞主要通过Collagen以及Chemerin信号通路网络相互作用,提示成纤维细胞作用于巨噬细胞后可能与瘢痕疙瘩胶原的生成相关。Ⅲ型巨噬细胞与Ⅱ型成纤维细胞相互作用的其他通路还包括FN1、VEGF、MK、THY1及SEMA3信号通路等,未来需揭示放疗后上述细胞Collagen信号通路的上调是否与瘢痕疙瘩放疗敏感性相关。脂肪细胞因子Chemerin是由CMKLR1/ChemR23基因编码的G蛋白偶联受体的内源性配体,在人类中CMKLR1基因主要在单核细胞及巨噬细胞中表达,同样也在脂肪、皮肤真皮中也具有高表达[19]。未来的研究需进一步揭示放疗后Chemerin信号通路的上调是否与瘢痕疙瘩放疗抵抗相关。
综上所述,本研究初步阐释了瘢痕疙瘩放疗前后相关细胞及通路的变化。瘢痕疙瘩放疗后Ⅱ型成纤维细胞、Ⅲ型巨噬细胞数量的上升,其与瘢痕疙瘩放疗抵抗可能相关。同时,成纤维细胞如Ⅱ型成纤维细胞与Ⅲ型巨噬细胞之间存在密切的相互作用,这种作用在瘢痕疙瘩接受放疗后更为显著。上述发现为未来瘢痕疙瘩放疗增敏提供了一定的理论基础。
利益冲突 无
作者贡献声明 李伟、凃贝霖、李晓倩负责查阅文献、设计实施实验、数据采集、分析数据、撰写及修改文章;许学文、肖海涛、张艳阁负责指导实验、审阅论文;张舒羽负责文章审阅和修改、指导实验、提供技术支持
| [1] |
Jagdeo J, Kerby E, Glass DA Ⅱ. Keloids[J]. JAMA Dermatol, 2021, 157(6): 744. DOI:10.1001/jamadermatol.2020.4705 |
| [2] |
Dong W, Qiu B, Fan F. Adjuvant radiotherapy for keloids[J]. Aesthetic Plast Surg, 2022, 46(1): 489-499. DOI:10.1007/s00266-021-02442-w |
| [3] |
Hong M, Li X, Liu Y, et al. Molecular response of keloids to ionizing radiation: targeting FOXO1 radiosensitizes keloids[J]. Int J Radiat Biol, 2023, 99(5): 835-844. DOI:10.1080/09553002.2022.2121871 |
| [4] |
Liu X, Chen W, Zeng Q, et al. Single-cell RNA-sequencing reveals lineage-specific regulatory changes of fibroblasts and vascular endothelial cells in keloids[J]. J Invest Dermatol, 2022, 142(1): 124-135. e11. DOI:10.1016/j.jid.2021.06.010 |
| [5] |
Feng C, Shan M, Xia Y, et al. Single-cell RNA sequencing reveals distinct immunology profiles in human keloid[J]. Front Immunol, 2022, 13: 940645. DOI:10.3389/fimmu.2022.940645 |
| [6] |
Deng CC, Hu YF, Zhu DH, et al. Single-cell RNA-seq reveals fibroblast heterogeneity and increased mesenchymal fibroblasts in human fibrotic skin diseases[J]. Nat Commun, 2021, 12(1): 3709. DOI:10.1038/s41467-021-24110-y |
| [7] |
Direder M, Weiss T, Copic D, et al. Schwann cells contribute to keloid formation[J]. Matrix Biol, 2022, 108: 55-76. DOI:10.1016/j.matbio.2022.03.001 |
| [8] |
Ojeh N, Bharatha A, Gaur U, et al. Keloids: Current and emerging therapies[J]. Scars Burn Heal, 2020, 6: 2059513120940499. DOI:10.1177/2059513120940499 |
| [9] |
Thornton NJ, Garcia BA, Hoyer P, et al. Keloid scars: An updated review of combination therapies[J]. Cureus, 2021, 13(1): e12999. DOI:10.7759/cureus.12999 |
| [10] |
Zainib M, Amin NP. Radiation therapy in the treatment of keloids[M/OL]. StatPearls, Treasure Island (FL): StatPearls Publishing, 2023-7-31. https://www.ncbi.nlm.nih.gov/books/NBK499973/.
|
| [11] |
Liu X, Chen W, Zeng Q, et al. Single-cell RNA-sequencing reveals lineage-specific regulatory changes of fibroblasts and vascular endothelial cells in keloids[J]. J Invest Dermatol, 2022, 142(1): 124-135. DOI:10.1016/j.jid.2021.06.010 |
| [12] |
Guo S, Dong Y, Wang C, et al. Integrative analysis reveals the recurrent genetic etiologies in idiopathic pulmonary fibrosis[J]. QJM, 2023, 116(12): 983-992. DOI:10.1093/qjmed/hcad206 |
| [13] |
Yoon H, Dean LS, Jiyarom B, et al. Single-cell RNA sequencing reveals characteristics of myeloid cells in pulmonary post-acute sequelae of SARS-CoV-2[J]. bioRxiv, 2023, 2023.07.31.551349. DOI:10.1101/2023.07.31.551349 |
| [14] |
Feng C, Shan M, Xia Y, et al. Single-cell RNA sequencing reveals distinct immunology profiles in human keloid[J]. Front Immunol, 2022, 13: 940645. DOI:10.3389/fimmu.2022.940645 |
| [15] |
Xu H, Zhu Z, Hu J, et al. Downregulated cytotoxic CD8(+) T-cell identifies with the NKG2A-soluble HLA-E axis as a predictive biomarker and potential therapeutic target in keloids[J]. Cell Mol Immunol, 2022, 19(4): 527-539. DOI:10.1038/s41423-021-00834-1 |
| [16] |
Shim J, Oh SJ, Yeo E, et al. Integrated analysis of single-cell and spatial transcriptomics in keloids: Highlights on fibrovascular interactions in keloid pathogenesis[J]. J Invest Dermatol, 2022, 142(8): 2128-2139. DOI:10.1016/j.jid.2022.01.017 |
| [17] |
Tabib T, Huang M, Morse N, et al. Myofibroblast transcriptome indicates SFRP2(hi) fibroblast progenitors in systemic sclerosis skin[J]. Nat Commun, 2021, 12(1): 4384. DOI:10.1038/s41467-021-24607-6 |
| [18] |
Solé-Boldo L, Raddatz G, Schütz S, et al. Single-cell transcriptomes of the human skin reveal age-related loss of fibroblast priming[J]. Commun Biol, 2020, 3(1): 188. DOI:10.1038/s42003-020-0922-4 |
| [19] |
Banas M, Zegar A, Kwitniewski M, et al. The expression and regulation of chemerin in the epidermis[J]. PLoS One, 2015, 10(2): e0117830. DOI:10.1371/journal.pone.0117830 |
 2024, Vol. 44
2024, Vol. 44


