2. 宁夏石嘴山市第二人民医院老年医学科, 石嘴山 753000
2. Department of Gerontology, 2nd People's Hospital of Shizuishan, Shizuishan 753000, China
食管癌是临床上常见的恶性肿瘤。据统计,2020年全球食管癌新发病例数约60万例,我国食管癌的发病率占全世界的53.6%[1]。其中,食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是我国食管癌的主要病理类型[2]。放射治疗是食管癌治疗的主要手段之一。然而,放射抵抗仍然是影响ESCC疗效的重要因素。
UBQLN2是UBQLNs(泛素样蛋白家族)中的一员,介导蛋白质通过泛素-蛋白酶体途径得以降解。近年来多项研究表明,UBQLN2在肝细胞癌、尿路上皮癌、骨肉瘤、ESCC等多种肿瘤细胞中高表达[3-7]。在肝细胞癌中,UBQLN2可作为独立危险因子和潜在的预后标志物[5]。在乏氧应激和促进骨肉瘤进展中,UBQLN2也起重要作用[3]。然而,UBQLN2如何参与食管鳞癌发生和进展的机制尚不清楚,且目前鲜有关于UBQLN2与ESCC放射敏感性的相关报道。代谢重编程是肿瘤发生的基本特征。有研究表明,嘌呤代谢失调与肿瘤的发生发展有关,参与嘌呤代谢的多种酶与肿瘤细胞的增殖、耐药有关[8]。本研究将从代谢重编程角度探索UBQLN2表达水平与食管鳞癌放射敏感性的关系及可能的分子机制,为寻找放疗增敏剂提供实验基础。
材料与方法1. 主要仪器与试剂:胎牛血清(FBS)购自美国GIBCO公司;RMPI 1640培养基、MEM基础培养基购自美国HyClone公司;DMEM高糖培养基购自美国Thermofisher公司;UBQLN2(D7R2Z)抗体购自德国CST公司;GAPDH抗体购自德国MERCK公司,辣根酶标记山羊抗兔购自美国Affinity公司;CCK-8细胞活力检测试剂盒购自北京普利莱基因技术有限公司;NanoDrop ND1000紫外分光光度仪购自美国Thermofisher公司。总RNA提取试剂盒(DP420)购自天根生化科技(北京)有限公司;第一链cDNA合成试剂盒购自美国Thermofisher公司;实时荧光定量PCR试剂盒购自日本TaKaRa公司;siRNA转染试剂Opti-MEM®Reduced Sermum Medium购自美国GIBCO公司,RNA iMAX购自美国Thermofisher公司;慢病毒转染试剂购自上海吉凯基因科技有限公司。
2. 细胞培养与照射条件:人食管鳞癌细胞株EC109购于通派(上海)生物有限公司、KYSE30购于上海博古生物细胞所。EC109细胞、KYSE30细胞分别用RMPI 1640和MEM培养基培养。过表达细胞用DMEM高糖培养基培养。所有培养基添加10%胎牛血清和1%青霉素/链霉素(美国GIBCO公司)。细胞置于含5%CO2的37℃恒温培养箱内培养。细胞照射采用美国瓦里安Clinac IX医学直线加速器。根据本课题组此前的实验结果以及相关文献[9],确定照射剂量为6 MV X射线4 Gy,照射剂量率为300 MU/min,机架角度180°,源靶距100 cm,培养瓶下方放厚度为1.5 cm的组织补偿物。
3. 细胞实验分组:EC109和KYSE30细胞株分为:野生对照组(WT组)、阴性对照组(NC组)、单纯照射组(R组)、UBQLN2-敲低组(UBQLN2-KD组)、UBQLN2-过表达组(UBQLN2-OE组)、UBQLN2-敲低+照射组(UBQLN2-KD+R组)、UBQLN2-过表达+照射组(UBQLN2-OE+R组)。
4. 细胞转染:应用siRNA转染技术构建UBQLN2表达水平敲低的ESCC细胞株。最佳转染条件已通过预实验确定(转染实验细胞密度:50%~70%,siRNA浓度:200 nmol/L)。应用慢病毒转染技术构建UBQLN2过表达ESCC细胞株。将对数生长期的EC109和KYSE30细胞种植于6孔板中,每孔约种2 × 105,培养16~24 h,待融合度为30%时进行慢病毒转染,待细胞密度为70%时,加入浓度为2 μg/ml的Puromycin进行筛选,直至对照组细胞被完全杀死后(约24 h),再依次使用1、0.5 μg/ml浓度的Puromycin各培养24 h,即得到UBQLN2基因过表达稳定细胞株。通过蛋白印迹实验进行过表达验证。
5.蛋白印迹实验:各组T25培养瓶中加入200 μl裂解液,冰上裂解20 min。4℃,12 000 r/min,离心半径8.3 cm,离心5 min后收集上清液即为全蛋白液,二喹啉甲酸(BCA)法检测蛋白液浓度。十二烷基硫酸钠-PAGE(SDS-PAGE)凝胶电泳,聚偏二氟乙烯(PVDF)膜恒流湿转,5%脱脂牛奶封闭1.5 h后,UBQLN2抗体(1∶1 000)4℃摇床孵育至少18 h。加入二抗辣根酶标记山羊抗兔(1∶10 000)室温孵育60 min,使用电化学发光(ECL)底物,ChemiDocTMMP Imaging System进行曝光、显影、分析。
6. CCK-8实验:将对数生长期的ESCC消化,1 000 r/min,离心半径8.3 cm,离心5 min后弃去上清液,加入2 ml培养基重悬,采用血细胞计数板法计数,并以每孔4 000个细胞接种至96孔板,每组6个重复孔。将培养板置于培养箱中过夜,待其贴壁后照射组即可进行X射线照射。照射后置于培养箱中继续培养24 h,然后向各孔加入10 μl的CCK-8检测液,37℃温箱孵育1~2 h。用酶标仪检测在450 nm波长处每孔的吸光度(A)值,计算细胞活力的公式为:细胞相对存活率(%) = (A实验组-A空白)/(A对照组-A空白)×100%。
7.克隆形成实验:取对数生长期的细胞,经4 Gy照射后制备单细胞悬液,计数,种6孔板(每孔500个细胞),“8字法”混匀放置细胞培养箱培养10~14 d。当大多数单克隆团细胞数>50个时,终止培养。磷酸盐缓冲液(PBS)清洗后每孔加1 ml 4%多聚甲醛固定15 min,再加入1 ml 0.1%结晶紫染色20 min,洗净、自然干燥后拍照、计算克隆形成率。计算方法为:克隆形成率(%) = (克隆数/接种细胞数)×100%。
8.代谢组学分析:设置野生组和UBQLN2敲低组,每组设6个组内重复样品。提取代谢物进行LC分析,将显著的差异性代谢物的表达量对各组样本进行层次聚类,以评价筛选出的代谢物的合理性。最终筛选出的差异代谢物提交到京都基因与基因组百科全书(KEGG)- PATHWAY数据库,进行相关通路分析。
9.实时荧光定量PCR(qRT-PCR)分析:引物序列如表 1所示。按照试剂盒步骤说明提取各组总RNA,反转录为cDNA。将cDNA模板及各试剂加入96孔反应板中。qRT-PCR反应条件:95℃ 30 s (1个循环),95℃ 5 s(40个循环),60℃ 30 s(40个循环)。2 -ΔΔCt计算相对表达水平。
|
|
表 1 PCR引物序列 Table 1 PCR primer sequences |
10. 实验药品制备:霉酚酸(MPA)购于美国MCE公司,将MPA溶解于二甲基亚砜(DMSO)中,制备为10 mmol/L的储存液于-80℃保存。进行后续实验时,加入完全培养基稀释至10 μmol/L工作液。三磷酸腺苷(ATP)购于美国Sigma公司,三磷酸鸟苷(GTP)购于上海爱必信生物科技有限公司。将ATP与GTP分别溶解于PBS中配制成储存液(10 mmol/L)-80℃保存。进行后续实验时,将其配制成20 μmol/L的工作液。由于目前没有嘌呤代谢酶类的激活剂可供实验所用,查阅相关文献,多采用药物ATP+GTP或AMP+GMP(两者对实验结果无差异)外源性补充嘌呤核苷酸[10]。因此本实验分别在UBQLN2敲低和过表达的ESCC细胞株中,外源性地加入ATP+GTP和MPA,即UBQLN2敲低+ATP+GTP+照射组和UBQLN2过表达+MPA+照射组。
11. 统计学处理:采用SPSS 22.0软件进行统计学处理,作图工具选用GraphPad Prism 9.5.1、ImageJ软件。计量资料符合正态分布,以x±s表示,两组间比较采用独立样本t检验。P<0.05为差异具有统计学意义。
结果1. 构建UBQLN2敲低与过表达食管鳞癌细胞系:Western blot实验验证siRNA转染效果如图 1A与1B所示:UBQLN2-KD组相较于WT组及NC组,其UBQLN2蛋白表达水平明显降低(t=3.35、7.61,P<0.05),UBQLN2敲低食管鳞癌细胞系构建成功。慢病毒转染构建UBQLN2过表达细胞系Western blot结果如图 1C与1D所示:与WT及NC组相比,UBQLN2-OE组的UBQLN2蛋白水平明显升高(t=7.16、4.12,P<0.05),UBQLN2过表达食管鳞癌细胞株构建成功。

|
注:WT. 野生对照组;NC. 阴性对照组;UBQLN2-KD/OE. UBQLN2敲低组/过表达组。 a与WT组比较,t=3.35、7.61、7.16、4.12,P<0.05 图 1 UBQLN2蛋白在食管鳞癌细胞系中的表达水平 A、C. Western blot代表条带;B、D. UBQLN2相对表达水平 Figure 1 The expression level of UBQLN2 protein in esophageal squamous cell carcinoma (ESCC) cells A, C. Representative protein bands of Western blot; B, D. Relative expression levels of UBQLN2 |
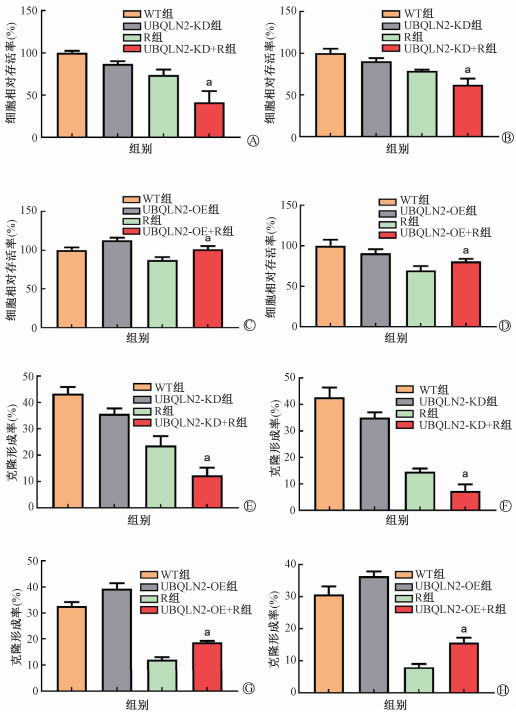
2. 食管鳞癌细胞系EC109和KYSE30中UBQLN2表达水平与放射敏感性呈负相关:CCK-8实验显示,与R组相比,UBQLN2-KD+R组的细胞存活率分别下降32.29%和16.42%(t=5.35、4.88, P<0.05),见图 2A。而UBQLN2-OE+R的细胞存活率与R组相比则分别上升了14.07%和10.64%(t=5.88、4.21, P<0.05),见图 2B。克隆形成实验结果显示,与R组相比,UBQLN2-KD+R组的细胞集落形成能力分别下降了11.07%和7.47%(t=4.18、5.09, P<0.05),见图 2C。而UBQLN2-OE+R组的细胞集落形成能力分别上升了6.53%和7.87%(t=8.60、8.28, P<0.05),见图 2D。这表明食管鳞癌细胞中UBQLN2敲低可增加放射敏感性,而UBQLN2过表达可产生放射抵抗效应。
|
注:WT. 野生对照组;R. 单纯照射组;UBQLN2-KD/OE. UBQLN2敲低组/过表达组。a与单纯照射组相比,t=5.35、4.88、5.88、4.21、4.18、5.09、8.60、8.28,P<0.05。A、C、E、G: EC109;B、D、F、H: KYSE30 图 2 UBQLN2的表达水平与食管鳞癌细胞的放射敏感性呈负相关 A、B、E、F. UBQLN2敲低ESCC细胞株的CCK-8活性与克隆形成结果;C、D、G、H.UBQLN2过表达ESCC细胞株的CCK-8活性与克隆形成结果 Figure 2 The expression level of UBQLN2 was negatively related to the radiosensitivity of esophageal squamous cell carcinoma cells A, B, E, F. Results of CCK-8 activity proliferation and clone formation in the UBQLN2-knockdown ESCC cells; C, D, G, H. Results of CCK-8 activity proliferation and clone formation in the UBQLN2-overexpression ESCC cells |
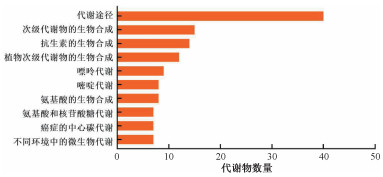
3. 代谢组学分析:UBQLN2敲低主要影响嘌呤代谢通路。采用UPLC-Q-TOF-MS技术筛选出UBQLN2-KD组和WT组的差异代谢物,并对其进行聚类分析及KEGG代谢通路分析。筛选出主要的KEGG通路如图 3所示。UBQLN2-KD组与WT组的嘌呤代谢途径有差异。
|
图 3 差异代谢物KEGG通路分析(TOP10) Figure 3 KEGG pathway analysis of differential metabolites (TOP10) |
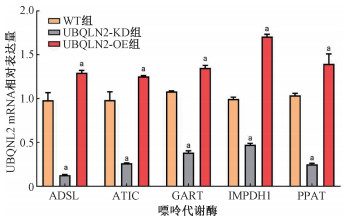
4. EC109细胞系中UBQLN2表达水平与嘌呤代谢酶的mRNA水平呈正相关:UBQLN2表达水平与5种嘌呤代谢酶的mRNA表达量的关系如图 4所示。与WT组比,UBQLN2-KD组中腺苷琥珀酸裂解酶(ADSL)、甲酰基转移酶(ATIC)、甘氨酰胺核苷酸合成酶(GART)、次黄嘌呤核苷酸脱氢酶1(IMPDH1)、磷酸核糖焦磷酸酶(PPAT)的mRNA相对表达量明显降低(t=24.17、22.86、7.73、39.29、15.72,P<0.05),而UBQLN2-OE组中上述酶的mRNA相对表达量明显升高(t=8.54、8.74、3.56、24.14、6.49,P<0.05)。这说明EC109细胞系中UBQLN2表达水平与上述5种嘌呤代谢酶的mRNA水平呈正相关性。
|
注:a与WT组比较,t=24.17、8.54、22.86、8.74、7.73、3.56、39.29、24.14、15.72、6.49,P<0.05 图 4 qRT-PCR实验检测EC109细胞各组嘌呤代谢酶的mRNA表达水平 Figure 4 qRT-PCR assay of mRNA expression levels of purine metabolism enzymes in the different groups of EC109 cells |
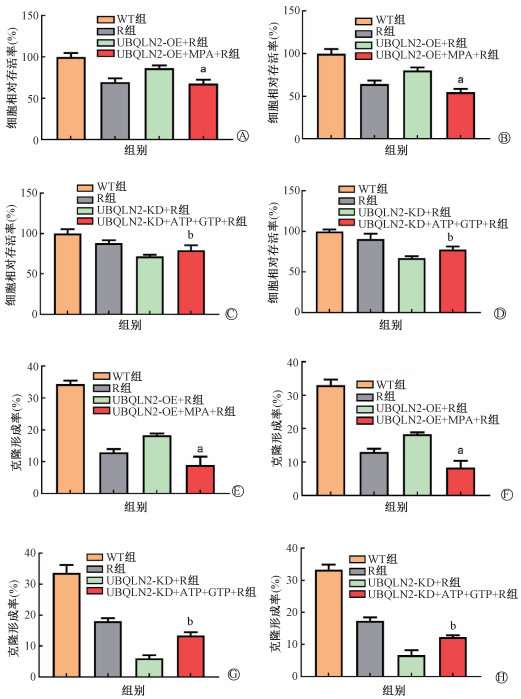
5. MPA可逆转UBQLN2过表达引起的放射抵抗:CCK-8与克隆形成实验结果如图 5A、5C所示,与UBQLN2-OE+R组相比,加入MPA后细胞存活率分别下降了18.28%和25.58%、集落形成能力分别下降了9.33%和9.93%(t=7.76、10.95、5.97、8.02, P<0.05)。而与UBQLN2-KD+ R组相比,在UBQLN2敲低ESCC细胞系中外源性补充ATP+GTP后,细胞存活率分别上升了8.28%和10.74%,集落形成率分别上升了7.33%和5.80%,如图 5B、5D所示(t=2.83、6.20、7.16、5.49, P<0.05)。结果表明嘌呤代谢酶抑制剂可对抗UBQLN2过表达引起的放射抵抗,而外源性补充核苷酸可逆转UBQLN2敲低所引起的放射增敏。
|
注:a与UBQLN2-OE+R组相比,t=7.76、10.95、5.97、8.02,P<0.05;b与UBQLN2-KD+R比较,t=2.83、6.20、7.16、5.49,P<0.05。A、C、E、G:EC109;B、D、F、H. KYSE30 图 5 MPA与外源性补充核苷酸(ATP+GTP)可逆转ESCC细胞株的放射敏感性 A、B、E、F. UBQLN2过表达ESCC细胞株中加入MPA后的CCK-8活性增殖与克隆形成实验结果;C、D、G、H. UBQLN2敲低ESCC细胞株中补充核苷酸(ATP+GTP)的CCK-8活性增殖与克隆形成实验结果 Figure 5 The radiosensitivity of ESCC cell lines was reversed by purine metabolizing enzyme inhibitors (MPA) and exogenous nucleotide supplements (ATP+GTP) A, B, E, F. Results of CCK-8 activity proliferation and clone formation in the UBQLN2 overexpressing ESCC cell lines after adding MPA; C, D, G, H. Results of proliferation and clone formation of CCK-8 activity of UBQLN2 knockdown ESCC supplemented with nucleotides (ATP+GTP) |
讨论
UBQLN2是一种蛋白酶体穿梭蛋白,参与蛋白质降解途径的调节,并维持蛋白质稳态[11]。近年来,关于UBQLN2与恶性肿瘤相关的研究越来越多。Tsukamoto等[3]对34例人高级别骨肉瘤患者进行UBQLN2免疫组织化学分析,并通过Kaplan-Meier法估计无转移生存期,结果表明UBQLN2高表达与骨肉瘤患者的无转移生存率降低相关;缺氧条件下沉默UBQLN2可能通过激活JNK和p38途径诱导人骨肉瘤细胞凋亡;沉默UBQLN2可抑制骨肉瘤模型大鼠肿瘤生长并诱导细胞凋亡。UBQLN2在尿路上皮癌细胞中组成性表达,通过增强蛋白酶体对异常氧化蛋白的降解,保护癌细胞免受活性氧(ROS)介导的细胞毒性[4]。UBQNL2过表达对于产生高水平内源性ROS的尿路上皮癌细胞的存活至关重要,UBQNL2蛋白免疫染色方法可以替代ROS标记技术,成为检测尿路上皮癌细胞的有用工具。另有研究发现,UBQNL2的高表达标记了一组具有侵袭性疾病的肝细胞癌患者[5]。UBQNL2与肿瘤大小和TNM分期密切相关,且UBQNL2高表达的肝细胞癌患者的生存率很低。UBQNL2似乎与突变的连环蛋白β1(CTNNβ1)有密切关系。此外,研究发现,在肺腺癌细胞中,UBQLN1和UBQLN2的缺失可诱导上皮-间充质转化(EMT)、增加细胞增殖、克隆形成潜能和细胞迁移[12]。多项证据表明,UBQLN2在细胞周期、凋亡、膜受体、DNA修复、EMT等重要角色的调节中发挥作用,从而参与恶性肿瘤的发生发展[3, 5, 12]。本研究发现UBQLN2表达水平与ESCC放射敏感性呈负相关,紧接着探究了UBQLN2调控ESCC放射敏感性可能的分子机制。
癌细胞的代谢重编程为肿瘤的生长、侵袭和转移提供能量和生物合成原料,从而促进其发生和发展,被认为是肿瘤发生和发展的重要特征之一[13]。泛素化在癌细胞代谢重编程调控中的作用受到广泛关注[14]。以往的研究表明,有氧糖酵解通过在喉癌、前列腺癌、头颈部癌中产生与放射抗性相关的化学还原环境,从而促进各种恶性肿瘤的放射抗性[15-17]。除了葡萄糖代谢外,肿瘤的代谢重编程还发生在谷氨酰胺、乳酸、脂肪酸以及核苷酸等代谢中。嘌呤是细胞增殖中核苷酸的基本组成部分,新的证据表明,嘌呤代谢失调与肿瘤有关[8]。通过代谢组学研究结果表明,与野生组相比,UBQLN2敲低组的嘌呤代谢通路有明显差异,而代谢相关酶是调节代谢途径的关键。通过qRT-PCR实验显示,UBQLN2敲低后嘌呤代谢酶的mRNA水平明显下降,反之,UBQLN2过表达后嘌呤代谢酶的mRNA水平明显升高。这个实验结果验证了UBQLN2表达水平的变化可影响嘌呤核苷酸的代谢。
由于嘌呤代谢过程中的多种酶都与癌细胞的增殖、耐药相关,因此,靶向嘌呤代谢一直是癌症治疗的策略。近年来,利用嘌呤代谢相关激酶的小分子抑制剂治疗癌症的方法有了许多进展。嘌呤代谢途径中的其他酶可能是治疗化疗耐药ALL的合适靶点[18]。霉酚酸(MPA),又称麦考酚酸,是人类发现的第一个IMPDH1抑制剂。研究表明,MPA对于人多种肿瘤细胞,如前列腺癌细胞(DU-145)、肺腺癌细胞(CaLu-3)、胰腺癌细胞(CaPan-2)等,都可诱导凋亡、抑制肿瘤细胞生长[19]。在之前的实验中,已经证实UBQLN2的表达水平与食管鳞癌细胞的放射敏感性有关。还通过代谢组学以及qRT-PCR实验发现UBQLN2可以影响嘌呤核苷酸的代谢。那么本团队推测UBQLN2可能通过介导嘌呤代谢从而调控食管鳞癌放射敏感性。通过CCK-8实验和克隆形成实验观察到,在UBQLN2过表达稳定细胞株中加入MPA后,UBQLN2过表达所引起的放射抵抗可被逆转。研究发现,嘌呤核苷酸,尤其是鸟苷酸(GTP)水平,与脑胶质瘤(GBM)的放射敏感性呈负相关[20]。有趣的是,本研究在UBQLN2敲低细胞株中外源性补充嘌呤核苷酸(ATP+GTP),会产生放射抵抗的结果。所以,UBQLN2通过上调嘌呤核苷酸代谢水平而调控食管鳞癌细胞放射敏感性。
综上所述,本研究从代谢重编程的角度探索UBQLN2调控食管鳞癌放射敏感性的机制,为寻找放疗增敏剂提供实验基础,对提高食管鳞癌放射治疗疗效提供新的理论依据。
利益冲突 无
作者贡献声明 马艳丽负责实验操作与数据分析、论文撰写;马蓉、王嘉琳负责课题设计与部分实验操作;潘闻燕、拜周兰负责部分数据分析;王艳阳负责课题设计、指导论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Zeng H, Zheng R, Guo Y, et al. Cancer survival in China, 2003-2005: a population-based study[J]. Int J Cancer, 2015, 136(8): 1921-1930. DOI:10.1002/ijc.29227 |
| [3] |
Tsukamoto S, Shimada K, Honoki K, et al. Ubiquilin 2 enhances osteosarcoma progression through resistance to hypoxic stress[J]. Oncol Rep, 2015, 33(4): 1799-1806. DOI:10.3892/or.2015.3788 |
| [4] |
Shimada K, Fujii T, Tatsumi Y, et al. Ubiquilin2 as a novel marker for detection of urothelial carcinoma cells in urine[J]. Diagn Cytopathol, 2016, 44(1): 3-9. DOI:10.1002/dc.23332 |
| [5] |
Luo YD, Yu HQ, Liu XY, et al. Prognostic and predicted significance of Ubqln2 in patients with hepatocellular carcinoma[J]. Cancer Med, 2020, 9(12): 4083-4094. DOI:10.1002/cam4.3040 |
| [6] |
Yasuda K, Hirohashi Y, Kuroda T, et al. MAPK13 is preferentially expressed in gynecological cancer stem cells and has a role in the tumor-initiation[J]. Biochem Biophys Res Commun, 2016, 472(4): 643-647. DOI:10.1016/j.bbrc.2016.03.004 |
| [7] |
Wang JL, Mu XY, Ma R, et al. Silencing UBQLN2 enhances the radiosensitivity of esophageal squamous cell carcinoma (ESCC) via activating p38 MAPK[J]. J Oncol, 2023, 2023: 2339732. DOI:10.1155/2023/2339732 |
| [8] |
Nishimura T, Nakata A, Chen X, et al. Cancer stem-like properties and gefitinib resistance are dependent on purine synthetic metabolism mediated by the mitochondrial enzyme MTHFD2[J]. Oncogene, 2019, 38(14): 2464-2481. DOI:10.1038/s41388-018-0589-1 |
| [9] |
Xia D, Zhang XR, Ma YL, et al. Nrf2 promotes esophageal squamous cell carcinoma (ESCC) resistance to radiotherapy through the CaMKⅡα-associated activation of autophagy[J]. Cell Biosci, 2020, 10: 90. DOI:10.1186/s13578-020-00456-6 |
| [10] |
Kitabatake K, Kaji T, Tsukimoto M. ATP and ADP enhance DNA damage repair in gamma-irradiated BEAS-2B human bronchial epithelial cells through activation of P2X7 and P2Y12 receptors[J]. Toxicol Appl Pharmacol, 2020, 407: 115240. DOI:10.1016/j.taap.2020.115240 |
| [11] |
Renaud L, Picher-Martel V, Codron P, et al. Key role of UBQLN2 in pathogenesis of amyotrophic lateral sclerosis and frontotemporal dementia[J]. Acta Neuropathol Commun, 2019, 7(1): 103. DOI:10.1186/s40478-019-0758-7 |
| [12] |
Ko HS, Uehara T, Tsuruma K, et al. Ubiquilin interacts with ubiquitylated proteins and proteasome through its ubiquitin-associated and ubiquitin-like domains[J]. FEBS Lett, 2004, 566(1-3): 110-114. DOI:10.1016/j.febslet.2004.04.031 |
| [13] |
Hirschey MD, DeBerardinis RJ, Diehl A, et al. Dysregulated metabolism contributes to oncogenesis[J]. Semin Cancer Biol, 2015, 35 Suppl: S129-S150. DOI:10.1016/j.semcancer.2015.10.002 |
| [14] |
Zhang KY, Yang S, Warraich ST, et al. Ubiquilin 2: a component of the ubiquitin-proteasome system with an emerging role in neurodegeneration[J]. Int J Biochem Cell Biol, 2014, 50: 123-126. DOI:10.1016/j.biocel.2014.02.018 |
| [15] |
Lin J, Xia L, Liang J, et al. The roles of glucose metabolic reprogramming in chemo- and radio-resistance[J]. J Exp Clin Cancer Res, 2019, 38(1): 218. DOI:10.1186/s13046-019-1214-z |
| [16] |
Milosevic M, Warde P, Ménard C, et al. Tumor hypoxia predicts biochemical failure following radiotherapy for clinically localized prostate cancer[J]. Clin Cancer Res, 2012, 18(7): 2108-2114. DOI:10.1158/1078-0432.CCR-11-2711 |
| [17] |
Spanos WC, Nowicki P, Lee DW, et al. Immune response during therapy with cisplatin or radiation for human papillomavirus-related head and neck cancer[J]. Arch Otolaryngol Head Neck Surg, 2009, 135(11): 1137-1146. DOI:10.1001/archoto.2009.159 |
| [18] |
Bouzar AB, Boxus M, Defoiche J, et al. Valproate synergizes with purine nucleoside analogues to induce apoptosis of B-chronic lymphocytic leukaemia cells[J]. Br J Haematol, 2009, 144(1): 41-52. DOI:10.1111/j.1365-2141.2008.07426.x |
| [19] |
Liu D, Yun Y, Yang D, et al. What is the biological function of uric acid? An antioxidant for neural protection or a biomarker for cell death[J]. Dis Markers, 2019, 2019: 4081962. DOI:10.1155/2019/4081962 |
| [20] |
Feng Y, Fu M, Guan X, et al. Uric acid mediated the association between BMI and postmenopausal breast cancer incidence: a bidirectional mendelian randomization analysis and prospective cohort study[J]. Front Endocrinol (Lausanne), 2021, 12: 742411. DOI:10.3389/fendo.2021.742411 |
 2024, Vol. 44
2024, Vol. 44


