2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850
2. Institute of Radiation Medicine, Academy of Military Medical Science, Academy of Military Science, Beijing 100850, China
放疗是肿瘤治疗的重要手段,但会不可避免地对肿瘤周围的正常组织造成损伤,导致一系列不良反应和并发症。超高剂量率(ultra-high dose rate, UHDR)放疗是一种新兴的放疗技术,其在极短的时间内给予超高剂量辐射,可产生FLASH效应,即在杀死肿瘤细胞的同时,显著降低对正常组织的损伤。研究表明,相对于常规剂量率(conventional dose rate, CONV)辐射,UHDR辐射增加了正常组织和肿瘤组织之间的差异反应[1-3]。Favaudon等[4]利用UHDR电子线照射C57BL/6J小鼠肺肿瘤和裸鼠皮下移植瘤,发现与CONV电子线相比,UHDR控制肿瘤效果相当,但可显著降低小鼠肺纤维化程度。其他相关研究也表明,UHDR脉冲辐射相较于CONV辐射更有利于保护正常组织[5-6]。
秀丽隐杆线虫作为模式生物有较多优势,如生命周期短、体积小(约1 mm)、易于观察等[7-8],在辐射对发育、运动、学习和衰老等研究中发挥重要作用[9-10]。此外,线虫基因组DNA序列与人类同源度较高,是研究免疫机制的天然模型[11-12]。这种模型生物体可在简单实验条件下进行操作,其光学透明的身体,更有利于机体氧化应激、氧含量等指标的可视化检测[13]。因此,建立UHDR脉冲辐射FLASH效应模型,对于其效应阈值及机制研究具有一定意义。但是,目前UHDR与CONV辐射对线虫影响差异研究较少。据此,本研究以野生型株系(N2)秀丽线虫为研究对象,观察CONV及UHDR辐射对其个体发育、运动能力、产卵率和寿命的影响,为深入研究UHDR辐射暴露对生物的影响提供新的模型。
材料与方法1. 秀丽线虫的培养:N2秀丽线虫,由美国线虫遗传中心(Caenorhabditis Genetics Center, CGC)提供。实验时将同步发育至L1期的线虫转移至含有E.coil OP50的90 mm线虫生长培养基(nematode growth medium, NGM)中,置于20℃生化培养箱内培养。
2. 线虫的同步化:培养秀丽线虫至成虫体内卵较多时,用M9 buffer冲洗线虫至离心管中,待线虫静置沉淀,去除上清液,此步骤重复3~5次直至上清液透明。向离心管中加入现配现用的线虫裂解液(8 mol/L NaClO 400 μl,10 mol/L NaOH 80 μl,均购自上海国药集团化学试剂有限公司)定容至5 ml,快速剧烈振荡6 min致线虫裂解。1 200 r/min,离心半径167.7 mm,离心1 min,弃上清,保留沉淀,加入5 ml M9 buffer重复离心3次获得虫卵。将虫卵置于35 mm不含食物的NGM培养皿中,于20℃生化培养箱培养16 h,此时线虫为L1期。将L1期线虫接种到涂有线虫食物的90 mm培养基上,待晾干后,将培养皿倒置于20℃生化培养箱培养。
3. 实验分组及脉冲照射条件:将同步化后发育至L1期的线虫(2 000±100)只/皿接种到NGM培养基上,培养至L4期时随机分为对照组(SHAM组)、常规剂量率组(CONV组)和超高剂量率组(UHDR组)。本研究采用清华大学工程物理系电子线UHDR垂直测试平台进行CONV电子射线和UHDR电子射线照射,能量为6 MeV,源靶距分别为100和80 cm,射野为8.2 mm×8.2 mm,两种射线剂量均为3 Gy,平均剂量率分别为0.3和200 Gy/s,采用美国Ashland公司的GafchromicTMEBT3胶片测定实际辐射剂量,保证整体剂量的准确性,具体参数见表 1。
|
|
表 1 超高剂量率和常规剂量率照射参数 Table 1 UHDR and CONV irradiation parameters |
4. 线虫个体发育检测:在辐射后的第3、6、10天测量线虫体长、体宽,每组随机选取40只线虫,使用日本尼康SMZ1500立体变焦显微镜结合NIS元素F4.0软件(日本Nikon公司)拍照保存。利用UOPView 2.0(重庆澳浦光电公司)数码显微图像处理分析系统对图像进行像素测量分析。
5. 运动能力的测定:在照射后第3、6、10天,每组随机选取10只,将线虫转入没有食物的NGM培养基上,使其自由活动2 min以适应环境,使用尼康SMZ1500显微镜结合NIS元素F4.0软件,分别测定其头部摆动、身体弯曲次数,每只观察记录时长均为10 s。线虫头部从一侧摆向另一侧后再摆动回来定义为1次头部摆动。在线虫向前爬行时,完成1个“S”形运动计为1次身体弯曲。
6. 产卵量统计:照射后每组即刻随机挑取9只线虫,平均转移到3个新的涂有菌液的35 mm NGM培养皿上(照射前1 d在平板中央滴加20 μl菌液),置于20℃的培养箱中。每隔24 h将线虫转移到新的培养皿中,直到线虫停止产卵,把线虫挑出后,计数线虫产卵的数量。实验进行3次重复。
7. 线虫寿命观察:从每组中选出100只线虫转到含有OP50的90 mm NGM板上进行寿命分析。每天统计存活和死亡的个数,直到所有线虫均死亡。线虫L1期计为第0天,成虫在产卵期每天转移到新鲜NGM板上,在第7天后,每隔1天转移一次。用铂金线轻轻刺激时,不动的线虫则被评为死亡。
8. 统计学处理:采用GraphPad Prism 9.0软件对实验数据进行处理,数据符合正态分布,以x±s表示,采用独立样本t检验进行两组间比较,生存曲线采用Log-rank(Mantel-Cox)统计分析。P<0.05为差异具有统计学意义。
结果1. 不同剂量率电子射线对N2线虫生长发育的影响:辐射后体长和体宽实验结果见图 1。体长检测结果显示,照后第3天,CONV组和UHDR组线虫体长均明显短于SHAM组(t=4.81、4.83,P<0.05)。第6和10天时,与SHAM组相比,CONV组体长明显较短(t=3.63、3.63,P<0.05);与SHAM和CONV组相比,UHDR组体长明显增加(t= -11.84~-2.87,P<0.05),见图 1A。体宽检测结果显示, 照后第3天,各组间体宽差异无统计学意义(P>0.05)。照后第6和10天,与SHAM组相比,CONV组体宽明显较短,差异有统计学意义(t=3.38、3.18,P<0.05);UHDR组与SHAM组比较差异无统计学意义(P>0.05),但与CONV组比较,体宽明显增加(t= -4.43、-3.37,P<0.05)(图 1B)。
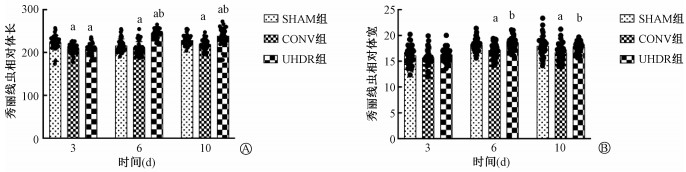
|
注:SHAM. 对照组;CONV. 常规剂量率组;UHDR. 超高剂量率组。a与同一时间SHAM组比较,t=4.81、4.83、3.63、-9.85、3.63、-2.87、3.38、3.18,P<0.05;b与同一时间CONV组比较,t=-11.84、5.70、-4.43、-3.37,P<0.05 图 1 CONV和UHDR脉冲电子射线辐射对线虫体长(A)和体宽(B)的影响 Figure 1 Effects of CONV and UHDR pulsed electron beam irradiation on body length (A) and body width (B) of C.elegans |
2. 不同剂量率电子射线对N2线虫运动能力的影响:线虫运动能力结果如图 2所示,照后第3和10天,与SHAM组相比,辐射组头部摆动和身体弯曲次数差异均无统计学意义(P>0.05);照后第6天,与SHAM组相比,CONV组和UHDR组头部摆动和身体弯曲次数均明显降低(t=2.91、3.52、3.97、2.71,P<0.05)。

|
注:SHAM. 对照组;CONV. 常规剂量率组;UHDR. 超高剂量率组。a与同一时间SHAM组比较,t=2.91、3.52、3.97、2.71,P<0.05 图 2 CONV与UHDR电子线照射对线虫运动能力的影响 A. 头部摆动次数;B. 身体弯曲次数 Figure 2 Effects of CONV and UHDR electron beam irradiation on the motility of C. elegans A. Number of head swings; B. Number of body bends |
3. 不同剂量率电子射线对N2线虫生殖能力的影响:SHAM组、CONV组、UHDR组平均产卵量分别为247、207、233个/只,与SHAM组相比,CONV组N2线虫总产卵量明显下降(t=5.54,P<0.01);UHDR组N2线虫总产卵量呈下降趋势,但差异无统计学意义(P>0.05)。与CONV组相比,UHDR组N2线虫总产卵量明显增多,差异有统计学意义(t=-5.99,P<0.01)。
4. 不同剂量率电子射线对N2寿命的影响:生存曲线结果如图 3所示,线虫照后第11天出现死亡,第19天全部死亡。与SHAM组相比,CONV组N2线虫存活时间明显缩短(χ2=8.49,P<0.01),UHDR组N2线虫存活时间呈下降趋势,但差异无统计学意义(P>0.05)。
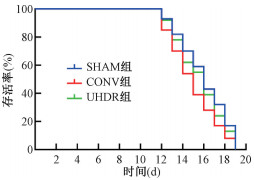
|
注:SHAM. 对照组;CONV. 常规剂量率组;UHDR. 超高剂量率组。CONV组与SHAM组比较,χ2=8.49,P<0.05 图 3 CONV与UHDR电子射线暴露对N2线虫寿命的影响 Figure 3 Effect of CONV and UHDR electron beam irradiation on the lifespan of N2 nematodes of C. elegans |
讨论
目前,UHDR脉冲辐射应用于肿瘤治疗还需要解决FLASH效应阈值和生物学机制的问题。一方面,大多数研究认为,产生FLASH效应,平均剂量率通常>40 Gy/s,但剂量率并不是唯一的决定因素,其他如脉宽、重频等射线参数同样重要。明确效应阈值及各参数最优化组合是其临床应用的前提,需要完成大量动物实验,现有动物模型通常难以进行大规模筛查。另一方面,UHDR脉冲辐射产生FLASH效应的生物学机制尚未完全阐明。领域内关于其机制的解释主要是氧耗竭学说[14-15]、免疫学说[16]等,但都不能合理解释FLASH效应,其问题主要在于缺乏适合的体内检测手段以及直接的实验证据。上述问题在一定程度上限制了UHDR脉冲辐射的转化应用。
UHDR脉冲辐射的FLASH效应特征,使其能够尽可能增加肿瘤照射剂量而提升患者疗效,因而在放疗领域有巨大潜力,成为该领域研究的热点。近年来,开展了大量研究,但其产生FLASH效应的阈值参数问题一直未根本解决,现有生物效应机制假说也存在诸多疑点,仍需大量实验研究予以充分解释和证明,建立合适的实验模型是解决上述问题的路径之一。
秀丽隐杆线虫已被证明是辐射生物研究的理想模式生物[17-18]。鉴于其特殊优势以及FLASH效应研究的需求,本研究通过检测UHDR脉冲电子射线照射后线虫的个体发育、运动能力、产卵率、寿命等指标,建立了UHDR脉冲辐射FLASH效应模型。线虫体长体宽可以直接反馈线虫的整体发育,运动能力可直接反映线虫抵御外界压力的能力[19]。线虫体型调节受到环境因素和神经系统的影响[20]。辐射作为一种应激源,可能会引发线虫体内的一系列应激反应,如激活某些保护性途径或信号通路,从而影响生长发育。体长、体宽和运动次数的检测结果显示,与常规电子线相比,UHDR脉冲辐射对线虫的损伤较小。产卵量可直接反映机体生殖能力,而在无脊椎动物模型中,生殖功能常被视为最为敏感的辐射生物效应指标,其对辐射的敏感性可能与生物体内的衰老机制相关联[21]。产卵量统计结果表明,相比于常规电子线,UHDR脉冲电子射线对线虫的生殖功能损伤较小,这与Pawelke等[22]发现高剂量率电子射线能保护斑马鱼胚胎的发育相互验证。寿命是线虫辐射损伤的评价终点,本研究发现,与常规剂量率照射不同,相同剂量的UHDR脉冲辐射线虫寿命无明显变化。
综上所述,常规放疗低剂量率辐照线虫会抑制其生长发育、降低运动行为能力、损害生殖系统和缩短寿命,而UHDR脉冲辐射对线虫造成整体损伤更轻,这与临床研究中UHDR照射相较常规剂量率照射能减轻不良反应相符[23]。鉴于秀丽隐杆线虫在大规模实验筛查和分子指标检测的优势,本研究建立的秀丽线虫UHDR脉冲辐射FLASH效应模型为探索UHDR脉冲辐射研究提供了新的参考。
利益冲突 全体作者没有任何利益冲突,未接受任何不当的职务或财务利益
作者贡献声明 吴双、李志慧负责实验操作、数据整理分析、论文撰写;洋雯茜负责部分数据及文献整理,协助论文撰写;董国福、王长振指导论文修改
| [1] |
Shi X, Yang Y, Zhang W, et al. FLASH X-ray spares intestinal crypts from pyroptosis initiated by cGAS-STING activation upon radioimmunotherapy[J]. Proc Natl Acad Sci USA, 2022, 119(43): e2208506119. DOI:10.1073/pnas.2208506119 |
| [2] |
Gao F, Yang Y, Zhu H, et al. First demonstration of the FLASH effect with ultrahigh dose rate high-energy X-rays[J]. Radiother Oncol, 2022, 166: 44-50. DOI:10.1016/j.radonc.2021.11.004 |
| [3] |
Vozenin MC, De Fornel P, Petersson K, et al. The advantage of FLASH radiotherapy confirmed in mini-pig and cat-cancer patients[J]. Clin Cancer Res, 2019, 25(1): 35-42. DOI:10.1158/1078-0432.CCR-17-3375 |
| [4] |
Favaudon V, Caplier L, Monceau V, et al. Ultrahigh dose-rate FLASH irradiation increases the differential response between normal and tumor tissue in mice[J]. Sci Transl Med, 2014, 6(245): 245ra93. DOI:10.1126/scitranslmed.3008973 |
| [5] |
Favaudon V, Fouillade C, Vozenin MC. Ultrahigh dose-rate, "flash" irradiation minimizes the side-effects of radiotherapy[J]. Cancer Radiother, 2015, 19(6-7): 526-531. DOI:10.1016/j.canrad.2015.04.006 |
| [6] |
Schüler E, Acharya M, Montay-Gruel P, et al. Ultra-high dose rate electron beams and the FLASH effect: From preclinical evidence to a new radiotherapy paradigm[J]. Med Phys, 2022, 49(3): 2082-2095. DOI:10.1002/mp.15442 |
| [7] |
Hunt PR. The C. elegans model in toxicity testing[J]. J Appl Toxicol, 2017, 37(1): 50-59. DOI:10.1002/jat.3357 |
| [8] |
The C. elegans Sequencing Consortium. Genome sequence of the nematode C. elegans: a platform for investigating biology[J]. Science, 1998, 282(5396): 2012-2018. DOI:10.1126/science.282.5396.2012 |
| [9] |
Roussel N, Sprenger J, Tappan SJ, et al. Robust tracking and quantification of C. elegans body shape and locomotion through coiling, entanglement, and omega bends[J]. Worm, 2014, 3(4): e982437. DOI:10.4161/21624054.2014.982437 |
| [10] |
Sakashita T, Takanami T, Yanase S, et al. Radiation biology of Caenorhabditis elegans: germ cell response, aging and behavior[J]. J Radiat Res, 2010, 51(2): 107-121. DOI:10.1269/jrr.09100 |
| [11] |
Marsh EK, May RC. Caenorhabditis elegans, a model organism for investigating immunity[J]. Appl Environ Microbiol, 2012, 78(7): 2075-2081. DOI:10.1128/AEM.07486-11 |
| [12] |
van der Hoeven R, McCallum KC, Garsin DA. Speculations on the activation of ROS generation in C. elegans innate immune signaling[J]. Worm, 2012, 1(3): 160-163. DOI:10.4161/worm.19767 |
| [13] |
Yuan J, Lin F, Wu Z, et al. Circ-CPSF1 worsens radiation-induced oxidative stress injury in Caenorhabditis elegans[J]. Biomolecules, 2023, 13(1): 102. DOI:10.3390/biom13010102 |
| [14] |
Pratx G, Kapp DS. A computational model of radiolytic oxygen depletion during FLASH irradiation and its effect on the oxygen enhancement ratio[J]. Phys Med Biol, 2019, 64(18): 185005. DOI:10.1088/1361-6560/ab3769 |
| [15] |
Cao X, Zhang R, Esipova TV, et al. Quantification of oxygen depletion during FLASH irradiation in vitro and in vivo[J]. Int J Radiat Oncol Biol Phys, 2021, 111(1): 240-248. DOI:10.1016/j.ijrobp.2021.03.056 |
| [16] |
Girdhani S, Abel E, Katsis A, et al. Abstract LB-280: FLASH: A novel paradigm changing tumor irradiation platform that enhances therapeutic ratio by reducing normal tissue toxicity and activating immune pathways[J]. Cancer Res, 2019, 79(13 Suppl): LB-280. DOI:10.1158/1538-7445.AM2019-LB-280 |
| [17] |
Schoenauen L, Stubbe FX, Van Gestel D, et al. C. elegans: A potent model for high-throughput screening experiments investigating the FLASH effect[J]. Clin Transl Radiat Oncol, 2024, 45: 100712. DOI:10.1016/j.ctro.2023.100712 |
| [18] |
Dhakal R, Yosofvand M, Yavari M, et al. Review of biological effects of acute and chronic radiation exposure on Caenorhabditis elegans[J]. Cells, 2021, 10(8): 1966. DOI:10.3390/cells10081966 |
| [19] |
Yamasaki A, Suzuki M, Funayama T, et al. High-dose irradiation inhibits motility and induces autophagy in Caenorhabditis elegans[J]. Int J Mol Sci, 2021, 22(18): 9810. DOI:10.3390/ijms22189810 |
| [20] |
Nagashima T, Ishiura S, Suo S. Regulation of body size in Caenorhabditis elegans: effects of environmental factors and the nervous system[J]. Int J Dev Biol, 2017, 61(6-7): 367-374. DOI:10.1387/ijdb.160352ss |
| [21] |
Kuzmic M, Galas S, Lecomte-Pradines C, et al. Interplay between ionizing radiation effects and aging in C. elegans[J]. Free Radic Biol Med, 2019, 134: 657-665. DOI:10.1016/j.freeradbiomed.2019.02.002 |
| [22] |
Pawelke J, Brand M, Hans S, et al. Electron dose rate and oxygen depletion protect zebrafish embryos from radiation damage[J]. Radiother Oncol, 2021, 158: 7-12. DOI:10.1016/j.radonc.2021.02.003 |
| [23] |
Jo HJ, Oh T, Lee YR, et al. FLASH Radiotherapy: A FLASHing idea to preserve neurocognitive function[J]. Brain Tumor Res Treat, 2023, 11(4): 223-231. DOI:10.14791/btrt.2023.0026 |
 2024, Vol. 44
2024, Vol. 44


