2. 四川大学华西基础医学与法医学院, 成都 610041
2. West China School of Basic Medical Science and Forensic Medicine, Sichuan University, Chengdu 610041, China
食管癌是我国高发的消化道肿瘤,目前已成为导致癌症相关死亡的第6大原因[1]。放疗作为食管癌临床治疗的手段之一,是许多不可手术切除肿瘤患者的治疗选择[2]。然而,其疗效往往都不是很理想。因此,亟需找到一种新的放射增敏途径,来提高食管癌的放疗效率。
三磷酸鸟苷环化水解酶1(GCH1)作为四氢生物蝶呤(BH4)体内从头合成途径的关键酶,在癌症进展中发挥重要作用[3-4]。GCH1的活性通过转录、转录后、翻译后修饰以及与GCH1反馈调节蛋白(GFRP)的相互作用进行调节[4-5]。研究发现,内皮细胞中,GCH1在丝氨酸81位点(S81)被磷酸化后,降低了GFRP的反馈抑制,并使其活性及BH4水平升高约30倍[6-7]。因此,突变GCH1的S81位点可能引起GCH1活性的显著抑制。前期实验已经证实,通过沉默在食管癌细胞中高表达的富含AU元件的RNA结合因子1(AUF1),可以降低GCH1的表达,进而抑制食管癌细胞的生长并促进细胞凋亡[8]。然而,食管癌细胞的生长及其放射敏感性是否受到GCH1磷酸化水平的调控,目前还尚未见有研究报道。
因此,本实验通过构建并感染S81点突变模拟去磷酸化的GCH1腺病毒载体,探究GCH1磷酸化水平对食管癌生长及放射敏感性的影响,验证GCH1去磷酸化突变体GCH1-S81A提高食管癌放射敏感性的可能性,有望为食管癌的临床治疗提供新的思路。
材料与方法1. 主要试剂与仪器:人食管鳞癌细胞KYSE-150购于上海中乔新舟生物科技有限公司,阴性对照腺病毒载体(Ad-NC)、编码野生型GCH1腺病毒载体(Ad-GCH1)、以天冬氨酸取代S81模拟磷酸化的GCH1腺病毒载体(Ad-GCH1-S81D)、以丙氨酸取代S81模拟去磷酸化的GCH1腺病毒载体(Ad-GCH1-S81A)购于济南维珍生物科技有限公司,RPMI-1640培养基、胎牛血清、青链霉素购于上海VivaCell公司,CCK-8试剂盒、活性氧检测试剂盒购于上海碧云天生物科技公司,脂质过氧化荧光探针购于美国MCE公司,Annexin-V/FITC细胞凋亡检测试剂盒购于上海YEASEN生物科技公司,GAPDH抗体购于美国CST公司,FACL4、α-Tubulin和GPX4抗体购于英国Abcam公司,GCH1抗体购于美国Affinity公司,GCH1磷酸化抗体由成都Zen Bioscience公司提供,HRP标记山羊抗兔二抗购于上海碧云天生物科技公司。采用美国KUBTEC公司KUBTEC XCELL320生物辐照仪进行X射线照射。
2. 细胞培养及照射方式:KYSE-150人食管鳞癌细胞采用10% 胎牛血清及青、链霉素各100 U/ml的RPMI-1640培养基,在37℃、含5% CO2饱和湿度的培养箱中培养。辐照仪能量为320 kV,射野大小20 cm × 20 cm,源靶距为50 cm,克隆实验照射剂量为2、4、6和8 Gy,其余实验均采用10 Gy X射线进行照射,剂量率为1.50 Gy/min。
3. 细胞感染:选取对数生长期的KYSE-150细胞,以2×105个/孔接种于6孔板中,待细胞汇合度达40%左右,换为无血清培养基,根据病毒感染复数值(MOI)计算所需病毒体积,根据前期实验结果,感染KYSE-150细胞最佳MOI为100。分别加入Ad-NC、Ad-GCH1、Ad-GCH1-S81D、Ad-GCH1-S81A腺病毒感染,感染体系为1 ml,6~8 h后更换为正常培养基,继续培养48 h后予以检测感染效率,并将稳定细胞系传代用于后续试验。
4. Western blot法检测相关蛋白表达:收集各组KYSE-150细胞,置于冰上用放射免疫沉淀法裂解缓冲液(RIPA)裂解15 min后刮取收集,将制备好的蛋白样品于10% SDS-PAGE凝胶中电泳分离,设置浓缩胶电压90 V,电泳30 min待蛋白Marker分离后,分离胶130 V继续电泳70 min,随后300 mA恒流转膜120 min至PVDF膜,5%脂奶粉室温封闭2 h,按比例稀释并加入相关一抗,4℃孵育过夜。Tris缓冲盐溶液+吐温(TBST)洗膜3次后加入按比例稀释的辣根过氧化物酶(HRP)标记山羊抗兔二抗,室温孵育2 h,TBST洗膜3次后电化学发光(ECL)显影、曝光,以α-Tubulin及GAPDH为参照,采用ImageJ分析各蛋白表达水平。
5. CCK-8法检测细胞存活率:取对数生长期的KYSE-150细胞,按上述方法进行铺板感染,实验组分为空载病毒组、空载+照射组、GCH1去磷酸化组、GCH1去磷酸化+照射组、回补验证组、回补验证+照射组。其中回补验证组及回补验证+照射组中,Ad-GCH1-S81A与Ad-GCH1同时感染,病毒总量与其他组一致,比例为1∶1。形成稳定细胞株后,消化重悬,以7×103个/孔接种于96孔板中,每组设4平行复孔;铺板24 h后对各照射组给予10 Gy的X射线处理,继续培养24 h后按CCK-8试剂盒说明书对各组进行检测。使用酶标仪读取450 nm波长处吸光度(A)值,计算各组细胞存活率。
6. 细胞克隆实验检测放射敏感性:选取对数生长期的KYSE-150细胞,按分组要求(空载病毒组和GCH1去磷酸化组)予以对应腺病毒感染处理,形成稳定细胞株后,按X射线照射剂量分别将0、2、4、6和8 Gy以2 000、3 500、5 000、7 000和10 000个/孔接种于6孔板中,每组设4平行复孔。予以对应剂量的X射线照射,照射后更换培养液,继续培养10 d,至出现肉眼可见的细胞克隆团后终止培养。收板后用4%多聚甲醛固定细胞,结晶紫染色30 min,只对≥50个细胞的克隆团予以计数,计算克隆形成率及辐射增敏率。
7. 流式细胞术检测细胞活性氧(ROS)含量、凋亡率及脂质过氧化水平:选取对数生长期的KYSE-150细胞,以1×105个/孔接种于12孔板中。按上述分组要求进行感染处理,每组设4平行复孔。感染48 h后对各照射组予以10 Gy的X射线处理,继续培养8 h后使用活性氧检测试剂盒,按照说明书对细胞进行处理;培养48 h后使用Annexin V-FITC/PE及脂质过氧化荧光探针并按照说明书对细胞进行染色。使用流式细胞仪检测细胞ROS水平、细胞凋亡水平及脂质过氧化水平,使用FlowJo软件进行数据分析。
8. 统计学处理:应用SPSS 23.0软件进行统计学分析,所有实验重复3次。经正态性检验实验数据符合正态分布采用x±s表示。采用配对t检验分析两组间差异,多组间比较经方差齐性检验采用单因素方差分析。P < 0.05为差异有统计学意义。
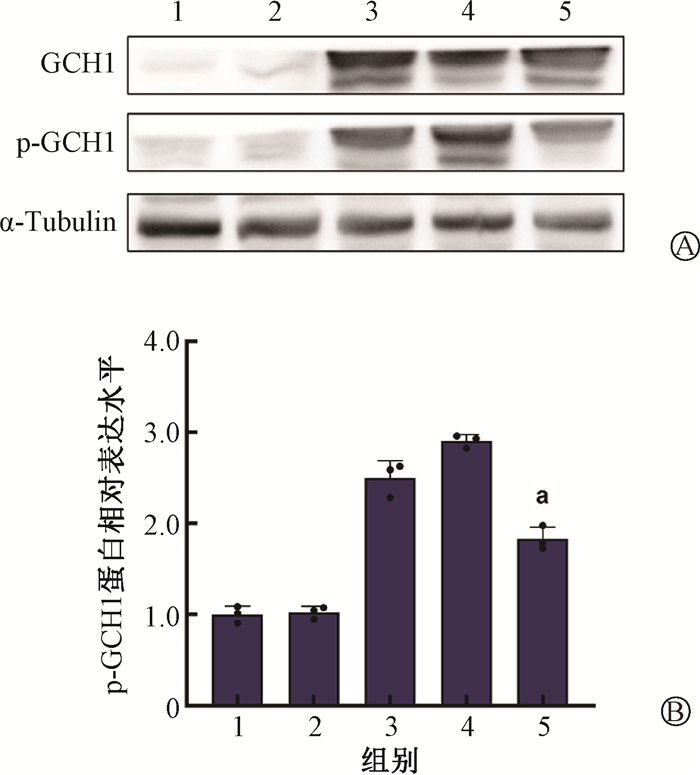
结果1. 腺病毒感染效率检测:相较于空白对照组,空载病毒组中KYSE-150细胞GCH1及p-GCH1蛋白表达量均无明显差异。与空载病毒组相比,GCH1腺病毒感染后的各组KYSE-150细胞GCH1表达量均有上升;而在感染Ad-GCH1-S81A腺病毒去磷酸化后,KYSE-150细胞磷酸化蛋白p-GCH1表达量较野生GCH1组(Ad-GCH1)和GCH1磷酸化组(Ad-GCH1-S81D)均有下降[GCH1去磷酸化组vs. 野生GCH1组=(1.83±0.11) vs.(2.50±0.15),t=9.35,P < 0.05;GCH1去磷酸化组vs. GCH1磷酸化组=(1.83±0.11) vs.(2.91±0.06),t=16.57,P < 0.05,图 1]。结果表明Ad-GCH1-S81A腺病毒感染KYSE-150细胞后GCH1去磷酸化效果明显。
|
注:1.空白对照组;2.空载病毒组;3.野生GCH1组;4.GCH1磷酸化组;5.GCH1去磷酸化组。a与野生GCH1组及GCH1磷酸化组相比,t=9.35,16.57,P < 0.05 图 1 Western blot检测Ad-GCH1-S81A腺病毒去磷酸化效率 A. Western blot检测条带;B. p-GCH1蛋白相对表达水平柱状图 Figure 1 Dephosphorylation efficiency of Ad-GCH1-S81A adenoviruses detected using the western blot A. Western blot bands; B. Bar chart showing the relative expression levels of p-GCH1 proteins |
2. GCH1-S81A突变联合电离辐射对细胞活性影响:与空载病毒+照射组相比,GCH1-S81A突变后的KYSE-150细胞,在受到10 Gy X射线照射后存活率明显降低[GCH1去磷酸化+照射组vs.空载+ 照射组=(65.60±0.76)% vs.(97.57±2.25)%,t=26.97,P < 0.05];而在回补验证+照射组中,KYSE-150细胞存活率较去磷酸化+照射组有所上升[回补验证+照射组vs. GCH1去磷酸化+照射组=(75.09± 4.25)% vs.(65.60±0.76)%,t=4.40,P < 0.05,图 2]。结果表明GCH1-S81A突变联合电离辐射能够明显降低食管癌细胞存活率,而补充野生型GCH1能够一定程度提高照射后GCH1-S81A突变的细胞的存活率。

|
注:1.空载病毒组;2.GCH1去磷酸化组;3.回补验证组。 a与空载+照射组相比,t=26.97,P < 0.05;b与GCH1去磷酸化+照射组相比,t=4.40,P < 0.05 图 2 CCK-8法检测不同剂量照射24 h后GCH1突变体对KYSE-150细胞存活率的影响 Figure 2 Impacts of GCH1 mutants on the survival rates of KYSE-150 cells after 24 h of 10 Gy X-ray irradiation detected using the CCK-8 assay |
3. GCH1-S81A突变对食管癌细胞放射敏感性的影响:随着辐射剂量的增加,空载病毒组KYSE-150细胞的克隆形成能力逐渐减弱,且GCH1-S81A突变后的细胞克隆形成能力在各照射剂量下(2、4、6、8 Gy)均弱于空载病毒组(图 3A),并依据“单击多靶模型”拟合细胞存活分数曲线图[各照射剂量下GCH1去磷酸化组vs.空载病毒组=(0.66±0.03)vs.(0.87±0.05);(0.35±0.03)vs.(0.51±0.03);(0.19±0.03)vs.(0.39±0.02);(0.04±0.01)vs.(0.13±0.02);t=7.31、7.94、11.80、8.16,P < 0.05,图 3B],通过计算获得放射增敏参数与增敏比(表 1)。与空载病毒组相比,GCH1去磷酸化组的D0、Dq的值均减小,SER为1.17。结果表明,GCH1-S81A突变可明显促进放射治疗中食管癌细胞的增殖抑制。

|
注:GCH1.三磷酸鸟苷环化水解酶1 图 3 GCH1-S81A突变对KYSE-150细胞放射敏感性的影响 A. KYSE-150细胞克隆集落形成图片;B. KYSE-150细胞存活分数曲线 Figure 3 Impacts of GCH1-S81A mutants on the radiosensitivity of KYSE-150 cells A. Images showing the colony formation of KYSE-150 cells; B. Curves showing the survival fractions of KYSE-150 cells |
|
|
表 1 GCH1-S81A对KYSE-150细胞的放射增敏性影响 Table 1 Impacts of GCH1-S81A on the radiosensitization of KYSE-150 cells |
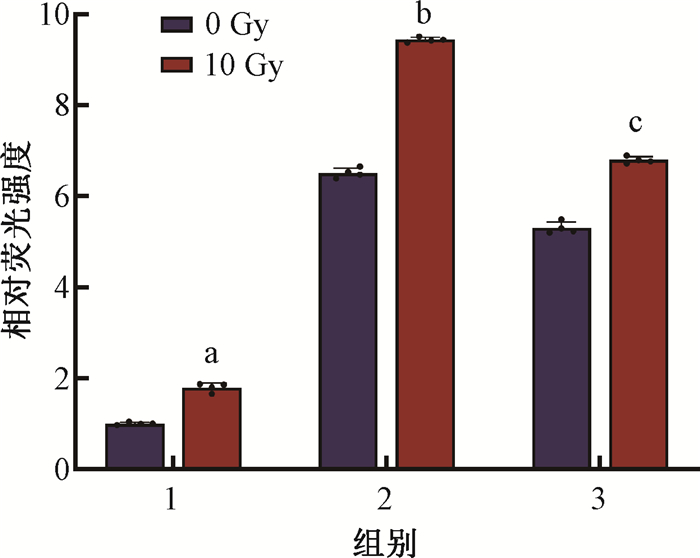
4. GCH1-S81A突变联合电离辐射对细胞ROS生成影响:与空载病毒组相比,KYSE-150细胞受到10 Gy X射线照射后,ROS水平升高,具有统计学意义[空载+照射组vs.空载病毒组=(1.80±0.09)vs.(1.00±0.03),t=17.89,P < 0.05];而在GCH1-S81A突变去磷酸化后,去磷酸化+照射组的细胞ROS释放量明显高于空载+照射组[GCH1去磷酸化+照射组vs.空载+照射组=(9.45±0.05)vs.(1.80±0.09),t=157.06,P < 0.05]。在回补验证+照射组中,细胞ROS水平明显低于GCH1去磷酸化+照射组,具有统计学意义[回补验证+照射组vs. GCH1去磷酸化+照射组=(6.80±0.06)vs.(9.45±0.05),t=66.38,P < 0.05,图 4]。结果表明,GCH1-S81A突变能提高食管癌细胞受照射后的ROS水平,促进细胞氧化损伤;而在补充野生型GCH1提高其磷酸化程度后,能够一定程度抑制由GCH1-S81A突变联合电离辐射所引起的ROS增加。
|
注:1.空载病毒组;2.GCH1去磷酸化组;3.回补验证组 a与空载病毒组相比,t=17.89,P < 0.05;b与空载+照射组相比,t=17.89,P < 0.05;c与GCH1去磷酸化+照射组相比,t=66.38,P < 0.05 图 4 流式细胞术检测10 Gy X射线照射8 h后GCH1-S81A突变体对KYSE-150细胞ROS水平的影响 Figure 4 Impacts of GCH1-S81A mutants on ROS levels in KYSE-150 cells after 8 h of 10 Gy X-ray irradiation detected using the flow cytometry |
5. GCH1-S81A突变联合电离辐射对细胞凋亡水平影响:相比于空载病毒组,KYSE-150细胞在受到10 Gy X射线照射后,凋亡水平明显升高,具有统计学意义[空载+照射组vs.空载病毒组=(11.54±0.26)% vs.(4.82±0.26)%,t=37.19,P < 0.05]。而在GCH1-S81A突变联合照射后,细胞凋亡水平明显高于空载+照射组,且差异具有统计学意义[GCH1去磷酸化+照射组vs.空载+照射组=(27.92± 0.26)% vs.(11.54±0.26)%,t=59.02,P < 0.05]。而在回补验证+照射组中,细胞凋亡水平较GCH1去磷酸化+照射组有明显降低,差异有统计学意义[回补验证+照射组vs. GCH1去磷酸化+照射组=(20.45±0.18)% vs. (27.92±0.26)%,t=30.62,P < 0.05,图 5]。结果表明,电离辐射能够诱导KYSE-150细胞发生凋亡,且在联合GCH1-S81A突变去磷酸化后促凋亡效果更加明显,GCH1-S81A突变具有放射增敏作用;而在补充野生型GCH1后,能够一定程度抑制由GCH1-S81A突变所引起的辐照后的KYSE-150细胞的凋亡。

|
注:1.空载病毒组;2.GCH1去磷酸化组;3.回补验证组。 a与空载病毒组相比,t=37.19,P < 0.05;b与空载+照射组相比,t=59.02,P < 0.05;c与GCH1去磷酸化+照射组相比,t=30.62,P < 0.05 图 5 流式细胞术检测10 Gy X射线照射48 h后GCH1-S81A突变体对KYSE-150细胞凋亡率的影响 Figure 5 Impacts of GCH1-S81A mutants on the apoptosis rates of KYSE-150 cells after 48 h of 10 Gy X-ray irradiation detected using the flow cytometry |
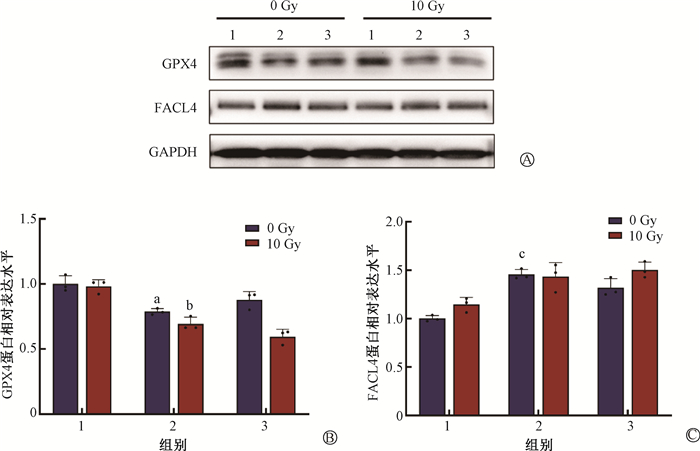
6. GCH1-S81A突变联合电离辐射对细胞铁死亡相关蛋白表达量的影响:相较于空载病毒组,GCH1-S81A突变后GPX4表达量有所下降[GCH1去磷酸化组vs.空载病毒组=(0.79±0.02)vs.(1.00 ± 0.05),t=4.55,P < 0.05],且在联合照射后GPX4表达量低于空载+照射组[GCH1去磷酸化+照射组vs.空载+照射组=(0.69±0.04)vs.(0.98±0.04),t=12.98,P < 0.05,图 6B],而FACL4蛋白表达量仅在GCH1-S81A突变后有所上升[GCH1去磷酸化组vs.空载病毒组=(1.45±0.04)vs.(1.00±0.03),t=18.58,P < 0.05,图 6C]。结果表明GCH1-S81A突变联合电离辐射可以降低食管癌细胞中GPX4水平,促进细胞铁死亡。
|
注:1.空载病毒组;2.GCH1去磷酸化组;3.回补验证组。a与空载病毒组相比,t=4.55,P < 0.05;b与空载+照射组相比,t=12.98,P < 0.05;c与空载病毒组相比,t=18.58,P < 0.05 图 6 Western blot检测铁死亡相关蛋白的表达量 A. Western blot检测条带;B. GPX4蛋白相对表达水平柱状图;C. FACL4蛋白相对表达水平柱状图 Figure 6 Expression levels of ferroptosis-related proteins detected using the western blot A. Western blot bands; B. Bar chart showing the relative expression levels of GPX4 proteins; C. Bar chart showing the relative expression levels of FACL4 proteins |
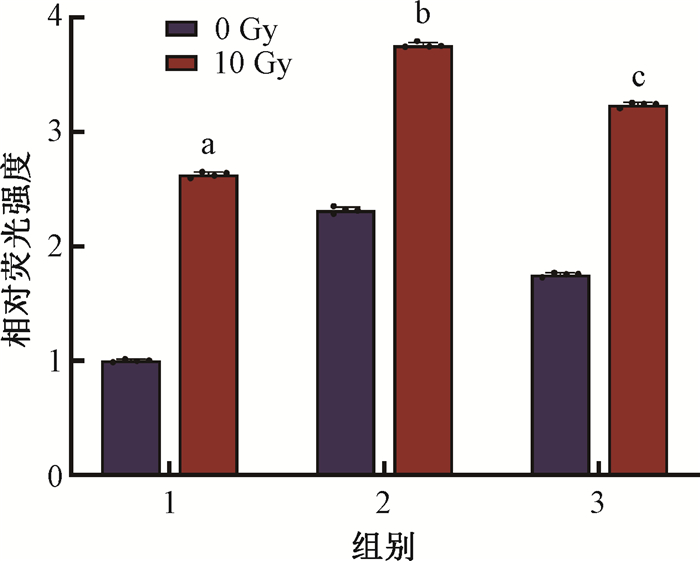
7. GCH1-S81A突变联合电离辐射对细胞脂质过氧化水平的影响:为了对实验结果进行进一步验证,采用流式细胞术检测辐照后食管癌细胞脂质过氧化水平,反应其铁死亡程度(图 7)。与空载病毒组相比,KYSE-150受到10 Gy X射线照射后脂质过氧化水平明显升高[空载+照射组vs.空载病毒组=(2.63±0.02)vs.(1.00±0.01),t=131.10,P < 0.05],且在GCH1-S81A突变联合照射后,脂质过氧化水平高于空载+照射组[GCH1去磷酸化+照射组vs.空载+照射组=(3.76±0.02)vs.(2.63±0.02),t=97.81,P < 0.05];在回补验证+照射组中,细胞脂质过氧化水平较GCH1去磷酸化+照射组有所降低,差异有统计学意义[回补验证+照射组vs. GCH1去磷酸化+照射组=(3.27±0.02)vs.(3.76±0.02),t=23.08,P < 0.05]。结果表明,GCH1-S81A突变可以促进食管癌细胞发生脂质过氧化,诱导细胞铁死亡,且在联合X射线照射后能够加剧这一现象;而在补充野生型GCH1提高其磷酸化程度后,能够一定程度抑制由GCH1-S81A突变联合电离辐射所引起的细胞铁死亡。
|
注:1.空载病毒组;2.GCH1去磷酸化组;3.回补验证组。 a与空载病毒组相比,t=131.1,P < 0.05;b与空载+照射组相比,t=97.81,P < 0.05;c与GCH1去磷酸化+照射组相比,t=23.08,P < 0.05 图 7 流式细胞术检测10 Gy X射线照射48 h后GCH1-S81A突变体对KYSE-150细胞脂质过氧化水平的影响 Figure 7 Impacts of GCH1-S81A mutants on lipid peroxidation levels in KYSE-150 cells after 48 h of 10 Gy X-ray irradiation detected using the flow cytometry |
讨论
降低食管癌中的GCH1表达能够抑制肿瘤细胞增殖并促进其凋亡。而在前期研究中,与直接敲低或抑制细胞中GCH1的表达及活性相比,利用腺病毒载体构建的过表达GCH1的食管癌细胞株更具稳定性和可控性,因此,选择通过构建可显著抑制GCH1活性的GCH1-S81A突变体来探究其对食管癌细胞放射敏感性的影响。GCH1活性受到GFRP的调节,过去的研究认为,GFRP结合GCH1的抑制作用是通过降低底物亲和力、抑制与底物结合产生的。近期报道,GCH1-GFRP复合物通过控制解离速率的非竞争性抑制机制起作用,研究发现,GFRP是一种支架蛋白,其与GCH1结合对GCH1整体构象没有显著改变,并不影响GCH1与底物相结合,只是影响产物转化[9-10]。GCH1-S81A突变后会增强其与GFRP的结合,因此,GCH1-S81A突变体可能会对食管癌细胞自身GCH1产生拮抗作用,其可能通过竞争性结合底物GTP,降低产物BH4的转化率,从而影响食管癌放射敏感性。本研究发现,在补充未被去磷酸化的GCH1后,GCH1-S81A突变对细胞造成的影响会被抑制,也验证了这一假设。
电离辐射能够诱导ROS积累,引起氧化应激导致细胞损伤[11]。而GCH1-BH4轴可以通过抑制一氧化氮合酶(NOS)解偶联,恢复NO水平以及抑制ROS的产生,起到辐射防护作用[12]。研究报道,食管癌细胞中ROS升高能够诱导内质网应激从而导致细胞死亡[13];同时,高水平的ROS还能通过激活JNK信号通路以及抑制Nrf2的产生,促进食管癌细胞凋亡[14]。在本研究中发现,通过GCH1-S81A突变,能够提高食管癌细胞中ROS水平,促进肿瘤细胞凋亡,并且抑制了GCH1-BH4轴的辐射抵抗作用,提高其辐射敏感性。
GCH1-BH4通路同样被报道为是铁死亡的保护机制[15]。近年来,由于铁死亡在癌症治疗中的潜在作用,逐渐成为研究热点。谷胱甘肽-谷胱甘肽过氧化物酶4(GSH-GPX4)轴是铁死亡的主要防御机制,其主要通过GSH与GPX4的协同作用,消除细胞内积累的ROS,从而中止脂质氧化反应[16]。研究表明,GPX4抑制剂可以诱导食管癌细胞发生铁死亡,具有抗肿瘤作用[17]。而GCH1-BH4通路能够保护GPX4敲除细胞免于铁死亡,完全独立于GSH-GPX4轴发挥作用。GCH1衍生产物BH4作为强效抗氧化剂,其本身能够抑制细胞内脂质过氧化物产生并对抗铁死亡;另一方面,过表达GCH1的细胞能够选择性保护一些多不饱和脂肪酸(PUFA)链免于降解,从而抑制铁死亡的发生[15]。电离辐射能够降低BH4水平和生物利用度,这可能与BH4的氧化和诱导GCH1反馈调节蛋白(GFRP)表达从而抑制GCH1活性有关,为GCH1参与电离辐射诱导的细胞铁死亡提出可能[7]。本研究中,GCH1-S81A突变能够降低GPX4的表达,并促进其发生脂质过氧化,诱导食管癌细胞铁死亡,且在联合电离辐射后进一步加剧这种作用。这表明GCH1铁死亡保护作用可能还受其磷酸化水平调控,且GCH1/BH4轴可能并非完全独立GSH/GPX4轴发挥作用,两者可能相互影响。这一结果同时为GCH1-S81A突变能够提高食管癌放射敏感性提供了有力证据。
此外,铁死亡和细胞凋亡之间存在相互联系,铁死亡诱导剂与肿瘤坏死因子相关凋亡诱导配体(TRAIL)联合使用可以显著增强肿瘤杀伤效果[18]。另一项研究表明,经典的抑癌基因P53可以在某些条件下诱导铁死亡,MON-P53作为P53的一种新型复合物,当其被内化时,铁离子可以诱导芬顿反应,产生ROS。体内外研究发现,除了细胞凋亡外,在MON-P53处理过的细胞中还观察到明显的铁死亡,这不仅抑制了肿瘤细胞的生长,还延长了荷瘤小鼠的寿命[19]。而本研究发现GCH1-S81A突变体有相似的作用,能够同时促进受照的食管癌细胞凋亡与铁死亡,这种凋亡/铁死亡混合途径有望成为一种新的抗癌策略。
本研究揭示了GCH1磷酸化水平变化对食管癌进展的影响,还进一步验证了去磷酸化突变体GCH1-S81A提高食管癌放射敏感性的可行性,这为临床治疗以及开发相关放射增敏药物提供了新的思路。
利益冲突 无
作者贡献声明 徐霄鹏和戴军负责实验设计、实施研究、采集并整理数据、起草论文、统计分析;高昳、王坚、孙春堂参与部分实验和数据整理;刘鹏飞和张舒羽指导实验设计和论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Ng J, Lee P. The role of radiotherapy in localized esophageal and gastric cancer[J]. Hematol Oncol Clin North Am, 2017, 31(3): 453-468. DOI:10.1016/j.hoc.2017.01.005 |
| [3] |
Wei JL, Wu SY, Yang YS, et al. GCH1 induces immunosuppression through metabolic reprogramming and IDO1 upregulation in triple-negative breast cancer[J]. J Immunother Cancer, 2021, 9(7): e002383. DOI:10.1136/jitc-2021-002383 |
| [4] |
Werner ER, Blau N, Thöny B. Tetrahydrobiopterin: biochemistry and pathophysiology[J]. Biochem J, 2011, 438(3): 397-414. DOI:10.1042/BJ20110293 |
| [5] |
Tatham AL, Crabtree MJ, Warrick N, et al. GTP cyclohydrolase I expression, protein, and activity determine intracellular tetrahydrobiopterin levels, independent of GTP cyclohydrolase feedback regulatory protein expression[J]. J Biol Chem, 2009, 284(20): 13660-13668. DOI:10.1074/jbc.M807959200 |
| [6] |
Widder JD, Chen W, Li L, et al. Regulation of tetrahydrobiopterin biosynthesis by shear stress[J]. Circ Res, 2007, 101(8): 830-838. DOI:10.1161/CIRCRESAHA.107.153809 |
| [7] |
Li L, Rezvan A, Salerno JC, et al. GTP cyclohydrolase I phosphorylation and interaction with GTP cyclohydrolase feedback regulatory protein provide novel regulation of endothelial tetrahydrobiopterin and nitric oxide[J]. Circ Res, 2010, 106(2): 328-336. DOI:10.1161/CIRCRESAHA.109.210658 |
| [8] |
Gao Y, Wang W, Cao J, et al. Upregulation of AUF1 is involved in the proliferation of esophageal squamous cell carcinoma through GCH1[J]. Int J Oncol, 2016, 49(5): 2001-2010. DOI:10.3892/ijo.2016.3713 |
| [9] |
Gamble LD, Purgato S, Murray J, et al. Inhibition of polyamine synthesis and uptake reduces tumor progression and prolongs survival in mouse models of neuroblastoma[J]. Sci Transl Med, 2019, 11(477): eaau1099[pii]. DOI:10.1126/scitranslmed.aau1099 |
| [10] |
Lange I, Geerts D, Feith DJ, et al. Novel interaction of ornithine decarboxylase with sepiapterin reductase regulates neuroblastoma cell proliferation[J]. J Mol Biol, 2014, 426(2): 332-346. DOI:10.1016/j.jmb.2013.09.037 |
| [11] |
Mozdarani H. Biological complexities in radiation carcinogenesis and cancer radiotherapy: impact of new biological paradigms[J]. Genes (Basel), 2012, 3(1): 90-114. DOI:10.3390/genes3010090 |
| [12] |
Xue J, Yu C, Sheng W, et al. The Nrf2/GCH1/BH4 axis ameliorates radiation-induced skin injury by modulating the ros cascade[J]. J Invest Dermatol, 2017, 137(10): 2059-2068. DOI:10.1016/j.jid.2017.05.019 |
| [13] |
Liu Q, He J, Zhou X, et al. ACP-5862 suppresses esophageal squamous cell carcinoma growth through inducing apoptosis via activation of endoplasmic reticulum stress and ROS production[J]. Biochem Biophys Res Commun, 2021, 534: 995-1002. DOI:10.1016/j.bbrc.2020.10.052 |
| [14] |
An K, Zhang Y, Liu Y, et al. Neferine induces apoptosis by modulating the ROS-mediated JNK pathway in esophageal squamous cell carcinoma[J]. Oncol Rep, 2020, 44(3): 1116-1126. DOI:10.3892/or.2020.7675 |
| [15] |
Kraft V, Bezjian CT, Pfeiffer S, et al. GTP cyclohydrolase 1/tetrahydrobiopterin counteract ferroptosis through lipid remodeling[J]. ACS Cent Sci, 2020, 6(1): 41-53. DOI:10.1021/acscentsci.9b01063 |
| [16] |
Xu C, Sun S, Johnson T, et al. The glutathione peroxidase Gpx4 prevents lipid peroxidation and ferroptosis to sustain Treg cell activation and suppression of antitumor immunity[J]. Cell Rep, 2021, 35(11): 109235. DOI:10.1016/j.celrep.2021.109235 |
| [17] |
Wang Z, Wu S, Zhu C, et al. The role of ferroptosis in esophageal cancer[J]. Cancer Cell Int, 2022, 22(1): 266. DOI:10.1186/s12935-022-02685-w |
| [18] |
Lee YS, Lee DH, Choudry HA, et al. Ferroptosis-induced endoplasmic reticulum stress: cross-talk between ferroptosis and apoptosis[J]. Mol Cancer Res, 2018, 16(7): 1073-1076. DOI:10.1158/1541-7786.MCR-18-0055 |
| [19] |
Zheng DW, Lei Q, Zhu JY, et al. Switching apoptosis to ferroptosis: metal-organic network for high-efficiency anticancer therapy[J]. Nano Lett, 2017, 17(1): 284-291. DOI:10.1021/acs.nanolett.6b04060 |
 2024, Vol. 44
2024, Vol. 44


