2. 福建医科大学医学影像学院, 福州 350122
2. School of Medical Imaging of Fujian Medical University, Fuzhou 350122, China
放射治疗是各种原发性或转移性脑肿瘤以及头颈部肿瘤的常用治疗方法[1],脑部常用放疗手段包括全脑放射治疗和立体定向放疗,可以有效改善肿瘤控制率和降低肿瘤复发风险。放射性脑损伤(radiation\|induced brain injury, RIBI)是指电离辐射后出现的脑部损伤,如海马体和白质损伤、血管异常、脱髓鞘、局部性神经缺陷、颅内压升高等。其中,认知功能障碍为较为严重的损伤之一,在接受脑部放射治疗的幸存患者中(>6个月)有50%~90%出现认知功能障碍[2],包括学习和记忆能力受损,以及注意力、处理速度、执行能力和精细运动协调性降低,严重影响患者的生活质量和生存期限。
放射性脑损伤基于临床表现的时间分为急性型、早迟发反应型、晚迟发反应型。急性型和早迟发反应型放射性脑损伤通常发生在照射后的几天至几个月内,症状通常表现为头痛、恶心、呕吐、易怒、记忆力减退等,严重者也可能迅速发展至意识障碍。晚迟发反应型是临床最常见类型,通常在照射6个月后发生,脑部出现脑水肿、脑组织病灶局部坏死和病灶囊性变等,也可能迅速恶化导致脑疝,患者甚至可能昏迷或死亡。
随着新兴治疗技术的发展与临床应用,特别是立体定向放疗(SBRT)、立体定向消融治疗(SABR)、图像引导放射治疗(IGRT)、质子重离子治疗以及基于磁共振(MR)图像重建的靶区勾画等各种新型放疗技术的应用,放射性脑损伤的发生率已有所下降,但仍无法完全避免,其发生率为0.5%~25.0%[3],受放疗方式、辐射剂量、受照射区域、肿瘤类型、患者年龄、疾病进程等多重因素影响。随着近年来免疫治疗、电场治疗等新型治疗手段的兴起,是否会增加放射性脑损伤的风险仍然不明确,据相关报道可知脑转移瘤放疗后放射性脑损伤的1年累计发生率为8%~20%[4],仍呈现高发趋势。因此,需要了解放射性脑损伤所涉及的致病机制,研究放射性脑损伤中多种机制和细胞类型之间复杂和动态的相互作用,包括血管损伤、炎症反应、神经功能障碍、胶质细胞损伤以及肠道微生物和脑肠轴之间的相互作用。本文介绍了放射性脑损伤新的发病机制与诊治技术,并进行了系统的分析与总结。
一、放射性脑损伤的组织、细胞与分子水平研究1. 血管损伤:辐射会诱导引发脑部血管变化,导致内皮细胞凋亡、血管壁增厚、血管扩张、血管通透性增加、内皮紧密连接的完整性受损以及血管密度下降[5],血脑屏障(BBB)的损伤和渗透增强是辐射后血管损伤的重要特征。一直以来,认为BBB功能障碍的主要原因是辐射诱导的血管内皮细胞凋亡、紧密连接蛋白表达减少、粘黏连接破坏等,继而导致的大脑中微血管密度降低。
周细胞(pericytes,PCs)是包裹在微血管内皮周围的特化细胞,与血管内皮细胞共同影响血管生成和创伤愈合、血脑屏障通透性、脉管系统稳定、细胞迁移及分化等过程[6]。由于物理同位,周细胞和内皮细胞能够进行密切沟通,包括血小板衍生生长因子(PDGF-B)-PDGF受体-β(PDGFR-β)信号通路。PDGF-B是促进血管生成和修复的主要介质,而PDGFR-β是一种跨膜受体,主要表达在周细胞上,PDGF-B能够诱导PDGFR-β的配体特异性激活。一项最新研究表明,RIBI患者和接受颅脑照射的小鼠均出现了血脑屏障渗漏和脑毛细血管PDGFR-β覆盖减少,因PDGFR-β具有维持微血管结构稳定、脑血管功能调节以及维持血脑屏障的关键作用,所以认为颅脑放射后周细胞PDGFR-β下调与放疗后BBB损伤以及RIBI密切相关[7]。这项研究还证实,沙利度胺能够通过增加内皮细胞产生PDGF-B以及上调周细胞中的PDGFR-β来挽救血脑屏障中断,使得RIBI患者和RIBI小鼠模型的病理和认知障碍得到改善,或许为RIBI药理学治疗提供新思路。
BBB损伤后将继发各种炎症反应,例如外周免疫细胞渗入脑组织,活性氧(ROS)积累,随后小胶质细胞、星形胶质细胞激活等。星形细胞是血脑屏障通透性的主要细胞调节剂[8],且已被证明具有抗炎、促炎能力,星形胶质细胞在辐照后的急性阶段会加剧BBB的通透性,但在亚急性阶段通过减少氧化应激和促炎细胞因子及趋化因子的分泌,转向更具保护性的表型。探索星形胶质细胞与小胶质细胞的正负调节性转化的具体机制在放疗后出现BBB损伤的预防与治疗意义重大。
2. 炎症反应:辐射早期会直接导致受照射部位的细胞死亡,形成血管损伤、BBB泄露、神经发生减少以及氧化应激,进而产生炎症因子和自由基,进一步加剧细胞损伤,形成恶性循环。颅内照射后的急性细胞因子反应产生的趋化因子CCL2/MCP-1可以上调内皮细胞黏附因子以及刺激各种免疫细胞释放原发性促炎细胞因子,例如增加肿瘤坏死因子α(TNF-α)的表达,以及转录因子(AP-1、NF-κB、CREB)活化。辐照后的内皮细胞可以通过NF-κB途径分泌细胞信号,该途径激活小胶质细胞并诱导小胶质细胞迁移到邻近血管[9],释放炎症因子破坏血管结构。此外,小胶质细胞还会被分泌的TNF-α激活,该因子将下调claudin-5的表达,导致辐射诱导的早期BBB破坏,进一步加重大脑炎症反应。
除了炎性因子,适应性免疫中的外周免疫细胞也在神经系统疾病中起着关键作用,尤其是外周T淋巴细胞(CD8+ T)的影响。研究发现,RIBI患者脑实质中CD8+ T细胞浸润明显升高[10],已知激活的CD8+ T细胞对初级皮质神经元具有细胞毒性作用[11]。而小胶质细胞源性CCL2/CCL8趋化因子在介导CCR2+/CCR5+ CD8+ T细胞的渗透[12]和组织损伤方面具有趋化作用。促炎微胶质亚型(MG6)以表达CCL2和CCL8来介导CD8+ T细胞的脑浸润,细胞毒性CD8+ T细胞则通过CCL2/CCL8和CCR2/CCR5趋化机制被招募到缺血性大脑中,从而破坏轴突和髓鞘,导致神经元神经功能退行,且激活小胶质细胞的IFN信号通路,导致炎症反应进一步加强、炎症因子水平提高,形成恶性循环,严重加剧了大脑中的细胞损伤和神经炎症反应。
3. 神经元功能障碍:神经元功能障碍与神经元微形态的变化密切相关。树突棘是神经元树突分枝上的球状膜突起,是兴奋性突触传递的主要部位,其密度和结构可影响突触可塑性和突触功能。已有研究证实,辐射会诱导树突棘数量和密度的减少,从而使树突复杂性降低[13]。辐射后的炎性环境中还会发生突触蛋白的变化,包括齿状回中突触后密度蛋白(PSD-95)的上调和齿状肺门中突触前蛋白突触素的下调,这些变化相互作用会对树突的可塑性产生深远的影响。重要的是,辐射会导致海马体中的GluR1表达下降。AMPAR在突触后膜介导兴奋性突触传递,诱发和维持LTP,从而增强突触传递强度,GluR1损失可能导致突触外AMPARs减少和突触强度减弱,从而导致神经元功能弱化,如动作电位传播和信息处理等能力降低,这些被认为是辐射导致神经元功能障碍的直接原因。
海马体是大脑中负责学习和记忆功能的重要区域,辐射导致神经元损伤,抑制神经前体细胞分化为成熟的神经元细胞[14],从而影响该区域的神经发生或导致神经炎症,在辐射诱导的认知障碍中起着关键作用。辐射后海马突触可塑性标记囊泡谷氨酸转运体1(VGLUT1)的表达降低,导致海马CA1区锥体神经元的内在兴奋性和突触可塑性受到辐射损伤,使兴奋性突触产生不可逆转的丧失,形成认知缺陷[15]。未来需对受辐照的大脑中驱动兴奋性突触从急性增加转变为丧失的精确机制以及其对认知的相关后果进行深度研究,为降低脑部放疗后出现认知功能的发生提供新的预防策略。
4. 胶质细胞损伤
(1) 小胶质细胞:辐射会导致小胶质细胞和星形胶质细胞以及少突胶质细胞活化增加[16],活化的小胶质细胞可分为促炎的M1表型和抗炎的M2表型。辐射还会导致神经元HMGB1易位和分泌,从而激活小胶质细胞,并导致促炎细胞因子释放的增加和随后的神经元损伤。小胶质细胞激活后,吞噬凋亡神经元和细胞碎片,但同时也会产生大量的促炎介质如白介素6(IL-6)、IL-1β和TNF-α,并损害神经功能、血管完整性、神经发生、免疫稳态和认知功能,而激活的小胶质细胞将持续释放促炎因子,导致脑部环境处于炎症状态,进一步造成神经元和祖细胞的死亡,形成恶性循环。最新研究表明,普瑞巴林能够通过抑制HMGB1介导的微胶质细胞NF-κB炎症信号通路来降低小胶质细胞的激活,在RIBI中调节微胶质激活和神经炎症方面可发挥重要作用[17]。普瑞巴林临床上多用于治疗癫痫和神经痛,新发现为它的临床应用提供了新的证据,也为RIBI的治疗开辟新思路。
此外,小胶质细胞作为内源性中枢神经系统(CNS)的免疫炎症细胞,在放射性脑损伤中发挥着双重作用,既加重辐射对正常组织的损伤,其吞噬功能又在急性脑损伤的恢复过程中发挥着至关重要的作用,有助于轴突再生和微环境恢复。因此,小胶质细胞也有望成为治疗靶细胞,通过改变小胶质细胞的活化状态,如极化状态、吞噬能力及焦亡等,从而影响放射性脑损伤的发生。
(2) 星形胶质细胞:星形胶质细胞是CNS中非神经元细胞中数量最多的细胞,具有稳态维持功能,和小胶质细胞类似的是,星形胶质细胞也具有正负调节性[18]。A1星形胶质细胞主要源于小胶质细胞分泌的IL-1α、TNF-α和C1q诱导,并且可以分泌诱导神经元和少突胶质细胞快速死亡的神经毒性因子,从而驱动神经变性和疾病进展[18]。A2星形胶质细胞主要是由缺血和急性创伤模型中诱导产生,具有神经保护功能,可利于神经元存活和组织修复[19]。
补体系统是受干扰的炎性环境的直接传感器,并且是CNS中具有非免疫功能的神经胶质增生的有效介质,补体系统激活之后,能产生具有强大免疫功能的效应分子,保护组织以防止感染,还能通过突触修剪机制建立神经网络。辐照会导致大脑补体成分蛋白C1q(补体级联的近端成分)和C3(补体级联的下游部分,由C1q激活)的水平升高,使补体系统失调,继而导致星形胶质细胞表达,引起炎症反应和神经元损伤等[8]。C1q在辐照早期由小胶质细胞大量产生,而大量C3在辐照后期与星形胶质细胞共存。因此推测,辐射会先激活小胶质细胞,导致其产生C1q,然后激活星形胶质细胞,诱发星形胶质细胞的神经毒性作用。
(3) 少突胶质细胞:少突胶质细胞也是辐射损伤的神经胶质细胞之一,可以在CNS内的轴突周围产生使轴突绝缘的髓鞘。神经元是中枢神经系统中最具特征的细胞,主要负责信息传递,而神经元中动作电位的速度和效率依赖于髓鞘[20]。髓磷脂在电脉冲沿轴突的跳跃式传播中起到重要作用,使电脉冲快速传播以支持CNS功能。除了通过产生髓鞘以增加轴突传导速度,少突胶质细胞还为神经元提供代谢支持[21],保证轴突完整性以及神经元存活[22]。而在受损后,会引起局部脱髓鞘,使得轴突暴露于毒性环境,导致轴突横切以及神经元死亡,最终造成退行性疾病的产生[23]。
5. 肠道微生物:近年来,越来越多的证据表明,辐射诱导的不良反应与肠道微生物群有关。肠道细菌和肠道来源的微生物代谢物通过肠道微生物群-脑轴调节血脑屏障、人类行为和大脑功能等。研究已知,肠道微生物群及其代谢产物通过调节脑-肠轴对大脑功能产生影响,如克罗恩病(CD)、阿尔茨海默症(AD)、肌萎缩侧索硬化症(ALS)。然而,肠道微生物群具有较强的放射敏感性,肠道菌群的平衡与否将影响放疗的疗效及其诱发的相关不良反应。例如,辐射会显著改变相关肠道微生物群的组成[24],尤其表现在有害微生物群(如拟杆菌科、肠杆菌科)的增加及有益微生物群(如双歧杆菌、普氏粪杆菌和梭状芽孢杆菌)的减少。最近有报道,肠道微生物群的改变使LPS的产生增加,它能够穿过BBB进入大脑,促进炎症-神经退化级联PTP1B-pCaMKII-pGSK3β,诱导小胶质细胞激活介导的突触吞噬,并改变海马体中的突触信号分子,最终导致认知能力下降[25]。这提示了肠道微生物群的改变可能导致认知障碍,这对于研究放射性脑损伤中的认知功能障碍有一定的借鉴意义。
肠道微生物与辐射诱导的脑神经炎症也密切相关。肠道菌群通过脂多糖、脂肪酸等代谢信号激活小胶质细胞[26]和增加促炎因子,如COX-2、TNF-α和IL-6,导致星形胶质细胞的激活和神经炎症,影响放疗效果,并加重放疗引起的血管内皮组织损伤、神经炎症和神经退行性病变,阻碍CNS修复。然而,也有相关报道提出一种新型脑-肠轴[27],即部分由肠道微生物组控制的色氨酸代谢物可穿过BBB,从而抑制星形胶质细胞的致病活性。共生菌群产生的膳食色氨酸(Trp)的代谢物控制微胶质激活和TGF-α、VEGF-B的产生,通过芳基碳氢化合物受体(AHR)介导的机制调节星形胶质细胞和中枢神经系统炎症的转录程序。总而言之,以上研究都证实肠道微生物群是全脑辐照过程中的一个关键调节因子,肠道微生物群易通过调节紧密连接蛋白的表达来破坏血脑屏障BBB的通透性[28],也表明平衡的肠道微生物群和肠-脑轴的利用可能为RIBI的创新治疗策略提供新的途径。
6. 不同发病机制的相互作用:辐射诱导的脑损伤的分子机制是复杂和多样的,这里围绕星形胶质细胞为中心,讨论不同发病机制之间存在的基本相互作用与交叉(图 1)。星形细胞的末端几乎环绕着脑毛细血管的整个外表面,与毛细血管密切互动,并且其衍生的分泌因子能够驱动BBB的形成与维持,参与营养、废物交换,以维持大脑正常的生理秩序[29]。然而,辐射会诱导星形胶质细胞和内皮细胞活化增殖,增殖的星形胶质细胞释放高水平的血管内皮生长因子(VEGF)和促炎细胞因子,导致神经血管结构损伤,释放细胞间黏附分子1(ICAM-1)、炎性因子以及辐射下肠道微生物释放的代谢信号和凋亡神经元的共同刺激下激活组织中的静息小胶质细胞,激活的小胶质细胞又将参与损害神经功能、血管完整性、神经发生、免疫稳态和认知功能的进一步改变,而持续激活的小胶质细胞将持续释放促炎因子,引发大脑炎症反应、神经细胞损伤,从而形成一个恶性循环。
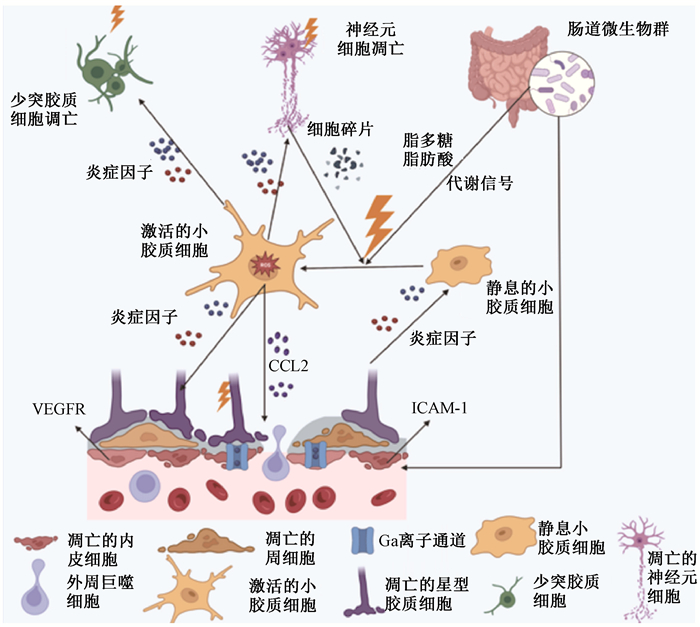
|
注:VEGFR.血管内皮细胞生长因子受体;CCL2.趋化因子配体2;ICAM-1.细胞间黏附分子-1 图 1 放射性脑损伤的发病机制 Figure 1 Pathogenesis of radiation-induced brain injury |
星形胶质细胞功能的失调,还将影响神经元活动的控制、神经递质的释放以及与突触修剪相关的过程,星形胶质细胞通过这些途径和机制动态优化负责学习和记忆的局部电路中的突触特性和功能连接[16]。此外,辐射诱导的胶质细胞减少,微血管损伤、白质的丧失、神经炎症等损伤也间接会损伤神经元的结构,阻碍神经元的功能,造成认知功能障碍。而辐射诱导后的小胶质细胞与星形胶质细胞具有共性,都可以被不同的细胞因子诱导到神经毒性状态或神经保护性状态,在放射性脑损伤中发挥着正负性作用。因此,近年来神经胶质细胞已成为一个新的研究方向,有望成为治疗放射性脑损伤的潜在治疗靶点。
二、放射性脑损伤的治疗与预防在现有指南中,放射性脑损伤治疗策略通常包括3个方面:药物治疗、手术治疗和长期随访与评估,具体根据患者的病灶进展和临床表现进行积极干预与评估处理[4],并且遵循早期诊断、早期治疗、定期复诊的原则。
1. 临床运用
(1) 药物治疗策略:药物治疗是放射性脑损伤的常规治疗策略,以对症治疗为主要原则,经典的一线治疗药物见表 1。目前大多药物表现为短暂性与支持性,主要是对于临床症状的积极干预,临床使用中应注意药物的有效性、安全剂量及不良事件等。
|
|
表 1 已运用于临床的放射性脑损伤治疗药物 Table 1 Drugs used in clinical treatment of radiation-induced brain injury |
此外,近年还有越来越多的学者开始探索中药在治疗放射性脑损伤中的作用。例如,参芪扶正注射液(SFI)可抑制炎症反应,并抑制辐照诱导的脑损伤中的微胶质激活,降低BBB通透性。槲皮素也在脑损伤中发挥着显著的神经保护作用,相关实验表明,槲皮素通过调节肠道微生物群的相对丰度和多样性,对RIBI有明显神经保护作用[34]。中药地骨皮中的活性成分地骨皮甲素还可以通过抑制NF-κB和AP-1的激活,来预防辐射诱导的神经炎症并保留大鼠海马体的神经发生[35]。
中药因靶点多和不良反应小的特性,使其成为富有前景的放射性脑损伤的治疗方法之一,但仍需未来进一步的分子机制研究,以更好地发掘中药在放射性脑损伤治疗中的潜在价值。
(2) 高压氧疗:目前,无创性物理疗法也已用于临床治疗放射性脑损伤,其中高压氧疗(HBOT)可以增加脑部溶氧来增加脑部含氧量,且较少出现后遗症,是目前最常见的放射性脑损伤的治疗方法。研究还证实,放疗期间高压氧治疗和美曼汀相结合, 可促进海马功能和白质完整性的恢复[36],有效改善患者预后。其次,重复经颅磁刺激可促进颅脑照射后海马体中的神经干细胞(NSC)的增殖和分化[37],增强海马神经元突触的可塑性,减少神经元死亡,对RIBI具有预防和治疗作用。
2. 在研阶段
(1) 干细胞治疗:除了药物治疗外,干细胞因其独特的组织修复能力和功能完整性,使得干细胞疗法成为减轻放射性脑损伤的潜在策略。内皮祖细胞(EPC)具有维持和修复内皮的功能。最新的一项研究评估了EPC移植治疗RIBI的效用,证实经过WBI后,循环EPC水平的增加可能会恢复对BBB、紧密连接和脑毛细血管密度的损害[38]。对于治疗神经元损伤,间充质干细胞能够增加放疗后存活的海马神经元的密度,使海马神经元结构清晰、规则,缓解辐射后的神经元损伤。
尽管临床应用的干细胞治疗的基本机制以及最佳剂量和时间需要进一步研究,但干细胞的移植仍可能是治疗RIBI患者减轻辐照不利影响的新选择。
(2) 分子靶点治疗:目前的医学研究已进入分子时代,在放射性脑损伤的治疗方法研究中,分子靶点治疗有可能成为未来研究的热点。已有研究表明,通过调节NO/BH4通路可以防止辐射诱导的神经元损伤。NO/BH4通路组合可抵消辐射诱导的DNA氧化性,减轻DNA损伤,减少神经元凋亡[39]。CO释放分子3(CORM-3)可以抑制小胶质细胞的激活,缓解MG介导的神经元凋亡,促进神经再生,预防神经元损伤,并改善辐射诱导性脑损伤期间的记忆功能[40]。
研究显示,小胶质细胞特异性C1q缺失可减少小胶质细胞活化、突触丢失、神经炎症和认知障碍,故可以考虑特异性敲除C1q来治疗小胶质细胞引起的放射性损伤[41]。另外,Leavitt团队的分子水平实验也显示,使用细胞外囊泡介导的miR-124移植治疗可以减少无胸腺裸大鼠的神经炎症[42]。
因此,在分子医学时代,微观层面上的治疗方法在放射性脑损伤的治疗中不断涌现,并且相信在不久的将来,分子靶向治疗放射性脑损伤也将取得重大突破。
3. 新型放疗技术对于预防放射性脑损伤的积极作用:在过去的几年里,观察到脑转移患者放疗后的临床预后有所改善,这得益于进行颅脑放疗的新型放疗技术被引进于临床治疗中,例如螺旋断层放疗(TOMO)、射波刀(CK)、立体定向放射治疗(SBRT)等,为脑肿瘤放疗提供高精度非侵入性治疗,神经不良反应小,对于脑部重要器官具有突出的保护优势。相较于传统全脑放射而言,TOMO和射波刀所提供的立体定向放疗在避免海马受损以及保护脑干等保护患者认知功能及基本生理功能方面,表现出了更好的功能结果[43]。
在精确放疗过程中,对肿瘤靶区、临床靶区、危及器官的准确勾画以及照射剂量的合理选择是保证疗效、降低正常组织损伤的一个重要环节。虽然剂量处方与分割设计有一般的临床指南,但临床指南中仍然有灵活性,医生可以根据个人判断选择处方。值得注意的是,近年来人工智能(AI)的发展或许能够预测脑转移放射手术中的剂量与分割处方[44],未来也有望辅助临床医生进行临床决策,提高临床实践的效率。
三、展望放射性脑损伤严重损害了患者的生活质量和生存期限。关于放射性脑损伤的具体发病机制目前尚无统一定论,本文总结了近年来研究者最新提出的放射性脑损伤的发病机制,为临床预防、诊疗该病提供可靠的理论依据。然而,加深对辐射诱导脑损伤背后机制的理解仍然具有挑战性,包括辐射对于大脑后发生的分子和细胞变化影响的不确定性、肠道微生物群-脑轴调节血脑屏障及神经炎症的具体机制等。
目前,对于放射性脑损伤的治疗方法还大多局限于临床前研究,缺乏对临床应用效果的评估,仍需进行深入研究,探索放射性脑损伤新的预防及治疗靶点。与辐射环境中预防或抑制小胶质细胞和星形胶质细胞的激活、改善神经炎症和维持肠道微生物平衡的相关研究可能会提供一系列适用于放射性脑损伤预防与治疗的有前途的方法,为放疗患者提供了显著改善生活质量和生存期限的机会。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未因进行该研究接受任何不正当的职务或财务利益,再次对研究的独立性和科学性予以保证
作者贡献声明 曾丽晶、夏煌、陈钰昕、林佩悦、杨晶、曾文艺负责文献收集、论文撰写与修改;李小波、徐本华负责提出修改意见;郑榕负责指导论文立题、撰写与修改
| [1] |
Owonikoko TK, Arbiser J, Zelnak A, et al. Current approaches to the treatment of metastatic brain tumours[J]. Nat Rev Clin Oncol, 2014, 11(4): 203-222. DOI:10.1038/nrclinonc.2014.25 |
| [2] |
Makale MT, McDonald CR, Hattangadi-Gluth JA, et al. Mechanisms of radiotherapy-associated cognitive disability in patients with brain tumours[J]. Nat Rev Neurol, 2017, 13(1): 52-64. DOI:10.1038/nrneurol.2016.185 |
| [3] |
严沁. 放射性脑损伤的研究进展[D]. 重庆: 重庆医科大学, 2014. DOI: 10.7666/d.Y2689335. Yan Q. Research progress of post-radiation brain injury[D]. Chongqing: Chongqing Medical University, 2014. DOI: 10.7666/d.Y2689335. |
| [4] |
中国放射性脑损伤多学科协作组, 中国医师协会神经内科分会脑与脊髓损害专业委员会. 放射性脑损伤诊治中国专家共识[J]. 中华神经医学杂志, 2019, 18(6): 541-549. Chinese Multidisciplinary Collaboration Group of Radiation-induced Brain Injury, Specialized Committee Professional Board of Brain and Spinal Cord Injury, Neurology Branch of Chinese Medical Doctor Association. Diagnoses and treatments of radiation-induced brain injury: an expert consensus[J]. Chin J Neuromed, 2019, 18(6): 541-549. DOI:10.3760/cma.j.issn.1671-8925.2019.06.001 |
| [5] |
Yang R, Duan C, Yuan L, et al. Inhibitors of HIF-1α and CXCR4 mitigate the development of radiation necrosis in mouse brain[J]. Int J Radiat Oncol Biol Phys, 2018, 100(4): 1016-1025. DOI:10.1016/j.ijrobp.2017.12.257 |
| [6] |
Armulik A, Genové G, Mäe M, et al. Pericytes regulate the blood-brain barrier[J]. Nature, 2010, 468(7323): 557-561. DOI:10.1038/nature09522 |
| [7] |
Cheng J, Jiang J, He B, et al. A phase 2 study of thalidomide for the treatment of radiation-induced blood-brain barrier injury[J]. Sci Transl Med, 2023, 15(684): eabm6543. DOI:10.1126/scitranslmed.abm6543 |
| [8] |
Verma SD, Passerat de la Chapelle E, Malkani S, et al. Astrocytes regulate vascular endothelial responses to simulated deep space radiation in a human organ-on-a-chip model[J]. Front Immunol, 2022, 13: 864923. DOI:10.3389/fimmu.2022.864923 |
| [9] |
Allen BD, Apodaca LA, Syage AR, et al. Attenuation of neuroinflammation reverses Adriamycin-induced cognitive impairments[J]. Acta Neuropathol Commun, 2019, 7(1): 186. DOI:10.1186/s40478-019-0838-8 |
| [10] |
Shi Z, Yu P, Lin WJ, et al. Imbroglio drive transient insult-induced brain injury by chemotactic recruitment of CD8+ T lymphocytes[J]. Neuron, 2023, 111(5): 696-710.e9. DOI:10.1016/j.neuron.2022.12.009 |
| [11] |
Groh J, Knöpper K, Arampatzi P, et al. Accumulation of cytotoxic T cells in the aged CNS leads to axon degeneration and contributes to cognitive and motor decline[J]. Nat Aging, 2021, 1(4): 357-367. DOI:10.1038/s43587-021-00049-z |
| [12] |
Jorfi M, Park J, Hall CK, et al. Infiltrating CD8+ T cells exacerbate Alzheimer's disease pathology in a 3D human neuroimmune axis model[J]. Nat Neurosci, 2023, 26(9): 1489-1504. DOI:10.1038/s41593-023-01415-3 |
| [13] |
Parihar VK, Limoli CL. Cranial irradiation compromises neuronal architecture in the hippocampus[J]. Proc Natl Acad Sci U S A, 2013, 110(31): 12822-12827. DOI:10.1073/pnas.1307301110 |
| [14] |
Monje ML, Mizumatsu S, Fike JR, et al. Irradiation induces neural precursor-cell dysfunction[J]. Nat Med, 2002, 8(9): 955-962. DOI:10.1038/nm749 |
| [15] |
Wu MY, Zou WJ, Yu P, et al. Cranial irradiation impairs intrinsic excitability and synaptic plasticity of hippocampal CA1 pyramidal neurons with implications for cognitive function[J]. Neural Regen Res, 2022, 17(10): 2253-2259. DOI:10.4103/1673-5374.336875 |
| [16] |
Xiao M, Li X, Wang L, et al. Skin wound following irradiation aggravates radiation-induced brain injury in a mouse model[J]. Int J Mol Sci, 2023, 24(13): 10701. DOI:10.3390/ijms241310701 |
| [17] |
Zhang Z, Jiang J, He Y, et al. Pregabalin mitigates microglial activation and neuronal injury by inhibiting HMGB1 signaling pathway in radiation-induced brain injury[J]. J Neuroinflammation, 2022, 19(1): 231. DOI:10.1186/s12974-022-02596-7 |
| [18] |
Liddelow SA, Guttenplan KA, Clarke LE, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. DOI:10.1038/nature21029 |
| [19] |
Anderson MA, Burda JE, Ren Y, et al. Astrocyte scar formation aids central nervous system axon regeneration[J]. Nature, 2016, 532(7598): 195-200. DOI:10.1038/nature17623 |
| [20] |
Korimerla N, Wahl DR. A complementary strategy to mitigate radiation-induced cognitive decline[J]. Cancer Res, 2021, 81(7): 1635-1636. DOI:10.1158/0008-5472.CAN-20-4277 |
| [21] |
Tognatta R, Miller RH. Contribution of the oligodendrocyte lineage to CNS repair and neurodegenerative pathologies[J]. Neuropharmacology, 2016, 110(Pt B): 539-547. DOI:10.1016/j.neuropharm.2016.04.026 |
| [22] |
Gan C, Li W, Xu J, et al. Advances in the study of the molecular biological mechanisms of radiation-induced brain injury[J]. Am J Cancer Res, 2023, 13(8): 3275-3299. |
| [23] |
Huang B, Zhao W, Cai X, et al. Expression and activity of the transcription factor CCAAT/enhancer-binding protein β (C/EBPβ) is regulated by specific pulse-modulated radio frequencies in oligodendroglial cells[J]. Int J Mol Sci, 2023, 24(13): 11131. DOI:10.3390/ijms241311131 |
| [24] |
Li Z, Ke X, Zuo D, et al. New insights into the relationship between gut microbiota and radiotherapy for cancer[J]. Nutrients, 2022, 15(1): 48. DOI:10.3390/nu15010048 |
| [25] |
Shi H, Ge X, Ma X, et al. A fiber-deprived diet causes cognitive impairment and hippocampal microglia-mediated synaptic loss through the gut microbiota and metabolites[J]. Microbiome, 2021, 9(1): 223. DOI:10.1186/s40168-021-01172-0 |
| [26] |
Rothhammer V, Borucki DM, Tjon EC, et al. Microglial control of astrocytes in response to microbial metabolites[J]. Nature, 2018, 557(7707): 724-728. DOI:10.1038/s41586-018-0119-x |
| [27] |
Sampson TR, Debelius JW, Thron T, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease[J]. Cell, 2016, 167(6): 1469-1480.e12. DOI:10.1016/j.cell.2016.11.018 |
| [28] |
Zhu S, Jiang Y, Xu K, et al. The progress of gut microbiome research related to brain disorders[J]. J Neuroinflammation, 2020, 17(1): 25. DOI:10.1186/s12974-020-1705-z |
| [29] |
Nagai J, Yu X, Papouin T, et al. Behaviorally consequential astrocytic regulation of neural circuits[J]. Neuron, 2021, 109(4): 576-596. DOI:10.1016/j.neuron.2020.12.008 |
| [30] |
Jiang X, Engelbach JA, Yuan L, et al. Anti-VEGF antibodies mitigate the development of radiation necrosis in mouse brain[J]. Clin Cancer Res, 2014, 20(10): 2695-2702. DOI:10.1158/1078-0432.CCR-13-1941 |
| [31] |
Jasielski P, Piędel F, Piwek M, et al. Application of citicoline in neurological disorders: a systematic review[J]. Nutrients, 2020, 12(10): 3113. DOI:10.3390/nu12103113 |
| [32] |
Zhang P, Cao Y, Chen S, et al. Combination of vinpocetine and dexamethasone alleviates cognitive impairment in nasopharyngeal carcinoma patients following radiation injury[J]. Pharmacology, 2021, 106(1-2): 37-44. DOI:10.1159/000506777 |
| [33] |
Yang H, Zeng Q, Silverman HA, et al. HMGB1 released from nociceptors mediates inflammation[J]. Proc Natl Acad Sci U S A, 2021, 118(33): e2102034118. DOI:10.1073/pnas.2102034118 |
| [34] |
Hu J, Jiao W, Tang Z, et al. Quercetin inclusion complex gels ameliorate radiation-induced brain injury by regulating gut microbiota[J]. Biomed Pharmacother, 2023, 158: 114142. DOI:10.1016/j.biopha.2022.114142 |
| [35] |
Zhang Y, Gao L, Cheng Z, et al. Kukoamine A prevents radiation-induced neuroinflammation and preserves hippocampal neurogenesis in rats by inhibiting activation of NF-κB and AP-1[J]. Neurotox Res, 2017, 31(2): 259-268. DOI:10.1007/s12640-016-9679-4 |
| [36] |
Hokama Y, Nishimura M, Usugi R, et al. Recovery from the damage of cranial radiation modulated by memantine, an NMDA receptor antagonist, combined with hyperbaric oxygen therapy[J]. Neuro Oncol, 2023, 25(1): 108-122. DOI:10.1093/neuonc/noac162 |
| [37] |
Liu LY, Qin TZ, Guo L, et al. The preventive and therapeutic effect of repetitive transcranial magnetic stimulation on radiation-induced brain injury in mice[J]. Int J Radiat Biol, 2022, 98(8): 1316-1329. DOI:10.1080/09553002.2022.2038806 |
| [38] |
Huang X, Li M, Zhou D, et al. Endothelial progenitor cell transplantation restores vascular injury in mice after whole-brain irradiation[J]. Brain Res, 2020, 1746: 147005. DOI:10.1016/j.brainres.2020.147005 |
| [39] |
Thabet NM, Rashed ER, Abdel-Rafei MK, et al. Modulation of the nitric oxide/BH4 pathway protects against irradiation-induced neuronal damage[J]. Neurochem Res, 2021, 46(7): 1641-1658. DOI:10.1007/s11064-021-03306-0 |
| [40] |
Lu K, Wu WJ, Zhang C, et al. CORM-3 regulates microglia activity, prevents neuronal injury, and improves memory function during radiation-induced brain injury[J]. Curr Neurovasc Res, 2020, 17(4): 464-470. DOI:10.2174/1567202617999200730213259 |
| [41] |
Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer, 2012, 12(4): 252-264. DOI:10.1038/nrc3239 |
| [42] |
Leavitt RJ, Acharya MM, Baulch JE, et al. Extracellular vesicle-derived miR-124 resolves radiation-induced brain injury[J]. Cancer Res, 2020, 80(19): 4266-4277. DOI:10.1158/0008-5472.CAN-20-1599 |
| [43] |
Gaebe K, Li AY, Park A, et al. Stereotactic radiosurgery versus whole brain radiotherapy in patients with intracranial metastatic disease and small-cell lung cancer: a systematic review and meta-analysis[J]. Lancet Oncol, 2022, 23(7): 931-939. DOI:10.1016/S1470-2045(22)00271-6 |
| [44] |
Cao Y, Kunaprayoon D, Ren L. Interpretable AI-assisted clinical decision making (CDM) for dose prescription in radiosurgery of brain metastases[J]. Radiother Oncol, 2023, 187: 109842. DOI:10.1016/j.radonc.2023.109842 |
 2024, Vol. 44
2024, Vol. 44


