2. 贵州医科大学附属肿瘤医院妇科肿瘤科, 贵阳 550004
2. Department of Gynecological Oncology, Affiliated Cancer Hospital of Guizhou Medical University, Guiyang 550004, China
局部晚期宫颈癌同步放化疗是标准治疗方案[1]。随着放疗设备的发展,调强放射治疗技术(IMRT)成为局部晚期宫颈癌标准的放疗技术,能够明显降低治疗相关不良反应[2]。宫颈癌放疗过程中,膀胱受照剂量与放射性泌尿系统症状相关,剂量越高,发生放射性损伤的可能性越大[3]。目前,欧洲放射肿瘤协会近距离治疗组(GEC-ESTRO)[4]和国际辐射单位与测量委员会(ICRU)89号报告[5]规定,离靶区最近的2 cm3膀胱体积接受的剂量(D2 cm3)大小代表膀胱的受照剂量,由于膀胱D2 cm3与膀胱的解剖结构无明显相关性,该报告存在一定局限性。因此,没有足够证据表明膀胱D2 cm3及膀胱参考点与放疗引起的泌尿系反应存在直接相关性。目前对于宫颈癌外照射尿道受照剂量与泌尿系统不良反应相关性研究较少,对下尿道受照剂量与并发症相关性值得研究。本研究对局部晚期宫颈患者盆腔外照射时膀胱、尿道剂量学与泌尿系统发生不良反应的相关性进行分析。
资料与方法1. 病例资料:回顾性收集2019年3月1日至2023年1月31日贵州医科大学附属医院收治的宫颈癌患者148例,其中位年龄51岁,病理类型绝大部分为鳞癌(87.2%),宫颈局部肿块直径中位值5 cm,其余见表 1。纳入标准:所有患者必须进行宫颈肿块活检病理证实为鳞癌、腺癌或腺鳞癌,同时两位妇科医师进行妇科检查进行分期,按照宫颈癌诊疗规范行盆腔磁共振检查(有禁忌行盆腔CT增强检查)、腹部CT增强检查及胸部CT平扫、心电图、血常规、肝肾功能等检查,分期采用国际妇产科联盟(FIGO)标准[6]。排除标准:合并尿路感染患者和肿瘤侵犯膀胱及尿道的患者。所有患者均为局部晚期宫颈癌(IB3及以上),经患者同意,且通过医院伦理委员会审核通过(FZ2019-03-097)。
|
|
表 1 患者的一般临床资料 Table 1 General clinical data of patients |
2. 放疗前准备、靶区勾画及计划设计
(1) CT模拟定位:患者取仰卧位,双手抱头,体膜固定,扫描范围双肾上极至坐骨结节下5 cm,扫描层厚5 mm。
(2) 靶区勾画:临床靶体积(CTV)包括大体肿瘤区、宫旁、部分阴道及相应淋巴引流区。影像学上符合诊断标准的肿大淋巴结为淋巴结肿瘤靶体积(GTVnd)。CTV外放0.5 cm为计划靶体积(PTV)。处方剂量PTV为50.4 Gy,1.8 Gy/次,5次/周,共28次,对于转移淋巴结同步加量至60.2 Gy(2.15 Gy/次),在外照射放疗至17~20次时给予三维后装近距离治疗(3D-BT),靶区勾画具体如下:按照ICRU89号报告[5]勾画高危临床靶区(HR-CTV)及直肠、膀胱、乙状结肠及小肠等危及器官。HR-CTV剂量为30 Gy/5~6次,HR-CTV剂量以2 Gy等效生物效应计算达到85 Gy以上。
(3) 膀胱及尿道勾画:膀胱勾画从膀胱颈至膀胱底逐层勾画,尿道勾画上界至尿道内口开口,下界至会阴区,参照治疗前盆腔磁共振图像T2序列[7]及GEC-ESTRO[8]推荐进行勾画,具体见图 1。剂量学参数主要收集膀胱、尿道D2 cm3、D1 cm3、D0.1 cm3,V5~V50等。
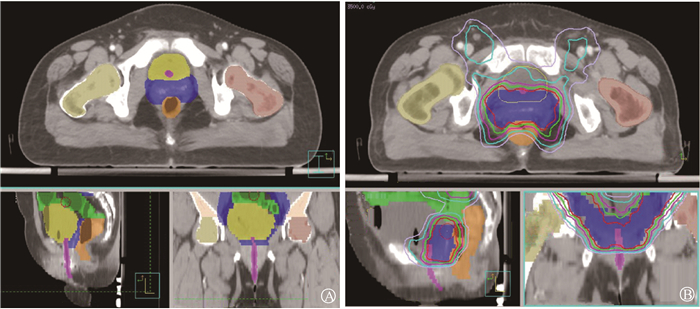
|
注:紫色为尿道 图 1 尿道勾画示意图(A)及受照剂量示意图(B) Figure 1 Schematic diagrams of urethra (A) and radiation dose to urethra (B) |
(4) 计划设计:以计划靶区的几何中心为射野中心,设置5~7个共面照射野,以6 MV X射线照射。要求 < 93% PTV处方剂量体积 < 3%,>105% PTV处方剂量体积 < 20%,>110% PTV处方剂量不允许出现。
(5) 器官限制剂量:根据RTOG 0415[9]及ICRU 89号报告[5]设定危及器官剂量-体积限值,小肠V40 Gy≤40%;D2 cm3≤65 Gy,直肠V40 Gy≤50%;D2 cm3≤73 Gy,膀胱V45 Gy≤50%;D2 cm3≤90 Gy。
(6) 化疗方案:给予单药顺铂每周同步化疗4~6个周期。
3.泌尿系不良反应:采用RTOG急性放射损伤分级标准进行评估,G0:无明显不适;G1:排尿频率或夜尿为疗前的2倍或排尿困难、尿急,无需用药;G2:排尿困难或夜尿少于每小时1次,排尿困难、尿急、膀胱痉挛需要局部用药;G3:尿频伴尿急和夜尿,每小时1次或更频/排尿困难,盆腔痛或膀胱痉挛,需定时、频繁地予麻醉剂/肉眼血尿伴或不伴血块;G4:血尿需输血/急性膀胱梗阻,非继发于血块、溃疡或坏死[10]。
4.统计学处理:采用SPSS 20.0软件进行数据分析,以每组参数的中位值为界分成两组,描述性数据和定量资料符合正态分布,采用x±s表示,定性数据采用百分比表示。独立样本t检验进行组间比较,多因素分析采用logistic回归模型。P<0.05为差异具有统计学意义。
结果1. 膀胱相关剂量学参数与泌尿系统不良反应的相关性:膀胱的中位体积为294.80(144.84~486.75)cm3,以膀胱每个参数的中位值为界分成两组。当膀胱Dmax>62.35 Gy、D0.1cm3>61.40 Gy、D1 cm3>59.61 Gy、D2 cm3>58.65 Gy,高剂量体积V40 Gy>50.34%、V45 Gy>34.47%及V50 Gy>21.55%时,发生2级泌尿系不良反应明显升高(t=13.42、9.18、10.15、18.83、7.48、5.66、5.51,P<0.05,表 2)。
|
|
表 2 局部晚期宫颈癌同步放化疗中膀胱相关参数与不良反应的相关性(%) Table 2 Correlations of bladder-related parameters with adverse reactions during concurrent chemoradiotherapy for locally advanced cervical cancer(%) |
2. 尿道相关剂量学参数与泌尿系不良反应的相关性:尿道的中位体积为4.71(2.68~6.69)cm3,以尿道每个参数的中位值为界分成两组,当尿道Dmax>56.52 Gy、Dmin>3.12 Gy、Dmean>29.63 Gy、V5 Gy>73.40%、V10 Gy>61.28%、V15 Gy>57.84%、V20 Gy>56.28%、V25 Gy>55.13%、V30 Gy>51.19%、V35 Gy>49.02%、V40 Gy>48.06%、V45 Gy>43.08%、V50 Gy>31.25%时,发生2级泌尿系不良反应明显升高(t=14.30、21.65、32.19、33.36、16.62、17.91、21.52、20.11、12.27、37.25、30.18、36.24、21.98,P<0.05,表 3)。
|
|
表 3 局部晚期宫颈癌同步放化疗中尿道相关参数与不良反应的相关性(%) Table 3 Correlations between urethra-related parameters and adverse reactions during concurrent chemoradiotherapy for locally advanced cervical cancer(%) |
3. 尿道及膀胱剂量学参数与泌尿系不良反应
相关性多因素分析:将差异有统计意义的参数纳入多因素Logistic回归分析,结果显示,尿道D2 cm3、V20、V40(P<0.05)及膀胱D2 cm3、D1 cm3及V40(P<0.05)是预测泌尿系发生2级不良反应的独立因素。
讨论局部晚期宫颈癌标准的治疗为含铂的同步放化疗联合三维后装近距离治疗,随着放疗技术的发展,基于图像引导的调强放射治疗可明显降低盆腔正常器官严重并发症发生率。有文献报道3级泌尿系并发症<5%,未见4级及以上并发症[11],2级发生率为5%~25%[12]。本研究结果提示,2级泌尿系不良反应发生率为10%,与文献报道相似,但本研究纳入的患者大部分为ⅡB期以上患者,且局部宫颈肿块大,其中合并盆腔淋巴结转移患者占41.2%,这可能是导致2级反应相对较高的原因。
对于泌尿系放疗不良反应,如2级尿频、尿急、尿痛等,会影响生活质量,并可能导致治疗中断[13]。目前,评估膀胱受照剂量常用膀胱D2 cm3,Georg等[14]证实宫颈癌放射治疗时,膀胱D2 cm3能够预测整个泌尿系相关并发症,且D2 cm3<100 Gy能够明显降低相关不良反应。本研究结果提示膀胱D2 cm3、D1 cm3均与泌尿系不良反应相关,当D2 cm3、D1 cm3分别≤58.65、59.61 Gy时,2级不良反应明显降低。但D2 cm3在膀胱的具体位置受膀胱充盈程度影响较大,另外,单一指标不能代替膀胱亚结构如膀胱三角区、膀胱颈及尿道的剂量分布,因此该评估有一定的局限性。首先,引起泌尿系反应的症状与膀胱的不同结构有关;其次,膀胱不同亚结构受照剂量可能引起不同的症状,因此,需要评估剂量对膀胱不同区域功能的影响。
有文献报道,前列腺癌患者行盆腔外照射及低剂量率后装治疗中,膀胱底部特别是膀胱三角区及尿道剂量与放疗引起的尿频、尿急及排尿困难等症状直接相关[15-16]。在前列腺癌患者中,有研究显示泌尿系相关急慢性不良反应与肿瘤体积及膀胱接受75 Gy体积占整个膀胱体积的百分比(V75)相关,而与膀胱颈D2 cm3无明显相关。另外,在前列腺癌中膀胱不同的亚解剖区域与泌尿系急慢性并发症相关[17]。因此,为了更精准地预测不良反应与膀胱不同区域剂量相关性,需要确定膀胱不同亚解剖结构部位及受照的剂量,从而根据不同区域剂量与不良反应相关性进行剂量限定,以减少放疗并发症[18]。宫颈癌患者由于宫颈肿块位于膀胱及直肠中间位置,特别是肿瘤侵及阴道时,肿瘤与膀胱及尿道关系紧密,行放疗时,容易受到照射引起泌尿系统症状,早期症状如尿频、尿急、尿痛,晚期症状包括排尿困难等。现有研究越来越关注膀胱不同区域及亚结构受照剂量与放疗引起的并发症之间的相关性[19]。女性下尿道亚结构包括膀胱壁、膀胱三角区及尿道,膀胱三角区为双侧输尿管开口与尿道内口组成的区域,容易受膀胱充盈程度的影响,变化较大。而尿道在膀胱颈以下呈管状结构,有研究采用尿道的点剂量代替尿道剂量,且主要限于近距离治疗的研究结果[20]。Spampinato等[21]通过分析EMBRACE研究发现,宫颈癌盆腔放疗导致的2级尿频、尿失禁等并发症的发生率约11.4%,且与ICRU规定的膀胱参考点(ICRU BP)呈现一定相关性,建议ICRU BP与体积剂量一起检测以便更好地预测相关并发症。但行盆腔外照射时尿道受照剂量与泌尿系并发症之间有无相关性,目前尚未有关于宫颈癌患者尿道受照剂量学参数与泌尿系相关性的研究。
本研究发现女性尿道的体积约为4.71 cm3,进一步分析相关剂量学参数结果,经过单因素及多因素检测发现尿道Dmax、Dmin、Dmean、D1 cm3及D0.1 cm3与2级泌尿系不良反应无明显相关性,这与膀胱明显不同,分析原因考虑可能与尿道体积较小有关;对膀胱体积剂量学参数检测提示,V5 Gy、V10 Gy、V15 Gy、V20 Gy、V25 Gy、V30 Gy、V35 Gy、V40 Gy、V45 Gy、V50 Gy与2级泌尿系不良反应相关,但进一步行多因素分析发现仅尿道D2 cm3、V20、V40是预测泌尿系发生2级不良反应的独立因素,当尿道D2 cm3≤45.26 Gy、V20≤56.28%、V40≤48.06%时,能明显降低2级泌尿系不良反应。
总之,本研究报道盆腔外照射时尿道相关剂量学参数与泌尿系不良反应的相关性,这些数据表明,膀胱亚临床结构如尿道也可预测泌尿系不良反应,建议限制尿道的D2 cm3、V20及V40以尽量减少2级泌尿系统并发症的风险,这些限制需要前瞻性研究进一步验证。
利益冲突 无
作者贡献声明 李凤虎、梅烦负责研究设计及论文撰写;杜燕军、田雪、胡丽丽、洪卫、班红、殷水水、胡银祥负责数据收集;卢冰、李杰慧负责数据分析及论文修改
| [1] |
Gennigens C, De Cuypere M, Hermesse J, et al. Optimal treatment in locally advanced cervical cancer[J]. Expert Rev Anticancer Ther, 2021, 21(6): 657-671. DOI:10.1080/14737140.2021.1879646 |
| [2] |
Lin AJ, Kidd E, Dehdashti F, et al. Intensity modulated radiation therapy and image-guided adapted brachytherapy for cervix cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 103(5): 1088-1097. DOI:10.1016/j.ijrobp.2018.11.012,PMID:30445171 |
| [3] |
Patel RB, Gururajachar JM, Revathy T. Implications of bladder volume on target coverage and dose to critical structures during high dose rate intracavitary brachytherapy for cervical cancer: A dosimetric study[J]. J Cancer Res Ther, 2019, 15(6): 1207-1211. DOI:10.4103/jcrt.JCRT_253_19 |
| [4] |
Schmid MP, Fokdal L, Westerveld H, et al. Recommendations from gynaecological (GYN) GEC-ESTRO working group - ACROP: Target concept for image guided adaptive brachytherapy in primary vaginal cancer[J]. Radiother Oncol, 2020, 145: 36-44. DOI:10.1016/j.radonc.2019.11.005 |
| [5] |
International Commission on Radiation Units and Measurements. Prescribing, recording, and reporting brachytherapy for cancer of the cervix[J]. J ICRU, 2013, 13: 1-2. DOI:10.1093/jicru/ndw027 |
| [6] |
Grigsby PW, Massad LS, Mutch DG, et al. FIGO 2018 staging criteria for cervical cancer: Impact on stage migration and survival[J]. Gynecol Oncol, 2020, 157(3): 639-643. DOI:10.1016/j.ygyno.2020.03.027 |
| [7] |
Spampinato S, Tanderup K, Marinovskij E, et al. MRI-based contouring of functional sub-structures of the lower urinary tract in gynaecological radiotherapy[J]. Radiother Oncol, 2020, 145: 117-124. DOI:10.1016/j.radonc.2019.12.011 |
| [8] |
Iwai Y, Nemoto MW, Horikoshi T, et al. Comparison of CT-based and MRI-based high-risk clinical target volumes in image guided-brachytherapy for cervical cancer, referencing recommendations from the Japanese Radiation Oncology Study Group (JROSG) and consensus statement guidelines from the Groupe Européen de Curiethérapie-European Society for Therapeutic Radiology and Oncology (GEC ESTRO)[J]. Jpn J Radiol, 2020, 38(9): 899-905. DOI:10.1007/s11604-020-00980-y |
| [9] |
Lee WR, Dignam JJ, Amin MB, et al. Randomized phase Ⅲ noninferiority study comparing two radiotherapy fractionation schedules in patients with low-risk prostate cancer[J]. J Clin Oncol, 2016, 34(20): 2325-2332. DOI:10.1200/JCO.2016.67.0448 |
| [10] |
Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. DOI:10.1016/0360-3016(95)00060-C |
| [11] |
Manea E, Escande A, Bockel S, et al. Risk of late urinary complications following image guided adaptive brachytherapy for locally advanced cervical cancer: refining bladder dose-volume parameters[J]. Int J Radiat Oncol Biol Phys, 2018, 101(2): 411-420. DOI:10.1016/j.ijrobp.2018.02.004 |
| [12] |
le Guyader M, Lam Cham Kee D, Thamphya B, et al. High-dose-rate brachytherapy boost for locally advanced cervical cancer: Oncological outcome and toxicity analysis of 4 fractionation schemes[J]. Clin Transl Radiat Oncol, 2022, 32: 15-23. DOI:10.1016/j.ctro.2021.10.005 |
| [13] |
Gil KM, Pugh SL, Klopp AH, et al. Expanded validation of the EPIC bowel and urinary domains for use in women with gynecologic cancer undergoing postoperative radiotherapy[J]. Gynecol Oncol, 2019, 154(1): 183-188. DOI:10.1016/j.ygyno.2019.04.682 |
| [14] |
Georg P, Pötter R, Georg D, et al. Dose effect relationship for late side effects of the rectum and urinary bladder in magnetic resonance image-guided adaptive cervix cancer brachytherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): 653-657. DOI:10.1016/j.ijrobp.2010.12.029 |
| [15] |
Henderson DR, Murray JR, Gulliford SL, et al. An investigation of dosimetric correlates of acute toxicity in prostate stereotactic body radiotherapy: dose to urinary trigone is associated with acute urinary toxicity[J]. Clin Oncol (R Coll Radiol), 2018, 30(9): 539-547. DOI:10.1016/j.clon.2018.05.001 |
| [16] |
Hathout L, Folkert MR, Kollmeier MA, et al. Dose to the bladder neck is the most important predictor for acute and late toxicity after low-dose-rate prostate brachytherapy: implications for establishing new dose constraints for treatment planning[J]. Int J Radiat Oncol Biol Phys, 2014, 90(2): 312-319. DOI:10.1016/j.ijrobp.2014.06.031 |
| [17] |
Ben Aicha I, Hathout L, Carignan D, et al. Dose to the bladder neck is not correlated with urinary toxicity in patients with prostate cancer treated with HDR brachytherapy boost[J]. Brachytherapy, 2020, 19(5): 584-588. DOI:10.1016/j.brachy.2020.06.017 |
| [18] |
Mylona E, Acosta O, Lizee T, et al. Voxel-based analysis for identification of urethrovesical subregions predicting urinary toxicity after prostate cancer radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2019, 104(2): 343-354. DOI:10.1016/j.ijrobp.2019.01.088 |
| [19] |
Spampinato S, Fokdal L, Marinovskij E, et al. Assessment of dose to functional sub-structures in the lower urinary tract in locally advanced cervical cancer radiotherapy[J]. Phys Med, 2019, 59: 127-132. DOI:10.1016/j.ejmp.2019.01.017 |
| [20] |
Chen J, Zhang N, Liu Y, et al. Analysis of applicator insertion related acute side effects for cervical cancer treated with brachytherapy[J]. Front Oncol, 2021, 11: 677052. DOI:10.3389/fonc.2021.677052 |
| [21] |
Spampinato S, Fokdal LU, Pötter R, et al. Importance of the ICRU bladder point dose on incidence and persistence of urinary frequency and incontinence in locally advanced cervical cancer: An EMBRACE analysis[J]. Radiother Oncol, 2021, 158: 300-308. DOI:10.1016/j.radonc.2020.10.003 |
 2024, Vol. 44
2024, Vol. 44


