放射治疗是肝癌的重要治疗方式之一,在杀伤肿瘤细胞的同时会引起细胞因子的变化,导致肿瘤微环境(TME)重塑,影响疗效[1]。研究发现,高剂量X射线可引起肿瘤细胞坏死并释放双链DNA(dsDNA)[2]。环鸟苷酸腺苷酸合成酶(cGAS)-干扰素激活基因刺激物(STING)信号通路可通过感应dsDNA,介导机体免疫应答[3],而巨噬细胞是参与肿瘤免疫应答的重要细胞[4]。因此,本研究建立小鼠肝癌模型,给予不同剂量X射线照射,观察肿瘤生长状况,检测血清中巨噬细胞相关细胞因子的含量及肿瘤组织中巨噬细胞不同表型的比例,对不同剂量X射线照射通过cGAS-STING信号通路重塑肿瘤免疫微环境进行初步探讨。
材料与方法1. 主要试剂:CD86 (B7-2) 单抗(GL1)、APC、CD163单抗(TNKUPJ)、PE-Cyanine7、CD206 (MMR) 单抗(MR6F3)、PE、F4/80单抗(BM8)、PE-Cyanine5均购自美国赛默飞公司,小鼠肿瘤坏死因子α(TNF-α)、白介素-6(IL-6)、IL-10、生长转化因子β1(TGF-β)、趋化因子配体5(CCL-5)/RANTES、IL-13、干扰素γ(IFN-γ)ELISA试剂盒购自杭州联科生物公司。BCA蛋白定量试剂盒购自北京全式金生物技术有限公司、RIPA裂解液与蛋白酶抑制剂购自武汉博士德生物工程有限公司、cGAS和STING多克隆抗体购自武汉三鹰生物技术有限公司,二抗购自英国Abcam公司,β-肌动蛋白抗体购自北京义翘神州科技公司。
2. 细胞培养:小鼠肝癌细胞(Hepa 1-6)购自武汉普诺赛公司,细胞培养条件为DMEM(高糖)培养基+10%胎牛血清+1%盘尼西林,37℃、5% CO2以及饱和湿度。细胞贴壁90%时,1 ml 0.25%胰酶消化细胞2 min,加入1 ml完全培养基终止消化,离心半径10 cm,1 000 r/min离心5 min,弃上清,用500 μl完全培养基重悬细胞,备用。
3. 小鼠肝癌模型建立:C57BL/C小鼠购自新疆医科大学动物中心[合格证号:SCXK(新)2018-0002],选取6~8周龄,体重(18±2)g的SPF级雄性小鼠40只。适应性饲养1周后实验。使用无血清培养基将Hepa 1-6细胞制成单细胞悬液,调整细胞浓度至4×107/ ml。每只0.1 ml接种于小鼠右侧腋部皮下(细胞总数为4×106个,细胞悬液与基质胶1∶1混合)。隔天观察并记录小鼠肿瘤生长情况,游标卡尺测定肿瘤大小。肿瘤大小达到100 mm3,视为建模成功。
4. 照射条件:将小鼠按体重大小编号,生成随机数字并排序,按顺序随机分为0、4、8、12 Gy组,每组10只。用1%戊巴比妥钠(50 mg/ kg) 腹腔注射麻醉后固定,采用高能直线加速器(瑞典医科达公司)6 MV X射线照射,吸收剂量率为300 cGy/min,源皮距(SSD)100 cm,照射野1.5 cm ×1.5 cm。0 Gy组以同样方法麻醉后,施以假照射。
5.体重及肿瘤测量:自Hepa 1-6细胞注射后,每2天对小鼠进行称重,并测量皮下肿瘤的最大长径(a)和横径(b),根据公式(体积=1/2 ×ab2)计算,计算各组平均肿瘤体积变化。在处死小鼠后,取瘤块,计算抑瘤率,公式为:抑瘤率(IR)=(0 Gy组平均瘤重-实验组平均瘤重)/ 0 Gy组平均瘤重×100%
6.标本采集和处理:照射后28 d处死小鼠,收集小鼠全血,室温放置30 min,14 000 r/min,离心半径10 cm,离心15 min,得到血浆。剥离肿瘤组织进行称重、测量直径。将组织块分为3份,一份放入10%中性甲醛中在室温下固定24 h,另两份迅速冻存于-80℃进行后续指标检测。
7. 苏木精-伊红染色(HE染色):组织切片置于65℃恒温箱中烘烤2 h;二甲苯浸泡10 min,更换后再浸泡10 min,无水乙醇Ⅰ、Ⅱ各5 min,95%、90%、80%、70%乙醇、蒸馏水各5 min;苏木精复染3 min,盐酸乙醇分化1~2 s。自来水中终止分化5 min。置于蒸馏水、各浓度梯度乙醇中各3 min,无水乙醇Ⅰ、Ⅱ各5 min;用0.5%伊红乙醇液对比染色1 min,将切片放入95%乙醇中洗去多余的红色,然后放入无水乙醇中5 min;二甲苯Ⅰ、Ⅱ各5 min,中性树胶封片,镜下观察。
8. ELISA检测:将收集好的血清按照TNF-α、IL-6、IL-10、TGF-β、CCL-5试剂盒操作,收集的肿瘤组织匀浆液,按照IL-4、IL-13、IFN-γ指标试剂盒操作,记录实验测定的吸光度值,以标准品浓度为x值,以吸光度为y值拟合标准曲线:y = (A - D) / [1 + (x/C)B] + D。式中,A为x趋近于无穷大或无穷小时,y的最大值;B为拐点处曲线斜率;C为曲线拐点浓度;D为x趋近于无穷大或无穷小时,y的最小值,由待测样品的吸光度值进一步计算得到样品浓度。
9. 流式细胞仪检测:取各组新鲜采集的小鼠肿瘤组织,研磨制备成单细胞悬液。离心半径10 cm,1 500 r/min,离心5 min,弃上清,加入100 μl磷酸盐缓冲液重悬细胞,随后加入5 μl F4/80-PE-Cyanine5(M0)、CD86-APC(M1)、CD163-PE-Cyanine7(M2)、CD206-PE(M2),抗体4℃避光孵育15 min;细胞洗涤2次,1 500 r/min,离心5 min,弃上清,用400 μl磷酸盐缓冲液重悬细胞,过200目筛网,2 h内上机检测。
10. 荧光定量检测:将组织在液氮中研磨成粉,取50 mg于离心管中,加1 ml TRIzol混匀,室温放置15 min。加入200 μl氯仿,颠倒混匀室温放置5 min。4℃,12 000 r/min,离心半径10 cm,离心15 min。吸取上清至新离心管中,加入等体积的异丙醇混匀,-20℃放置60 min。4℃,12 000 r/min,离心半径10 cm,离心15 min,弃上清液。加入75%乙醇洗涤,4℃ 12 000 r/min,离心15 min,弃上清液,重复一次。空管离心,吸尽液体。用RNase free的水溶解沉淀。核酸蛋白定量仪检测RNA浓度,琼脂糖电泳检测RNA完整性,RNA反转录用于后续实验。按照第一链cDNA合成反应体系配制;37℃ 15 min,60℃ 10 min,95℃ 3 min后取出。将反转录得到的cDNA置于-80℃保存,后续荧光定量检测的样本cDNA使用RNase-free Water按照1 ∶1的比例稀释进行反应。按照95℃ 3 min预变性1个循环,95℃ 10 s、60℃ 30 s,40个循环的PCR程序进行实验。
11. 蛋白免疫印迹试验检测:取50 mg组织粉末加入120 μl RIPA裂解液(已加入蛋白酶抑制剂和磷酸酶抑制剂)摇匀,冰浴放置60 min,12 000 r/min,离心半径10cm,4℃离心15 min收集上清,BCA法测定蛋白浓度。十二烷基硫酸钠聚丙烯酰胺凝胶电泳结束后,将蛋白电转到聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉室温封闭1 h。一抗按比稀释β-肌动蛋白(1 ∶1 000)、cGAS(1 ∶ 500)、STING(1∶500)4℃孵育过夜。加入适当稀释的二抗,室温孵育1 h。将显色液A液和B液混合,加2 ml至膜上,用ChemiScope mini化学发光仪检测、拍照。
12. 统计学处理:运用SPSS 19.0软件进行统计学分析,Kolmogorov-Smirnov检验数据正态性、levene检验数据方差齐性。数据用x±s表示,符合正态分布和方差齐性的数据,组间比较采用单因素方差分析,LSD法进行两两比较。P<0.05为差异具有统计学意义。
结果1. X射线照射对肿瘤生长及坏死的影响:随着照射剂量的增加,照射区域脱毛和色素沉着逐渐加重,皮肤无破溃,各组小鼠体重变化不明显(P>0.05)。肿瘤体积随着照射剂量增加明显缩小,在照后26 d,照射组肿瘤平均体积与0 Gy组相比, 差异有统计学意义(F=8.42,P<0.05,图 1)。各组肿瘤重量分别为1.10、0.98、0.93、0.84 g,通过计算可知4、8、12 Gy组抑瘤率分别为11.66%、16.15%和24.24%。
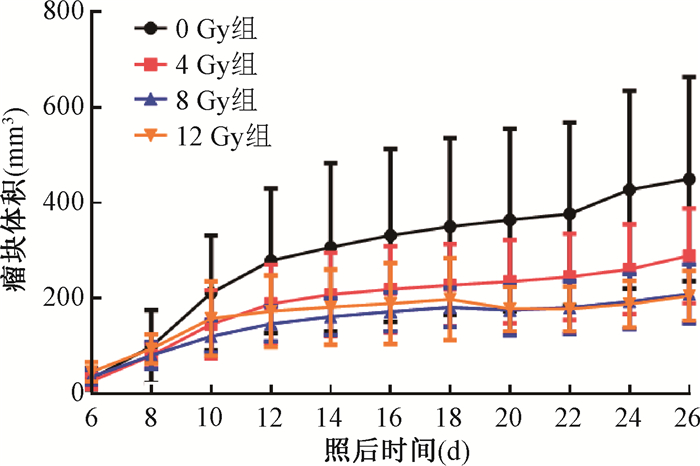
|
图 1 不同剂量照射后不同时间肿瘤体积变化 Figure 1 Changes in tumor volume at different times after different doses of irradiation |
各组瘤细胞形态及排列方式差异不明显(图 2),0、4、8、12 Gy组的坏死比例分别为52.30%、54.50%、70.04%和72.14%,与0 Gy组相比,8 Gy组和12 Gy组的坏死比例差异有统计学意义(P<0.05),与4 Gy组相比,8 Gy组和12 Gy组的坏死比例差异有统计学意义(P<0.05)。
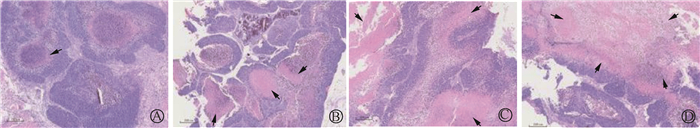
|
注:箭头表示细胞坏死区域 图 2 不同照射剂量组肿瘤组织观察×40 A.0 Gy;B.4 Gy;C.8 Gy;D.12 Gy Figure 2 HE staining observation of tumor tissues in different irradiation dose groups ×40 A.0 Gy Group; B.4 Gy Group; C.8 Gy Group; D.12 Gy Group |
2. X射线对巨噬细胞相关细胞因子的影响:检测不同剂量X射线照射后荷瘤小鼠血清中M1型巨噬细胞相关细胞因子(TNF-α、IFN-γ、IL-4、IL-6、CCL5)和M2型巨噬细胞相关细胞因子(IL-10、IL-13、TGF-β)的变化。与0 Gy组相比,4、8、12 Gy组的TNF-α、IFN-γ、IL-6、CCL5、IL-10、IL-13、TGF-β含量明显升高,差异有统计学意义(P<0.05,表 1)。表明X射线照射可引起肝癌肿瘤免疫微环境中巨噬细胞相关的细胞因子发生变化,但不同的照射剂量之间差异无统计学意义(P>0.05)。
|
|
表 1 不同剂量照射后血清中巨噬细胞相关细胞因子含量(pg/ml,x±s) Table 1 Macrophage-associated cytokines in serum after different doses of irradiation(pg/ml, x±s) |
3. X射线对M1/M2型巨噬细胞比例的影响:M1(CD86+)/M2(CD206+)在各组之间差异无统计学意义(P>0.05);而M1(CD86+)/M2(CD163+)随照射剂量升高而升高,差异有统计学意义(F=5.46,P<0.05),12 Gy组与0、4、8 Gy组相比差异有统计学意义(P<0.05);M1(CD86+)/M2(CD206+CD163+)随照射剂量升高也呈升高趋势,差异有统计学意义(F=5.14,P<0.05),12 Gy组与0、4、8 Gy组相比差异有统计学意义(P<0.05,表 2)。以上证明X射线对肝癌肿瘤免疫微环境中的巨噬细胞不同表型之间的比例有影响,高照射剂量对巨噬细胞不同表型之间比例的影响更大,说明X射线会导致以M1/M2巨噬细胞比例变化为主的肿瘤免疫微环境重塑。
|
|
表 2 不同剂量照射后组织中M1、M2型巨噬细胞比例(x±s) Table 2 Proportion of M1 and M2 type macrophages in tissues after different doses of irradiation(x±s) |
4. X射线通过cGAS-STING信号通路影响肝癌肿瘤免疫微环境:与0 Gy组比较,照射组细胞中cGAS和STING基因表达水平升高(P<0.05);与4 Gy组比较,8 Gy组的STING基因表达水平差异有统计学意义(P<0.05,图 3)。照射提高了cGAS-STING通路的蛋白表达水平,并且随着照射剂量升高,其表达水平也升高(P<0.05,图 4)。上述观察到的结果与照射剂量对巨噬细胞相关细胞因子和M1/M2比例的变化趋势基本一致。
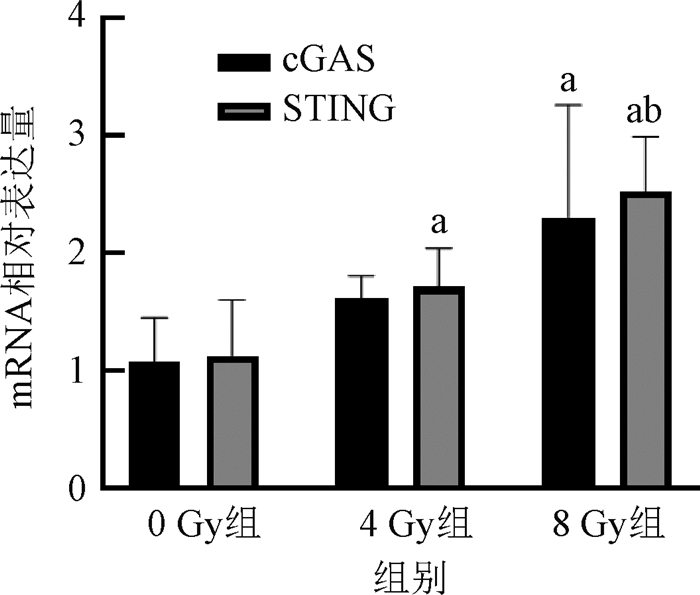
|
注:a与0 Gy组比较,P < 0.05;b与4 Gy组比较,P < 0.05 图 3 不同照射剂量组同一mRNA表达水平 Figure 3 Expression level of the same mRNA in different irradiation dose groups |
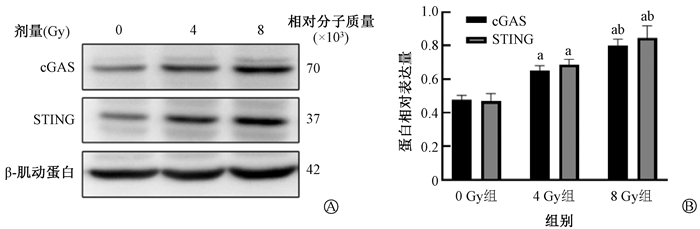
|
注:a与0 Gy组比较,P < 0.05;b与4 Gy组比较,P < 0.05 图 4 不同照射剂量组组织中同一蛋白表达水平 A. Western blot;B. 蛋白表达水平柱状图 Figure 4 Expression level of the same protein in tissues of different irradiation dose groups A. Western blot; B. Histogram of the expression levels of each protein |
讨论
肝癌是威胁我国人民健康的一大杀手,死亡率约为23.7/10万。放射治疗是重要的治疗手段之一[5-6]。放射治疗通过诱导DNA损伤,导致细胞凋亡、坏死或细胞有丝分裂停滞,达到治疗效果[7-8]。近期研究表明,放射治疗对免疫系统也有调节作用[9-10],杀伤肿瘤细胞时,释放活性物质,刺激免疫系统[11],影响近处或远隔部位肿瘤细胞[12]。但照射引起的肿瘤微环境变化对肿瘤生长的影响以及相关免疫学机制,尚不清楚。
巨噬细胞是肝癌肿瘤免疫微环境中的重要成分[13],在不同的环境中可极化为促炎抗肿瘤的M1型或抗炎促肿瘤的M2型[14]。M1型巨噬细胞可被脂多糖和IFN-γ激活,M2型可被IL-4、IL-13、IL-10、TGF-β和巨噬细胞集落刺激因子(M-CSF)诱导[15]。本研究发现不同剂量X射线照射肝癌细胞后,肿瘤微环境中巨噬细胞相关细胞因子TNF-α、IL-6、IL-10、TGF-β、CCL5、IL-13、IFN-γ与0 Gy组相比均有明显的增加;除M1(CD86+)/M2(CD206+)比例在0 Gy组和照射组中没有差别之外,其他细胞群M1/M2比例随着照射剂量逐渐升高。上述结果表明X射线重塑了肝癌的肿瘤微环境,这可能是导致肝癌放射治疗抵抗的原因之一。有研究报道,M2型巨噬细胞可促进血管生成,而放射治疗对M2型巨噬细胞极化有促进作用,这为肿瘤的生长发展创造了一个适宜的环境[16]。Ren等[17]报道了放疗在宫颈癌中促进巨噬细胞M1型即促炎表型的极化,从而介导抗肿瘤免疫效应。因此,计划下一步从放射治疗对巨噬细胞不同表型标志物,如M2型TAMs的标志物精氨酸酶1(Arg1),M1型TAMs的标志物诱导型NO合酶(iNOS)的影响着手,对X射线导致巨噬细胞不同表型的具体变化进行更深入的研究。
cGAS作为一种DNA传感器,识别并结合dsDNA生成环状GMP-AMP(cGAMP),cGAMP作为第二信使,触发下游途径引发免疫反应[18],其中大部分是由干扰素基因刺激因子(STING)通路介导的[18-19]。X射线致DNA损伤是其能够治疗恶性肿瘤的基础,由此推测,该通路与肝癌放射治疗中巨噬细胞环境依赖性极化过程有关。本研究发现,X射线对肝癌组织中该信号通路有激活作用,且激活程度随X射线剂量的增加而增加。研究报道,在肝癌的放射治疗中,激活的cGAS-STING信号通路使免疫检查点PD-L1的表达上调,促进肝癌的免疫逃避[20]。Li等[21]在胰腺癌研究中也发现,cGAS-STING通路参与了肿瘤免疫微环境中巨噬细胞的极化,M2型巨噬细胞的标志物表达增加,敲除该通路上游分子后M2型标志物表达下降。据此推断,肝癌中放射治疗可能通过cGAS-STING信号通路影响不同表型巨噬细胞在肿瘤免疫微环境中的招募和聚集,从而影响肿瘤发生发展。
本研究表明,不同剂量X射线照射会导致M1/M2型巨噬细胞比例增加,并从基因和蛋白水平证实X射线照射会激活cGAS-STING信号通路。但影响巨噬细胞的cGAS-STING通路的下游信号分子,以及巨噬细胞两种表型的具体变化情况,有待于进一步探索。
利益冲突 无
作者贡献声明 许明燕负责实验操作和论文撰写;陈娴负责数据分析和部分实验操作;张华、伊力亚尔·努尔如拉参与课题设计;肖蕾负责课题设计、指导论文修改
| [1] |
McLaughlin M, Patin EC, Pedersen M, et al. Inflammatory microenvironment remodelling by tumour cells after radiotherapy[J]. Nat Rev Cancer, 2020, 20(4): 203-217. DOI:10.1038/s41568-020-0246-1 |
| [2] |
Zhao X, Wang B, Zhuang Y, et al. Single high-dose irradiation-induced irhom2 upregulation promotes macrophage antitumor activity through cGAS/STING signaling[J]. Int J Radiat Oncol Biol Phys, 2023, 116(5): 1150-1162. DOI:10.1016/j.ijrobp.2023.02.013 |
| [3] |
Du M, Chen ZJ. DNA-induced liquid phase condensation of cGAS activates innate immune signaling[J]. Science, 2018, 361(6403): 704-709. DOI:10.1126/science.aat1022 |
| [4] |
Li J, Xie Y, Wang X, et al. Prognostic impact of tumor-associated macrophage infiltration in esophageal cancer: a meta-analysis[J]. Future Oncol, 2019, 15(19): 2303-2317. DOI:10.2217/fon-2018-0669 |
| [5] |
安澜, 曾红梅, 郑荣寿, 等. 2015年中国肝癌流行情况分析[J]. 中华肿瘤杂志, 2019, 41(10): 721-727. An L, Zeng HM, Zheng RS, et al. Liver cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(10): 721-727. DOI:10.3760/cma.j.issn.0253-3766.2019.10.001 |
| [6] |
Shanker MD, Liu HY, Lee YY, et al. Stereotactic radiotherapy for hepatocellular carcinoma: Expanding the multidisciplinary armamentarium[J]. J Gastroenterol Hepatol, 2021, 36(4): 873-884. DOI:10.1111/jgh.15175 |
| [7] |
Barnes RP, Fouquerel E, Opresko PL. The impact of oxidative DNA damage and stress on telomere homeostasis[J]. Mech Ageing Dev, 2019, 177: 37-45. DOI:10.1016/j.mad.2018.03.013 |
| [8] |
Zimmer C, Fabre E. Chromatin mobility upon DNA damage: state of the art and remaining questions[J]. Curr Genet, 2019, 65(1): 1-9. DOI:10.1007/s00294-018-0852-6 |
| [9] |
Appleton E, Hassan J, Chan Wah Hak C, et al. Kickstarting immunity in cold tumours: Localised tumour therapy combinations with immune checkpoint blockade[J]. Front Immunol, 2021, 12: 754436. DOI:10.3389/fimmu.2021.754436 |
| [10] |
Moon EJ, Petersson K, Olcina MM. The importance of hypoxia in radiotherapy for the immune response, metastatic potential and FLASH-RT[J]. Int J Radiat Biol, 2022, 98(3): 439-451. DOI:10.1080/09553002.2021.1988178 |
| [11] |
Ngwa W, Irabor OC, Schoenfeld JD, et al. Using immunotherapy to boost the abscopal effect[J]. Nat Rev Cancer, 2018, 18(5): 313-322. DOI:10.1038/nrc.2018.6 |
| [12] |
Yao D, Zhang JL, Zheng W, et al. Effects of fractionated irradiation on splenic immune cells in mice transplanted with hepatocellular carcinoma[J]. Chin J Radiol Med Prot, 2020, 40(2): 82-87. DOI:10.3760/cma.j.issn.0254-5098.2020.02.002 |
| [13] |
Valenza C, Taurelli Salimbeni B, Santoro C, et al. Tumor infiltrating lymphocytes across breast cancer subtypes: Current issues for biomarker assessment[J]. Cancers (Basel), 2023, 15(3): 767. DOI:10.3390/cancers15030767 |
| [14] |
He K, Barsoumian HB, Puebla-Osorio N, et al. Inhibition of stat6 with antisense oligonucleotides enhances the systemic antitumor effects of radiotherapy and anti-pd-1 in metastatic non-small cell lung cancer[J]. Cancer Immunol Res, 2023, 11(4): 486-500. DOI:10.1158/2326-6066.CIR-22-0547 |
| [15] |
Jeannin P, Paolini L, Adam C, et al. The roles of CSFs on the functional polarization of tumor-associated macrophages[J]. FEBS J, 2018, 285(4): 680-699. DOI:10.1111/febs.14343 |
| [16] |
Stockmann C, Doedens A, Weidemann A, et al. Deletion of vascular endothelial growth factor in myeloid cells accelerates tumorigenesis[J]. Nature, 2008, 456(7223): 814-818. DOI:10.1038/nature07445 |
| [17] |
Ren J, Li L, Yu B, et al. Extracellular vesicles mediated proinflammatory macrophage phenotype induced by radiotherapy in cervical cancer[J]. BMC Cancer, 2022, 22(1): 88. DOI:10.1186/s12885-022-09194-z |
| [18] |
Du JM, Qian MJ, Yuan T, et al. cGAS and cancer therapy: a double-edged sword[J]. Acta Pharmacol Sin, 2022, 43(9): 2202-2211. DOI:10.1038/s41401-021-00839-6 |
| [19] |
Ablasser A, Hur S. Regulation of cGAS- and RLR-mediated immunity to nucleic acids[J]. Nat Immunol, 2020, 21(1): 17-29. DOI:10.1038/s41590-019-0556-1 |
| [20] |
Du SS, Chen GW, Yang P, et al. Radiation therapy promotes hepatocellular carcinoma immune cloaking via pd-l1 upregulation induced by cGAS-STING activation[J]. Int J Radiat Oncol Biol Phys, 2022, 112(5): 1243-1255. DOI:10.1016/j.ijrobp.2021.12.162 |
| [21] |
Li H, Zhu R, Liu X, et al. Siglec-15 regulates the inflammatory response and polarization of tumor-associated macrophages in pancreatic cancer by inhibiting the cGAS-STING signaling pathway[J]. Oxid Med Cell Longev, 2022, 2022: 3341038. DOI:10.1155/2022/3341038 |
 2024, Vol. 44
2024, Vol. 44


