2. 北京协和医院放射治疗科, 北京 100730
2. Department of Peking Union Medical College Hospital, Beijing 100730, China
Flash放疗使用超高剂量率束流照射,相比常规剂量率放疗具有独特的放射生物学效应,能够降低正常组织损伤,同时保有相当的肿瘤控制率,即Flash效应[1]。目前相关实验表明,触发Flash效应的束流平均剂量率达40 Gy/s,脉冲内瞬时剂量率则高达103~105 Gy/s,较常规剂量率照射高出几个数量级[2],这给剂量测量提出了巨大挑战[3]。气体电离室在超高脉冲剂量束流条件下表现不佳,随着剂量率的增大,会产生严重的离子复合效应[4-6],在0.1~1 Gy/pulse范围内电荷收集效率明显下降,且目前仍缺乏被广泛接受的离子复合修正模型[7]。辐射显色胶片是目前使用最多的Flash剂量测量方式[8],其剂量响应与剂量率无关,但由于辐射显色反应具有滞后性且随时间呈非线性变化,难以实现实时剂量测量[9-10],丙氨酸剂量计[11]、切伦科夫辐射成像[12-13]、热释光剂量计[14]等方法也存在不稳定、不确定度大等问题。
目前,清华大学工程物理系加速器实验室已经实现了电子和X射线超高剂量率束流加速器原型样机。本研究设计了一款金刚石探测器,在该平台上分别验证了电子和X射线Flash照射下的剂量和剂量率线性响应表现,验证了金刚石探测器用于Flash束流剂量测量的可行性。
材料与方法1. 探测器设计与实时剂量测量原理:本研究采用CIVIDECTM公司的化学气相沉积(chemical Vapor Deposition,CVD)金刚石探头B1HV,探测器金刚石灵敏体积为4.5 mm × 4.5 mm × 0.14 mm,采用金作为电极材料,探测器电容为3 pF,标准偏压为400 V,最大辐射耐受剂量1 MGy[15]。人工单晶金刚石探测器具有响应速度快、抗辐照能力强、噪声小、漏电流低、线性电流大、组织等效性好、受环境影响小等优势,且载流子在金刚石内的迁移率非常高,不易饱和,CVD金刚石的载流子迁移率可以达到4 500 cm2/(V·s),远高于硅和砷化镓等其他半导体材料,可以有效避免超高剂量率造成的离子复合效应[16]。然而,探测器的电子学系统大多是针对常规剂量率照射模式,对探测器信号进一步放大,而超高剂量率束流产生的脉冲电流数倍高于常规剂量率,继续使用常规剂量率束流监测的电子学系统可能会导致电子学饱和。因此,为了能够对金刚石探测器输出的瞬时超大电流进行测量,保证输出总电荷量不变,本研究对后端电子学模块进行特殊设计,优化输出电流信号的采集过程。
探测器几何结构及输出信号电路如图 1所示。首先采用由电容(0.1 μF)和电阻(5 MΩ)构成的预积分电路对电流进行滤波处理,探测器收集到的电荷先存储到电容中,再缓慢释放,从而在维持输出电荷不变的情况下降低了脉冲电流;随后利用一个电流灵敏前置放大器来放大信号,数模转换器(ADC)测量反馈电阻两端的电压,并使用kHz频率的采样器进行采样,从而实现脉冲电流的实时测量。对所得脉冲电流(I)进行积分,获得探测器接受电离辐射而产生的电荷量(Q),当探测器处于线性工作状态时,积分电荷与脉冲辐射在金刚石灵敏体积内的沉积剂量(D)成正比,即Q∝D,对探测器进行剂量标定获得比例系数,即可通过输出积分电荷量(Q)获得金刚石灵敏体积处的沉积剂量(D)。
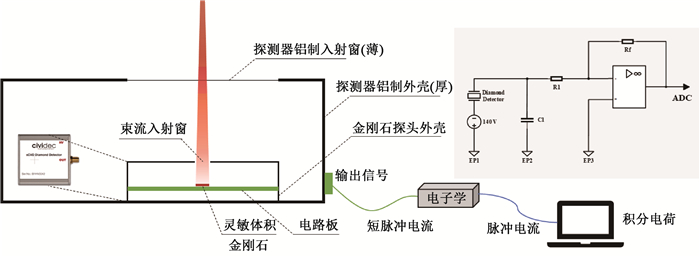
|
图 1 金刚石探测器几何结构及输出信号示意图 Figure 1 Geometry and output electronic set-up of the diamond detector |
2. Flash超高剂量率线性响应测试:为了验证该金刚石探测器用于Flash照射剂量测量的可行性,本研究分别在电子和X射线束流照射下用金刚石探测器进行超高剂量率线性响应实验。
(1) 电子Flash照射剂量响应测试:在清华大学工程物理系加速器实验中心开展电子束Flash照射实验,分别测试了探测器的脉冲剂量响应和不同水平平均剂量率下的剂量响应。束流发生装置采用本系加速器实验室自主研发的S波段加速管,脉冲流强为110 mA,加速后获得6 MeV超高剂量率电子束,脉冲重复频率为300 Hz,脉冲宽度为4 μs,在距出射窗90 cm处单位脉冲剂量率达到0.133 Gy/pulse,平均剂量率为40 Gy/s,脉冲内剂量率达33.3 MGy/s,达到Shüller等[17]对超高剂量率束流的定义(> 0.01 Gy/pulse),通过改变灵敏体积距离出射窗的位置,改变单位脉冲剂量,验证其在超高剂量率下的线性响应能力。
进一步测试金刚石探测器在超高平均剂量率和常规平均剂量率下的剂量响应,由于加速器平台调整,脉冲流强调整为54 mA,电子能量仍为6 MeV,脉冲宽度为3.8 μA。超高平均剂量率模式下金刚石表面距离电子出射窗SSD的距离为56 cm,脉冲剂量率达到1.6 Gy/pulse,脉冲重复频率为250 Hz,平均剂量率达到400 Gy/s,对于常规平均剂量率模式,SSD调整至100 cm,脉冲剂量降为0.3 Gy/pulse,脉冲重复频率调整为1 Hz,平均剂量率可降至0.3 Gy/s。在0 ~ 20 Gy范围内测试金刚石探测器的剂量响应线性情况,如图 2所示。

|
图 2 电子Flash束流剂量测量装置示意图 Figure 2 Illustration of dose calculation set-up for electron Flash radiation |
紧贴着金刚石探测器表面放置临床常用的Gafchromic EBT3胶片作为剂量的参考值,建立金刚石脉冲输出电荷量与胶片剂量的关系,若呈线性相关,则认为金刚石探测器在该脉冲剂量范围内未达到饱和,可以正常工作。在北京大学肿瘤医院放射治疗科(Varian C series)对EBT3胶片进行0~20 Gy的剂量标定,标定剂量间隔为2 Gy,采用光密度改变值(netOD)建立红色通道照射24 h后的剂量响应曲线[18]。
(2) X射线Flash照射剂量响应测试:在清华大学工程物理系和同方威视技术股份有限公司共同开发的X射线超高剂量率实验平台[19]开展光子Flash照射剂量测量实验。该实验平台由回形波电子直线加速器产生电子束,脉冲电流为300 mA,10 MeV电子轰击钨靶产生MV级X射线,脉冲重复频率为700 Hz,脉冲宽度为13 μs,在距离转换靶40 cm处单位脉冲剂量率达到0.1 Gy/pulse,平均剂量率为75.5 Gy/s,脉冲内瞬时剂量率达76.9 MGy/s。通过调整脉冲重复频率可以获得不同水平的平均剂量率,当频率降低至5 Hz时,平均剂量率可降至0.54 Gy/s。在该平台上开展常规和超高平均剂量率下金刚石探测器剂量线性响应测试。
如图 3所示,在等中心距转换靶100 cm处放置PTW UNIDOS气体电离室作为相对剂量参考,由于距离靶较远,此处的剂量率已跌至较低水平,电离室响应仍处于线性范围。若金刚石探测器输出电荷量与电离室输出照射量呈线性相关,可认为此时金刚石探测器亦未达到饱和状态。
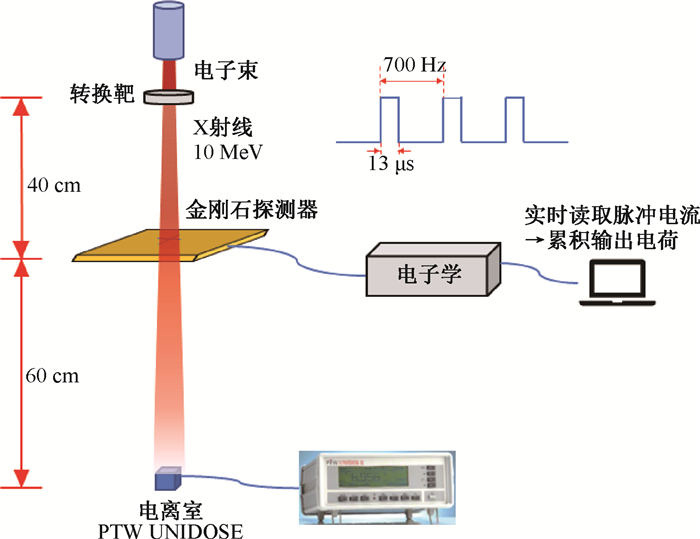
|
图 3 X射线Flash束流剂量测量装置示意图 Figure 3 Illustration of dose measurement set-up for X-ray Flash radiation |
3. 剂量标定:在测试了金刚石探测器超高剂量率线性响应后,为进一步实现实时剂量测量,使用医用加速器对金刚石探测器进行剂量(率)标定,得到金刚石输出信号与灵敏体积沉积剂量(率)之间的关系,即:
| $ D =k_1 Q $ | (1) |
| $ \begin{aligned} \dot{D} =k_2 I \end{aligned} $ | (2) |
式中,k1为积分电荷-剂量转换系数(Gy/μC),k2为脉冲电流-剂量率转换系数(μA·Gy·s-1)。剂量标定在北京协和医院放射治疗科完成,具体标定步骤如下:
(1) 加速器校准:使用美国瓦里安TrueBeam加速器,根据放射治疗科常规流程进行剂量校准。
(2) 获得加速器执行照射条件:使用CT模拟定位机扫描探测器和剂量建成板,将CT图像导入计划系统,计算测量点(金刚石灵敏体积处)剂量,得到加速器的执行照射条件,即测量点剂量(Gy)与加速器输出机器跳数(MU)之间的关系,测量点沉积剂量1 Gy对应的加速器输出机器跳数为112.3 MU。
(3) 实施照射并记录探测器输出电荷:按照治疗计划放置金刚石和剂量建成板(图 4)。分别针对剂量标定和剂量率标定进行多剂量、剂量率点照射。保持剂量率不变,改变机器跳数(MU),分别实施1、2、4、8、12和16 Gy共6个剂量点照射;保持机器总MU不变,即总剂量不变,改变剂量率,实施100、200、300、400和600 MU/min共5个剂量率点照射。实时读取探测器输出脉冲电流,积分后获得输出总电荷。
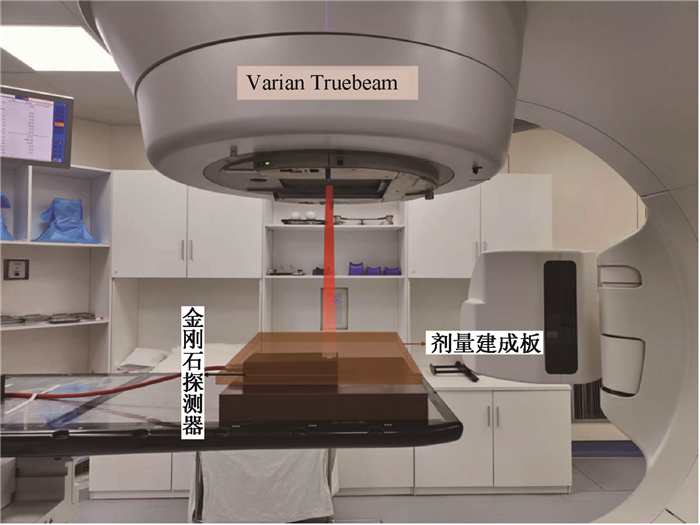
|
图 4 金刚石探测器剂量标定示意图 Figure 4 Illustration of dose calibration for the diamond detector |
(4) 对实验数据进行线性拟合,获得转换系数:根据实验数据,建立探测器输出电荷与对应剂量点的线性关系,获得k1;建立探测器脉冲电流与对应剂量率点的线性关系,获得k2。
结果1. 电子束Flash照射剂量响应结果:通过改变SSD,在0.08 ~ 0.50 Gy/pulse范围内改变电子束单位脉冲剂量,金刚石探测器单位脉冲累计输出电荷量和胶片剂量的拟合结果如图 5所示,二者线性相关系数平方(R2)为0.998 1,呈现较强的线性相关性,同时考虑到EBT3胶片测量剂量本身具有一定不确定度(~5%)[20],拟合结果和实验值的偏差基本在该误差范围内,因此可以认为金刚石探测器在该剂量率范围内具备较好的线性响应能力。
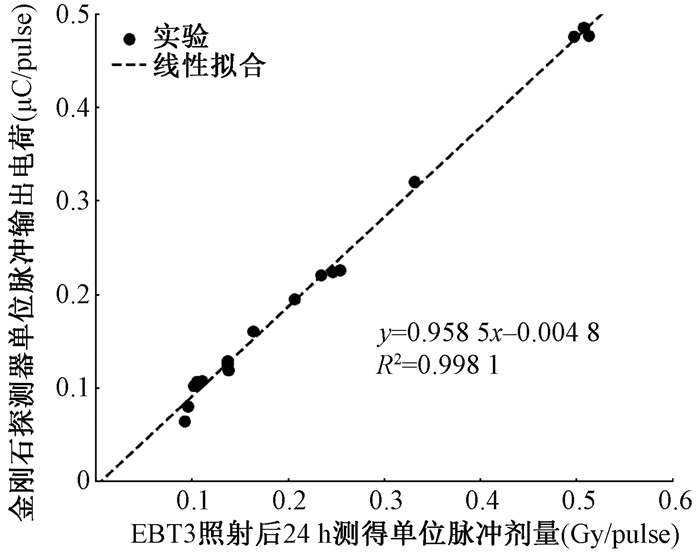
|
图 5 电子束超高剂量率照射下金刚石探测器剂量率线性响应 Figure 5 Dose rate linear response of the diamond detector under electron Flash radiation |
在0~20 Gy范围内,分别测量超高平均剂量率和常规平均剂量率模式下金刚石探测器剂量响应,探测器输出电荷量和胶片剂量的线性拟合结果如图 6所示,线性相关平方系数(R2)分别为0.999 7和0.997 8,认为金刚石探测器在电子束不同平均剂量率下(0.3 ~ 400 Gy/s)均保持良好的剂量线性响应。两种剂量率模式下的剂量响应系数有所差异,主要是由两种模式下SSD的差异导致。
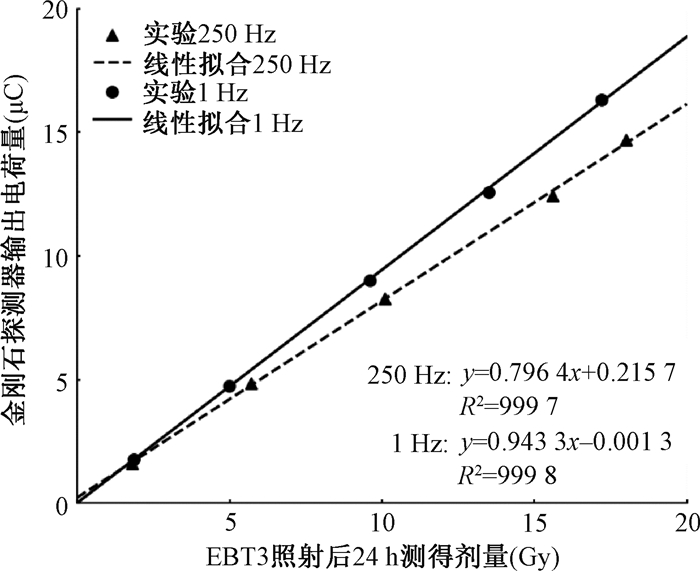
|
图 6 电子束超高脉冲剂量率、超高平均剂量率模式(250 Hz, A)和超高脉冲剂量率、常规平均剂量率模式(1 Hz, B)照射下金刚石探测器剂量线性响应 Figure 6 Dose linear response of the diamond detector under electron Flash radiation with UHDR per pulse and average (250 Hz, A) and UHDR per pulse and CONV average dose rate (1 Hz, B) |
2. X射线Flash照射剂量响应结果:保持单位脉冲剂量不变,通过调整脉冲频率改变束流平均剂量率,分别在700和5 Hz对应的剂量率模式下改变脉冲数,进行剂量响应测试,金刚石探测器输出电荷量与电离室照射量的线性,拟合结果如图 7所示,两种剂量率模式下电离室输出电荷量和金刚石输出电荷量均严格线性相关(R2=1),表明金刚石探测器在X射线超高脉冲剂量(0.1 Gy/pulse) 照射下仍保持良好的剂量线性响应,且在常规(0.54 Gy/s)和超高(75.5 Gy/s)的平均剂量率下保持一致。
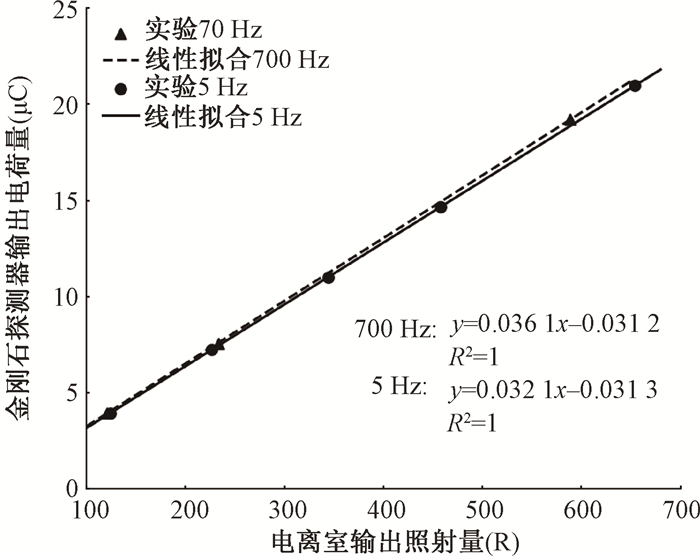
|
图 7 MV级X射线在超高脉冲剂量率、700 Hz超高平均剂量率模式(A)和超高脉冲剂量率、5 Hz常规平均剂量率模式(B)照射下金刚石探测器剂量线性响应 Figure 7 Dose linear response of the diamond detector under X-ray (MV) Flash radiation with UHDR per pulse and average (700 Hz, A) and UHDR per pulse and CONV average dose rate (5 Hz, B) |
3. 剂量标定线性转换系数:金刚石探测器的剂量和剂量率标定结果如图 8所示,得到积分电荷-剂量系数k1为0.751 7 μC/Gy,脉冲电流-剂量率系数k2为0.753 5 μA·Gy·s-1。刻度剂量范围为1~16 Gy,覆盖了大部分临床照射剂量区间,且k1与k2基本一致,显示出在常规剂量率下金刚石探测器剂量和剂量率响应的一致性。
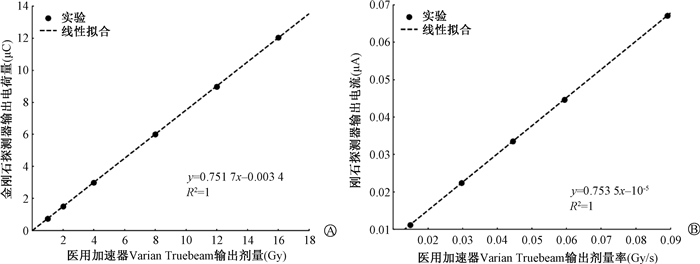
|
图 8 金刚石探测器的剂量(A)和剂量率(B)标定曲线 Figure 8 Dose(A) and dose rate(B) calibration curves for the diamond detector |
讨论
金刚石探测器剂量率线性响应范围广,极有潜力应用于Flash放疗剂量测量。目前金刚石探测器已经被用于高剂量率术中放疗(0.026~0.105 Gy/pulse)剂量测量[21],以及超短超强激光加速辐射场(脉冲内瞬时剂量率达107 Gy/s)剂量测量[22],近年来也有相关研究探究其用于Flash超高剂量率束流剂量测量的可行性[23-25]。2022年Kranzer等[23]测试了商用人工单晶金刚石探测器PTW microDiamond T60019在超高剂量率束流下的剂量率线性表现,单位脉冲剂量阈值存在不确定性,在0.15 Gy/pulse以上的剂量率下探测器出现饱和现象,尚不能直接用于Flash照射剂量测量。同年,意大利罗马大学Marinelli等[24]设计了一款新的金刚石探测器,并在电子超高剂量率束流下测试了其剂量特性,结果表明其在11.9 Gy/pulse剂量率下仍能保持良好的线性响应[25],在此基础上,PTW推出了针对Flash剂量测量的剂量计PTW flashDiamond T60025[26],还需要更多实验测试其在不同类型Flash束流剂量测量上的可靠性。
本研究在不同射线类型下对人工单晶金刚石探测器CIVIDECTM B1HV进行超高剂量率剂量响应测试,其中电子束照射下使用贴在金刚石探测器表面的胶片剂量计作为剂量绝对参考,X射线照射下使用电离室作为剂量相对参考(电离室因放置较远处而未达饱和状态),将剂量参考值与金刚石探测器输出信号(累积脉冲电荷量)进行线性拟合,结果显示金刚石探测器在电子束脉冲剂量响应和X射线总剂量响应梯度测试中均呈现出良好的线性响应。受限于实验平台尚处于研发状态,未能在电子束和X射线束流平台实施统一的剂量(率)响应测试,但由于测试中均使用较高脉冲剂量(≥ 0.08 Gy/pulse)束流,在1.6 Gy/pulse电子束照射下仍能保持良好的剂量线性响应,目前的测试结果在一定程度上反映了该金刚石探测器在短时间大剂量Flash束流照射下具有较好的剂量(率)线性响应能力,考虑到一些Flash效应相关动物实验研究发现40 Gy/s可能并非Flash效应剂量率阈值,可能需要更高的剂量率才能触发Flash效应[27],因此Flash剂量测量方案需要满足更大的剂量率线性响应范围,后续还需要进一步测试该金刚石探测器的剂量率线性响应阈值。
由于金刚石探测器输出电荷量在未达饱和状态时具有剂量率无关性,即“电荷-剂量”转换系数在不同剂量率照射下保持一致,医用放疗加速器虽然仅能进行常规剂量率照射,但能够提供经过标准场校准的剂量监测系统,而超高剂量率束流发生设备难以获得相同的校准条件,因此,本研究选择在常规剂量率照射条件下对金刚石探测器进行剂量标定,获得实用剂量转换系数,该系数可用于超高剂量率照射条件,作为金刚石探测器的剂量测量实用量。
本研究的金刚石探测器仅作为实验探究的原型样机,灵敏体积小,尚不具备空间分辨率,仅能用于单点剂量测量,难以获得二维剂量分布。金刚石探测器的设计与制备还存在较大的改进空间,小型化、轻便化的金刚石探测器也是未来的发展方向。
Flash效应显示出巨大的放射生物学优势,但目前对于引发Flash效应的关键束流条件,如脉冲剂量率、平均剂量率、总剂量等,还有待进一步实验探究,罗马大学相关研究[24-25]和本研究均表明金刚石探测器可实现从常规剂量率到超高剂量率的超宽脉冲剂量范围束流剂量测量,有潜力为Flash预临床实验提供精确剂量测量保障;同时Flash照射能大大缩短治疗时间,在呼吸门控方面具有显著优势,但对实施剂量的准确性提出了更高的要求,目前常规医用电离室难以满足该需求,金刚石探测器或能成为Flash放疗剂量监测系统中的重要一环。
利益冲突 无
作者贡献声明 周婉仪负责实验操作、数据处理和论文撰写;宫辉负责金刚石探测器制备;邱睿指导论文选题和修改论文;胡安康负责实验设计和实验操作;李君利、张辉负责论文修改;于浪、王伟平负责剂量标定实验
| [1] |
Favaudon V, Caplier L, Monceau V, et al. Ultrahigh dose-rate FLASH irradiation increases the differential response between normal and tumor tissue in mice[J]. Sci Transl Med, 2014, 6(245): 93. DOI:10.1126/scitranslmed.3008973 |
| [2] |
Kacem H, Almeida A, Cherbuin N, et al. Understanding the FLASH effect to unravel the potential of ultra-high dose rate irradiation[J]. Int J Radiat Biol, 2022, 98(3): 506-516. DOI:10.1080/09553002.2021.2004328 |
| [3] |
Vignati A, Giordanengo S, Fausti F, et al. Beam monitors for tomorrow: The challenges of electron and photon FLASH RT[J]. Front Phys, 2020, 8: 375. DOI:10.3389/fphy.2020.00375 |
| [4] |
Gómez F, Gonzalez-Castaño DM, Fernández NG, et al. Development of an ultra-thin parallel plate ionization chamber for dosimetry in FLASH radiotherapy[J]. Med Phys, 2022, 49(7): 4705-4714. DOI:10.1002/mp.15668 |
| [5] |
McManus M, Romano F, Lee ND, et al. The challenge of ionisation chamber dosimetry in ultra-short pulsed high dose-rate very high energy electron beams[J]. Sci Rep, 2020, 10(1): 9089. DOI:10.1038/s41598-020-65819-y |
| [6] |
Poppinga D, Kranzer R, Farabolini W, et al. VHEE beam dosimetry at CERN linear electron accelerator for research under ultra-high dose rate conditions[J]. Biomed Phys Eng Express, 2020, 7(1): 015012. DOI:10.1088/2057-1976/abcae5 |
| [7] |
Petersson K, Jaccard M, Germond JF, et al. High dose-per-pulse electron beam dosimetry - A model to correct for the ion recombination in the advanced markus ionization chamber[J]. Med Phys, 2017, 44(3): 1157-1167. DOI:10.1002/mp.12111 |
| [8] |
Szpala S, Huang V, Zhao Y, et al. Dosimetry with a clinical linac adapted to FLASH electron beams[J]. J Appl Clin Med Phys, 2021, 22(6): 50-59. DOI:10.1002/acm2.13270 |
| [9] |
Jaccard M, Petersson K, Buchillier T, et al. High dose-per-pulse electron beam dosimetry: Usability and dose-rate independence of EBT3 Gafchromic films[J]. Med Phys, 2017, 44(2): 725-735. DOI:10.1002/mp.12066 |
| [10] |
Karsch L, Beyreuther E, Burris-Mog T, et al. Dose rate dependence for different dosimeters and detectors: TLD, OSL, EBT films, and diamond detectors[J]. Med Phys, 2012, 39(5): 2447-2455. DOI:10.1118/1.3700400 |
| [11] |
Gondré M, Jorge PG, Vozenin MC, et al. Optimization of alanine measurements for fast and accurate dosimetry in FLASH radiation therapy[J]. Radiat Res, 2020, 194(6): 573-579. DOI:10.1667/RR15568.1 |
| [12] |
Ashraf MR, Rahman M, Zhang RX, et al. Dosimetry for FLASH radiotherapy: A review of tools and the role of radioluminescence and cherenkov emission[J]. Front Phys, 2020, 8: 328. DOI:10.3389/fphy.2020.00328 |
| [13] |
Rahman M, Ashraf MR, Zhang RX, et al. Spatial and temporal dosimetry of individual electron FLASH beam pulses using radioluminescence imaging[J]. Phys Med Biol, 2021, 66(13): 135009. DOI:10.1088/1361-6560/ac0390 |
| [14] |
Bourgouin A, Schüller A, Hackel T, et al. Calorimeter for real-time dosimetry of pulsed ultra-high dose rate electron beams[J]. Front Phys, 2020, 8: 567340. DOI:10.3389/fphy.2020.567340 |
| [15] |
Instrumentation cividec. B1-HV sCVD diamond beam loss detector[EB/OL]. [2022-10-22] https://cividec.at/index.php?module=public.product&idProduct=10&scr=0.
|
| [16] |
王兰. 电流型CVD金刚石探测器研制[D]. 北京: 清华大学, 2008. Wang L. Studies on CVD diamond detectors for pulsed radiation detection[D]. Beijing: Tsinghua University, 2008. |
| [17] |
Schüller A, Heinrich S, Fouillade C, et al. The European Joint Research Project UHDpulse - Metrology for advanced radiotherapy using particle beams with ultra-high pulse dose rates[J]. Phys Med, 2020, 80: 134-150. DOI:10.1016/j.ejmp.2020.09.020 |
| [18] |
张月美, 李光俊, 白龙, 等. 辐射显色胶片剂量仪在放射治疗中的应用进展[J]. 中国医学物理学杂志, 2018, 35: 638-642. Zhang YM, Li GJ, Bai L, et al. Implementation and development of radiochromic film dosimeter in radiotherapy[J]. Chin J Med Phys, 2018, 35: 638-642. DOI:10.3969/j.issn.1005-202X.2018.06.004 |
| [19] |
Liu F, Shi J, Zha H, et al. Development of a compact linear accelerator to generate ultrahigh dose rate high-energy X-rays for FLASH radiotherapy applications[J]. Med Phys, 2023, 50(3): 1680-1698. DOI:10.1002/mp.16199 |
| [20] |
Fiandra C, Ragona R, Ricardi U, et al. Absolute and relative dose measurements with Gafchromic EBT film for high energy electron beams with different doses per pulse[J]. Med Phys, 2008, 35(12): 5463-5470. DOI:10.1118/1.3005975 |
| [21] |
Di Venanzio C, Marinelli M, Tonnetti A, et al. Characterization of a microDiamond detector in high-dose-per-pulse electron beams for intra operative radiation therapy[J]. Phys Med, 2015, 31(8): 897-902. DOI:10.1016/j.ejmp.2015.06.008 |
| [22] |
Wei S, Gong H, Song H, et al. An active dose measurement device for ultra-short, ultra-intense laser facilities[J]. Health Phys, 2022, 122(6): 685-695. DOI:10.1097/HP.0000000000001560 |
| [23] |
Kranzer R, Schüller A, Bourgouin A, et al. Response of diamond detectors in ultra-high dose-per-pulse electron beams for dosimetry at FLASH radiotherapy[J]. Phys Med Biol, 2022, 67(7): 075002. DOI:10.1088/1361-6560/ac594e |
| [24] |
Marinelli M, Felici G, Galante F, et al. Design, realization, and characterization of a novel diamond detector prototype for FLASH radiotherapy dosimetry[J]. Med Phys, 2022, 49(3): 1902-1910. DOI:10.1002/mp.15473 |
| [25] |
Verona Rinati G, Felici G, Galante F, et al. Application of a novel diamond detector for commissioning of FLASH radiotherapy electron beams[J]. Med Phys, 2022, 49(8): 5513-5522. DOI:10.1002/mp.15782 |
| [26] |
PTW. FlashDiamond Detector T60025[EB/OL]. (2023-06-07)[2023-07-06]. https://www.ptwdosimetry.com/en/products/flashdiamond-detector/.
|
| [27] |
Borghini A, Vecoli C, Labate L, et al. FLASH ultra-high dose rates in radiotherapy: preclinical and radiobiological evidence[J]. Int J Radiat Biol, 2022, 98(2): 127-135. DOI:10.1080/09553002.2022.2009143 |
 2023, Vol. 43
2023, Vol. 43


