2. 上海联影医疗科技股份有限公司, 上海 201807
2. Shanghai United Imaging Healthcare Co., Ltd., Shanghai 201807, China
中剂量投照失误会造成严重的后果[1-2]。治疗前验证作为常用的验证手段,用来检测放疗计划在加速器上能否正确执行、加速器的运行状态是否稳定,但无法检测出患者体内的真实受量是否准确。患者的真实吸收剂量具不确定性,易受摆位误差、肿瘤体积变化、器官内运动等因素影响。因此,对患者真实吸收剂量的测量显得更为重要。基于电子射野影像装置(EPID)的在体剂量验证通过测量透体剂量并进行二维透射图像对比和三维剂量重建,可以评估患者真实吸收剂量[3-5]。但其在临床应用中的使用建议及规范较少,部分在体剂量验证结果偏低是由于未按规范化的流程进行,给在体剂量验证的临床应用带来挑战。本研究对肺癌和食管癌肿瘤放疗患者行在体剂量验证,分析在体剂量验证的影响因素,探讨其在临床治疗应用中的使用规范并建立规范化流程。
材料与方法1. 定位设备及计划系统:采用一体化固定板(瑞典Macromedics公司)和热塑膜(广州科莱瑞迪)联合对患者进行体位固定。使用Discovery大孔径CT(美国GE公司)扫描图像并将图像传输至uRT-TPOIS(ROO1)计划系统(上海联影公司)制作放疗计划和EPID在体剂量验证(以下简称In vivo EPID)计划。
2. 直线加速器以及电子射野影像装置:uRT-Linac 506c直线加速器(上海联影公司)是将6 MV X射线直线加速器和诊断级扇束CT (FBCT)集成的一款放射治疗设备。加速器机头配备60对多叶准直器,其中中心40对,叶片厚度0.5 cm,两侧20对,叶片厚度1 cm。最大射野达到40 cm × 40 cm。本设备支持静态调强放疗(sIMRT)、动态调强放疗(dIMRT)及容积旋转调强放疗(uARC)。机载EPID采用非晶硅材料,有效面积为40.96 cm × 40.96 cm,在1 × 1 binning模式下包含1 024 × 1 024像素,像素大小为0.4 mm; 在2 × 2 binning模式下包含512 × 512像素,像素大小为0.8 mm。源像距离为145 cm; 因此,等中心平面的空间分辨率为0.27 mm (1 × 1 binning)或0.55 mm (2 × 2 binning)。配备EPID在体剂量验证二维评估功能(In vivo EPID 2D)和三维重建剂量评估功能(In vivo EPID 3D)。
3. In vivo EPID 2D及In vivo EPID 3D
(1) In vivo EPID 2D:使用蒙特卡罗算法结合患者CT进行透射图像的计算。在对加速器精确建模的基础上,完成粒子抽样,结合患者CT信息,精确追踪每一个粒子。对EPID精确建模[6-7],得到不同能量电子和光子在不同入射角度下的信号响应,计算粒子在平板上沉积的“伪剂量”图像。最后通过粒子的能量点扩散函数来模拟粒子在探测器上散射和能量沉积过程,得到In vivo EPID 2D预期图像。在实际治疗过程中,治疗射线透过患者,在EPID上进行能量沉积,产生测量图像,经过平板增益校正、几何校正、坏点校正后,得到最终可用的灰度图像。将预期图像和实测图像对比,通过γ通过率判断实测图像和预期的符合程度。
(2) In vivo EPID 3D:计划执行过程中,多叶光栅和准直器开口位置、机器的实际出束强度等信息都反映到了In vivo EPID 2D测量图像上。In vivo EPID 3D重建算法模型基于治疗中采集的In vivo EPID 2D图像,重建剂量计算使用的通量图,结合患者CT信息,使用联影自研的快速蒙特卡罗剂量算法[8],计算得到患者的In vivo EPID 3D重建剂量场。
4. 患者临床应用:图 1为患者在体剂量验证工作流程。主要包括在体剂量验证及验证结果分析。
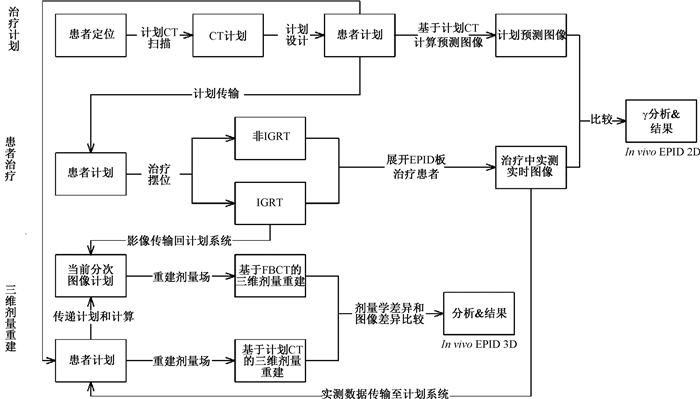
|
注:EPID.电子射野影像装置;IGRT.图像引导放疗; FBCT.诊断级扇束CT; In vivo EPID 2D.EPID在体剂量验证二维评估功能; In vivo EPID 3D.三维重建剂量评估功能 图 1 患者在体剂量验证工作流程图 Figure 1 Workflow of in vivo dose verification of patients |
(1) 患者计划及在体剂量验证计划:选取胸部肿瘤dIMRT放疗患者32例(其中肺癌患者14例,食管癌患者18例),计划设计5~7野,采用蒙特卡罗算法,计划结果符合临床要求后,创建In vivo EPID计划。所有计划进行治疗前计划验证,结果符合TG 218号报告[9]要求方可进行治疗。治疗期间患者IGRT(图像引导放疗)的频次为首次治疗及之后每周1次。每次治疗时,展开EPID板接收穿透患者后的射线,在每个治疗射野结束后,利用In vivo EPID 2D将治疗计划系统计算的预期图像和EPID收集到的实测图像进行对比,得到当前射野的2D γ通过率。
(2) 验证结果分析:设置全局γ分析3 mm/3%、10%低剂量阈值、95%通过率为阈值,以首次治疗的各射野2D γ通过率为基线,之后每次治疗的各射野2D γ通过率与之比对,对所有患者的2D γ通过率进行分析。对低于基线的分次均由两位资深物理师通过In vivo EPID 2D进行EPID透射图像分析,同时通过In vivo EPID 3D在计划CT图像和当日FBCT图像上进行三维剂量场的重建,比较两者剂量差异超过5%和图像差异的位置是否一致,以评估引起γ通过率下降原因。
5. 统计学处理:采用SPSS 25.0进行统计学分析,采用Shapiro-Wilk方法检验数据正态性,结果符合正态分布的用x±s表示,两组间比较行双侧t检验,不符合正态分布行Wilcoxon signed-rank秩检验法。P<0.05为差异有统计学意义。
结果1. γ通过率降低的可能因素:对肺癌和食管癌病例的3 mm/5%、3 mm/3%、2 mm/2%的2D γ通过率进行统计分析。肺癌、食管癌3 mm/5%γ通过率均值分别为(95.1±5.7)%、(96.5±4.5)%,3 mm/3%γ通过率均值分别为(91.5±8.4)%、(92.2±4.9)%,2 mm/2%γ通过率均值分别为(79.1±14.1)%、(83.7±8.2)%,两者通过率差异无统计学意义(P > 0.05)。病种不是引起γ通过率变化的影响因素。
经两位资深物理师对低于基线的分次进行分析,认为可能影响患者在体剂量验证结果的因素包括机架角度、摆位误差、分次间图像差异大、图像结构未扫全、摆位区间错误(仅针对联影uRT 506加速器)等。
2. 机架角度对γ通过率的影响:将肺癌和食管癌病例的γ通过率按射野角度每隔5°归为一组,不足或超过分隔的归至临近角度。射野角度变化会引起γ通过率的改变,呈现出靠近0°/180°高,靠近90°/270°低。
进一步分析,根据肺癌、食管癌dIMRT计划常用布野角度(前4后3或前3后4),将靠近0°/180°的射野(机架角介于330°~30°或160°~220°)归为A组,靠近90°/270°的射野(机架角介于60°~140°或220°~330°)的归为B组。3 mm/5%γ通过率A组均值为97.3%±3.6%,B组均值为94.7%±5.5%,差异有统计学意义(Z = -25.4,P < 0.05), 3 mm/3%γ通过率A组均值为95.4%±5.5%,B组均值为89.0%±8.9%,差异有统计学意义(Z = -26.8,P < 0.05),表明靠近0°/180°的射野通过率高于靠近90°/270°射野。
3. IGRT对γ通过率的影响:选取执行IGRT的通过率数据和之后1 d的非IGRT通过率数据进行配对,IGRT和非IGRT下3 mm/5%γ通过率均值为96.3%±5.1%、96.0%±4.9%,差异有统计学意义(Z = -5.50, P < 0.05);3 mm/3%γ通过率均值为92.3%±8.0%、91.3%±7.7%,差异有统计学意义(Z = -9.54, P < 0.05),说明IGRT的应用能够提高γ通过率。
4. 分次间影像差异对γ通过率的影响:对执行过IGRT的通过率结果进一步分析,发现分次间图像差异大可能影响患者在体剂量验证结果,主要包括以下几方面因素:
(1) 肿瘤变化的影响:一小细胞肺癌患者随治疗分次增加,γ通过率下降。分析第22次治疗的γ通过率,剂量测量值高于计划值(例如340°射野3 mm/3% 2D γ通过率为73.6%),三维剂量重建结果表明,靶区的重建剂量高于计划值,且剂量偏差超过5%的范围较大。分析当日FBCT图像,发现肿瘤体积退缩减半,重新制作计划并治疗,通过率提高(340°射野3 mm/3% 2D γ通过率为90.1%),三维剂量重建提示靶区内剂量偏差超过5%的区域明显减少(图 2)。说明肿瘤体积变化会引起γ通过率下降。

|
注:C、F图蓝色为重建剂量大于计划剂量5%,红色为重建剂量小于计划剂量5% 图 2 肺癌患者计划更改前后二维计划通量(A)、测量通量(B)、三维重建剂量偏差(C)和更改后二维计划通量(D)、测量通量(E)、三维重建剂量偏差(F)比较 Figure 2 Comparison of 2D planned flux, measured flux, and 3D reconstruction-derived dose deviation before plan change (A, B, and C) with those after plan change (D, E, and F) of lung cancer patients |
(2) 正常组织变化的影响:食管癌患者Ⅰ整个疗程中γ通过率表现为30°射野通过率较低(3 mm/3% 2D γ通过率为73.2%),测量值高于计划值,三维剂量重建结果显示,剂量偏差超过5%的范围与相应射野入射方向一致。结合当日FBCT图像分析,患者所有FBCT图像下心脏体积为594.8~678.2 cm3,均小于定位图像的心脏体积770 cm3。对第3次FBCT图像进行三维剂量重建,剂量偏差超过5%的范围明显减少,30°射野γ通过率提高(3 mm/3% 2D γ通过率为99.2%)(图5)。因此,心脏体积变化是引起该计划通过率下降的主要原因。
(3) 定位和治疗前准备充分与否的影响:食管癌患者Ⅱγ通过率(3 mm/3%,2D)均值为87.7%,无随治疗分次增加而降低的情况。由于患者年纪大,胃壁弹性减弱,定位时胃内一半体积为空气,且患者医从性差,不能做到每次治疗前胃充盈。某一分次下,γ通过率降低(如15°射野3 mm/3% 2D γ通过率为78.6%),分析发现测量剂量低于计划剂量,三维剂量重建显示剂量偏差超过5%范围较大。当日FBCT图像提示胃充盈同定位状态,但胃内充满食糜。对该图像进行三维剂量重建计算,剂量偏差超过5%区域减少, γ通过率提高(15°射野3 mm/3% 2D γ通过率为98.9%)(图 3)。说明由于患者治疗前准备不充分,胃充盈度或内容物有差异,导致γ通过率下降。
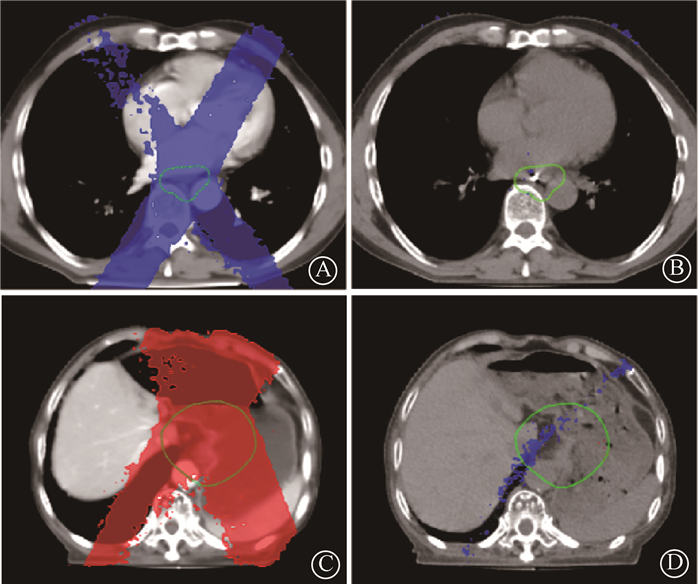
|
注:蓝色为重建剂量大于计划剂量5%,红色为重建剂量小于计划剂量5% 图 3 2例食管患者三维剂量重建偏差比较患者1的CT图像计划剂量偏差(A)和当日FBCT影像计划剂量偏差(B)比较;患者2CT图像计划剂量偏差(C)和当日FBCT影像计划剂量偏差(D)比较 Figure 3 Comparison of 3D dose reconstruction-derived dose deviations for two esophageal cancer patients. Comparison of deviations between CT image-based planned dose and 3D dose reconstruction-derived dose (A) and between FBCT image (B)- based planned dose on the same day for patient 1; Comparison of deviations between CT image-based planned dose and 3D dose reconstruction-derived dose (C) and between FBCT image (D)-based planned dose on the same day for patient 2 |
讨论
In vivo EPID可用于检测治疗中的错误,发现剂量差异[10-11]。本研究对低于基线的分次进行原因分析,认为可能影响患者在体剂量验证结果的因素包括机架角度、摆位误差、分次间图像差异大、图像结构未扫全、摆位区间错误等。其中图像结构未扫全是指CT扫描时扫描野设置过小导致横截面图像中一体化固定板结构未完整扫描,临床中如真空垫、发泡胶等辅助摆位附件均可能出现这样的情况;摆位区间错误是指uRT- 506c治疗床A区(用于头部摆位)床板宽度较B区(用于体部摆位)窄,治疗时未按照计划摆位区进行摆位,这种摆位区间错误只针对uRT-506c治疗床。由于碳纤维治疗床及体架固定板对吸收剂量有衰减作用[12-13],若计算通量时未考虑体架固定板的衰减影响,可能会导致2D γ通过率下降。这两种人为错误,可通过规范工作流程避免。
临床上影响患者在体剂量验证结果的主要因素为射野角度、IGRT及分次间影像差异。本研究中,靠近0°/180°射野γ通过率高于靠近90°/270°射野,可能原因是机架旋转过程中的重力因素影响。机架旋转时,EPID的位置可能会发生变化(包括源到探测器距离和中心位置的变化)。本研究通过每日治疗前进行EPID位置精度QA,保证EPID到位准确,排除了机架旋转过程中EPID位置变化对通过率的影响。但准直器叶片受重力影响对放疗剂量的影响[14],机架旋转过程中电离室、均整器的位置等与通过率结果有何关联,需进一步研究。
摆位误差、肿瘤体积变化、患者体型变化等因素均会引起患者治疗与定位状态不一致,造成剂量准确性下降,此时应通过自适应放疗的方式快速调整计划。Feng等[15]研究结果表明,基于每日FBCT图像的在体剂量验证通过率比基于计划CT图像的通过率高,且更具敏感性和特异性。这与本研究中使用当日FBCT影像重新计划并进行在体剂量验证,γ通过率提高的结果一致。另外,随治疗分次增加,治疗总体不确定性增大。这就要求放疗技师严格按照计划设计进行摆位和放疗,避免错误,适时增加IGRT频次,提高治疗准确性。
分次间图像差异对γ通过率的影响主要体现在生理运动引起的影像差异。胸部肿瘤的生理运动如呼吸运动、心脏搏动、大血管搏动等因素会造成肿瘤位移,影响靶区精度,使计划靶区和实际靶区剂量吻合程度产生较大的误差[16]。研究表明,呼吸运动幅度及部分幅度下呼吸运动周期对剂量分布有影响,呼吸幅度增大,γ通过率降低[17]。这种变化反映了放疗前准备工作的重要性,对胸部肿瘤患者定位时,需综合考虑呼吸运动、器官运动等变化,采用合适的定位方法减少分次间图像的差异对γ通过率的影响。对靶区易受呼吸运动或心脏运动影响的患者进行定位时,宜在平静呼吸下进行定位或采用深吸气屏气技术定位。
研究存在以下局限性:①2D γ通过率和临床剂量学指标的相关性并不高[18],它只能初步提示当前射野的理论剂量沉积和实际剂量沉积存在差异,无法反映出剂量在患者体内的沉积结果是否达到计划要求,如靶区剂量、剂量覆盖率、正常组织剂量等,这需要采用例如人工智能的方法挖掘EPID通量变化的影响特征,从更高维度的数据来进行误差因素影响。②其他可能的影响因素如射野面积、体架固定结构和治疗床以及摆位因素本研究未作进一步研究。③对于2D γ通过率阈值的设置,本研究IGRT下3 mm/3% γ通过率均值为92%,3 mm/5% γ通过率均值为96.2%,与文献[6]报道的3 mm/3%通过率设置95%过于严苛的结论一致,但由于目前数据量太少,还不足以给出明确值,需后续扩大数据量。目前建议设置全局伽玛分析3 mm/5%、10%低剂量阈值、95%通过率为阈值。
综上所述,本研究建议临床中使用在体剂量验证流程包括使用前对平板性能稳定性检查。治疗中设置3 mm/5% 2D γ通过率95%作为阈值,当通过率低于阈值时,进行FBCT扫描,在计划系统上进行三维剂量重建,分析其中的影像差异和剂量差异,明确引起通过率下降的原因。因靶区体积变化或器官生理运动等原因引起的分次间图像差异,需重新制定治疗计划;因摆位误差引起的通过率下降,下一次治疗前进行IGRT纠正摆位误差,提高通过率。同时,还需注意:①选择合适的定位方式保证计划图像和分次间图像的稳定性。②设置合适的视野(FOV)保证图像结构扫全。③适当增加IGRT频次提高验证通过率。④对于通过率低于阈值或持续下降的患者,及时查找原因,对需要进行自适应放疗的患者及时调整计划。⑤若同一天所有病例所有分次γ通过率都降低,提示设备错误可能,需要检查束流稳定性、机架、光栅等到位精度。
患者治疗前验证是确保患者接受正确的剂量投射的重要环节,在此基础上引入在体剂量验证作为治疗计划验证的一种完善与补充手段能够避免错误照射,但需规范使用在体剂量验证功能,以避免人为因素导致的通过率降低。当通过率低于阈值时,应及时进行原因分析,必要时重新制定治疗计划。建立在体剂量验证规范化流程有助于其更好的临床推广,也为肺癌和食管癌在体剂量验证设立评价标准建立基础。
利益冲突 无
作者贡献声明 方家负责设计研究方案,研究实施及论文撰写;朱万里负责研究实施及数据分析;戴春艳负责数据分析和统计分析;杨昕、孙红娟负责数据分析和论文修改;梅英杰、刘艳芳负责数据收集和分析;丁叔波负责论文修改和技术指导
| [1] |
Roach M 3rd, Gandara DR, Yuo HS, et al. Radiation pneumonitis following combined modality therapy for lung cancer: analysis of prognostic factors[J]. J Clin Oncol, 1995, 13(10): 2606-2612. DOI:10.1200/JCO.1995.13.10.2606 |
| [2] |
叶根耀. 国内外辐射事故的临床诊治新进展[J]. 中华放射医学与防护杂志, 2004, 24(1): 81-84. Ye GY. New progress in the clinical diagnosis and treatment of radiation accidents at home and abroad[J]. Chin J Radiol Med Prot, 2004, 24(1): 81-84. DOI:10.3760/cma.j.issn.0254-5098.2004.01.039 |
| [3] |
Wendling M, Louwe RJ, McDermott LN, et al. Accurate two-dimensional IMRT verification using a back-projection EPID dosimetry method[J]. Med Phys, 2006, 33(2): 259-273. DOI:10.1118/1.2147744 |
| [4] |
Wendling M, McDermott LN, Mans A, et al. A simple backprojection algorithm for 3D in vivo EPID dosimetry of IMRT treatments[J]. Med Phys, 2009, 36(7): 3310-3321. DOI:10.1118/1.3148482 |
| [5] |
Zhang J, Cheng Z, Fan Z, et al. A feasibility study for in vivo treatment verification of IMRT using Monte Carlo dose calculation and deep learning-based modelling of EPID detectorresponse[J]. Radiat Oncol, 2022, 17(1): 31. DOI:10.1186/s13014-022-01999-3 |
| [6] |
Bossuyt E, Weytjens R, Nevens D, et al. Evaluation of automated pre-treatment and transit in-vivo dosimetry in radiotherapy using empirically determined parameters[J]. Phys Imaging Radiat Oncol, 2020, 16: 113-129. DOI:10.1016/j.phro.2020.09.011 |
| [7] |
上海联影医疗科技股份有限公司. 一种建模方法、验证方法、装置、设备及存储介质: CN202010316472.3[P]. 2020-08-07. Shanghai United Imaging Healthcare Co., Ltd. Modeling method, verification method and device, equipment and storage medium: CN202010316472.3[P]. 2020-08-07. |
| [8] |
上海联影医疗科技股份有限公司. 一种通量图重建方法和系统: CN201911314184.8[P]. 2020-04-10. Shanghai United Imaging Healthcare Co., Ltd. Systems and methods for reconstructing fluence map: CN201911314184.8[P]. 2020-04-10. |
| [9] |
Miften M, Olch A, Mihailidis D, et al. Tolerance limits and methodologies for IMRT IMRT measurement-based verification QA: Recommendations of AAPM Task Group No. 218[J]. Med Phys, 2018, 45(4): e53--e83. DOI:10.1002/mp.12810 |
| [10] |
Nailon WH, Welsh D, McDonald K, et al. EPID-based in vivo dosimetry using dosimetry check?: Overview and clinical experience in a 5-yr study including breast, lung, prostate, and head and neck cancer patients[J]. J Appl Clin Med Phys, 2019, 20(1): 6-16. DOI:10.1002/acm2.12441 |
| [11] |
吴志强, 陈元华, 王佳舟, 等. 基于患者出射EPID剂量验证的在体调强放疗质控技术研究[J]. 中国癌症杂志, 2020, 30(9): 689-693. Wu ZQ, Chen YH, Wang JZ, et al. A study of in vivo dosimetry verification based on EPID transit dose[J]. Chin Oncol, 2020, 30(9): 689-693. DOI:10.19401/j.cnki.1007-3639.2020.09.008 |
| [12] |
李军, 张西志, 花威, 等. VARIAN直线加速器IGRT全碳纤维治疗床与虚拟治疗床对高能X射线剂量的影响[J]. 中国医学物理学杂志, 2015, 32(4): 479-483. Li J, Zhang XZ, Hua W, et al. Effects of whole carbon fiber treatment couch and virtual treatment couch of VARIAN linear accelerator IGRT on radiotherapy dose of high-energy X-ray[J]. Chin J Med Phys, 2015, 32(4): 479-483. DOI:10.3969/j.issn.1005-202X.2015.04.006 |
| [13] |
牛振洋, 费振乐, 段宗锦, 等. 不同材料的定位板对吸收剂量的影响[J]. 中国医学物理学杂志, 2015, 32(6): 917-920. Niu ZY, Fei ZL, Duan ZJ, et al. Influences of positioning-board of different materials on the absorbed dose[J]. Chin J Med Phys, 2015, 32(6): 917-920. DOI:10.3969/j.issn.1005-202X.2015.06.033 |
| [14] |
阮长利, 徐利明, 宋启斌, 等. 加速器多叶准直器叶片重力对放疗剂量的影响[J]. 肿瘤学杂志, 2010, 16(12): 941-945. Ruan CL, Xu LM, Song QB, et al. Impact of accelerator's multi-leaf collimator gravity on radiation therapy dose[J]. J Chin Oncol, 2010, 16(12): 941-945. |
| [15] |
Feng B, Yu L, Mo E, et al. Evaluation of daily CT for EPID-based transit in vivo dosimetry[J]. Front Oncol, 2021, 11: 782263. DOI:10.3389/fonc.2021.782263 |
| [16] |
于甬华, 罗立民, 于金明, 等. 呼吸运动对胸腹部肿瘤精确放射治疗的影响[J]. 中华放射肿瘤学杂志, 2001, 10(4): 283-285. Yu YH, Luo LM, Yu JM, et al. The influence of respiratory movement upon the precision radiation therapy of chest and abdominal tumors[J]. Chin J Radiat Oncol, 2001, 10(4): 283-285. DOI:10.3760/j.issn:1004-4221.2001.04.028 |
| [17] |
吴先想, 牛振洋, 费振乐, 等. 呼吸运动状态对动态调强放疗剂量分布影响的研究[J]. 中华放射医学与防护杂志, 2019, 39(3): 197-201. Wu XX, Niu ZY, Fei ZL, et al. The effect of respiratory motion states on dynamic IMRT dose distribution[J]. Chin J Radiol Med Prot, 2019, 39(3): 197-201. DOI:10.3760/cma.j.issn.0254-5098.2019.03.007 |
| [18] |
马阳光, 麦日珍, 裴运通, 等. 宫颈癌VMAT剂量验证的γ与DVH评估及两者与剂量偏差相关性研究[J]. 中华放射肿瘤学杂志, 2022, 31(5): 450-455. Ma YG, Mai RZ, Pei YT, et al. The application and correlation study of γ rule and DVH evaluation for VMAT dose verification evaluation of cervical cancer patients[J]. Chin J Radiat Oncol, 2022, 31(5): 450-455. DOI:10.3760/cma.j.cn113030-20200927-00480 |
 2023, Vol. 43
2023, Vol. 43


