随着肿瘤综合治疗技术的飞速发展和肿瘤治疗疗效的不断提高,肿瘤患者原发部位的局部控制率和总体生存期进一步提升,使得原发肿瘤向脑部转移的概率显著增加(肺癌脑转移率为15%~50%[1],乳腺癌脑转移率为10%~16%[2])。全脑放射治疗(whole brain radiotherapy,WBRT)是临床治疗脑转移瘤的有效手段之一[3],但获益的同时也伴随着一定的风险和并发症。大量研究表明,神经认知功能(neurocognitive function,NCF)损伤和WBRT海马区照射相关[4-6],且海马区受照射剂量越高,患者的认知能力和记忆能力下降越明显[7]。美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)开展了使用海马保护全脑放疗(hippocampal avoidance-whole brain radiotherapy,HA-WBRT)技术治疗脑转移瘤的Ⅱ期及Ⅲ期试验[8-9],结果显示相较于WBRT,HA-WBRT能够更好地保护患者的认知及记忆功能。
Varian Halcyon 3.0直线加速器采用独特的双层交错叠加多叶光栅(multi-leave collimators,MLC)构造,提供了显著差别于其他直线加速器的子野调制功能[10]。借助Eclipse15.6版本放射治疗计划系统内置的射束形状控制器(aperture shape controller,ASC)算法,能够使用不同子野调制参数进行剂量优化,从而更好地实现放疗处方需求。
目前,Halcyon 3.0直线加速器在国内的使用日益广泛,但尚未有基于该平台,关于不同子野调制参数对海马保护全脑放疗计划影响的相关研究报道。本研究旨在探索利用Halcyon 3.0加速器的特殊MLC调制功能结合ASC算法对海马保护全脑放疗计划的影响进行综合性的剂量学评估,以期为该类计划的制定和执行提供临床应用参考。
资料与方法1. 病例选择:回顾性选取上海中医药大学附属曙光医院放疗科患者数据库中行WBRT的脑转移瘤患者。纳入标准:①原发癌经病理学检验确诊。②脑转移瘤经病理学或影像学检查确诊。符合入组标准的脑转移瘤患者共13例,其中乳腺癌脑转移的女性患者1例,肺癌脑转移的男性患者12例,平均年龄55岁(中位年龄60岁)。患者均在德国西门子Confidence 2.0大孔径CT行图像采集,体位选择仰卧位,扫描层厚3 mm,扫描范围要求头脚方向超出全颅5 cm以上。
2. 设备参数:放疗设备使用美国Varian Halcyon 3.0医用直线加速器,照射使用无均整器(flatting filter free,FFF)6 MV光子线,配备双层交错叠加结构的共计57对MLC(近源端29对,远源端28对),叶片分辨率为5 mm,最高剂量率为800 MU/min。放射治疗计划系统为Varian Eclipse计划系统,版本号15.6。计划验证系统:①美国Sun Nuclear公司的ArcCHECK三维剂量验证系统(包含SNC Patient Version 6.2.3分析软件),由圆柱形等效水模体和1 386个的半导体探测器组成,探测器间距为1 cm,有效探测面积为0.8 mm × 0.8 mm,螺旋状分布在离中心10.4 cm,长和直径均为21 cm的圆柱形聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)模体中。ArcCHECK模体本底校验后,分别对x轴方向对称性、y轴方向对称性及10 cm×10 cm射野中心剂量矫正[11],如有偏差,及时调整。②Varian Halcyon 3.0直线加速器自带的电子影像系统(electronic portal imaging device,EPID),像素矩阵为1 280× 1 280,像素尺寸为0.336 mm × 0.336 mm,有效探测面积为43 cm × 43 cm。
3. 靶区和危及器官勾画:使用Varian Velocity工作站勾画模块,参考国际辐射单位与测量委员会(ICRU)发布的50号[12]和62号[13]文件进行计划靶区(planning target volume,PTV)和危及器官勾画。海马区勾画参考美国肿瘤放射治疗协作组(RTOG) 0933报告[14],结合磁共振影像MR在轴向切面将勾画出的海马体轮廓三维方向外扩3 mm形成计划海马区体积。靶区及所有危及器官的勾画均由1名放疗主任医师审核修正。
4. 计划设计
(1) 处方剂量及基础参数设置:所有计划均使用容积旋转调强(volumetric modulated arc therapy,VMAT)技术,采用共面4弧设计(1弧及2弧为全弧,3弧机架角度由181°顺时针旋转到10°,4弧机架角度由179°逆时针旋转到350°),准直器角度为10°,优化算法选择Acuros XB算法。计划要求90%体积的PTV满足30 Gy的处方剂量,剂量分次为10次。危及器官剂量限值参考RTOG 0933报告[15]:视神经及视交叉的最大剂量Dmax < 37.5 Gy,海马区的Dmax < 17 Gy,平均剂量Dmean < 10 Gy。
(2) 射束形状控制器参数设置:射束形状控制器功能模块属于Eclipse 15.6计划系统中光子逆向调强优化算法子野调制能力设置的一部分,其原理本质上是通过对相邻的MLC顶端位置曲率罚分(曲率为0的相邻叶片不参与),从而获得不同的子野调制形状。根据罚分权重差异分为6组,分别是ASC关闭组(AO)、ASC极低组(AVL)、ASC较低组(AL)、ASC中位组(AM)、ASC较高组(AH)及ASC极高组(AVH)。其中AO组即将ASC设置为关闭,所有子野在调制过程中不参与罚分,剩余5组依次按照AVL、AL、AM、AH和AVH的顺序逐级提高子野参与罚分的权重。
5. 计划评估
(1) 剂量学指标:计划质量评估参考的所有剂量学指标均基于剂量-体积直方图(dose-volume histogram,DVH)。靶区适形度指数(conformity index,CI)见公式(1):
| $ \mathrm{CI}=\frac{V_{\mathrm{PTV}, \text { ref }} \times V_{\mathrm{PTV}, \text { ref }}}{V_{\mathrm{PTV}} \times V_{\text {ref }}} $ | (1) |
式中,VPTV, ref为处方剂量覆盖靶区的体积;VPTV为靶区体积;Vref为处方剂量覆盖的总体积。CI值趋近于1则靶区剂量适形度越好。
靶区均匀性指数(homogeneity index,HI)见公式(2):
| $ \mathrm{HI}=\frac{D_{2 \%}-D_{98 \%}}{D_{50 \%}} $ | (2) |
式中,D2%为2%靶区体积接受照射的剂量;D98%为98%靶区体积接受照射的剂量;D50%为50%靶区体积接受照射的剂量。HI值趋近于0则靶区剂量均匀性越好。
根据RTOG 0933报告[8]建议,危及器官评估指标包括:海马区Dmax越小越好,可接受的最低要求为Dmax < 17 Gy,Dmean < 10 Gy;视神经及视交叉Dmax < 37.5 Gy。此外,还包括脑干、眼球和眼晶状体的Dmax。相关研究表明,当海马区D40%的2 Gy分次生物等效剂量(equivalent dose in 2 Gy/次,EQD2) < 7.3 Gy时,能够很大程度上减缓患者认知功能的衰退[4]。因此,本研究还需尽量控制海马区D40%的EQD2剂量(α/β值取2)。
统计所有计划的总跳数,用于评估其治疗效率。
(2)γ通过率指标:VMAT相较于静态逆向调强治疗(intensity modulated radiation therapy,IMRT)在一定程度上可以提高靶区剂量的均匀性[16]。同时,配合Halcyon 3.0加速器高达24°/s的机架转速和800 MU/min的最高剂量率,能够有效减少治疗时间,提高患者的放疗体验。但VMAT计划原本较为复杂,其中HA-WBRT的VMAT计划,对剂量分布的要求更为严格。出束过程中机架角度、MLC叶片位置和射束强度都在动态变化,尤其是结合不同等级的子野调制能力,剂量沉积的精准性在应用ASC参数的HA-WBRT VMAT计划中显得格外重要。本研究采用ArcCHECK三维剂量验证系统和Varian Portal Dosimetry剂量验证系统对所有计划γ通过率进行双重验证。γ分析通过剂量阈值设置为10%,剂量容差(dose tolerance,DT)/距离一致性(distance to agreement,DTA)设置为2%/2 mm和3%/3 mm,计划验证通过率为>97%。
6. 统计学处理:采用SPSS 21.0软件进行统计学分析,图表使用Origin 2022绘制。数据以x±s表示,以ASC关闭组(AO)作为对照组,其余5组进行单因素方差分析,P < 0.05为差异有统计学意义。
结果1. 不同子野调制参数计划中靶区的剂量学参数比较:应用6组不同ASC参数进行计划优化,共78例HA-WBRT计划均满足处方要求。
所有78例计划具体剂量参数值如表 1所示。6组间靶区的CI和HI值无明显波动,差异均无统计学意义(P>0.05)。
|
|
表 1 计划靶区的剂量参数比较(x±s) Table 1 Comparison of dosimetric parameters of planning target volumes (x±s) |
2. 不同子野调制参数计划中海马区等危及器官的剂量学参数比较:在应用不同子野调制参数的情况下,6组计划的海马区等危及器官的剂量指标见表 2。AVL的脑干Dmax < AO、视交叉Dmax>AO,差异具有统计学意义(F=6.26、8.04,P < 0.05)。AH的眼球Dmax < AO、视神经Dmax>AO,差异具有统计学意义(F=2.04、1.37,P < 0.05)。AVH的脑干、眼球和眼晶状体Dmax < AO,差异具有统计学意义(F=6.26、2.04、2.02,P < 0.05)。其余剂量学参数对比组间差异均无统计学意义(P> 0.05)。海马区的剂量学指标参数各组间无明显差异,最大差异 < 0.2 Gy。其他危及器官应用不同ASC参数进行优化的计划质量差异较明显,视交叉、视神经、脑干、眼球和眼晶状体的剂量学指标参数最大差异分别达到1.23、0.80、1.10、2.78和2.08 Gy。
|
|
表 2 海马区等危及器官的剂量参数比较(x±s) Table 2 Comparison of dosimetric parameters of the hippocampus and other organs at risk (x±s) |
将6组计划的海马区等危及器官的剂量学指标取均值得到平均剂量组,平均剂量组可视为该患者的常规质量计划。将6组计划的海马区和危及器官剂量学参数分别与平均剂量组取差值, 结果如表 3所示。AO的眼球和眼晶状体Dmax较高于平均剂量组;AH的眼球Dmax较低于平均剂量组,但视神经和脑干的Dmax则较高于平均剂量组;AVH除视神经外,其他危及器官的剂量学参数均低于平均剂量组。这表明了AVH参数能够在满足靶区处方剂量的要求下,更全面地保护危及器官免受高剂量的照射。
|
|
表 3 不同子野调制参数计划海马区和危及器官剂量学参数与平均剂量组间差异比较 Table 3 Differences in dosimetric parameters of the hippocampus and other organs at risk between plans with different ASC parameters and the average dose group |
3. 不同子野调制参数计划γ通过率及跳数比较:使用ArcCHECK三维剂量验证系统和Portal Dosimetry剂量验证系统进行射束剂量沉积精准性验证,结果见图 1。DT/DTA设置为2%/2 mm时,ArcCHECK验证通过率在98%~100%之间,Portal Dosimetry验证通过率在99%~100%之间,两种验证方式的γ通过率均> 97%。DT/DTA设置为3%/3 mm时,ArcCHECK和Portal Dosimetry验证γ通过率均为100%。从验证结果可以看出,不同级别子野调制参数的应用不会对执行计划时射束剂量沉积精准性产生显著影响。6组计划间跳数范围为1 274~1 289,组间跳数差异最大为15,可见不同子野调制参数参与剂量优化对计划的执行效率无明显影响。
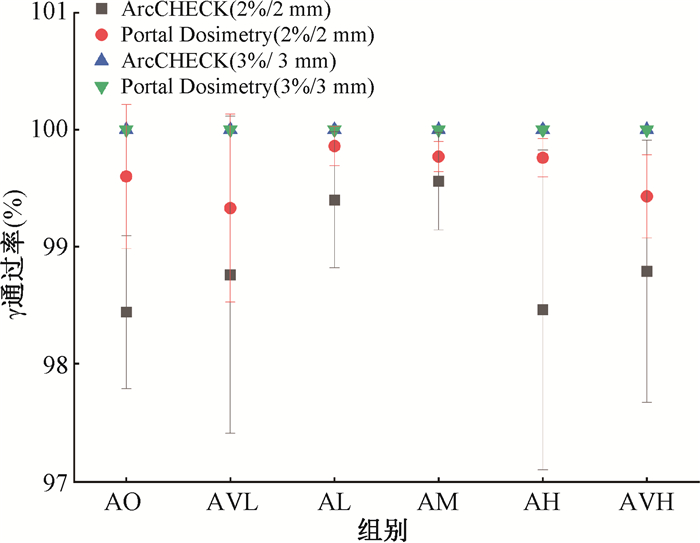
|
注:AO. 射束形状控制器关闭组;AVL. 射束形状控制器极低组;AL. 射束形状控制器较低组;AM. 射束形状控制器中位组;AH. 射束形状控制器较高组;AVH. 射束形状控制器极高组 图 1 不同子野调制参数计划γ通过率 Figure 1 γ-passing rates of plans with different ASC parameters |
讨论
全脑放疗的不良反应除了急性反应如恶心、脱发、疲劳和呕吐等,还存在神经不良反应[17]。Chang等[18]使用霍普金斯语言学习测验修订版作为学习和记忆的神经认知指标对WBRT患者在放疗4个月后表现进行观察,结果显示这些患者的学习和记忆功能在一定程度上都出现了下降,该研究反映了放射引发的海马区损伤在WBRT患者的NCF下降中起着重要作用。Gondi等[8]提出“海马保护”的概念,并开展了Ⅱ期研究:纳入113例脑转移瘤患者接受海马保护的IMRT照射,并进行了标准化的NCF和生活质量评估,证实了HA-WBRT对全脑放疗患者认知及记忆功能的保护作用。但在该研究中,近1/4的HA-WBRT计划存在不可接受的偏差,原因为海马区自身的不对称性和周围近邻的杏仁核,导致放疗医师对海马区的勾画缺乏较高的准确性[15]。相关研究表明,基于深度学习算法开发海马区自动勾画模型能够达到放疗医师满意的成果,这对提高HA-WBRT的精准性有着重要的积极意义[19-21]。除了海马区勾画方面的困难,由于靶区和海马区本身的矛盾位置关系和特殊的剂量分布要求(30 Gy全脑剂量中海马区Dmax < 17 Gy),使HA-WBRT计划一直具有较高的复杂度。随着直线加速器硬件的不断更新和计划系统功能的持续完善,VMAT技术在HA-WBRT放射治疗中获得广泛应用。VMAT相较于IMRT拥有更高的角度自由度,在剂量优化的过程中也兼具更优的子野调制性:MLC叶片运动位置、射束剂量率能够随着机架角度控制点的改变实时调整。但多个灵活可变的参数也在更多维度上增加了HA-WBRT VMAT计划的复杂度。Du等[22]考虑平均子野面积、不规则小子野的数量以及权重等参数与计划复杂度之间的关系,验证了计划复杂性评分和靶区几何敏感性、剂量不稳定性和治疗时间呈正相关。Eclipse 15.6版本内置了ASC算法,理论上通过限制相邻MLC叶片变化曲率的方式,影响每个控制点的子野形状,能够在不同程度上降低计划的复杂度。本研究综合比较了6组不同子野调制参数在HA-WBRT计划中的应用情况,通过设置AO-AVH等不同的子野调制水平,在保证靶区处方剂量覆盖、适形性和均匀性良好的同时,有效降低了危及器官的受照剂量,尤其是脑干、眼球和眼晶状体的剂量差异具有统计学意义。目前,HA-WBRT的计划设计流程没有明确的规范,物理师在制定该类计划时对ASC参数的使用也没有清晰的标准。本研究通过对6组不同子野调制参数的HA-WBRT计划的靶区和危及器官受照剂量进行综合性的评估,以期能够为该类放疗计划设计之初,在子野优化参数选择上的质量把控提供了数据支持。
Varian Halcyon 3.0直线加速器是一款环形加速器,因其独特的双层堆叠式MLC构造、24°/s的机架最高转速和5 cm/s的叶片最快移速,在子野调制能力及计划执行效率等方面都区别于传统C型臂加速器。因此,单独对基于Halcyon 3.0加速器平台的HA-WBRT计划质量进行综合性分析是必要的。γ分析法广泛应用于临床各类剂量验证系统,它兼具了剂量偏差分析法和剂量一致性分析法的优势,能够对射束剂量沉积精准性进行更为全面的评估[23-24]。本研究综合使用了ArcCHECK三维剂量验证系统和Portal Dosimetry剂量验证系统对6组不同子野调制参数的HA-WBRT计划进行了双重剂量验证。研究结果显示,在3%/3 mm较为宽松的条件下,所有计划的γ通过率均为100%,在2%/2 mm较为严格的条件下,所有计划的γ通过率也都在98%以上。这表明基于Halcyon 3.0加速器平台,不同子野参数参与调制的HA-WBRT计划在满足临床治疗剂量验证标准的情况下,具有较高的剂量沉积精准性。ArcCHECK验证结果通过率在6组计划中都要低于Portal Dosimetry验证,分析原因可能是Halcyon 3.0加速器的定位激光误差为1 mm,ArcCHECK受探测器摆位精度不确定性的影响,产生了数据偏移。
计划执行效率方面,6组计划间总跳数差异不明显。Halcyon 3.0高达24°/s的机架转速、800 MU/min的最高剂量率以及非共面的HA-WBRT VMAT技术能够有效缩短治疗时间,在一定程度上不会因为计划跳数的微小差异对执行效率产生显著影响。
综上所述,基于Halcyon 3.0直线加速器平台能够完成符合临床治疗标准的HA-WBRT计划,使用不同子野调制参数会对计划质量产生一定影响,AVH参数对于危及器官的保护效果更好。所有不同子野参数参与调制的计划均具备较好的射束剂量沉积精准性,执行效率几乎相当。后续研究希望可以纳入更多的病例,并结合HA-WBRT患者的预后NCF评分,为临床放射治疗脑转移瘤提供更全面的参考。
利益冲突 无
作者贡献声明 曾宏伟负责实验设计、数据采集分析和论文撰写;张瑜、鄂翔宇、封悦参与实验拟定;于静萍负责实验指导和论文修改
| [1] |
Zhao R, Kong W, Shang J, et al. Hippocampal-sparing whole-brain radiotherapy for lung cancer[J]. Clin Lung Cancer, 2017, 18(2): 127-131. DOI:10.1016/j.cllc.2016.09.007 |
| [2] |
Rostami R, Mittal S, Rostami P, et al. Brain metastasis in breast cancer: a comprehensive literature review[J]. J Neurooncol, 2016, 127(3): 407-414. DOI:10.1007/s11060-016-2075-3 |
| [3] |
Brown PD, Ahluwalia MS, Khan OH, et al. Whole-brain radiotherapy for brain metastases: evolution or revolution?[J]. J Clin Oncol, 2018, 36(5): 483-491. DOI:10.1200/JCO.2017.75.9589 |
| [4] |
Gondi V, Hermann BP, Mehta MP, et al. Hippocampal dosimetry predicts neurocognitive function impairment after fractionated stereotactic radiotherapy for benign or low-grade adult brain tumors[J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): e487-493. DOI:10.1016/j.ijrobp.2011.10.021 |
| [5] |
Redmond KJ, Mahone EM, Terezakis S, et al. Association between radiation dose to neuronal progenitor cell niches and temporal lobes and performance on neuropsychological testing in children: a prospective study[J]. Neuro Oncol, 2013, 15(3): 360-369. DOI:10.1093/neuonc/nos303 |
| [6] |
Gondi V, Tomé WA, Mehta MP. Why avoid the hippocampus? A comprehensive review[J]. Radiother Oncol, 2010, 97(3): 370-376. DOI:10.1016/j.radonc.2010.09.013 |
| [7] |
Rubin RD, Watson PD, Duff MC, et al. The role of the hippocampus in flexible cognition and social behavior[J]. Front Hum Neurosci, 2014, 8: 742. DOI:10.3389/fnhum.2014.00742 |
| [8] |
Gondi V, Pugh SL, Tome WA, et al. Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933): a phase Ⅱ multi-institutional trial[J]. J Clin Oncol, 2014, 32(34): 3810-3816. DOI:10.1200/JCO.2014.57.2909 |
| [9] |
Brown PD, Gondi V, Pugh S, et al. Hippocampal avoidance during whole-brain radiotherapy plus memantine for patients with brain metastases: phase Ⅲ trial NRG oncology CC001[J]. J Clin Oncol, 2020, 38(10): 1019-1029. DOI:10.1200/JCO.19.02767 |
| [10] |
祝起禛, 杨波, 汪之群, 等. Halcyon和Truebeam加速器平台在直肠癌术后辅助放射治疗中的计划质量及执行效率研究[J]. 中国医学装备, 2022, 19(4): 19-25. Zhu QZ, Yang B, Wang ZQ, et al. Study on the plan quality and delivery efficiency of Halcyon and Truebeam accelerator platform in adjuvant radiotherapy after surgery for rectal cancer[J]. China Med Equip, 2022, 19(4): 19-25. DOI:10.3969/j.issn.1672-8270.2022.04.004 |
| [11] |
Aristophanous M, Suh Y, Chi PC, et al. Initial clinical experience with ArcCHECK for IMRT/VMAT QA[J]. J Appl Clin Med Phys, 2016, 17(5): 20-33. DOI:10.1120/jacmp.v17i5.6118 |
| [12] |
International Commission on Radiation Units and Measurements. ICRU Report 50. Prescribing, recording, and reporting photon beam therapy[R]. Bethesda: ICRU, 1993.
|
| [13] |
International Commission on Radiation Units and Measurements. ICRU Report 62. Prescribing, recording, and reporting photon beam therapy (Supplement to Report ICRU 50). Bethesda: ICRU, 1999.
|
| [14] |
Gondi V, Tome WA, Marsh J, et al. Estimated risk of perihippocampal disease progression after hippocampal avoidance during whole-brain radiotherapy: safety profile for RTOG 0933[J]. Radiother Oncol, 2010, 95(3): 327-331. DOI:10.1016/j.radonc.2010.02.030 |
| [15] |
Gondi V, Cui Y, Mehta MP, et al. Real-time pretreatment review limits unacceptable deviations on a cooperative group radiation therapy technique trial: quality assurance results of RTOG 0933[J]. Int J Radiat Oncol Biol Phys, 2015, 91(3): 564-570. DOI:10.1016/j.ijrobp.2014.10.054 |
| [16] |
戴红娅, 黄江华, 陈露, 等. RapidArc和IMRT在脑胶质瘤术后放疗中保护海马的剂量学比较[J]. 中国医学物理学杂志, 2018, 35(12): 1404-1407. Dai HY, Huang JH, Chen L, et al. Dosimetric comparison of RapidArc and IMRT in hippocampus sparing during postoperative radiotherapy for glioma[J]. Chin J Med Phys, 2018, 35(12): 1404-1407. DOI:10.3969/j.issn.1005-202X.2018.12.007 |
| [17] |
Sun A, Bae K, Gore EM, et al. Phase Ⅲ trial of prophylactic cranial irradiation compared with observation in patients with locally advanced non-small-cell lung cancer: neurocognitive and quality-of-life analysis[J]. J Clin Oncol, 2011, 29(3): 279-286. DOI:10.1200/JCO.2010.29.6053 |
| [18] |
Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial[J]. Lancet Oncol, 2009, 10(11): 1037-1044. DOI:10.1016/S1470-2045(09)70263-3 |
| [19] |
Bartel F, Vrenken H, van Herk M, et al. FAst segmentation through SURface fairing (FASTSURF): A novel semi-automatic hippocampus segmentation method[J]. PLoS One, 2019, 14(1): e0210641. DOI:10.1371/journal.pone.0210641 |
| [20] |
Liu M, Li F, Yan H, et al. A multi-model deep convolutional neural network for automatic hippocampus segmentation and classification in Alzheimer's disease[J]. Neuroimage, 2020, 208: 116459. DOI:10.1016/j.neuroimage.2019.116459 |
| [21] |
Pan K, Zhao L, Gu S, et al. Deep learning-based automatic delineation of the hippocampus by MRI: geometric and dosimetric evaluation[J]. Radiat Oncol, 2021, 16(1): 12. DOI:10.1186/s13014-020-01724-y |
| [22] |
Du W, Cho SH, Zhang X, et al. Quantification of beam complexity in intensity-modulated radiation therapy treatment plans[J]. Med Phys, 2014, 41(2): 021716. DOI:10.1118/1.4861821 |
| [23] |
国家癌症中心/国家肿瘤质控中心. 调强放疗剂量验证实践指南[J]. 中华放射肿瘤学杂志, 2020, 29(12): 1021-1024. National Cancer Center/National Cancer Quality Control Center. Practice guideline of patient-specific dosimetric verification for intensity-modulated radiotherapy[J]. Chin J Radiat Oncol, 2020, 29(12): 1021-1024. DOI:10.3760/cma.j.cn113030-20200525-00273 |
| [24] |
Miften M, Olch A, Mihailidis D, et al. Tolerance limits and methodologies for IMRT measurement-based verification QA: Recommendations of AAPM Task Group No. 218[J]. Med Phys, 2018, 45(4): e53-e83. DOI:10.1002/mp.12810 |
 2023, Vol. 43
2023, Vol. 43


