2. 中国医学科学院北京协和医学院放射医学研究所, 天津 300192;
3. 郑州大学, 郑州 450001
2. Institute of Radiation Medicine, Peking Union Medical College and Chinese Academy of Medical Science, Tianjin 300192, China;
3. Zhengzhou University, Zhengzhou 450001, China
放射性肺纤维化(RIPF)是肿瘤患者胸部放射治疗后的严重并发症之一,其发生率为14.6%~37.2%[1]。RIPF不仅影响肿瘤放射治疗计划的实施,导致肿瘤控制率降低,还严重影响患者的生活质量。目前,临床上缺乏特异有效的治疗方法,预后较差。有文献报道,吡非尼酮具有抗纤维化的作用,能够改善特发性肺纤维化患者的肺功能、延长无进展生存时间[2],但吡非尼酮对RIPF的有效性需要更多的临床证据。因此,寻找逆转RIPF的药物具有重要意义。
近年来,有研究表明细胞衰老是RIPF的主要发病机制之一,抑制细胞衰老能够预防或逆转放射性肺纤维化的发生[3-5]。FOXO4已被证明通过与P53相互作用,发挥促进细胞衰老的作用[6]。FOXO4-DRI是一种靶向干扰FOXO4与P53相互作用的人工合成多肽,能够改善衰老小鼠的健康状态和肾脏功能[6-7]。前期研究发现,FOXO4-DRI能够靶向清除衰老细胞,逆转博来霉素诱导的肺纤维化[8]。本研究通过建立RIPF小鼠模型,探索FOXO4-DRI能否逆转RIPF并初步探讨其作用机制。
材料与方法1.实验动物:SPF级别的C57BL/6雄性小鼠,6~8周龄,体重19~21 g,购自北京华阜康生物科技有限公司[许可证号:SCXK(京)2019-0008]。
2. 仪器与试剂:主要仪器包括X射线辐照仪(德国Rad Source公司,RS-2000)、多功能凝胶成像仪(美国Bio-Rad公司,Chemi DocXRS)和实时荧光定量PCR仪(美国Life Technologies公司,ABI 7500)。FOXO4-DRI由上海诺优生物科技公司合成,其结构参考既往研究[6]。MASSON三色染色试剂盒购自北京索莱宝科技有限公司,羟脯氨酸比色测定试剂盒购自美国BioVision公司,β-半乳糖苷酶(β-gal)染色试剂盒购自江苏碧云天生物技术公司,小鼠活性氧(ROS)检测试剂盒购自上海研谨生物科技有限公司。SYBR Green Master试剂盒购自德国Roche公司。抗P21、P16Ink4a抗体购自美国Abcam公司。抗磷酸化P53(p-P53 ser15)、p-AKT、p-PI3K、AKT、PI3K、FOXO4和β-tubulin抗体购自美国Cell Signaling公司。
3.动物分组及处理:将48只小鼠随机分为4组:对照组、FOXO4-DRI组、照射组、照射+ FOXO4-DRI组,每组12只。实验处理流程见图 1。照射组和照射+ FOXO4-DRI组:小鼠麻醉后仰卧位固定于动物台上,右侧全胸部接受17 Gy X射线照射(射野2 cm × 2 cm,剂量率1.32 Gy/min)。对照组和照射组:照射后第16周和第20周分别腹腔注射磷酸盐缓冲液(PBS)溶液100 μl,隔天1次,1周3次。FOXO4-DRI组和照射+ FOXO4-DRI组:照射后第16周和第20周分别腹腔注射含5 mg/kg FOXO4-DRI的PBS溶液100 μl,隔天1次,1周3次。照射后第24周处死小鼠,收集其右肺组织,进行后续实验。
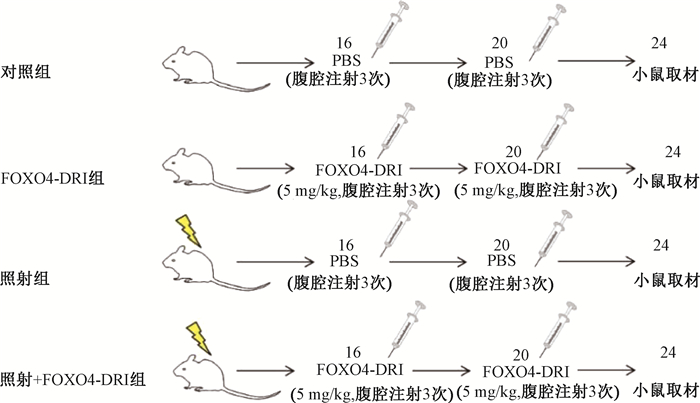
|
图 1 实验流程图 Figure 1 The diagram of experimental protocols |
4.组织形态学观察和免疫组织化学染色:取小鼠肺组织固定于10%甲醛溶液中,常规脱水、石蜡包埋、切片后进行HE染色和Masson三色染色,观察肺组织形态学改变和胶原沉积情况。Masson三色染色的切片,每张切片随机选择5个视野,应用Image Pro Plus 6.0软件分析每个视野中胶原组织占肺组织面积的百分比。应用免疫组织化学法检测肺组织中col1α1和α-SMA的表达,每张切片随机选择5个视野,应用Image Pro Plus 6.0软件分析每个视野中阳性表达的积分光密度,结果用相对积分光密度表达。
5. β-gal染色:小鼠肺组织的冰冻切片,使用试剂盒内固定液固定15 min后,PBS冲洗3次,滴加染色工作液,置于无CO2的37℃恒温箱内孵育过夜。PBS冲洗掉多余染色液后,0.2%核固红液室温复染5 min。PBS冲洗,封片后光学显微镜下观察。
6. 羟脯氨酸含量测定:肺组织加入去离子水中均质化,组织匀浆加入浓HCl中120℃水解3 h。水解后的样本和试剂盒内的标准品均加入氯胺T工作液,室温孵育5 min,再加入DMAB工作液,60℃孵育90 min。检测560 nm吸光度A,根据标准曲线,计算每个样品对应羟脯氨酸的质量。
7. qRT-PCR:应用TRIzol研磨肺组织提取RNA,反转录试剂盒制备cDNA,利用ABI 7500实时荧光定量PCR仪和SYBR Green Master试剂盒及所列引物进行PCR,以GAPDH为内参根据公式2-ΔΔCt计算基因的相对表达量。引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primers sequences |
8.Western blot:肺组织加入RIPA裂解液和蛋白酶抑制剂进行研磨,冰上裂解后提取上清,BCA试剂盒检测蛋白浓度。等量的蛋白通过12%或6%聚丙烯酰胺(SDS-PAGE)凝胶电泳分离,浓缩胶80 V恒压电泳30 min,分离胶80 V恒压电泳至分离胶下缘。1%BSA-TBST溶液室温封闭2 h,TBST洗膜后,1%BSA配置一抗P21 (1∶1 000)、P16Ink4a (1∶1 000)、p-P53 (ser15)(1∶1 000)、p-AKT(1∶1 000)、p-PI3K(1∶1 000)、AKT(1∶1 000)、PI3K(1∶1 000)、FOXO4(1∶1 000),一抗4 ℃孵育过夜。TBST洗去多余一抗,1%BSA配制二抗(1∶5 000),室温孵育2 h,TBST洗去多余二抗。滴加显影液,多功能凝胶成像仪进行成像。
9. ROS测定:取部分肺组织置于4℃ PBS中研磨,离心取上清,利用小鼠ROS试剂盒加样后37℃温育30 min,洗涤液洗涤后,加入酶标试剂37℃温育30 min。洗涤液洗涤后,加入显色剂37℃避光孵育15 min,加入终止液,酶标仪检测450 nm吸光度A。
10. 统计学处理:采用SPSS 25.0软件进行统计学分析。数据服从正态分布,用x±s表示,两组间均数的比较采用独立样本t检验。P < 0.05为差异有统计学意义。
结果1. FOXO4-DRI改善小鼠RIPF:小鼠右肺照射24周后处死,收集右肺进行后续实验。HE染色显示,与对照组相比,受照小鼠肺泡壁增厚,肺泡间隔增宽,炎症细胞浸润增加,胶原纤维组织沉积增加;FOXO4-DRI的应用能够改善照射诱导的肺组织形态学改变。如图 2所示,MASSON染色显示,与对照组相比,受照小鼠肺组织胶原纤维(蓝染)面积明显增加[(3.150±0.706)% vs. (21.840±2.875)%,t=-19.97,P < 0.001],而FOXO4-DRI的应用使受照小鼠肺组织中胶原纤维的沉积[(13.940±2.839)%,t=6.18,P < 0.001]。免疫组织化学结果显示,与对照组相比,受照小鼠肺组织中col1α1和α-SMA表达显著增加(1.008±0.166 vs. 2.897±0.518和1.027±0.224 vs. 3.035±0.775,t=-8.51、-6.10,P < 0.001),而FOXO4-DRI降低了照射后小鼠肺组织中col1α1和α-SMA的表达(2.897±0.518 vs. 1.684±0.366和3.035±0.775 vs. 1.873±0.437,t=4.69、3.20,P < 0.05)。羟脯氨酸是胶原蛋白的主要成分之一,通过检测羟脯氨酸可以评估组织中胶原组织的含量。与对照组相比,受照小鼠肺组织中羟脯氨酸含量明显升高[(0.521±0.028)μg/mg vs. (1.007±0.203)μg/mg,t=-5.30,P=0.005],而FOXO4-DRI降低了受照小鼠肺组织中的羟脯氨酸含量[(1.007±0.203)μg/mg vs. (0.672±0.652)μg/mg,t=3.52,P=0.018]。
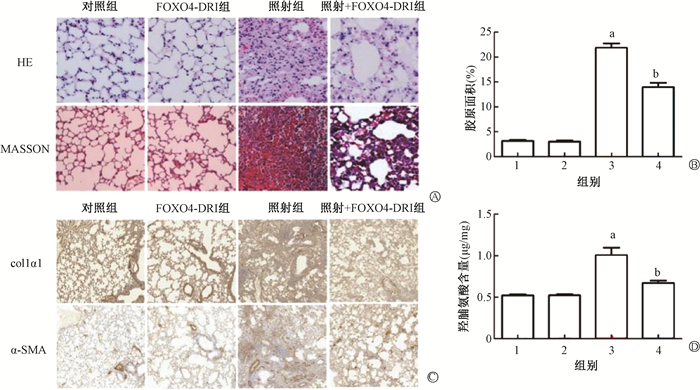
|
注:1. 对照组;2. FOXO4-DRI组;3. 照射组;4. 照射+FOXO4-DRI组。a与对照组比较,t=-19.97、3.52, P < 0.05; b与照射组比较,t=6.18、-5.30, P < 0.05 图 2 不同染色方法观察FOXO4-DRI照射与FOXO4-DRI对小鼠RIPF的影响 A. 小鼠肺组织HE染色和MASSON染色×200; B. MASSON染色中胶原组织占肺组织面积的百分比; C. 小鼠肺组织col1α1和α-SMA免疫组织化学染色×100; D. 单位重量小鼠肺组织中羟脯氨酸的含量 Figure 2 FOXO4-DRI attenuated RIPF in mice A. HE staining and MASSON staining of lung tissue ×200; B. The percentage of collagen area in the lung tissue with MASSON staining; C. col1α1 and α-SMA in the lung tissue ×100; D. The content of hydroxyproline in the lung tissue of mice per unit weight |
2. FOXO4-DRI减轻RIPF小鼠肺组织的衰老:如图 3所示,β-gal染色结果显示,与对照组相比,照射组小鼠肺组织中β-gal阳性细胞的数量显著增加(t=-23.55,P < 0.001),而FOXO4-DRI的应用减少了照射后小鼠肺组织中β-gal阳性细胞的数量(t=6.09,P < 0.001)。qRT-PCR结果提示,与对照组相比,照射组小鼠肺组织中P21和P16Ink4a mRNA表达显著升高(t=-17.12、-8.58,P < 0.001),而FOXO4-DRI能够抑制受照小鼠肺组织中P21和P16Ink4a mRNA的表达(t=5.31、4.77,P < 0.001)。Western blot结果也提示照射诱导小鼠肺组织中p-P53(ser15)、P21和P16Ink4a蛋白表达增加(t=-3.83、-3.91、-4.86,P < 0.05),FOXO4-DRI抑制接受照小鼠肺组织中P21和P16Ink4a蛋白的表达(t=3.32、3.37,P < 0.05),但上调p-P53(ser15) 蛋白的表达(t=-2.82,P < 0.05)。此外,照射还诱导小鼠肺组织中衰老相关分泌表型(SASP)基因IL-1α、IL-1β、TNF-α和MMP2表达升高(t=-10.66、-8.98、-8.38、8.49,P < 0.001),而FOXO4-DRI抑制照射后小鼠肺组织中IL-1α、IL-1β、TNFα和MMP2基因的表达(t=4.36、4.84、4.47、3.82,P < 0.05)。
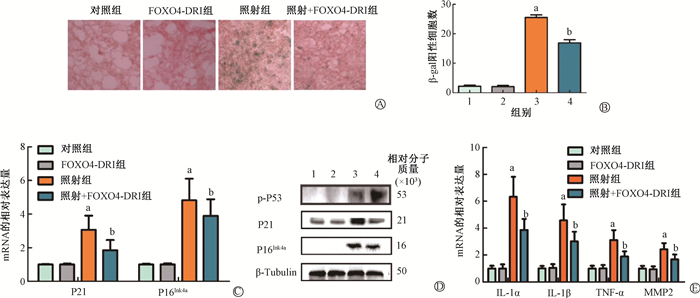
|
注:1. 对照组;2. FOXO4-DRI组;3. 照射组;4. 照射+FOXO4-DRI组。a与对照组比较,t=-23.55、-17.12、-8.58、-10.66、-8.98、-8.38、8.49,P < 0.05;b与照射组比较,t=6.09、5.31、4.77、4.36、4.84、4.47、3.82,P < 0.05 图 3 FOXO4-DRI减轻RIPF小鼠肺组织的衰老 A. 小鼠肺组织β-gal染色×200; B. β-gal染色每个视野中β-gal阳性细胞的数量; C. qRT-PCR检测肺组织中P21和P16Ink4a mRNA的相对表达量; D.Western blot检测p-P53(ser15)、P21和P16Ink4a蛋白表达; E. qRT-PCR检测SASP基因的相对表达量 Figure 3 FOXO4-DRI attenuated radiation-induced cell senescence in the lung tissue of mice A. β-gal staining in the lung tissue; B. The number of β-gal positive cells in each field of β-gal staining; C. The relative expression levels of P21and P16Ink4a mRNA detected by qRT-PCR; D. p-P53(ser15), P21and P16Ink4a protein expression detected by Western blot; E. The relative expression levels of SASP genes detected by qRT-PCR |
3.FOXO4-DRI能够降低RIPF小鼠肺组织的氧化应激水平和上调PI3K/AKT信号通路:如图 4所示,ROS检测显示,与对照组相比,照射组小鼠肺组织的ROS水平升高[(0.999±0.174)vs.(1.748±0.163),t=-7.00,P < 0.001],而FOXO4-DRI能够降低接受照射小鼠肺组织的ROS水平[(1.748±0.163) vs. (1.449±0.169),t=2.84,P=0.022]。与对照组相比,照射组小鼠肺组织中FOXO4 mRNA表达水平显著升高(t=-7.43,P < 0.001),而FOXO4-DRI能够使照射后小鼠肺组织中FOXO4基因的表达下降(t=2.33,P=0.033),见图 4。Western blot分别检测FOXO4、AKT、PI3K和p-AKT、p-PI3K的表达,以p-AKT与AKT相对表达量的比值代表p-AKT的激活水平,以p-PI3K与PI3K的相对表达量的比值代表p-PI3K的激活水平。结果显示,照射诱导小鼠肺组织中FOXO4、蛋白表达升高(t=-3.65,P=0.022),FOXO4-DRI能够使接受照射小鼠肺组织中FOXO4蛋白的表达下降(t=2.84,P=0.047)。照射诱导小鼠肺组织中p-AKT和p-PI3K的激活水平显著升高(t=-3.78、-8.85,P < 0.05),但FOXO4-DRI却促进了接受照射小鼠肺组织中p-AKT和p-PI3K蛋白的激活(t=-7.13、-12.61,P < 0.05)。
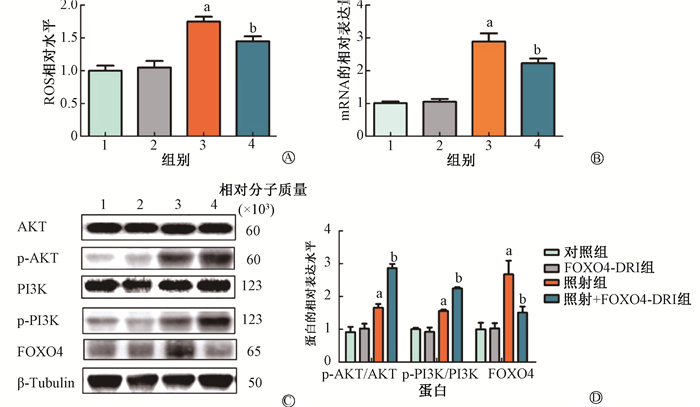
|
注:1. 对照组;2. FOXO4-DRI组;3. 照射组;4. 照射+FOXO4-DRI组。a与对照组比较,t=-7.00、-7.43、3.78、-8.85、-3.65,P < 0.05;b与照射组比较,t=2.84、2.33、-7.13、-12.61、2.84,P < 0.05 图 4 FOXO4-DRI降低RIPF小鼠肺组织的氧化应激水平和上调PI3K/AKT信号通路的表达 A. 小鼠肺组织ROS的相对水平; B. qRT-PCR检测小鼠肺组织中FOXO4 mRNA的相对表达水平; C~D. FOXO4、p-AKT/AKT和p-PI3K/PI3K蛋白的相对表达水平 Figure 4 FOXO4-DRI decreased the ROS level and up-regulated the protein expressions of PI3K/AKT signaling pathway in the lung of RIPF mice A. The relative ROS level in the lung tissue; B. The relative expression level of FOXO4 mRNA detected by qRT-PCR; C-D. The relative expression levels of FOXO4, p-AKT/AKT and p-PI3K/PI3K protein |
讨论
放射性肺损伤是影响胸部肿瘤放疗的重要限制因素之一,包括早期出现的放射性肺炎和后期发生的RIPF两个阶段。放射性肺损伤发生发展的本质是肺组织因受到放射线损伤而引起的修复反应,是由肺泡上皮细胞、炎症细胞、血管内皮细胞、成纤维细胞等多种细胞共同参与[9]。在急性期,其病程包括肺泡上皮细胞、血管内皮细胞的损伤,炎症细胞的招募和细胞因子瀑布的启动等。当持续的损伤超过了肺组织的修复能力时,成纤维细胞向肌成纤维细胞转化,结缔组织大量增生,胶原逐渐沉积,肺组织的功能逐渐丧失,形成RIPF[10]。本研究建立了RIPF小鼠模型,FOXO4-DRI能够改善放射诱导的肺组织形态学改变,包括抑制肺泡塌陷和肺泡壁增厚,减少炎症细胞浸润和胶原纤维组织沉积。Ⅰ型胶原是细胞外基质(ECM)的主要成分,也是器官纤维化时病变部位沉积的主要ECM成分。肺内产生ECM的主要细胞是肌成纤维细胞,其胞浆表达α-SMA,是导致肺纤维化的主要作用细胞[11-12]。本研究发现FOXO4-DRI能够抑制照射诱导的肺组织中Ⅰ型胶原α1,即col1α1及α-SMA的表达,提示FOXO4-DRI可能通过抑制照射诱导的成纤维细胞向肌成纤维细胞转化,从而减少了肺组织中Ⅰ型胶原的沉积。
越来越多的证据表明,细胞衰老在RIPF发生中发挥重要作用,照射后小鼠肺组织中衰老细胞增加,以Ⅱ型肺泡上皮细胞为主[9, 13-14]。衰老细胞β-gal活性增强,能够分泌有炎性细胞因子、生长因子、趋化因子和金属蛋白酶等SASP,使肺组织受到慢性炎症刺激,诱导上皮-间质转化,促进肺纤维化的发生[4, 15]。本研究发现,FOXO4-DRI能够减少RIPF小鼠肺组织中衰老细胞的数量,抑制SASP的表达,抑制衰老相关通路蛋白P21和P16Ink4a的表达。其机制可能是FOXO4-DRI通过靶向干扰FOXO4与P53相互作用,促进活化p-P53(ser15)排出胞核,激活caspase依赖的线粒体凋亡通路,促进衰老细胞的凋亡[6],但仍需进一步实验验证。此外,本研究发现FOXO4-DRI不影响未受照射小鼠肺组织中FOXO4的表达,原因可能是FOXO4-DRI的作用在于靶向干扰FOXO4与P53相互作用,不是直接抑制FOXO4的表达。未受照射细胞中FOXO4表达量很低,FOXO4-DRI对FOXO4表达的影响不显著;而照射导致细胞衰老,衰老细胞中FOXO4表达显著升高,FOXO4-DRI可通过抑制细胞衰老等机制导致FOXO4表达显著下降,与Baar等[6]的报道一致。
氧化应激、端粒缩短、DNA损伤等是诱导细胞衰老的应激压力,同时也是促进肺纤维发生的因素[4, 16]。FOXO4已经被证明能够促进细胞衰老,细胞内ROS水平的升高促进FOXO4的活化,而活化的FOXO4与氧化应激之间形成正反馈循环,诱导细胞衰老[7, 17]。Liu等[18]发现FOXO4上游的PI3K-AKT信号通路的活化能够抑制FOXO4介导的氧化应激。PI3K-AKT信号通路已被证实在肺纤维化过程中发挥重要作用,而加强PI3K-AKT信号通路的活化却促进了放射性肺损伤中肺组织的再生和修复[19-20],提示PI3K-AKT信号通路在肺纤维化中作用的双面性。本研究发现FOXO4-DRI在照射诱导细胞衰老的肺组织中能够激活PI3K-AKT信号通路,下调FOXO4的表达,降低RIPF肺组织的氧化应激水平。除了PI3K-AKT信号通路,FOXO4-DRI是否通过其他信号通路发挥作用,有待后续通过多组学等方法进一步筛选和探索。
综上,本研究表明,FOXO4-DRI通过上调PI3K-AKT信号通路,减少肺组织中氧化应激、抑制细胞衰老,逆转RIPF的进程,为临床RIPF的治疗提供新策略。
利益冲突 无
作者贡献声明 韩晓丹负责实验设计、实验操作、数据整理、起草论文;苑通、宋迪协助部分实验操作数据分析;张俊伶、石永刚指导实验设计和论文修改
| [1] |
Benveniste MF, Welsh J, Godoy MC, et al. New era of radiotherapy: an update in radiation-induced lung disease[J]. Clin Radiol, 2013, 68(6): e275-290. DOI:10.1016/j.crad.2013.01.013 |
| [2] |
King TE Jr, Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis[J]. N Engl J Med, 2014, 370(22): 2083-2092. DOI:10.1056/NEJMoa1402582 |
| [3] |
He Y, Thummuri D, Zheng G, et al. Cellular senescence and radiation-induced pulmonary fibrosis[J]. Transl Res, 2019, 209: 14-21. DOI:10.1016/j.trsl.2019.03.006 |
| [4] |
Schafer MJ, White TA, Iijima K, et al. Cellular senescence mediates fibrotic pulmonary disease[J]. Nat Commun, 2017, 8: 14532. DOI:10.1038/ncomms14532 |
| [5] |
赵雯月, 李娜, 李科君, 等. 牙龈间充质干细胞抑制Ⅱ型肺泡上皮细胞衰老预防放射性肺纤维化[J]. 中华放射医学与防护杂志, 2022, 42(11): 830-838. Zhao WY, Li N, Li KJ, et al. Gingival mesenchymal stem cells inhibited senescence of type Ⅱ alveolar epithelial cells and prevented radiation-induced pulmonary fibrosis[J]. Chin J Radiol Med Prot, 2022, 42(11): 830-838. DOI:10.3760/cma.j.cn112271-20220823-00341 |
| [6] |
Baar MP, Brandt RMC, Putavet DA, et al. Targeted apoptosis of senescent cells restores tissue homeostasis in response to chemotoxicity and aging[J]. Cell, 2017, 169(1): 132-147.e16. DOI:10.1016/j.cell.2017.02.031 |
| [7] |
Bourgeois B, Madl T. Regulation of cellular senescence via the FOXO4-p53 axis[J]. FEBS Lett, 2018, 592(12): 2083-2097. DOI:10.1002/1873-3468.13057 |
| [8] |
Han X, Yuan T, Zhang J, et al. FOXO4 peptide targets myofibroblast ameliorates bleomycin-induced pulmonary fibrosis in mice through ECM-receptor interaction pathway[J]. J Cell Mol Med, 2022, 26(11): 3269-3280. DOI:10.1111/jcmm.17333 |
| [9] |
Wang P, Yan Z, Zhou PK, et al. The promising therapeutic approaches for radiation-induced pulmonary fibrosis: targeting radiation-induced mesenchymal transition of alveolar type Ⅱ epithelial cells[J]. Int J Mol Sci, 2022, 23(23): 15014. DOI:10.3390/ijms232315014 |
| [10] |
Huang Y, Zhang W, Yu F, et al. The cellular and molecular mechanism of radiation-induced lung injury[J]. Med Sci Monit, 2017, 23: 3446-3450. DOI:10.12659/msm.902353 |
| [11] |
Staab-Weijnitz CA. Fighting the fiber: targeting collagen in lung fibrosis[J]. Am J Respir Cell Mol Biol, 2022, 66(4): 363-381. DOI:10.1165/rcmb.2021-0342TR |
| [12] |
Misharin AV, Budinger GRS. Targeting the myofibroblast in pulmonary fibrosis[J]. Am J Respir Crit Care Med, 2018, 198(7): 834-835. DOI:10.1164/rccm.201806-1037ED |
| [13] |
Lehmann M, Korfei M, Mutze K, et al. Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo[J]. Eur Respir J, 2017, 50(2): 1602367. DOI:10.1183/13993003.02367-2016 |
| [14] |
Pan J, Li D, Xu Y, et al. Inhibition of Bcl-2/xl with ABT-263 selectively kills senescent type Ⅱ pneumocytes and reverses persistent pulmonary fibrosis induced by ionizing radiation in mice[J]. Int J Radiat Oncol Biol Phys, 2017, 99(2): 353-361. DOI:10.1016/j.ijrobp.2017.02.216 |
| [15] |
Hernández L, Terradas M, Camps J, et al. Aging and radiation: bad companions[J]. Aging Cell, 2015, 14(2): 153-161. DOI:10.1111/acel.12306 |
| [16] |
López-Ramírez C, Suarez Valdivia L, Rodriguez Portal JA. Causes of pulmonary fibrosis in the elderly[J]. Med Sci (Basel), 2018, 6(3): 58. DOI:10.3390/medsci6030058 |
| [17] |
Essers MA, Weijzen S, de Vries-Smits AM, et al. FOXO transcription factor activation by oxidative stress mediated by the small GTPase Ral and JNK[J]. EMBO J, 2004, 23(24): 4802-4812. DOI:10.1038/sj.emboj.7600476 |
| [18] |
Liu H, Wang L, Weng X, et al. Inhibition of Brd4 alleviates renal ischemia/reperfusion injury-induced apoptosis and endoplasmic reticulum stress by blocking FoxO4-mediated oxidative stress[J]. Redox Biol, 2019, 24: 101195. DOI:10.1016/j.redox.2019.101195 |
| [19] |
Wang J, Hu K, Cai X, et al. Targeting PI3K/AKT signaling for treatment of idiopathic pulmonary fibrosis[J]. Acta Pharm Sin B, 2022, 12(1): 18-32. DOI:10.1016/j.apsb.2021.07.023 |
| [20] |
Chen S, Li K, Zhong X, et al. Sox9-expressing cells promote regeneration after radiation-induced lung injury via the PI3K/AKT pathway[J]. Stem Cell Res Ther, 2021, 12: 381. DOI:10.1186/s13287-021-02465-9 |
 2023, Vol. 43
2023, Vol. 43


