2. 天津医科大学肿瘤医院放射科 国家肿瘤临床医学研究中心 天津市肿瘤防治重点实验室 天津市恶性肿瘤临床医学研究中心 乳腺癌防治教育部重点实验室, 天津 300060
2. Department of Radiology, Tianjin Medical University Cancer Institute & Hospital, National Clinical Research Center for Cancer, Tianjin Key Laboratory of Cancer Prevention and Therapy, Tianjin's Clinical Research Center for Cancer, Key Laboratory of Breast Cancer Prevention and Therapy, Tianjin 300060, China
2020年,全球女性乳腺癌新发病例为第1,占所有癌症新发病例数的11.7%;死亡病例为第5,占所有癌症合并死亡人数的6.9%[1],严重威胁着女性的身体健康。乳腺癌筛查是防治乳腺癌的关键,乳腺X射线摄影(mammography,MG)作为国际公认的乳腺癌筛查金标准[2],在其中发挥了重要作用。在我国的乳腺癌筛查指南中,针对不同风险人群都提出了定期接受MG的建议[3]。但X射线具有诱发癌症的随机性效应,MG在提高乳腺癌检出率的同时会增加女性群体罹患乳腺癌的风险[4],且这种风险会随着剂量的增加而变大。国际放射防护委员会(ICRP)103号报告[5]将乳腺的组织权重因子从0.05调整到0.12,说明乳腺组织对辐射非常敏感。因此,在保证MG检查图像质量的同时,应尽量控制其辐射剂量,降低辐射随机性效应发生的概率。
本文对临床常用的几种乳腺X射线摄影技术的检查模式,受检者辐射剂量评估方法及辐射剂量的相关影响因素等研究现状进行综述,为进一步开展乳腺X射线摄影中受检者受照剂量水平的研究提供参考。
一、不同乳腺X射线设备检查模式传统MG是指包括屏片乳腺X射线摄影(screen-film mammography,SFM)、乳腺计算机X射线摄影(computed radiography for mammography,CRM)和数字乳腺X射线摄影(digital mammography,DM)在内的二维乳腺X射线摄影技术。近年来,包括数字乳腺体层合成摄影(digital breast tomosynthesis,DBT)和乳腺锥形束CT(cone beam computed tomography,CBCT)在内的新型乳腺X射线技术被逐渐开发并应用于临床。目前国内最常使用的MG设备仍是DM,在2017—2019年的全国医疗放射诊断资源基本情况的调查中,DM占全国乳腺X射线摄影机的61.4%[6]。
二维MG属于投影式成像,检查时需要对受检乳房进行压迫,使乳房腺体组织均匀铺开,X射线管在整个检查过程中保持固定。在乳腺癌筛查和一般临床检查中,通常需要对两侧乳房分别进行头尾位(craniocaudal,CC)和侧斜位(mediolateral oblique,MLO)两个方向上的检查。
DBT是在MG的基础上发展起来的技术,采用与MG相同的压迫方式,不同的是,在检查过程中,X射线管会围绕乳房进行一定角度的旋转,从多个角度进行多次曝光以获得一系列二维图像,后被重建为一组不同厚度下的体层影像,可视为“伪三维”影像。在临床检查中,一般会对两侧乳房分别进行CC位和MLO位的检查。
乳腺CBCT是一种较新的三维乳腺扫描技术,在检查过程中,不需要对乳房进行压迫,受检乳房自然下垂,利用半锥形束的X射线和平板探测器围绕整个乳房进行360°的旋转扫描,在检查过程中会获取几百幅不同角度的乳房投影图像,再经过计算机重建生成包含数百个图层的三维动态影像,包括乳房的横断面、矢状面、冠状面及3D视图,既能观察全乳整体,又能采集到乳腺局部的信息[7]。在一般临床检查中,每侧乳房需分别进行成像检查。
二、受检者剂量评估现状1. 剂量评估方法:乳腺癌大多始于腺体或导管上皮,平均腺体剂量(average glandular dose,AGD)被认为是乳腺X射线摄影中评估受检者剂量较适宜的指标[8],定义为在进行乳腺X射线检查时受检者乳房中的腺体组织(不包括皮肤和脂肪组织)对电离辐射的平均吸收剂量。在实际研究中,AGD并不能在受检者乳房上直接进行测量,只能通过测量特定位置的空气比释动能(air kerma,Kair),再乘以一定的转换因子来计算获得。常用的剂量评估方法包括蒙特卡罗(Monte Carlo,MC)模拟法和实验测量法。
MC模拟法是一种基于“随机数”的计算方法。乳腺X射线受检者AGD会受多方面因素的影响,在测量条件有限时,可通过MC程序来构建剂量测量模型,进而模拟计算出一系列转换因子(conversion factor,CF)用于剂量计算,CF为测量值与实际辐射剂量间的转换因子,受设备类型、乳房特征以及辐射场几何特征等因素的影响,计算公式为AGD=Kair·CF。常用于乳腺X射线剂量模拟的MC程序主要包括MCNP[9]、GATE和GEANT4[10]等。尽管MC模拟简单易行,由于在剂量估算时一些实际参数无法精确确定,仅是研究者对其进行的合理假设,因此MC模拟结果可作为实际剂量的参考值,与实验测量方法结果相互对照,不能完全代替实验测量[11]。
实验测量法是利用由组织等效材料制成的乳房仿真模体来代替乳房进行X射线检查,并在模体内部或表面放置探测器来测量辐射剂量的方法。此时的AGD等于Kair乘以空气与乳房组织质能吸收系数μen/ρ的修正因子,即
|
|
表 1 不同组织材料的质能吸收系数μen/ρ[13] (cm2/g) Table 1 Mass energy absorption coefficients (μen/ρ) of different tissue materials (cm2/g) |
2. 不同乳腺X射线设备辐射剂量评估现状
(1) MG的辐射剂量评估:多年来,MG的剂量学研究已相对成熟,目前国际上常用的MG中AGD的评估方法主要包括英国的Dance等[14]提出的计算公式和转换因子,以及美国的Wu等[9]和Boone[15]提出的方法。根据MG的检查模式,通常把检查过程中受压迫的乳房定义成一个由一个中央部分(由腺体组织和脂肪组织的均匀混合物组成)和一个具有一定厚度的外部皮肤或脂肪区组成的半圆柱体模型,这种模型又被称为简单几何模型[16]。以该模型为基础,在乳房上表面的皮肤入射处(不包括反散射)测量Kair,并使剂量仪探头的灵敏区域位于胸壁侧向内40 mm的中线上(图 1)。对于不同的乳房压迫厚度、腺体密度和靶/滤过材料,Dance等[14]分别给出了相应的转换因子g、c和s,而Wu等[9]和Boone[15]则是把这些因素归一化成一个相对平均腺体剂量的转换因子DgN。
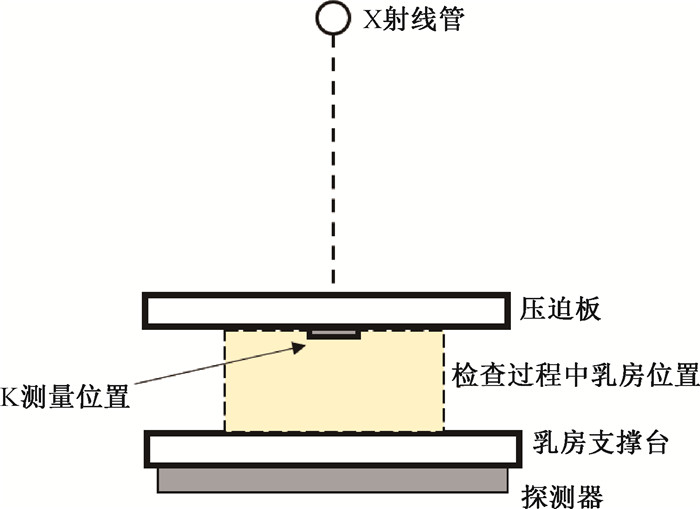
|
图 1 乳腺X射线摄影的空气比释动能测量示意图 Figure 1 Schematic of air Kerma measurement of mammography |
目前国际上的一些国家已经陆续开展了MG受检者辐射剂量水平的调查,并制定了相应的诊断参考水平(diagnostic reference level,DRL)[17-19]。在英国的一项回顾性调查中,接受MG乳腺癌筛查人群的AGD平均水平为(1.75±0.03)mGy(MLO位)和(1.57±0.03)mGy(CC位)[20]。土耳其的调查显示,大多数MG受检者的AGD水平在1.6 ~ 2.0 mGy (MLO位)和1.1 ~ 1.5 mGy(CC位)[21]。我国乳腺X射线摄影中受检者AGD平均水平为1.46 mGy(MLO位)和1.41 mGy(CC位)[22]。英国[23]、欧洲[24]和国际原子能机构(IAEA)的相关出版物[25]中都使用了Dance等[14]的转换因子,美国放射学会(ACR)曾基于Wu等[9]和Bonne[15]所提出的转换因子来进行剂量评估,而在2018年发布的质量控制手册[26]中则改用了Dance等[14]的转换因子;我国的质量控制检测卫生行业标准中参考了Dance等[14]的转换因子[27]。
(2) DBT的辐射剂量评估:DBT在检查时采用与MG相同的压迫方式,因此所使用的乳房模型与MG基本相同。不同的是,X射线管在检查过程中会进行一定角度的旋转,因此在进行剂量评估时需在MG的基础上增加一个与角度相关的转换因子。Sechopoulos等[28]在Wu等[9]的基础上,提出了相对腺体剂量[relative glandular dose(α),RGD(α)]的概念,即当X射线源位于非零投影角α°处时的相对腺体剂量。对于给定的DBT系统,整个DBT投影集的总输出量在所有投影中被平均分配,RGD(α)仅与X射线的入射角度有关,因此可以用整个投影的平均相对腺体剂量μRGD来代替。同样,在Dance等[29]对DBT辐射剂量的研究中也引入了因子T,与其在MG剂量研究中提出的g、c、s构成一组计算腺体剂量的转换因子,不同学者提出的AGD计算公式的比较见表 2。
|
|
表 2 MG和DBT中受检者AGD计算方法比较 Table 2 Comparison of calculation methods for patient AGD in MG and DBT |
(3) 乳腺CBCT的辐射剂量评估:乳腺CBCT检查不需要对受检乳房进行压迫,因此在乳腺CBCT的受检者剂量评估中,对于乳房模型的假设以及空气比释动能的测量位置都与MG和DBT不同。目前相关剂量学研究普遍接受了半椭球形[30]这一几何结构来代替悬垂乳房,其长半轴代表胸壁至乳头的距离,短轴侧表示乳房的直径。剂量计算方法则延用了上述MG的剂量测量公式,Kair可通过100 mm长的笔形电离室在X射线旋转中心轴向下垂直测量(图 2)。此时的转换因子CF为相对归一化腺体剂量系数DgNCT[31-32]。除MC模拟法之外,现有研究中用到过电离室剂量计、热释光剂量计以及胶片剂量计来进行实验测量[33-34]。一般来说,电离室性质稳定且精度高,常用于医学剂量评价,但电离室探头往往体积较大,容易受模体形状的影响,不能满足不同位置处的测量需求。热释光剂量计则可根据实验需求放置在乳房模体内部测量不同位置的剂量分布情况以及乳房受照剂量水平。而胶片法因其角响应问题,会因乳腺CBCT扫描中胶片所接受的X射线角度不同而导致较大的剂量误差。
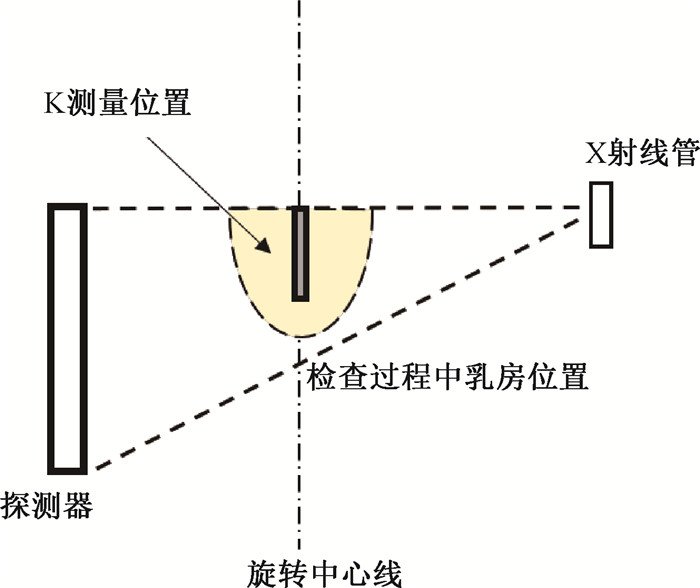
|
图 2 乳腺CBCT的空气比释动能测量示意图 Figure 2 Schematic of air Kerma measurement of CBCT for breasts |
乳腺CBCT在近几年来才逐渐应用于临床,其剂量评估方法仍处于初步研究阶段。目前国际上对于乳腺CBCT的剂量学研究多倾向于方法学的研究和仪器性能的研究,以及非压迫乳房特征的研究,鲜见国际出版物推荐普遍公认的剂量学评估方法。
(4) 国内剂量评估研究现状:国内全国剂量调查[22]和质量控制规范[27]中均使用了Dance等[14]开发的剂量计算公式和转换因子,是基于当地女性乳房特征所开发的,亚洲女性在无论在乳房大小还是腺体成分等方面都与其存在相当程度的差异[35]。近年来,清华大学邱睿团队根据我国女性MG摄影二维图像,构建了更贴近于我国女性乳房特征的3 D精细乳腺模型以及相应的压迫乳房模型[36],并将其应用于受检者剂量MC模拟,在其研究中计算了不同X射线、靶/滤过组合下,不同腺体密度和压迫厚度乳房的转换因子DgN,将其结果与Dance等[14]研究中简单乳房模型中的转换系数进行比较,差异为5.4%~38.0%。在Du等[37]对江苏1 828例乳腺X射线摄影中平均腺体剂量的研究中也得到了证实。近期,国内多项研究均开展了我国女性乳房密度特征的调查[38-39],可为建立更加准确的我国女性乳房一般模型提供参考。
三、平均腺体剂量的影响因素1. 不同类型设备对平均腺体剂量的影响:不同类型的X射线检查设备由于其靶/滤过材料、曝光参数和检查模式的不同,对受检者乳房所造成的辐射剂量也存在差异。
MG/DBT的靶材料一般有钼靶、铑靶、钨靶等,可选择的管电压在20 ~ 40 kV之间。一项全国范围的调查显示,我国女性在进行MG检查时所采用的管电压中位数为28 kV,管电流时间积的中位数为55 mAs[22]。表 3列举了DM和DBT检查中受检者剂量对比实验的研究结果[40-43]。可见DBT的辐射较高,可能与其动态扫描的检查模式有关。国内现有乳腺CBCT设备使用的靶/滤过材料为钨/铝组合,使用更高的管电压(49 kV)和管电流时间积(30 ~ 480 mAs)。有研究利用科宁公司的乳腺CBCT原型机调查了132例受检者的DICOM显示剂量并对其进行修正,所得双侧乳房总AGD的均值和中位数分别为13.9和12.6 mGy,作者提出了未来的工作将研究减少和优化乳腺CBCT辐射剂量的方法[44]。以往的乳腺CBCT受检者剂量研究中缺少大规模受检群体的乳房特征和剂量调查,缺乏可参考的临床剂量水平,有待进一步调查。
|
|
表 3 部分文献DM和DBT受检者平均腺体剂量对比研究结果 Table 3 Results of some comparative studies on average glandular doses during DM and DBT |
2. 受检者乳房特征对平均腺体剂量的影响因素:受检乳房特征对AGD的影响主要体现在乳房大小和乳房腺体密度两个方面。乳房大小在MG/DBT检查中表现为压迫乳房厚度(compressed breast thickness,CBT),AGD与CBT呈正相关[20],CBT越大,X射线衰减越严重,所需曝光条件越大,相应的AGD也会更高,我国女性CBT的平均水平为4.2 cm/4.5 cm(CC/MLO)[22],而在乳腺CBCT中更关注的是乳房的胸壁截面直径和胸壁到乳头的距离[31]。乳腺密度作为剂量评估的转换因子[14, 31],是影响受检者AGD的重要因素。其原因是物质密度是影响X射线衰减的主要因素,腺体密度越高,其本身吸收的X射线越多,满足相同摄影要求时所需要的曝光条件更大,进而影响受检者AGD[41]。不同人群乳房的腺体密度往往不同,一项关于种族和乳腺密度关系的研究发现,亚洲女性乳房的致密度最高[35]。
四、总结与展望乳房中的腺体组织是辐射敏感组织,对受检者剂量水平的研究可以为乳腺X射线摄影设备的选择和合理使用提供依据,并可以为受检者风险评估研究提供基础数据支持。目前国际上对于DM和DBT受检者剂量的评估方法已经相对成熟,而乳腺CBCT属于较新的乳腺检查设备,在临床诊断上表现出良好的应用价值[7],但辐射剂量表征和测量方面的研究较少,缺乏基于临床受检者的辐射剂量水平的实测研究。同时,Hernandez等[45]曾根据乳房直径、体积和纤维腺体的三维分布特点设计了一个腺体组织不均匀分布的仿真压迫乳房模型用于剂量评估,并与Boone[15]的均质乳房模型的测量结果进行对比,结果发现使用均匀乳房模型对辐射剂量的估计会偏高大约30%,说明除腺体密度外,乳房内腺体组织和脂肪组织的分布也会影响辐射剂量水平,以往以简单几何模型为基础的剂量评估方法并不能反映X射线辐射在受检乳房中实际的吸收和分布情况,对女性乳房一般特征的认识仍需进一步了解。
综上,未来的乳腺剂量学研究中,一是可进一步开展我国不同地区女性乳房一般特征调查,建立贴近我国妇女乳房真实特征的模型;二是随着我国乳腺CBCT设备临床应用逐渐广泛,急需开展乳腺CBCT临床受检者剂量评估和调查研究,为临床上乳腺X射线检查设备的合理选择和我国乳腺X射线受检者受照剂量评估提供依据。
利益冲突 无
作者贡献声明 薛珂负责文献调研和论文撰写;徐辉指导论文撰写与修改;岳保荣、丁艳秋、叶兆祥参与论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Cömert D, van Gils CH, Veldhuis WB, et al. Challenges and changes of the breast cancer screening paradigm[J]. J Magn Reson Imaging, 2023, 57(3): 706-726. DOI:10.1002/jmri.28495 |
| [3] |
沈松杰, 孙强, 黄欣, 等. 中国女性乳腺癌筛查指南(2022年版)[J]. 中国研究型医院, 2022, 9(2): 6-13. Shen SJ, Sun Q, Huang X, et al. Breast cancer screening guideline for Chinese women(version 2022)[J]. Chin J Res Hosp, 2022, 9(2): 6-13. DOI:10.19450/j.cnki.jcrh.2022.02.003 |
| [4] |
Miglioretti DL, Lange J, van den Broek JJ, et al. Radiation-induced breast cancer incidence and mortality from digital mammography screening: a modeling study[J]. Ann Intern Med, 2016, 164(4): 205-214. DOI:10.7326/M15-1241 |
| [5] |
International Commission on Radiological Protection. ICRP publication 103. The 2007 recommendations of the international commission on radiological protection[R]. Oxford: Pergamon Press, 2007.
|
| [6] |
安晶刚, 徐辉, 范胜男, 等. 全国医疗机构放射诊断资源基本情况分析[J]. 中华放射医学与防护杂志, 2021, 41(6): 450-455. An JG, Xu H, Fan SN, et al. Analysis of basic situation of diagnostic radiology resources of the nationawide medical institutions[J]. Chin J Radiol Med Prot, 2021, 41(6): 450-455. DOI:10.3760/cma.j.issn.0254-5098.2021.06.009 |
| [7] |
Zhu Y, O'Connell AM, Ma Y, et al. Dedicated breast CT: state of the art-Part Ⅰ. Historical evolution and technical aspects[J]. Eur Radiol, 2022, 32(3): 1579-1589. DOI:10.1007/s00330-021-08179-z |
| [8] |
International Commission on Radiological Protection. Statement from the 1987 Como meeting of the International Commission on Radiological Protection[J]. Ann ICRP, 1987, 17(4): i-v. DOI:10.1016/0146-6453(87)90006-6 |
| [9] |
Wu X, Gingold EL, Barnes GT, et al. Normalized average glandular dose in molybdenum target-rhodium filter and rhodium target-rhodium filter mammography[J]. Radiology, 1994, 193(1): 83-89. DOI:10.1148/radiology.193.1.8090926 |
| [10] |
Sechopoulosa I, D'Orsi CJ. Glandular radiation dose in tomosynthesis of the breast using tungsten targets[J]. J Appl Clin Med Phys, 2008, 9(4): 161-171. DOI:10.1120/jacmp.v9i4.2887 |
| [11] |
申善威. 乳腺专用CT辐射剂量与图像质量的定量研究[D]. 哈尔滨: 哈尔滨工程大学, 2014. Shen SW. Quantitative research of radiation dose and image quality in dedicated breast CT[D]. Harbin: Harbin Engineering University, 2014. |
| [12] |
李士骏. 电离辐射剂量学基础[M]. 苏州: 苏州大学出版社, 2008. Li SJ. Basics of ionizing radiation dosimetry[M]. Suzhou: Soochow University Press, 2008. |
| [13] |
National Institute of Standards and Technology: X-ray mass attenuation coefficients-table 4[EB/OL]. [2022-11-25]. https://physics.nist.gov/PhysRefData/XrayMassCoef/tab4.html.
|
| [14] |
Dance DR, Young KC, van Engen RE. Further factors for the estimation of mean glandular dose using the United Kingdom, European and IAEA breast dosimetry protocols[J]. Phys Med Biol, 2009, 54(14): 4361-4372. DOI:10.1088/0031-9155/54/14/002 |
| [15] |
Boone JM. Normalized glandular dose (DgN) coefficients for arbitrary X-ray spectra in mammography: computer-fit values of Monte Carlo derived data[J]. Med Phys, 2002, 29(5): 869-875. DOI:10.1118/1.1472499 |
| [16] |
Hammerstein GR, Miller DW, White DR, et al. Absorbed radiation dose in mammography[J]. Radiology, 1979, 130(2): 485-491. DOI:10.1148/130.2.485 |
| [17] |
Suleiman ME, McEntee MF, Cartwright L, et al. Diagnostic reference levels for digital mammography in New South Wales[J]. J Med Imaging Radiat Oncol, 2017, 61(1): 48-57. DOI:10.1111/1754-9485.12540 |
| [18] |
Storm C, Harvey A, Djukelic M. Mammography diagnostic reference levels in Western Australia[J]. Phys Eng Sci Med, 2020, 43(3): 1125-1129. DOI:10.1007/s13246-020-00914-y |
| [19] |
Vañó E, Miller DL, Martin CJ, et al. ICRP publication 135. Diagnostic reference levels in medical imaging[J]. Ann ICRP, 2017, 46(1): 1-144. DOI:10.1177/0146645317717209 |
| [20] |
Loveland J, Young KC, Oduko JM, et al. Radiation doses in the United Kingdom breast screening programmes 2016-2019[J]. Br J Radiol, 2022, 95(1135): 20211400. DOI:10.1259/bjr.20211400 |
| [21] |
Parmaksız A, Ataç GK, Bulur E, et al. Average glandular doses and national diagnostic reference levels in mammography examinations in Turkey[J]. Radiat Prot Dosim, 2020, 190(1): 100-107. DOI:10.1093/rpd/ncaa080 |
| [22] |
徐辉, 岳保荣, 尉可道, 等. 我国乳腺X射线摄影受检者乳腺剂量水平调查研究[J]. 中国辐射卫生, 2016, 25(6): 641-644. Xu H, Yue BR, Wei KD, et al. Research on glandular dose level of mammography in China[J]. Chin J Radiol Health, 2016, 25(6): 641-644. DOI:10.13491/j.cnki.issn.1004-714x.2016.06.001 |
| [23] |
Institute of Physics and Engineering in Medicine. IPEM Report 89. The commissioning and routine testing of mammographic X-ray systems: a technical quality control protocol[R]. York: IPEM, 2005.
|
| [24] |
Amendoeira I, Perry N, Broeders M, et al. European guidelines for quality assurance in breast cancer screening and diagnosis[M]. Luxembourg: European Commission, 2013.
|
| [25] |
International Atomic Energy Agency. IAEA human health series No. 17. quality assurance programme for digital mammography[R]. Vienna: IAEA, 2011.
|
| [26] |
Berns EA, Pfeiffer DE, Butler PF, et al. Digital mammography quality control manual[M]. Reston, Va: American College of Radiology, 2018.
|
| [27] |
国家卫生和计划生育委员会. WS 76-2020医用X射线诊断设备质量控制检测规范[S]. 北京: 中国标准出版社, 2020. National Health and Family Planning Commission. WS 76-2020 Specification for testing of quality control in medical X-ray diagnostic equipment[S]. Beijing: Standards Press of China, 2020. |
| [28] |
Sechopoulos I, Suryanarayanan S, Vedantham S, et al. Computation of the glandular radiation dose in digital tomosynthesis of the breast[J]. Med Phys, 2007, 34(1): 221-232. DOI:10.1118/1.2400836 |
| [29] |
Dance DR, Young KC, van Engen RE. Estimation of mean glandular dose for breast tomosynthesis: factors for use with the UK, European and IAEA breast dosimetry protocols[J]. Phys Med Biol, 2011, 56(2): 453-471. DOI:10.1088/0031-9155/56/2/011 |
| [30] |
Yi Y, Lai CJ, Han T, et al. Radiation doses in cone-beam breast computed tomography: a Monte Carlo simulation study[J]. Med Phys, 2011, 38(2): 589-597. DOI:10.1118/1.3521469 |
| [31] |
Sechopoulos I, Feng SSJ, D'Orsi CJ. Dosimetric characterization of a dedicated breast computed tomography clinical prototype[J]. Med Phys, 2010, 37(8): 4110-4120. DOI:10.1118/1.3457331 |
| [32] |
Hernandez AM, Boone JM. Average glandular dose coefficients for pendant-geometry breast CT using realistic breast phantoms[J]. Med Phys, 2017, 44(10): 5096-5105. DOI:10.1002/mp.12477 |
| [33] |
Russo P, Coppola T, Mettivier G. Distribution of absorbed dose in cone-beam breast computed tomography: a phantom study with radiochromic films[J]. IEEE Trans Nucl Sci, 2010, 57(4): 2220-2229. DOI:10.1109/TNS.2010.2050005 |
| [34] |
Russo P, Lauria A, Mettivier G, et al. Dose distribution in cone-beam breast computed tomography: an experimental phantom study[J]. IEEE Trans Nucl Sci, 2010, 57(1): 366-374. DOI:10.1109/TNS.2009.2036848 |
| [35] |
del Carmen MG, Halpern EF, Kopans DB, et al. Mammographic breast density and race[J]. AJR Am J Roentgenol, 2007, 188(4): 1147-1150. DOI:10.2214/AJR.06.0619 |
| [36] |
Wang W, Qiu R, Ren L, et al. Monte Carlo calculation of conversion coefficients for dose estimation in mammography based on a 3D detailed breast model[J]. Med Phys, 2017, 44(6): 2503-2514. DOI:10.1002/mp.12210 |
| [37] |
Du X, Wang J, Zhu BL. Estimated average glandular dose for 1, 828 mammography procedures in China: a multicenter study[J]. Biomed Environ Sci, 2019, 32(4): 242-249. DOI:10.3967/bes2019.034 |
| [38] |
胡从依, 马文娟, 柳杰, 等. 乳腺密度、年龄与乳腺癌发病风险的关系分析[J]. 临床放射学杂志, 2022, 41(11): 2037-2040. Hu CY, Ma WJ, Liu J, et al. Relationship between breast density, age and the risk of breast cancer[J]. J Clin Radiol, 2022, 41(11): 2037-2040. DOI:10.13437/.cnki.jcr.2022.11.013 |
| [39] |
王佳豪, 邱睿, 胡安康, 等. 女性乳腺体积密度及分布的影像学初步研究[J]. 中华放射医学与防护杂志, 2022, 42(10): 806-811. Wang JH, Qiu R, Hu AK, et al. Preliminary imaging study on the distribution of female volumetric breast density[J]. Chin J Radiol Med Prot, 2022, 42(10): 806-811. DOI:10.3760/cma.j.cn112271-20220527-00229 |
| [40] |
Gennaro G, Bernardi D, Houssami N. Radiation dose with digital breast tomosynthesis compared to digital mammography: per-view analysis[J]. Eur Radiol, 2018, 28(2): 573-581. DOI:10.1007/s00330-017-5024-4 |
| [41] |
Østerås BH, Skaane P, Gullien R, et al. Average glandular dose in paired digital mammography and digital breast tomosynthesis acquisitions in a population based screening program: effects of measuring breast density, air kerma and beam quality[J]. Phys Med Biol, 2018, 63(3): 035006. DOI:10.1088/1361-6560/aaa614 |
| [42] |
Teoh KC, Manan HA, Mohd Norsuddin N, et al. Comparison of mean glandular dose between full-field digital mammography and digital breast tomosynthesis[J]. Healthcare (Basel), 2021, 9(12): 1758. DOI:10.3390/healthcare9121758 |
| [43] |
Opitz M, Zensen S, Breuckmann K, et al. Breast radiation exposure of 3D digital breast tomosynthesis compared to full-field digital mammography in a clinical follow-up setting[J]. Diagnostics (Basel), 2022, 12(2): 456. DOI:10.3390/diagnostics12020456 |
| [44] |
Vedantham S, Shi L, Karellas A, et al. Personalized estimates of radiation dose from dedicated breast CT in a diagnostic population and comparison with diagnostic mammography[J]. Phys Med Biol, 2013, 58(22): 7921-7936. DOI:10.1088/0031-9155/58/22/7921 |
| [45] |
Hernandez AM, Seibert JA, Boone JM. Breast dose in mammography is about 30% lower when realistic heterogeneous glandular distributions are considered[J]. Med Phys, 2015, 42(11): 6337-6348. DOI:10.1118/1.4931966 |
 2023, Vol. 43
2023, Vol. 43


