2. 中南大学自动化学院, 长沙 410083
2. School of Automation, Central South University, Changsha 410083, China
立体定向放疗(SBRT)已成为无法手术的周围型早期非小细胞肺癌患者的标准治疗方案[1-3]。SBRT计划靶区体积较小、位置偏侧,在CT定位时难以准确地将计划等中心(体表铅点)定在肿瘤质心,存在不同程度的偏中心现象。随着加速器非对称准直技术和图像引导技术的发展,一些临床机构开始使用偏中心方式进行肺癌SBRT计划设计和治疗[4],不在校位过程中修改等中心标记点,以缩短患者治疗前准备流程和时间,并减少可能引入的额外位置误差和患者成像剂量[5-6]。然而,偏中心计划设计可能对计划质量和执行准确度产生不利影响。一方面,多叶准直器(multi-leave collimator,MLC)在偏中心位置的分辨率变差、准直半影变宽,可能导致SBRT计划的剂量学指标变差[7];另一方面,多数放疗质量保证工作都是在加速器等中心位置完成的(如射束中心与几何中心的一致性、输出剂量刻度等),偏中心位置的射束准确度难以保证,从而影响偏中心计划的执行准确度[8-10]。因此,研究不同程度的偏中心计划设计对肺癌SBRT计划质量和执行准确度的影响,具有重要的临床意义。基于此,本研究拟设计不同程度的偏中心SBRT计划,分析这些偏中心计划相比等中心参考计划的剂量学差异,为肺癌SBRT计划设计提供参考。
材料与方法1. 患者选择及计划设计:如图 1所示,回顾性选取了10例已完成放疗的肺部SBRT患者,病灶数均为1个。采用调强放疗(IMRT)技术,对上述10例患者分别重新设计等中心参考计划和不同程度的偏中心计划,等中心参考计划的中心点位于靶区质心(命名plan-0),偏中心计划的中心点为国际电工委员会(IEC)标准坐标系x方向分别偏离靶区质心1、3、5、8和10 cm,计划依次命名为plan-1、plan-3、plan-5、plan-8和plan-10。计划的优化参数同初始的临床已执行计划,开启铅门跟随功能,归一条件为95%的计划靶区(PTV)体积达到100%的处方剂量,危及器官(OAR) 受照剂量均在临床接受范围内,各项剂量学指标均满足美国肿瘤放射治疗协作组(RTOG)0915标准[15],共计60个放疗计划。
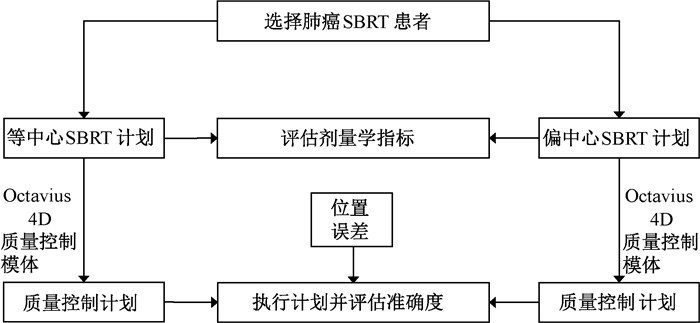
|
注:SBRT. 立体定向放疗 图 1 研究流程图 Figure 1 Flowchart of this study |
本研究所有的计划设计均使用Eclipse治疗计划系统(Version 15.6, 美国瓦里安),优化算法使用Photon optimization(PO, version 15606),剂量计算算法使用各向异性解析算法(anisotropic analytic algorithm, AAA, version 15606),计算网格边长为2.5 mm。电子直线加速器机型为Vital Beam(美国瓦里安),能量为有均整射束6 MV,计划剂量率为600 MU/min。
2. 剂量学评估:OAR剂量学指标包括正常肺组织(双肺减掉PTV)的肺平均剂量(MLD)和V20,以及脊髓、心脏、支气管和食管的最大剂量;PTV的剂量学指标包括适形性指数(CI)、剂量梯度指数(GI)、离靶区2 cm处最大剂量D2 cm和梯度距离(GD,即100%处方剂量降至50%处方剂量的平均距离),其中CI和GI的计算公式为
| $ \mathrm{CI}=\frac{V_{R x}}{V_T} $ | (1) |
| $ \mathrm{GI}=\frac{V_{50 \% R x}}{V_{R x}} $ | (2) |
式中,VT为靶区体积;VRx为处方等剂量线所包绕的体积;V50%Rx为50%处方等剂量线所包绕的体积。
3. 计划质量控制:本研究计划质量控制使用Octavius 4D高分辨率剂量测量系统(德国PTW)。使用的探测器为Octavius Detector 1500二维矩阵,共1 405个4.4 mm × 4.4 mm × 4.4 mm通气平行板电离室组成棋盘型矩阵。伽马通过率(GPR)分析采用Octavius 4D自带的软件VeriSoft 5.1,根据美国医学物理学家协会(AAPM)TG 218号[16]报告设置GPR计算参数:评估方式为全局γ、γ分析方式为3%/2 mm、剂量阈值为10%。投照计划所用的电子直线加速器Vital Beam经过严格的质量控制检测,各项参数均符合AAPM TG142号报告推荐的SBRT和立体定放射外科(SRS)容差标准[8]。
本研究引入了1、3和5 mm 3种肺癌SBRT可能出现的临床位置误差[14],研究不同程度的偏中心计划对于位置误差的鲁棒性,由于临床几乎不会出现10 mm的位置误差,因此,未研究10 mm位置误差的情况。首先,将Octavis 4D模体置于计划等中心位置摆位,测量plan-0、plan-1、plan-3、plan-5、plan-8和plan-10的GPR;然后,人为引入x方向(IEC坐标系)的位置误差1、3和5 mm,重复上述所有计划的验证过程,总计完成240次计划验证,得到不同偏中心计划在多种位置误差存在情况下的GPR。
4. 统计学处理:使用OriginPro 2021处理数据,符合正态分布数据以x±s表示。偏中心计划plan-i(i=1、3、5、8、10)的剂量学指标差异分析和GPR差异分析均以plan-0的结果为参考,统计方法使用Wilcoxon signed-rank test非参数检验方法。P < 0.05为差异具有统计学意义。
结果1. 病例资料统计:肺癌SBRT患者的靶区体积为(28.4 ± 20.7)cm3 (8.4 ~ 64.8 cm3),正常肺体积为(3 075.2 ± 1 120.7)cm3 (1 707.0 ~ 4 673.4 cm3),5例患者的肿瘤左偏,5例右偏,处方剂量均为60.0 Gy。
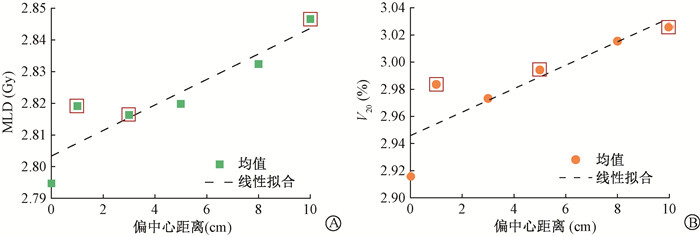
2. 偏中心计划设计对计划质量的影响:不同程度偏中心计划和等中心参考计划的剂量学指标统计结果如表 1所示。偏中心计划的靶区剂量学指标与等中心参考计划基本一致,其中GI、D2 cm和GD随着偏中心距离增加略有变差趋势,当偏中心距离至10 cm时,三者分别平均增加了0.04、1.39%和0.03 cm,差异无统计学意义(P>0.05)。支气管Dmax随着偏中心距离增加有变大趋势,当偏中心距离至10 cm时,差异有统计学意义(z=2.03,P < 0.05),平均增幅约为1.00 Gy。从图 2可以看出,随着偏中心距离增加,正常肺组织的MLD和V20呈线性增长。在偏中心距离10 cm处,MLD增幅约为0.05 Gy,最大增幅可达0.17 Gy,V20增幅约为0.1%,最大增幅为0.5%。
|
|
表 1 靶区和危及器官偏中心计划与无偏计划的剂量学指标对比(x±s) Table 1 Comparison of the dosimetric indices of target volumes and organs at risk between off-target isocenter plans and the isocenter reference plan(x±s) |
|
注:MLD. 肺平均剂量;V20. 肺剂量达到20 Gy的相对体积。图中红色方框为对应偏中心计划的剂量指标与无偏计划相比,z=-2.34~-1.99,P < 0.05 图 2 MLD和V20随偏中心距离的变化 Figure 2 Variations of MLD and V20 with the off-target distance |
3. 偏中心计划执行准确度对位置误差的鲁棒性:表 2为偏中心计划和等中心计划在有无位置误差时的GPR统计结果。当引入位置误差后,与等中心计划相比,偏中心计划的GPR降幅有变大趋势。例如,当位置误差达到5 mm时,对于偏中心距离5 cm以上的计划而言,降幅在1.0%以上,最高可达3.5%,与等中心计划相比,差异具有统计学意义(z=2.13~3.90,P < 0.05)。
|
|
表 2 不同位置误差对于偏中心计划与无偏计划执行准确度的鲁棒性对比 Table 2 Comparison of the robustness of delivery accuracy between off-target isocenter plans and the isocenter reference plan under different positional errors |
讨论
SBRT已成为无法手术的周围型早期非小细胞肺癌患者的标准治疗方案,5年局部控制率高达93%[17],5年生存率可达40%[18]。计划设计是肺癌SBRT技术的关键环节,所设计的计划应具备单次剂量高、剂量梯度大和执行准确度高等特点。随着加速器非对称准直技术和图像引导技术的发展,一些机构开始使用偏中心的方式进行SBRT计划设计与治疗,偏中心计划设计可能会对计划剂量学质量和执行准确度产生不利影响。目前,已有文献大多是对偏中心和等中心计划的剂量学指标进行简单对比,很少涉及计划质量和执行准确度随着偏中心程度变化的量化研究[4, 7, 11-12]。肺癌SBRT治疗中的位置误差很可能加剧偏中心现象对计划执行准确度的影响[13-14]。鲜有团队研究偏中心计划的执行准确度对这些误差的鲁棒性。
本研究探讨了肺癌偏中心SBRT计划对于临床位置误差的鲁棒性,综合分析了不同程度的偏中心距离对SBRT计划质量和执行准确度的影响。偏中心计划的关键剂量学指标略差于等中心参考计划,如肺受照剂量随着偏中心距离增大缓慢升高。偏中心计划的执行准确度对摆位误差的鲁棒性变差,且位置误差越大,影响越大。
总体而言,肺癌SBRT计划中重要OAR的剂量学指标(如正常肺组织的MLD和V20)随着偏中心距离的增大呈线性缓慢升高,当偏中心距离达到10 cm时,MLD和V20增幅均具有统计学意义,MLD最大增幅可达8%。本研究结果表明,偏中心计划的3类梯度指数(GI、D2 cm和GD)均差于等中心参考计划,考虑到剂量跌落梯度与射束半影直接相关,此现象产生的原因很可能为射束在偏中心位置的半影宽度增大,导致靶区周围正常肺组织中的剂量跌落变缓,从而在一定程度增大了正常肺组织受照剂量。此结果与van Timmeren等[11]的研究结果类似,该研究报道了两例多靶点、偏中心距离接近8 cm的肺癌SBRT患者,偏中心计划的MLD分别增大了22%和15%,具有临床相关性。考虑到MLD与放射性肺炎的发生风险显著相关[19-20],应力求MLD尽可能低。因此,当偏中心距离超过8 cm时,应考虑将计划等中心移至肿瘤质心位置,能够在一定程度降低肺剂量,从而降低放射性肺炎的发生风险。
更重要的是,本研究通过实验测量证明,偏中心计划的执行准确度对位置误差的鲁棒性变差。当存在位置误差时,GPR随着偏中心距离增加逐渐降低,且位置误差越大,偏中心计划GPR降幅越大。当位置误差达到5 mm时,偏中心距离5 cm及以上计划的GPR下降明显,差异具有统计学意义。Capaldi等[21]通过设计SRS质量控制模体,实验测量偏中心射束的射野中心与几何中心的一致性误差(偏中心Winston-Lutz测试),发现随着偏中心距离增大,一致性误差逐渐增大,当偏中心距离>7 cm时,一致性误差大于AAPM TG 142号报告[8]推荐的1 mm容差标准;类似地,Gao和Liu[10]通过设计另一种偏中心Winston-Lutz test方法,发现当偏中心距离>5 cm时,射束中心与几何中心的一致性误差会>1 mm容差标准。本研究认为,随着偏中心距离的增大,射野中心与几何中心的一致性误差增大,此误差将会和位置误差产生协同作用,导致偏中心计划的执行准确度对位置误差的鲁棒性下降,从而加剧偏中心计划设计对计划执行准确度的影响。考虑到肺癌SBRT存在多种位置误差(定位误差、患者不自主运动及呼吸运动等因素导致)[6, 14, 22],为了保证剂量投照的准确度,应考虑对偏中心距离≥5 cm的计划实行移位。
本研究仅考虑了偏中心计划的执行准确度对位置平移误差的鲁棒性,并未考虑旋转误差的影响,这类误差的影响会随着偏中心距离的增加而增大,可能与辐射中心和几何中心的一致性误差产生协同作用,从而影响偏中心计划的执行准确度。Miao等[23]设计了平移误差和旋转误差的叠加策略,提出了一种新的非均匀靶区边界外扩方法,这种误差叠加策略可为以后研究执行准确度对多种误差的鲁棒性提供新方法。此外,本研究是以单靶点肺癌SBRT病例开展,未研究多靶点情况,拟在后续工作中对上述内容开展进一步研究。
综上所述,对于单靶点的肺癌SBRT计划而言,偏中心计划的剂量学质量略差于等中心计划,其执行准确度对位置误差的鲁棒性变差。应尽量避免偏中心距离过大的(≥5 cm)计划设计与治疗。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 杨晓喻负责实验设计与实施、论文撰写;赵于前、杨振负责技术指导及论文修改;李书舟、邵其刚负责实施实验;曹瑛负责研究路线设计、论文修改
| [1] |
Farooqi A, Ludmir EB, Mitchell KG, et al. Increased biologically effective dose (BED) to the primary tumor is associated with improved survival in patients with oligometastatic NSCLC[J]. Radiother Oncol, 2021, 163: 114-118. DOI:10.1016/j.radonc.2021.08.005 |
| [2] |
Guckenberger M, Andratschke N, Dieckmann K, et al. ESTRO ACROP consensus guideline on implementation and practice of stereotactic body radiotherapy for peripherally located early stage non-small cell lung cancer[J]. Radiother Oncol, 2017, 124(1): 11-17. DOI:10.1016/j.radonc.2017.05.012 |
| [3] |
Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076. DOI:10.1001/jama.2010.261 |
| [4] |
Pokhrel D, Sanford L, Larkin S, et al. On the use of single-isocenter VMAT plans for SBRT treatment of synchronous multiple lung lesions: Plan quality, treatment efficiency, and early clinical outcomes[J]. J Appl Clin Med Phys, 2020, 21(8): 160-167. DOI:10.1002/acm2.12938 |
| [5] |
Critchfield LS, Bernard ME, Randall ME, et al. A novel restricted single-isocenter stereotactic body radiotherapy (RESIST) method for synchronous multiple lung lesions to minimize setup uncertainties[J]. Med Dosim, 2021, 46(4): 419-425. DOI:10.1016/j.meddos.2021.05.005 |
| [6] |
Hoogeman MS, Nuyttens JJ, Levendag PC, et al. Time dependence of intrafraction patient motion assessed by repeat stereoscopic imaging[J]. Int J Radiat Oncol Biol Phys, 2008, 70(2): 609-618. DOI:10.1016/j.ijrobp.2007.08.066 |
| [7] |
Sanford L, Molloy J, Kumar S, et al. Evaluation of plan quality and treatment efficiency for single-isocenter/two-lesion lung stereotactic body radiation therapy[J]. J Appl Clin Med Phys, 2019, 20(1): 118-127. DOI:10.1002/acm2.12500 |
| [8] |
Klein EE, Hanley J, Bayouth J, et al. Task Group 142 report: quality assurance of medical accelerators[J]. Med Phys, 2009, 36(9): 4197-4212. DOI:10.1118/1.3190392 |
| [9] |
Smilowitz JB, Das IJ, Feygelman V, et al. AAPM medical physics practice guideline 5.a.: commissioning and qa of treatment planning dose calculations-megavoltage photon and electron beams[J]. J Appl Clin Med Phys, 2015, 16(5): 14-34. DOI:10.1120/jacmp.v16i5.5768 |
| [10] |
Gao JF, Liu XQ. Off-isocenter Winston-Lutz test for stereotactic radiosurgery/stereotactic body radiotherapy[J]. Int J Med Phys Clin Eng Radiat Oncol, 2016, 5(2): 154-161. DOI:10.4236/ijmpcero.2016.52017 |
| [11] |
van Timmeren JE, Ehrbar S, Chamberlain M, et al. Single-isocenter versus multiple-isocenters for multiple lung metastases: Evaluation of lung dose[J]. Radiother Oncol, 2022, 166: 189-194. DOI:10.1016/j.radonc.2021.11.030 |
| [12] |
Mandal A, Asthana AK, Pradhan S, et al. Search of an ideal location of isocenter in intensity-modulated radiotherapy treatment plans: A dosimetrical approach[J]. J Cancer Res Ther, 2019, 15(1): 211-215. DOI:10.4103/jcrt.JCRT_985_16 |
| [13] |
Roper J, Chanyavanich V, Betzel G, et al. Single-isocenter multiple-target stereotactic radiosurgery: risk of compromised coverage[J]. Int J Radiat Oncol Biol Phys, 2015, 93(3): 540-546. DOI:10.1016/j.ijrobp.2015.07.2262 |
| [14] |
Purdie TG, Bissonnette JP, Franks K, et al. Cone-beam computed tomography for on-line image guidance of lung stereotactic radiotherapy: localization, verification, and intrafraction tumor position[J]. Int J Radiat Oncol Biol Phys, 2007, 68(1): 243-252. DOI:10.1016/j.ijrobp.2006.12.022 |
| [15] |
Videtic GM, Hu C, Singh AK, et al. A randomized phase 2 study comparing 2 stereotactic body radiation therapy schedules for medically inoperable patients with stage Ⅰ peripheral non-small cell lung cancer: NRG Oncology RTOG 0915(NCCTG N0927)[J]. Int J Radiat Oncol Biol Phys, 2015, 93(4): 757-764. DOI:10.1016/j.ijrobp.2015.07.2260 |
| [16] |
Miften M, Olch A, Mihailidis D, et al. Tolerance limits and methodologies for IMRT measurement-based verification QA: Recommendations of AAPM Task Group No. 218[J]. Med Phys, 2018, 45(4): e53-e83. DOI:10.1002/mp.12810 |
| [17] |
Lee P, Loo BW Jr, Biswas T, et al. Local control after stereotactic body radiation therapy for stage Ⅰ non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2021, 110(1): 160-171. DOI:10.1016/j.ijrobp.2019.03.045 |
| [18] |
Timmerman RD, Hu C, Michalski J, et al. Long-term results of RTOG 0236:A phase Ⅱ trial of stereotactic body radiation therapy (SBRT) in the treatment of patients with medically inoperable stage Ⅰ non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2014, 90(1, Supplement): S30. DOI:10.1016/j.ijrobp.2014.05.135 |
| [19] |
Guckenberger M, Baier K, Polat B, et al. Dose-response relationship for radiation-induced pneumonitis after pulmonary stereotactic body radiotherapy[J]. Radiother Oncol, 2010, 97(1): 65-70. DOI:10.1016/j.radonc.2010.04.027 |
| [20] |
Baker R, Han G, Sarangkasiri S, et al. Clinical and dosimetric predictors of radiation pneumonitis in a large series of patients treated with stereotactic body radiation therapy to the lung[J]. Int J Radiat Oncol Biol Phys, 2013, 85(1): 190-195. DOI:10.1016/j.ijrobp.2012.03.041 |
| [21] |
Capaldi D, Skinner LB, Dubrowski P, et al. An integrated quality assurance phantom for frameless single-isocenter multitarget stereotactic radiosurgery[J]. Phys Med Biol, 2020, 65(11): 115006. DOI:10.1088/1361-6560/ab8534 |
| [22] |
Wack LJ, Exner F, Wegener S, et al. The impact of isocentric shifts on delivery accuracy during the irradiation of small cerebral targets-Quantification and possible corrections[J]. J Appl Clin Med Phys, 2020, 21(5): 56-64. DOI:10.1002/acm2.12854 |
| [23] |
Miao J, Xu Y, Tian Y, et al. A study of nonuniform CTV to PTV margin expansion incorporating both rotational and translational uncertainties[J]. J Appl Clin Med Phys, 2019, 20(12): 78-86. DOI:10.1002/acm2.12763 |
 2023, Vol. 43
2023, Vol. 43


