2. 中国人民解放军军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 解放军总医院第五医学中心, 北京 100071
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China;
3. Fifth Medical Center, General Hospital of PLA, Beijing 100071, China
造血干/祖细胞(hematopoietic stem and progenitor cells,HSPCs)是具有自我复制能力和多能性的血液干细胞,其功能正常是移植成功的关键[1-2]。在经典的造血系统发育图谱中最顶层是长期造血干细胞(long-term hematopoietic stem cell, LT-HSC),它可以产生所有血细胞,LT-HSC每次不对称分裂时会产生一个与自己本身一样的细胞,和一个短期造血干细胞(short-term hematopoietic stem cells, ST-HSC)或是多能祖细胞(multipotent progenitor, MPP)[3-5]。HSPCs在发育过程中表面标记在不断变化,通常利用Lin-c-Kit+Sca1+(LSK)代表HSPCs从而进行研究[6]。
造血系统对电离辐射高度敏感,造血组织损伤出现时间早、症状严重、恢复困难,是所有类型急性放射病的共性以及病理生理基础。HSPCs作为所有血细胞的来源,其损伤修复对于放射造血损伤的救治具有重要意义。研究表明,电离辐射会造成骨髓HSPCs的活性氧(ROS)水平升高、DNA损伤增加、凋亡增加,以及克隆形成能力下降。胎肝HSPCs与成体骨髓HSPCs由于处于不同生态位及不同发育阶段,其特性存在多种差异,比如胎肝HSPCs增殖更加旺盛,处于S期细胞增多,ROS水平明显高于骨髓HSPCs等。但目前关于电离辐射对两种不同来源的HSPCs的影响,鲜见系统研究。本研究对电离辐射后胎肝和骨髓来源HSPCs中细胞凋亡、ROS水平、体外集落形成能力、DNA损伤情况进行了系统分析,并探讨了两种HSPCs体内重建能力,为深入探索不同来源HSPCs应对放射损伤应激的分子机制奠定了基础。
材料与方法1. 实验动物及受照条件:遗传背景为CD45.1的C57BL/6J雄性小鼠(SPF级)、C57BL/6J雌性小鼠(SPF级)饲养在军事医学研究院SPF级实验动物中心,合格证号: SYXK(军)2012-0065。实验小鼠8周龄,体重20~23 g。按随机数表法,将12只小鼠分为骨髓组(BM)和胎肝组(FL),每组6只,全身60Co照射,照射剂量依次为4.5、5.0 Gy,间隔30 min,吸收剂量率为61.28 cGy/min。c-Kit+细胞分为0、5、10 Gy组,接受单次60Co照射后培养12 h检测,吸收剂量率为71.61 cGy/min。
2. 主要试剂与仪器:M3434培养基购自加拿大Stemcell公司;红细胞裂解液购自深圳达科为公司;葡萄糖、丙酮酸钠、L-谷氨酰胺、羰基-氰-对-三氟甲氧基苯肼(FCCP)、鱼藤酮(Rotenone) 购自美国Sigma公司;Cell-TakTM细胞组织黏合剂购自美国Corning公司;Brdu粉剂购自美国Sigma公司;流式计数微球(BEADS)、ROS检测试剂、RPMI 1640培养基购自赛默飞公司;c-Kit+细胞分选试剂盒、FVS 510、Sca1 BV605、c-Kit PE、CD48 APC、CD150 PECY7、CD45.1 FITC、CD45.2 PE、Ly6G FITC、Ly6C PECY7、B220 PECY7、CD3 APC、CD11b ef450、CD4 BV421、CD8 PECY7、BrdU FITC、DAPI 355、Gr-1 APC、F4/80 PECY7生物耦联素抗体、Gr-1、Ter119、B220、CD3、CD4、CD8、CD5、APC-H7生物素-链霉亲和素偶联抗体均购自美国BioLegend公司;寡霉素(Oligomycin),抗霉素A(Antimycin A)购自英国Abcam公司;Seahorse XFe24细胞代谢动态分析仪购自美国安捷伦公司;流式细胞仪和流式分选仪购自美国BD公司;倒置相差显微镜及成像系统购自日本Olympus公司。
3. 骨髓细胞与胎肝细胞制备:取8周龄小鼠股骨和胫骨,用磷酸盐缓冲液(PBS)冲出骨髓,800 × g离心5 min收集细胞。加入1 ×红细胞裂解液,室温裂解红细胞5 min,再次离心收集细胞,过45 μm细胞筛制成单细胞悬液备用;取见栓怀孕14.5 d孕鼠,取出胚胎用解剖针将胎肝分离,用2 ml注射器研磨胎肝,过45 μm细胞筛,制成单细胞悬液后续处理同骨髓细胞。
4. 细胞凋亡检测:收集培养后的细胞,800 × g离心5 min,弃上清后,用500 μl结合缓冲液重悬,标记Annexin-V和7-AAD抗体,避光孵育15 min后流式检测。
5. ROS检测:骨髓细胞和胎肝细胞用RPMI 1640培养基重悬,每样本加入0.5 μl CellROXUNSCEA Ⓡ Deep Red,室温避光孵育30 min,用PBS清洗,800 × g离心5 min后,用PBS重悬标记流式抗体,避光孵育15 min,清洗重悬后,标记1 μl SYTOX Ⓡ Blue Dead抗体,标记15 min后上机检测,流式检测使用FITC和APC通道。
6. 骨髓集落能力形成能力检测:流式分选c-Kit+细胞,按照8 000个细胞/孔加入600 μl M3434培养基,接种到12孔细胞板中,37℃、5% CO2细胞培养箱培养8 d,倒置显微镜下观察集落形成情况,细胞数≥ 50为阳性集落。
7. γ-H2AX免疫荧光染色:细胞甩片,4%多聚甲醛固定,Triton X-100通透30 min,5%牛血清白蛋白(BSA)封闭1 h,加入PH2AX一抗4℃过夜染色,Tritc二抗染色1 h后加入4′, 6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染液,染色15 min,50%甘油封片,荧光显微镜下观察。
8. 细胞周期检测:用生理盐水配置BrdU溶液,实验前1 d按照10 μg/g体重腹腔注射BrdU,实验当天小鼠尾静脉注射BrdU,2 h后进行检测。
9. 胎肝和骨髓HSPCs体内重建能力检测:受体小鼠照射后6 h分选LSK细胞移植,一组移植骨髓细胞(骨髓组),一组移植胎肝细胞(胎肝组),将供体细胞与竞争骨髓细胞按照1 ∶1的比例混合后共移植2 × 106细胞。移植后12周处死,检测各谱系分化情况。
10. 线粒体压力检测:检测细胞外氧气消耗速率(oxygen consumption rate, OCR), 按照Seahorse XFe24细胞代谢动态分析仪操作步骤进行,葡萄糖、谷氨酰胺和丙酮酸钠使用浓度分别为1、2、10 mmol/L,pH为7.40 ± 0.05。线粒体压力测试剂分别注射2 μmol/L寡霉素(Oligomycin),1.75 μmol/L FCCP,R&A包括1 μmol/L抗霉素(Antimycin)和1 μmol/L鱼藤酮(Rotenone)。实验结果按照Seahorse提供的数据计算线粒体压力测试相关指标。
11. 统计学处理:数据经正态性检验符合正态分布用x±s表示。流式图采用FlowJo软件分析,实验数据采用Graphpad 7.0软件处理和图形绘制,组间比较采用双侧t检验。P<0.05为差异有统计学意义。
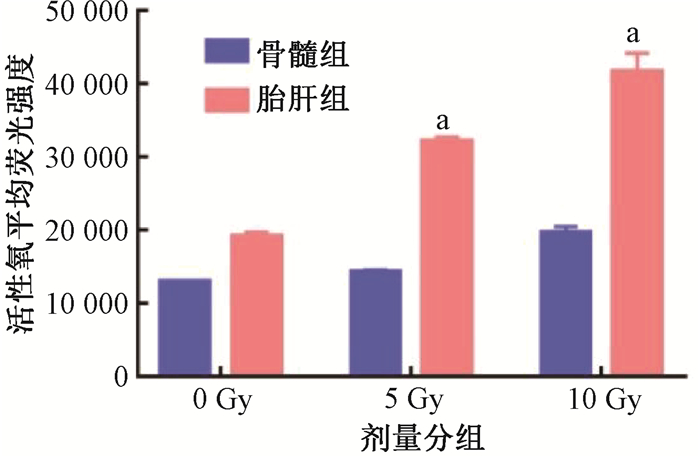
结果1. 照射后胎肝HSPCs与骨髓HSPCs中ROS水平检测:结果如图 1所示,照射后12 h骨髓HSPCs中ROS水平有一定升高,而胎肝HSPCs的ROS水平显著高于骨髓HSPCs(t=68.72、18.89,P<0.05),并且呈剂量相关效应,说明照射后胎肝HSPCs和骨髓HSPCs发生氧化应激损伤,并且相较于骨髓HSPCs,胎肝HSPCs氧化应激损伤更重。
|
注:同一时间胎肝组与骨髓组ROS水平比较,与BM相比,at=68.72、18.89,P<0.05 图 1 胎肝HSPCs和骨髓HSPCs中ROS的平均荧光强度 Figure 1 Average fluorescence intensity of ROS level in FL- and BM-derived HSPCs |
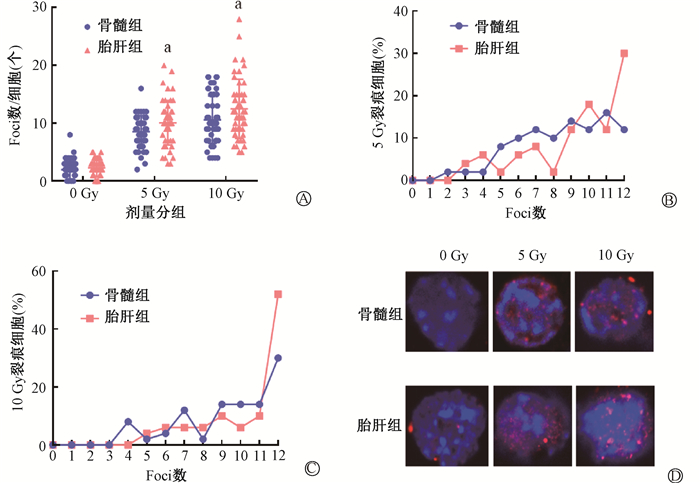
2. 照射后胎肝HSPCs与骨髓HSPCs的DNA损伤比较:利用免疫荧光检测细胞内γ-H2AX形成Foci的数量来评估DNA损伤程度,结果如图 2所示,在受照后12 h胎肝组形成Foci的数量明显多于骨髓组(t=2.27、2.03,P<0.05)。照射剂量为5 Gy时,胎肝组形成Foci数量>12个的比例有30%,而骨髓组只有12%;在照射剂量为10 Gy时,胎肝组Foci数量>12个的比例达到了52%,骨髓组仅有30%,表明胎肝HSPCs经过照射后DNA损伤更加严重。
|
注:γ-H2AX用PH2AX (红色) 染色,细胞核用Hoechst33342 (蓝色) 染色,与骨髓组相比,at=2.27、2.03,P<0.05 图 2 照射后胎肝HSPCs和骨髓HSPCs的DNA损伤比较 A. 每个细胞形成Foci数量; B. 5 Gy照射裂痕细胞所占比例;C.10 Gy照射裂痕细胞所占比例; D. 0、5、10 Gy照射后胎肝和骨髓细胞γ-H2AX染色 Figure 2 Comparison of DNA damage in FL- and BM- derived HSPCs after irradiation A. Number of Foci formed per cell; B. Distribution of foci number per cell with 5 Gy irradiation; C. Distribution of foci number per cell with 10 Gy irradiation; D. γ-H2AX staining of fetal liver and bone marrow cells after 0, 5, 10 Gy irradiation |
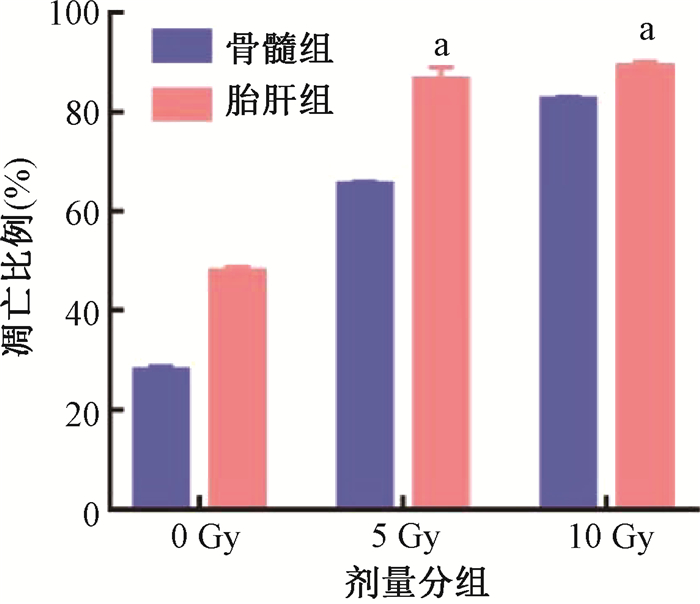
3. 照射后胎肝HSPCs与骨髓HSPCs细胞凋亡分析:结果如图 3所示,不同剂量照射下胎肝组的凋亡比例显著高于骨髓组(t=16.21、12.27,P<0.05),并且随着照射剂量的增加凋亡比例显著上升,说明电离辐射促进胎肝HSPCs凋亡的作用更明显。
|
与骨髓组凋亡比例比较,at=16.21、12.27,P<0.05 图 3 照射后胎肝和骨髓HSPCs细胞凋亡比较 Figure 3 Apoptosis analysis of FL- and BM-derived HSPCs after irradiation |
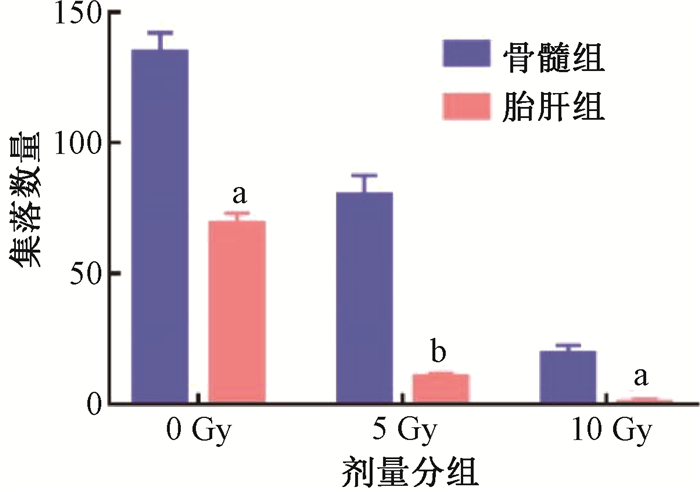
4. 照射后胎肝HSPCs与骨髓HSPCs集落形成能力比较:每组接种8 000个c-Kit+进行集落形成能力实验。结果如图 4所示,随着照射剂量增加,两组细胞的集落形成能力均显著降低(t=12.41、15.67、9.46,P<0.05),胎肝细胞在5 Gy照射剂量下形成的集落数量明显减少,在10 Gy照射剂量下完全不能形成集落,而骨髓细胞在受到10 Gy照射时还可以形成少量集落,表明电离辐射对胎肝HSPCs克隆形成能力的抑制更加严重。
|
注:与骨髓组相比,at=12.41、9.46,bt=15.67,P<0.05 图 4 不同剂量照射后胎肝和骨髓c-Kit+集落数量比较 Figure 4 Comparison of the number of fetal liver and bone marrow c-Kit+ colonies after different doses of irradiation |
5. 胎肝HSPCs与骨髓HSPCs体内重建能力比较:移植是评估HSPCs体内功能的金标准。分选胎肝及骨髓中LSK细胞,与竞争细胞混合移植经过致死剂量照射的受体小鼠。取移植后12周的受体小鼠外周血进行嵌合率检测,结果显示胎肝组的嵌合率显著低于骨髓组(t=5.84,P<0.05),表明胎肝HSPCs在体内重建造血的能力低于骨髓HSPCs(图 5)。
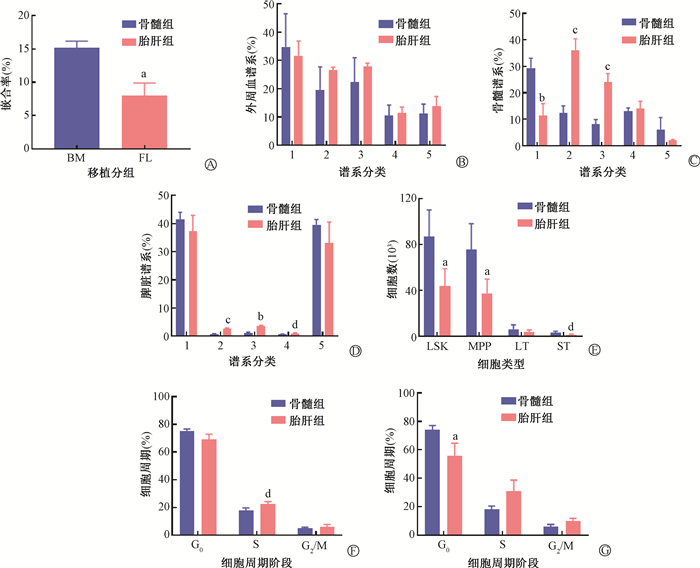
|
注:1. B细胞;2. 中性粒细胞;3. 单核细胞;4. 巨噬细胞;5. T细胞。与骨髓组相比,at=5.84、3.82、3.16,P<0.05; bt=7.63、9.28,P<0.05; ct=13.84、13.58、9.68,P<0.05; dt=2.96、2.52、2.89、3.36,P<0.05 图 5 胎肝与骨髓HSPCs体内重建能力检测 A. 嵌合率;B. 外周血谱系分化比例;C.骨髓谱系分化比例;D.脾脏谱系分化比例;E. 供体来源LSK、MPP、LT-HSC、ST-HSC细胞数;F. 供体来源LSK细胞周期分析;G. 供体来源LT-HSC细胞周期分析 Figure 5 In vivo reconstitution ability assay of FL- and BM- derived HSPCs A. Chimerism rate; B. Proportion of differentiation in each spectrum of peripheral blood; C. Proportion of differentiation in each spectrum of bone marrow; D. Proportion of differentiation in each spectrum of spleen; E. Number of donor-derived LSK, MPP, LT-HSC, and ST-HSC cells; F. Cycle analysis of donor-derived LSK cells; G. Cycle analysis of donor-derived LT-HSC cells |
以B220+代表B细胞、以CD3+代表T细胞,以CD11b+Ly6G+代表中性粒细胞、以CD11b+Ly6C+代表单核细胞、以CD11b+F4/80+代表巨噬细胞,对外周血、骨髓、脾脏中的谱系进行分析。结果表明外周血中各谱系分布两组无明显差异(P>0.05,图 5);胎肝组骨髓、脾脏中性粒细胞、单核细胞等髓系细胞的比例,明显高于骨髓组,表明移植的胎肝HSPCs具有明显的髓系分化倾向(图 5)。
进一步分析了两组小鼠骨髓中供体来源的HSPCs数量。结果显示,胎肝组骨髓LSK、MPP、ST-HSC的细胞数显著低于骨髓组(t=3.82、3.60、2.98,P<0.05),LT-HSC细胞数两组差异无统计学意义(P>0.05),进一步说明胎肝HSPCs重建能力低于骨髓组(图 5)。
对供体来源HSPCs的细胞周期进行了分析。结果显示,无论是在LSK中还是在LT-HSC中,胎肝组S期比例显著高于骨髓组(t=2.89,P < 0.05),与骨髓HSPCs相比,胎肝HSPCs更多处于增殖期(图 5 F-G)。
6. 胎肝HSPCs与HSPCs骨髓线粒体呼吸能力比较:有研究显示,线粒体呼吸的过度旺盛是造成造血干/祖细胞辐射敏感性增强的重要原因,因此本研究对比了胎肝HSPCs与骨髓HSPCs线粒体呼吸能力进行检测,结果如图 6所示。胎肝细胞与骨髓细胞最大呼吸能力差异无统计学意义(P>0.05);呼吸储备能力胎肝组低于骨髓组(t=5.53,P<0.05);基础呼吸能力、质子泄漏、三磷酸腺苷(ATP)产生、耦联效率均高于骨髓细胞(t=39.19、6.64、9.33、7.10,P<0.05)。该结果表明胎肝HSPCs具有更高水平的基础代谢,ATP产生更高,线粒体呼吸更旺盛。
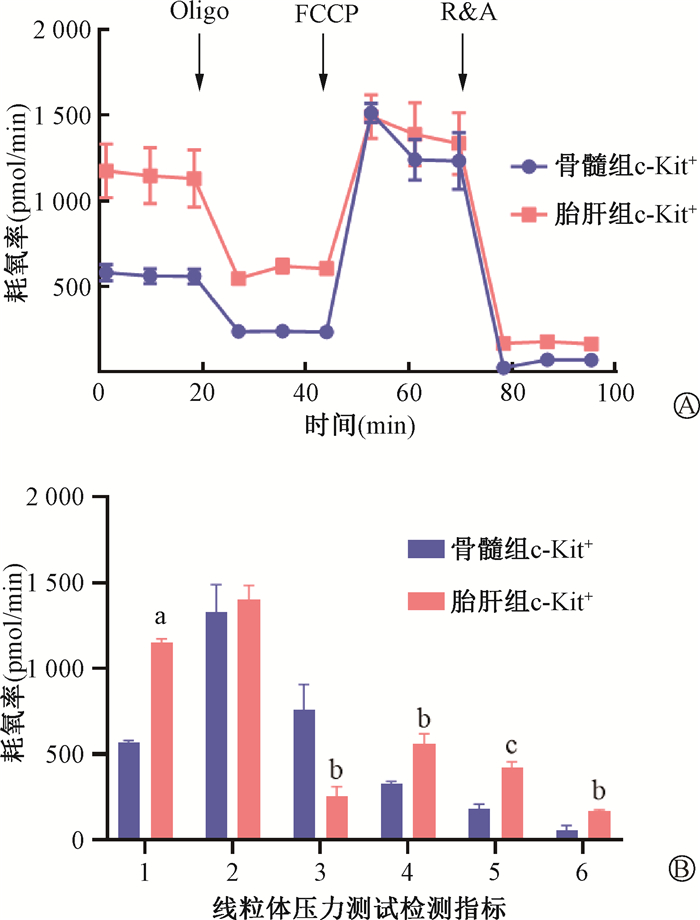
|
注:1. 基础呼吸;2. 最大呼吸能力;3. 呼吸储备能力;4. ATP产生;5. 质子泄漏;6. 耦联效率。与骨髓组c-Kit+相比,at=39.19,P<0.05; bt=5.53、6.64、7.10,P < 0.05; ct=9.33, P < 0.05 图 6 胎肝和骨髓c-Kit+细胞线粒体压力测试实验 A. 线粒体压力测试实验经典海马曲线;B. 对海马曲线OCR的定量分析 Figure 6 Mitochondrial stress test in FL and BM c-Kit+ cells A. Classical hippocampal curve of mitochondrial stress test; B. Quantitative analysis of the OCR of the hippocampal curve |
讨论
造血干细胞是造血系统的基础,具有产生所有成熟血细胞的功能,其功能的正常行使对于造血系统稳定的维持是必需的。电离辐射对造血干细胞的影响可能是致命的,可导致氧化应激,DNA损伤等,从而引起造血干细胞耗竭死亡。
胎肝HSPCs由于其发育特点大多数处于代谢活跃,增殖旺盛阶段。有研究表明,放射可特异靶向增殖旺盛的细胞,释放ROS,引起DNA损伤断裂,最终导致细胞死亡[7-8]。本研究发现相较于骨髓HSPCs,胎肝HSPCs受到电离辐射后ROS水平升高,凋亡增加,集落形成能力降低。免疫荧光染色的结果显示照射后胎肝HSPCs会形成更多的Foci,DNA损伤更重。由此推测强大的DNA损伤修复能力对于胎肝HSPCs的功能维持可能更为必要。事实上,有研究报道,特定DNA损伤修复分子的敲除对胎肝HSPCs比对成体骨髓HSPCs具有更显著的影响[9]。在胎肝中敲除Fancd2基因会导致集落形成减少,LT-HSC数量显著减少,凋亡增加和DNA损伤升高,以及HSPCs功能下降,但是在成体骨髓中敲除Fancd2只影响了HSPCs的体内与体外功能,对其数量的影响并不明显[9]。成年小鼠骨髓中静止的HSPCs对DNA损伤具有抵抗力,而增殖性HSPCs在电离辐射时容易发生细胞死亡[10]。这些研究表明,胚胎期HSPCs更容易被射线、抗肿瘤药物等诱导损伤,必要的防护对于胚胎发育具有重要作用。
在移植过程中,受体经过照射后,释放多种炎症因子,如IL-6β、TNF-α、IL-1、IL-8等[11],ROS水平升高[12],因此,机体处于高度应激的环境。本研究移植结果显示,胎肝来源的HSPCs移植后嵌合率更低,细胞周期S期比例增加,谱系分化倾向于髓系分化,提示胎肝HSPCs对ROS及炎症因子的攻击更加敏感,导致胎肝来源的HSPCs移植后分化更倾向于髓系分化。而骨髓HSPCs大部分处于静止期,对于移植的应激环境具有一定抵御能力。
有研究表明,线粒体活动的过度旺盛会导致HSPCs对电离辐射更加敏感。SCR-3是一种维持HSC的必需因子,在敲除SCR-3的小鼠骨髓细胞中发现HSPCs的线粒体氧化磷酸化增加,产生的ROS水平增加,从而导致HSPCs稳态被打破,不稳定的HSPCs对于电离辐射更加敏感[13]。本研究分选胎肝及骨髓的c-Kit+细胞进行线粒体压力检测发现,胎肝的c-Kit+细胞有着更高的基础呼吸,ATP产生更多,质子泄漏与耦联效率更高,说明胎肝HSPCs的线粒体活动更加旺盛,这一现象可能是造成胎肝HSPCs对电离辐射更加敏感的原因。
本研究在以往对电离辐射影响造血干细胞功能的基础上,全面比较了不同发育阶段的HSPCs的放射敏感性,为深入了解胎肝HSPCs和骨髓HSPCs应对放射应激损伤的具体机制奠定了基础。
利益冲突 无
作者贡献声明 高雅萌负责实验和论文撰写;赵珂、赵雄伟、吕志春、李思雨、武云强、孙慧颖、高慧英、向慎思参与实验操作;李长燕提供研究思路和指导论文修改
| [1] |
Gekas C, Rhodes KE, Van Handel B, et al. Hematopoietic stem cell development in the placenta[J]. Int J Dev Biol, 2010, 54(6-7): 1089-1098. DOI:10.1387/ijdb.103070cg |
| [2] |
Gao X, Xu C, Asada N, et al. The hematopoietic stem cell niche: from embryo to adult[J]. Development, 2018, 145(2): dev139691. DOI:10.1242/dev.139691 |
| [3] |
de Graaf CA, Choi J, Baldwin TM, et al. Haemopedia: an expression atlas of murine hematopoietic cells[J]. Stem Cell Reports, 2016, 7(3): 571-582. DOI:10.1016/j.stemcr.2016.07.007 |
| [4] |
Dzierzak E, Bigas A. Blood development: hematopoietic stem cell dependence and independence[J]. Cell Stem Cell, 2018, 22(5): 639-651. DOI:10.1016/j.stem.2018.04.015 |
| [5] |
Adolfsson J, Månsson R, Buza-Vidas N, et al. Identification of Flt3+ lympho-myeloid stem cells lacking erythro-megakaryocytic potential a revised road map for adult blood lineage commitment[J]. Cell, 2005, 121(2): 295-306. DOI:10.1016/j.cell.2005.02.013 |
| [6] |
Chen J, Ellison FM, Keyvanfar K, et al. Enrichment of hematopoietic stem cells with SLAM and LSK markers for the detection of hematopoietic stem cell function in normal and Trp53 null mice[J]. Exp Hematol, 2008, 36(10): 1236-1243. DOI:10.1016/j.exphem.2008.04.012 |
| [7] |
Jung CH, Kim EM, Song JY, et al. Mitochondrial superoxide dismutase 2 mediates γ-irradiation-induced cancer cell invasion[J]. Exp Mol Med, 2019, 51(2): 1-10. DOI:10.1038/s12276-019-0207-5 |
| [8] |
Chen L, Liu Y, Dong L, et al. Edaravone protects human peripheral blood lymphocytes from γ-irradiation-induced apoptosis and DNA damage[J]. Cell Stress Chaperones, 2015, 20(2): 289-295. DOI:10.1007/s12192-014-0542-3 |
| [9] |
Suzuki S, Racine RR, Manalo NA, et al. Impairment of fetal hematopoietic stem cell function in the absence of Fancd2[J]. Exp Hematol, 2017, 48: 79-86. DOI:10.1016/j.exphem,2016.11.006 |
| [10] |
Azzam EI, Jay-Gerin JP, Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury[J]. Cancer Lett, 2012, 31: 48-60. DOI:10.1016/j.canlet.2011.12.012 |
| [11] |
Mohrin M, Bourke E, Alexander D, et al. Hematopoietic stem cell quiescence promotes error-prone DNA repair and mutagenesis[J]. Cell Stem Cell, 2010, 7(2): 174-185. DOI:10.1016/j.stem.2010.06.014 |
| [12] |
Cao Y, Fang Y, Cai J, et al. ROS functions as an upstream trigger for autophagy to drive hematopoietic stem cell differentiation[J]. Hematology, 2016, 21(10): 613-618. DOI:10.1080/10245332.2016.1165446 |
| [13] |
Hu M, Zeng H, Chen S, et al. SRC-3 is involved in maintaining hematopoietic stem cell quiescence by regulation of mitochondrial metabolism in mice[J]. Blood, 2018, 132(9): 911-923. DOI:10.1182/blood-2018-02-831669 |
 2023, Vol. 43
2023, Vol. 43


