核医学主要的成像设备为正电子发射断层扫描与X射线计算机断层成像(PET/CT)与单光子发射断层成像(SPECT),在临床上可用于疾病的诊断、分期和疗效评估等,由于其功能及分子显像的优势,已成为临床中不可替代的诊断工具[1]。质量控制是保证核医学成像质量与安全的重要手段,模体是质量控制必备工具。此外模体还用于设备的验收、性能评估和不同设备、成像方法、重建算法间的评估比较以及多中心临床研究前不同设备间的对比等,不同模态、临床或研究需求下其设计不同[2-3]。模体的设计从满足设备性能指标的测量向更贴近临床真实条件的方向发展。核医学成像设备的性能评估需要从多方面考虑,难以通过单一指标或单一途径完成整体评估。本文通过调研及文献综述讨论核医学模拟临床模体及其相关性能指标测试,为各种用途中选用模体提供参考。
一、物理模体核医学模拟临床成像中的物理模体是实物模体,是由低散射、低吸收材料构造成多个腔室,用于灌注放射性药物,模拟人体的器官、组织及病灶。
1. NEMA NU2 IQ模体
(1) 模体构造:美国电气制造商协会(National Electrical Manufacturers Association,NEMA)提出的NEMA NU2-2001、2007、2012及2018版本标准中均有图像质量(image quality,IQ)及衰减及散射校正精度测试项目,其测试模体(NEMA NU2 IQ模体)广泛用于评估全身PET成像重建图像质量、定量准确性及不同PET设备间图像质量对比[1, 13-14]。该模体主要由3部分构成(图 1A)[4]:充满低原子序数材料的空心圆柱体(肺插件)置于模体中心用于模拟肺部;6个不同直径的小球环绕肺插件分布用于模拟病灶;剩余空腔区域用于模拟背景摄取。测试时,在背景区域灌注浓度为5.3 kBq/ml的18F溶液,模拟70 kg的人体注射370 MBq(10 mCi) 18F溶液在体内的平均分布。在NEMA NU2-2018标准中,6个球体均用于模拟热灶,与背景活度浓度之比为4∶1,与既往标准有所差异[15]。在NEMA NU2-2007、2012中,2个较大的空心球中灌注无放射性的水,模拟冷灶;4个较小的空心球中灌注4倍及8倍于背景区浓度的18F溶液,模拟不同对比度的热灶[16]。
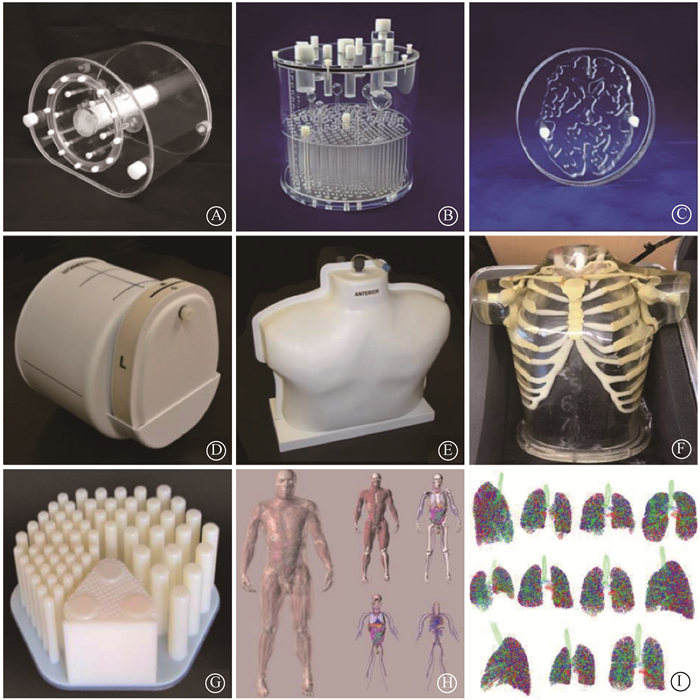
|
图 1 不同模体外观图 A. NEMA NU2 IQ模体[4];B. Esser模体[5];C. Hoffman 2D脑模体[6];D. CTN脑模体[7];E. CTN肿瘤模体[8];F. Probe-IQ模体[9];G. 3D打印模体[10];H. 4D XCAT模体[11];I. XCAT模体肺部结构[12] Figure 1 Outside views of different phantoms A. NEMA NU2 IQ phantom[4]; B. Esser phantom[5]; C. Hoffman 2D brain phantom[6]; D. CTN brain phantom[7]; E. CTN tumor phantom[8]; F. Probe-IQ phantom[9]; G. 3D printed phantom[10]; H. 4D XCAT phantom[11]; I. XCAT phantom of lung structure [12] |
(2) 性能指标:在NEMA NU2-2018版本中,用每个热球的对比度百分比QH,j与背景变异百分比Nj来描述图像质量[15]。对比度百分比QH,j为PET图像中测得的热球对比度与实际对比度之比,也称对比度恢复系数(contrast recovery ratio,CRC),反映在特定体积中PET图像上测得的活度浓度的准确程度[17]。CRC的理想值为1,CRC越大,图像质量越好。在Yussefian等[18]关于飞行时间(TOF)技术对小动物PET影响的研究中,CRC随扫描时间的变化不明显,因此认为CRC在评估图像质量方面不敏感。背景变异百分比Nj为所有同尺寸背景感兴趣区(region of interest,ROI)内平均计数的标准差与平均数之比,理想值为0。Nj越小,图像质量越好。
部分容积效应(partial volume effect,PVE)对小病变定量准确性具有显著影响,并与设备分辨率有关[19]。恢复系数(recovery coefficient,RC)是PET图像中测量活度与真实活度之比,能够简单直观的体现PVE,对于热灶,恢复系数的理想值为1 [20-21]。恢复系数越大,图像质量越高。随着病灶尺寸的减小,PVE带来的影响更严重,恢复系数呈下降趋势。对于直径10 mm的热球灶,恢复系数可低至0.2以下;对于直径较大的热球会出现恢复系数最大值>1的现象,这是由于图像最大像素叠加噪声造成的[19, 21]。恢复系数可通过不同ROI勾画方法计算出RC峰值、平均值与最大值。
|
|
表 1 不同模体优点与缺点对比 Table 1 Comparison of the advantages and disadvantages of different phantoms |
(3) 应用:NEMA NU2 IQ模体作为NEMA标准的模体,广泛用于核医学成像系统的性能评估,也被我国国家标准引用,用于PET设备的性能测试及验收[22]。此外,NEMA NU2 IQ模体还广泛用于PET及SPECT评估图像质量、定量准确性及小病灶探测能力的研究中。
Mansor等[23]使用NEMA NU2 IQ模体研究了扫描时间、重建参数、分析方法对PET/CT准确性的影响,并通过多次改变模体位置(<2 cm)研究同一患者多次扫描中不同结果间的可比性。结果显示位置改变会影响恢复系数准确性,在 < 17 mm的小球中尤为明显;相对于RCmax,位置改变对RCpeak与RCmean的影响更小,使用小体素成像也有助于减小位置改变对RC准确性的影响;扫描时间的缩短会造成RCmax的高估,应该是扫描时间短,信息量低,噪声水平高所致;点扩散函数(point spread function,PSF)重建的使用使RC变异系数从20%增大到30%。
Ryu等[24]通过NEMA NU2-2012的方法对使用99Tcm、177Lu的SPECT与18F、68Ga的PET系统性能进行直接比较,其中使用NEMA NU2 IQ模体评估并比较了图像质量与定量准确性等。两设备采集与重建参数均采用临床常用参数,4组实验中小球背景活度比各不相同。相同球体直径下,SPECT组恢复系数均低于PET组,背景变异均高于PET组,18F组中37与29 mm球体恢复系数均达到1。由于SPECT在高活度下受死时间影响较小导致其未达到噪声等效计数率峰值。本研究提出并验证了针对核医学中的主要成像设备进行统一测量评估的方法,并指出NEMA NU2在评估SPECT定量性能方面具有优势。
小病变的探测能力有利于疾病的早期诊断与分期,是评价PET成像性能的重要方面之一,如何对其有效评估是临床密切关注的问题[25-26]。NEMA NU2 IQ模体广泛应用于对PET成像系统各项性能指标的评估,模体内小球最小内径为10 mm,难以评估小病灶探测能力[27],但模体内部组件可以拆卸更换或者额外添加,因此对模体进行改装使其具有模拟更小尺寸病灶能力是设计评估探测能力模体的思路之一。Lu等[3]设计的NIM模体由PET成像模块与CT成像模块构成。PET成像模块在NEMA NU2 IQ模体的基础上,增加两个内径分别为4、7 mm的小球,兼容NEMA NU2标准同时在评估小病灶的图像质量与探测能力方面比NEMA NU2模体更具优势。
2. Jaszczak模体
(1) 模体构造:Jaszczak模体有多种型号,可用于SPECT或PET成像系统分辨率、图像质量、定量性能等性能评估。内部插件有多种,常用的由6个直径不同的冷棒扇区与6个直径不同的实心球体构成,冷棒可被替换为热灶插件,实心球体可替换为空心球体。可根据设备分辨率的高低选择不同的插件,其中可选择的冷棒最小直径为3.20 mm,球体最小直径为5.94 mm。Esser模体(图 1B)是Jaszczak模体变体之一,主要区别在于Esser模体盖子连接有不同大小的可填充圆柱形腔室,可用于PET系统的性能评估、验收测试等[5]。
(2) 性能指标:不同型号的Jaszczak模体可以获得不同的性能指标。通常使用的指标有标准摄取值(standard uptake value,SUV)、靶本底比值(target-to-background ratio,TBR)、对比噪声比(contrast-to-noise ratio,CNR)、信噪比(signal-to-noise ratio,SNR)及观察者评分等。SUV是在PET中常用的半定量参数,能够定量描述PET图像中放射性浓聚程度,在疾病鉴别诊断和疗效监测评估方面具有一定的参考价值[28-29];SUV测量结果受到多种生物因素与技术因素影响,不同ROI勾画方法得到的SUV不同[30]。TBR为图像上靶区像素平均值与背景像素平均值之比,是描述病灶对放射性示踪剂摄取强度的相对定量指标,靶区与背景ROI的勾画方法会严重影响TBR精度,设备性能与成像条件均会影响TBR的值[28-29]。SNR与CNR均可用于衡量图像质量。CNR为病灶与背景的对比度和背景中的噪声之比[31],用于衡量重建图像中感兴趣区的能见度,定量评估设备的探测能力与图像质量[17];根据Rose标准当目标物CNR> 5时可被探测到,CNR越大,目标物相对于背景的可见度越好[32]。SNR为真实信号与噪声之比,通过不同的信号与噪声的量化方式可以用多种方式定义信噪比[33]。不同研究中使用的SNR与CNR计算公式存在差异[23, 27, 31]。观察者评分属于人类观察者研究的方法,观察者根据主观印象对目标物可视程度评分,最终根据得分标准判断是否可以检测到病灶。常用的评估方法有3分法和5分法[16]。人类观察者评估与CNR分别从定性与定量的角度衡量了设备的探测能力[17]。
(3) 用途:相较于NEMA NU2模体,Jaszczak模体能够提供更小的热灶尺寸,因此可对成像系统小病灶探测能力进行评估。Oddstig等[34]使用NEMA NU2模体与Jaszczak模体对比了同一厂家传统PET与数字PET的图像质量与探测能力,研究保持所有扫描参数与重建参数的一致来探索SiPM带来的优势。结果显示,SiPM PET采集的图像具有略高的TBR,但在小病灶探测能力方面与传统PET没有表现出显著差异,认为使用基于SiPM的探测器不是导致数字PET图像质量提高的主要因素,SiPM在使用寿命与时间分辨率等方面带来的提高更明显。尽管Jaszczak模体组件可以提供更小的热灶尺寸,由于研究中使用的小球直径过小导致受PVE影响严重,无法提供可重复的恢复系数绘制恢复系数曲线,因此要根据实际情况在适当的范围内选择模体插件。
随着SPECT/CT、图像重建算法与光子衰减、康普顿散射和分辨率补偿方法的发展,使最初用于PET定量测量的标准摄取值(standard uptake value,SUV)同样可用于SPECT成像[35]。Halim等[36]利用Jaszczak模体评估了在使用99Tcm的SPECT/CT中,不同活度浓度、不同热灶背景活度比与不同重建参数下,不同类型的SUV指标定量准确性。结果显示所有实验组中SUVmean与其他3个指标存在显著差异,SUVmean对SUV真实值存在低估,SUVmax则显示高估。在低活性浓度下2次迭代、10个子集与无后滤波重建所获得的SUV值最接近理论值。4 mm高斯滤波使SUV准确性急剧下降,可能由于滤波在去除噪声同时也减少了重建图像的计数。因此建议在临床SPECT/CT工作中,为保证定量准确性必须合理选择重建参数与滤波器来权衡图像质量与噪声,考虑使用在各种活度浓度与TBR下较为准确的SUVmax进行临床定量分析,但Mansor等[23]的18F-FDG PET研究显示SUVmax受位置变化影响较大,降低了同一患者纵向对比中的定量准确性,建议使用SUVpeak取代SUVmax进行定量分析。SUVpeak是VOIpeak内SUV的平均值,VOIpeak包括肿瘤代谢最为活跃部分且尺寸固定,实体瘤的PET疗效评价标准中推荐将1 cm3球体作为SUVpeak的标准定义[37]。已有研究结果显示,在不同的TBR下SUVpeak比SUVmax具有更好的一致性,在18F-FDG的肿瘤显像中SUVpeak在短的采集时间下更可靠[9, 37]。但当ROIpeak大于或等于热灶大小时,背景区会被勾画至ROI内导致SUVpeak恢复能力变差,即使在使用PSF技术后小热灶的RCmax与RCmean有所提高,RCpeak仍处于较低水平,因此SUVpeak在微小肿瘤和衡量治疗效果等方面的应用值得进一步研究[23]。
3. 脑模体:常用的NEMA NU2 IQ模体背景大且活度浓度分布均匀,热灶小且活度浓度相对较高,适用于模拟肿瘤的摄取,而大脑中的示踪剂分布通常更均匀地分布在灰质与白质中,因此用上述模体模拟脑成像效果不理想[38]。
(1) 模体构造:Hoffman脑模体常用于模拟大脑血流或代谢摄取。Hoffman 2D脑模体(图 1C)是单层脑模体,具有真实的脑解剖结构;Hoffman 3D脑模体可以模拟整个脑部成像并准确地模拟内部的活度分布,通过PVE实现灰质与白质摄取之比为4∶1,其外部是内径为20.8 cm高为17.5 cm的圆柱体,可填充容积为1.2 L,内部由多层聚碳酸酯插件堆叠而成[6]。
北美核医学与分子影像学会(Society of Nuclear Medicine and Molecular Imaging,SNMMI)临床试验网络(Clinical Trials Network,CTN)脑模体(图 1D)专用于验证参与脑PET临床试验的PET/CT设备[7]。该模体由两个独立可填充部分构成,分别为分辨率与均匀性部分和模拟临床部分。分辨率与均匀性部分为长12.7 cm,直径20 cm的圆柱体,内含一组冷棒与一组热棒共24根,每对冷棒的直径分别为4.0、5.0、6.25、7.81、9.67和12.20 mm,热棒的直径和数量与冷棒相同且TBR为4,空间分辨率通过主观观测到最小冷棒与热棒的直径衡量,剩余区域为背景区,用于评估潜在伪影,并通过测量背景区的平均SUV值评估定量一致性。模拟临床部分通过对患者MRI数据建模模拟中脑横断面且灰质白质比(gray matter to white matter ratio,GMWMR)为4,脑室内不含放射性分布。该模体可通过单次采集同时评估图像均匀性、分辨率、定量准确定和图像质量,但其结构复杂且灌注难度较高导致灌注过程容易出现问题,在此情况下无法确定结果中的变异来自模体填充不佳或其他问题[7]。
(2) 用途:Wagatsuma等[39]通过Hoffman 3D模体提供了确立脑PET成像重建中最佳β值的方法。研究使用Discovery PET/CT 710对分别注有20 MBq 18F-FDG与20 MBq 11C-PiB的模体在相同采集条件下采集30 min,两组数据都分别进行OSEM+TOF与BPL+TOF的重建,除BPL中β值不同外其他重建参数相同。以对比度百分比与背景变异系数作为指标,分别确定两种示踪剂BPL重建优于OSEM的β值范围,通过对图像噪声、对比度、整体图像质量等指标的视觉评分之和确定18F-FDG与11C-PiB PET BPL中最佳β值分别为200与450。相较于OSEM重建,BPL重建的图像对比度更高,对噪声的控制更好,能达到更高的定量准确性。
Verwer等[38]通过Hoffman 3D模体建立了脑部PET重建标准以协调不同PET设备的定量性能,提高不同PET设备定量结果的可比性,并利用多中心的数据生成大型数据集。研究包含12台来自不同厂家的PET/CT,分别对采集的模体数据进行不同参数的重建,利用Elastix将重建图像配准至二进制灰质白质图,使用模体活度浓度归一化获得恢复系数RC图像,根据最终纳入分析的64幅图像的灰质恢复系数与GMWMR确定最小与最大限值,保证不同PET设备至少有一幅图像在此范围内,范围内图像的重建参数即该研究根据不同设备给出的推荐重建参数。
4. PET/MRI模体:对于PET/MRI,由于两种模态成像原理不同,任一模态中的常用模体难以在PET/MRI下同时采集两种数据并对设备进行整体评估,将两种模态分开测试则无法对基于MRI的PET数据衰减校正方法进行评估,因此PET/MRI模体材料的选取、结构的设计等一直是研究的热点[2]。除模体本身外,PET/MRI模体内的溶液也需要额外注意,不仅要满足对PET示踪剂的溶解性,还要考虑其在MRI的强磁场下是否会产生伪影。Ziegler等[40]指出使用18F-FDG进行PET/MRI模体扫描时,建议使用三甘醇作为溶剂;如果一定要将水作为溶剂,可以向水中加入NiSO4与NaCl以增加溶液导电性来降低MRI图像中的伪影。
5. 仿真模体:上述模体多数具有较为简单的几何结构,不能精确地模拟人体解剖结构,人体仿真模体能够弥补上述缺点并更真实地模拟临床成像条件。
CTN肿瘤模体(图 1E)是模拟人体胸腔结构的拟人化模体,最初设计目的是评估病灶探测能力[41]。该模体长宽高分别为40、34、18 cm,背景可灌注体积为(7.5±0.1)L。内含6个空心小球内径分别为7、10、15、10 mm分布在纵隔区、左侧腋窝淋巴区、左肩、左肺,右肺分布有两个内径分别为10与20 mm的小球,所有小球总体积为(60±5)ml,球内可灌注放射性浓度4倍于本底的放射性药物用于模拟病灶,小球之间通过窄口径管道串联连接,可一次性完成所有小球的灌注[8]。两侧肺内充满密度为0.5 g/cm3的低密度材料,用于模拟人体肺部对射线的衰减。SNMMI临床试验网络于2008年制定了通过CTN肿瘤模体验证参加肿瘤临床试验PET/CT设备的模体成像程序,五年内收集了超过400例来自不同品牌和型号的PET/CT模体扫描数据,指出CTN肿瘤模体在验证PET/CT校正准确性和表征不同型号PET/CT定量成像特征方面具有实用价值,不同重建参数扩大了相似PET/CT间的定量差异,其中重建后平滑滤波是最有影响力的参数[8]。Christian等[41]使用灌有89Zr的CTN肿瘤模体对来自3个中心的7台不同PET/CT依次进行视觉与定量图像分析,最终筛选出5台噪声水平与病灶探测能力相似的PET/CT用于进一步89Zr单抗PET成像研究,并确定了每台设备能够达到最佳性能和病灶探测能力的参数。Makris等[42]指出相较于ACR模体,CTN肿瘤模体与NEMA NU2图像质量模体更适用于检测和协调不同设备间的图像质量与定量性能的差异,使用VOI3Dpeak勾画方法可以进一步缩小不同设备间SUV定量分析的差异。
Fedrigo等[9]通过拼接胸部模体与骨盆模体制作了一种高度逼真的Probe-IQ模体(图 1F)。基于该模体研究了不同重建方法与ROI分割方法对定量指标的影响。结果显示尽管有序子集最大期望值(ordered subsets expectation maximization,OSEM)与块序正则化最大期望值(block sequential regularized expectation maximization,BSREM)两种重建算法能达到相似的定量准确性,BRSEM同时能提供更好的病灶探测能力与图像质量;在确定代谢肿瘤体积中梯度分割方法比40%固定阈值法更准确且稳定;定量指标方面与前文提到的结论相似,SUVmax由于缺乏准确性且受成像参数影响较大不被推荐,SUVpeak受不同TBR与重建算法影响更小。
上述模体模拟了人体真实解剖结构,但在临床中生理运动对图像质量与定量分析带来的影响不容小视,因此有研究在静态仿真模体基础上开发出能够模拟生理运动的模体。Black等[43]去除Probe IQ模体中部分金属结构,加入3D打印制作的弹性肺与驱动装置。该驱动装置通过改变胸腔内压力间接改变肺内压力,通过胸腔内负压使肺充盈,更真实地模拟呼吸运动。Bolwin等[44]则独立开发了一种拟人胸腔模体同时模拟呼吸与心脏运动。该模体包括胸腔、呼吸单元、心脏单元3个主要功能部分。模拟病灶可以放置在横膈附近模拟肝脏或下肺肿瘤,或附着在心肌模拟冠状动脉斑块。通过PET/CT对该模体的成像,可观察到呼吸门控对斑块的可探测性与结构的清晰程度有一定改善作用。
6. 3D打印模体:近年来3D打印技术广泛且成功地应用于生物医学领域,有关3D打印模体的研究日益增多[10, 45]。根据Filippou和Tsoumpas[46]将3D打印参与模体制作的方式大致分为以下几种:利用3D打印制作模体组件与已有模体结合使用;直接打印模体,向模体内灌注放射性药物;将放射性药物与材料结合打印出具有放射性的模体等。Bieniosek等[47]利用3D打印技术制作了与商用模体Micro Deluxe相同的模体,使用同一PET/CT、PET/MRI分别对商用模体和3D打印模体扫描,两模体内插入物直径之差介于0.07%到4.63%之间,测量结果具有较好一致性。Miller等[48]尝试将18F-FDG添加至3D打印机的粘合剂中,制作出人类大脑模体、含有结节的人类肺部模体与小鼠大脑模体。Gear等[10]首次将放射性药物99Tcm直接混入光致聚合物,以此作为3D打印材料制作模体(图 1 G)。通过SPECT对模体成像验证了使用该混合物打印的稳定性与均匀性,模体可用于评估成像设备的系统均匀性、对比度、分辨率等指标。作者认为通过类似的方式可以制作更拟人的模体和长半衰期核素模体,对成像系统进行更严格的质量控制。由此可见,3D打印技术为模体的制作带来了灵活且经济高效的方式[49]。
常见的模体在设计时,热灶与背景之间存在一定壁厚造成的冷边界,对评估PET系统在真实情况下的探测能力产生影响[31]。Gallivanone等[50]将含有琼脂、蔗糖、碘对比剂与18F-FDG的胶体混合物灌入3D打印制作的外壳中,待胶体混合物固化后去除外壳以消除冷边界。Wollenweber等[51]设计一种评估PET探测能力的模体,其由空心圆柱外壳、以尼龙为原料3D打印制作的小球与空心多面体填充物构成。使用小球与多面体逐层填满模体后注入预先混合好的放射性溶液,不含放射性的小球与填充物间的放射性溶液构成暖背景,空心多面体位置由纸质模板固定,内部的放射性溶液模拟髙摄取区。该设计中热灶与背景间不存在冷边界,更适用于评估探测能力;模体背景区不均匀的放射性活度分布能够真实地模拟临床成像条件。通过GE Discovery 710 PET/CT对模体进行两次计数相同的重复扫描,利用信道化霍特林模型观测器获得两次扫描ROC曲线下面积结果相似,验证了该模体设计在评估探测能力方面的可靠性。
二、数字模体数字模体不是实物模体,是通过计算机模拟的模体,常用于模拟研究,是虚拟临床试验的核心部分之一,能对成像设备与技术进行评估,也可用于患者器官的剂量估计研究。根据定义解剖结构的方法大致可将数字模体分为3类:①基于数学模型的模体:使用方程或简单的几何基元定义解剖结构,能够较为简单地模拟解剖结构的变化与运动,但缺乏真实性。②体素化模体:基于对患者图像的分割,具有较好的真实性,但灵活性差。③边界表示(boundary representation,BREP)模体:基于真实患者数据同时使用高级曲面表示方法定义每个器官或结构,同时具有真实性与灵活性,多数数字模体基于此方法设计[52]。
Segars等[11]设计了一种能够用于多模态成像研究的四维扩展心脏躯干(4D extended cardiac-torso,4D XCAT)模体(图 1 H)。该模体通过非均匀有理B样条曲面分割患者CT数据集中的器官构建,涵盖全身范围,在真实地模拟人类器官复杂的解剖结构和呼吸、心脏运动以及两者之间的相互作用同时允许通过调整参数改变解剖结构或模拟病灶。Abadi等[12]在XCAT模体的基础上丰富了肺内结构(图 1I),将气管、肺动静脉延伸至终末水平,考虑壁厚的同时避免了三者之间的交叉,但由于最初模体中建模的气管与血管有限,该研究提出的生长模型仅对粗大的气管与血管分叉与填充,因此在精确模拟肺内非实质结构方面存在局限性。
三、展望质量控制是保证核医学设备正常工作的必要环节,模体是质量控制中强有力的工具。此外,模体也用于验收设备、比较不同设备、不同的采集程序、多中心临床试验前设备的验证与协调等。模体从结构的单一到复杂,从静态到动态,向更能反映临床真实条件的方向发展,数字化、3D打印等技术的应用为模体的设计提供更经济灵活的方式。在质量控制、临床科研、设备性能评估及多中心研究中,应针对实际情况与需求合理选择模体,灵活地对已有模体进行改进或开发新的模体,以满足不同的目的。
利益冲突 无
作者贡献声明 苏雪松负责查阅文献,撰写论文;耿建华负责设计选题,指导论文修改
| [1] |
Tsutsui Y, Awamoto S, Himuro K, et al. Evaluating and comparing the image quality and quantification accuracy of SiPM-PET/CT and PMT-PET/CT[J]. Ann Nucl Med, 2020, 34(10): 725-735. DOI:10.1007/s12149-020-01496-1 |
| [2] |
Lennie E, Tsoumpas C, Sourbron S. Multimodal phantoms for clinical PET/MRI[J]. EJNMMI Phys, 2021, 8(1): 62. DOI:10.1186/s40658-021-00408-0 |
| [3] |
Lu S, Zhang P, Li C, et al. A NIM PET/CT phantom for evaluating the PET image quality of micro-lesions and the performance parameters of CT[J]. BMC Med Imaging, 2021, 21(1): 165. DOI:10.1186/s12880-021-00683-4 |
| [4] |
Zeimpekis KG, Kotasidis FA, Huellner M, et al. NEMA NU 2-2018 performance evaluation of a new generation 30-cm axial field-of-view Discovery MI PET/CT[J]. Eur J Nucl Med Mol Imaging, 2022, 49(9): 3023-3032. DOI:10.1007/s00259-022-05751-7 |
| [5] |
Bebbington NA, Jϕrgensen T, Dupont E, et al. Validation of CARE kV automated tube voltage selection for PET-CT: PET quantification and CT radiation dose reduction in phantoms[J]. Eur J Nucl Med Mol Imaging Phys, 2021, 8(1): 29. DOI:10.1186/s40658-021-00373-8 |
| [6] |
Ribeiro D, Hallett W, Tavares AAS. Performance evaluation of the Q.Clear reconstruction framework versus conventional reconstruction algorithms for quantitative brain PET-MR studies[J]. Eur J Nucl Med Mol Imaging Phys, 2021, 8(1): 41. DOI:10.1186/s40658-021-00386-3 |
| [7] |
Fahey F, Christian P, Zukotynski K, et al. Use of a qualification phantom for PET brain imaging in a multicenter consortium: a collaboration between the Pediatric Brain Tumor Consortium and the SNMMI Clinical Trials Network[J]. J Nucl Med, 2019, 60(5): 677-682. DOI:10.2967/jnumed.118.219998 |
| [8] |
Sunderland JJ, Christian PE. Quantitative PET/CT scanner performance characterization based upon the society of nuclear medicine and molecular imaging clinical trials network oncology clinical simulator phantom[J]. J Nucl Med, 2015, 56(1): 145-152. DOI:10.2967/jnumed.114.148056 |
| [9] |
Fedrigo R, Kadrmas DJ, Edem PE, et al. Quantitative evaluation of PSMA PET imaging using a realistic anthropomorphic phantom and shell-less radioactive epoxy lesions[J]. EJNMMI Phys, 2022, 9(1): 2. DOI:10.1186/s40658-021-00429-9 |
| [10] |
Gear JI, Cummings C, Sullivan J, et al. Radioactive 3D printing for the production of molecular imaging phantoms[J]. Phys Med Biol, 2020, 65(17): 175019. DOI:10.1088/1361-6560/aba40e |
| [11] |
Segars WP, Sturgeon G, Mendonca S, et al. 4D XCAT phantom for multimodality imaging research[J]. Med Phys, 2010, 37(9): 4902-4915. DOI:10.1118/1.3480985 |
| [12] |
Abadi E, Segars WP, Sturgeon GM, et al. Modeling lung architecture in the XCAT series of phantoms: physiologically based airways, arteries and veins[J]. IEEE Trans Med Imaging, 2018, 37(3): 693-702. DOI:10.1109/TMI.2017.2769640 |
| [13] |
Delcroix O, Bourhis D, Keromnes N, et al. Assessment of image quality and lesion detectability with digital PET/CT system[J]. Front Med (Lausanne), 2021, 8: 629096. DOI:10.3389/fmed.2021.629096 |
| [14] |
van Sluis J, de Jong J, Schaar J, et al. Performance characteristics of the digital biograph vision PET/CT system[J]. J Nucl Med, 2019, 60(7): 1031-1036. DOI:10.2967/jnumed.118.215418 |
| [15] |
National Electrical Manufacturers Association. Performance measurements of positron emission tomography(PET): NEMA NU2-2018[S]. Rosslyn: NEMA, 2018.
|
| [16] |
刘嘉宁, 耿建华. PET质量控制标准与性能测试研究进展[J]. 中国医学装备, 2021(7): 171-177. Liu JN, Geng JH. Advances in QC standard and performance testing of PET[J]. China Med Equip, 2021(7): 171-177. DOI:10.3969/J.ISSN.1672-8270.2021.07.039 |
| [17] |
ϕenSK, AasheimLB, EikenesL, 等. Image quality and detectability in Siemens biograph PET/MRI and PET/CT systems-a phantom study[J]. EJNMMI Phys, 2019, 6(1): 16. DOI:10.1186/s40658-019-0251-1 |
| [18] |
Yussefian NZ, Toussaint M, Gaudin É, et al. TOF benefits and trade-offs on image contrast-to-noise ratio performance for a small animal PET scanner[J]. IEEE Trans Radiat Plasma Med Sci, 2021, 5(5): 687-693. DOI:10.1109/TRPMS.2020.3018678 |
| [19] |
Srinivas SM, Dhurairaj T, Basu S, et al. A recovery coefficient method for partial volume correction of PET images[J]. Ann Nucl Med, 2009, 23(4): 341-348. DOI:10.1007/s12149-009-0241-9 |
| [20] |
Zhu X, Parker JA, Palmer MR. Recovery coefficient in PET as a function of object size and respiratory motion trajectory[C]. Fajardo: IEEE Nuclear Science Symposium Conference Record, 2005: 2170-2172. DOI: 10.1109/NSSMIC.2005.1596764.
|
| [21] |
Zhu Y, Geng C, Huang J, et al. Measurement and evaluation of quantitative performance of PET/CT images before a multicenter clinical trial[J]. Sci Rep, 2018, 8(1): 9035. DOI:10.1038/s41598-018-27143-4 |
| [22] |
国家质量监督检验总局, 国家标准化管理委员会. GB/T 18988.1-2013放射性核素成像设备性能和试验规则第1部分: 正电子发射断层成像装置[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Standardization Administration of the People's Republic of China. GB/T 18988.1-2013 Radionuclide imaging device-Characteristics and test conditions-Part 1: Positron emission tomograph[S]. Beijing: Standards Press of China, 2014. |
| [23] |
Mansor S, Pfaehler E, Heijtel D, et al. Impact of PET/CT system, reconstruction protocol, data analysis method, and repositioning on PET/CT precision: an experimental evaluation using an oncology and brain phantom[J]. Med Phys, 2017, 44(12): 6413-6424. DOI:10.1002/mp.12623 |
| [24] |
Ryu H, Meikle SR, Willowson KP, et al. Performance evaluation of quantitative SPECT/CT using NEMA NU 2 PET methodology[J]. Phys Med Biol, 2019, 64(14): 145017. DOI:10.1088/1361-6560/ab2a22 |
| [25] |
Schaefferkoetter J, Casey M, Townsend D, et al. Clinical impact of time-of-flight and point response modeling in PET reconstructions: a lesion detection study[J]. Phys Med Biol, 2013, 58(5): 1465-1478. DOI:10.1088/0031-9155/58/5/1465 |
| [26] |
刘嘉宁, 耿建华. PET/CT小病灶探测能力及其评价方法[J]. 中国医学装备, 2021, 18(4): 193-199. Liu JN, Geng JH. Detecting ability and evaluation methods of PET/CT for small lesions imaging[J]. China Med Equip, 2021, 18(4): 193-199. DOI:10.3969/j.issn.1672-8270.2021.04.046 |
| [27] |
Adler S, Seidel J, Choyke P, et al. Minimum lesion detectability as a measure of PET system performance[J]. EJNMMI Phys, 2017, 4(1): 13. DOI:10.1186/s40658-017-0179-2 |
| [28] |
陈盛祖. PET/CT技术原理及肿瘤学应用[M]. 北京: 人民军医出版社, 2007. Chen SZ. PET/CT technology principle and oncology application[M]. Beijing: People's Military Medical Press, 2007. |
| [29] |
耿建华, 陈英茂. 正电子图像的定量分析在临床肿瘤学中的应用[J]. 国外医学(放射医学核医学分册), 2005, 29(1): 6-9. Geng JH, Chen YM. Clinical applications of quantitative parameters of positron images in oncology[J]. Foreign Med Sci(Sec Radiat Med Nucl Med), 2005, 29(1): 6-9. DOI:10.3760/cma.j.issn.1673-4114.2005.01.002 |
| [30] |
Adams MC, Turkington TG, Wilson JM, et al. A systematic review of the factors affecting accuracy of SUV measurements[J]. AJR Am J Roentgenol, 2010, 195(2): 310-320. DOI:10.2214/AJR.10.4923 |
| [31] |
Bao Q, Chatziioannou AF. Estimation of the minimum detectable activity of preclinical PET imaging systems with an analytical method[J]. Med Phys, 2010, 37(11): 6070-6083. DOI:10.1118/1.3495817 |
| [32] |
Cherry SR, Sorenson JA, Phelps ME. Physics in nuclear medicine E-book[M]. Boca Raton: Elsevier Health Sciences, 2012.
|
| [33] |
Bushberg JT, Seibert JA, Leidholdt EM, et al. The essential physics of medical imaging[M]. 2020.
|
| [34] |
Oddstig J, Brolin G, Trägårdh E, et al. Head-to-head comparison of a Si-photomultiplier-based and a conventional photomultiplier-based PET-CT system[J]. EJNMMI Phys, 2021, 8(1): 19. DOI:10.1186/s40658-021-00366-7 |
| [35] |
Bailey DL, Willowson KP. An evidence-based review of quantitative SPECT imaging and potential clinical applications[J]. J Nucl Med, 2013, 54(1): 83-89. DOI:10.2967/jnumed.112.111476 |
| [36] |
Halim F, Yahya H, Jaafar KN, et al. Accuracy assessment of SUV measurements in SPECT/CT: a phantom study[J]. J Nucl Med Technol, 2021, 49(3): 250-255. DOI:10.2967/jnmt.120.259168 |
| [37] |
Sher A, Lacoeuille F, Fosse P, et al. For avid glucose tumors, the SUV peak is the most reliable parameter for[(18)F]FDG-PET/CT quantification, regardless of acquisition time[J]. EJNMMI Res, 2016, 6(1): 21. DOI:10.1186/s13550-016-0177-8 |
| [38] |
Verwer EE, Golla S, Kaalep A, et al. Harmonisation of PET/CT contrast recovery performance for brain studies[J]. Eur J Nucl Med Mol Imaging, 2021, 48(9): 2856-2870. DOI:10.1007/s00259-021-05201-w |
| [39] |
Wagatsuma K, Miwa K, Kamitaka Y, et al. Determination of optimal regularization factor in Bayesian penalized likelihood reconstruction of brain PET images using[18F]FDG and[11C]PiB[J]. Med Phys, 2022, 49(5): 2995-3005. DOI:10.1002/mp.15593 |
| [40] |
Ziegler S, Braun H, Ritt P, et al. Systematic evaluation of phantom fluids for simultaneous PET/MR hybrid imaging[J]. J Nucl Med, 2013, 54(8): 1464-1471. DOI:10.2967/jnumed.112.116376 |
| [41] |
Christian PE, Williams SP, Burrell L, et al. Optimization of (89)Zr PET imaging for improved multisite quantification and lesion detection using an anthropomorphic phantom[J]. J Nucl Med Technol, 2020, 48(1): 54-57. DOI:10.2967/jnmt.119.230474 |
| [42] |
Makris NE, Huisman MC, Kinahan PE, et al. Evaluation of strategies towards harmonization of FDG PET/CT studies in multicentre trials: comparison of scanner validation phantoms and data analysis procedures[J]. Eur J Nucl Med Mol Imaging, 2013, 40(10): 1507-1515. DOI:10.1007/s00259-013-2465-0 |
| [43] |
Black DG, Yazdi YO, Wong J, et al. Design of an anthropomorphic PET phantom with elastic lungs and respiration modeling[J]. Med Phys, 2021, 48(8): 4205-4217. DOI:10.1002/mp.14998 |
| [44] |
Bolwin K, Czekalla B, Frohwein LJ, et al. Anthropomorphic thorax phantom for cardio-respiratory motion simulation in tomographic imaging[J]. Phys Med Biol, 2018, 63(3): 035009. DOI:10.1088/1361-6560/aaa201 |
| [45] |
刘宸希, 康红军, 吴金珠, 等. 3D打印技术及其在医疗领域的应用[J]. 材料工程, 2021, 49(6): 66-76. Liu CH, Kang HJ, Wu JZ, et al. 3D printing and its application in the field of medicine[J]. J Mater Eng, 2021, 49(6): 66-76. DOI:10.11868/j.issn.1001-4381.2019.001042 |
| [46] |
Filippou V, Tsoumpas C. Recent advances on the development of phantoms using 3D printing for imaging with CT, MRI, PET, SPECT, and ultrasound[J]. Med Phys, 2018, 45(9): e740-760. DOI:10.1002/mp.13058 |
| [47] |
Bieniosek MF, Lee BJ, Levin CS. Characterization of custom 3D printed multimodality imaging phantoms[J]. Med Phys, 2015, 42(10): 5913-5918. DOI:10.1118/1.4930803 |
| [48] |
Miller MA, Hutchins GD. Development of anatomically realistic PET and PET/CT phantoms with rapid prototyping technology[C]. Honolulu: 007 IEEE Nuclear Science Symposium Conference Record. IEEE, 2007: 4252-4257.
|
| [49] |
Gear JI, Cummings C, Craig AJ, et al. Abdo-Man: a 3D-printed anthropomorphic phantom for validating quantitative SIRT[J]. EJNMMI Phys, 2016, 3(1): 17. DOI:10.1186/s40658-016-0151-6 |
| [50] |
Gallivanone F, D'Ambrosio D, Carne I, et al. A tri-modal tissue-equivalent anthropomorphic phantom for PET, CT and multi-parametric MRI radiomics[J]. Phys Med, 2022, 98: 28-39. DOI:10.1016/j.ejmp.2022.04.007 |
| [51] |
Wollenweber SD, Alessio AM, Kinahan PE. A phantom design for assessment of detectability in PET imaging[J]. Med Phys, 2016, 43(9): 5051. DOI:10.1118/1.4960365 |
| [52] |
Abadi E, Segars WP, Tsui B, et al. Virtual clinical trials in medical imaging: a review[J]. J Med Imaging (Bellingham), 2020, 7(4): 042805. DOI:10.1117/1.JMI.7.4.042805 |
 2023, Vol. 43
2023, Vol. 43


