宫颈癌是女性发病率第四高的癌症,也是女性癌症的第四大死因[1-3]。宫颈癌的常规放射治疗是外照射(external beam radiation therapy,EBRT)和近距离放射治疗相结合,其中,高剂量率(high dose rate,HDR)近距离治疗是治疗宫颈癌是一种有效的治疗方法[4],已有较多文献证实其能明显降低宫颈癌的局部复发率,提高生存率[4-5]。近距离治疗可采用腔内(intracavity brachytherapy,ICBT)、组织间插植(interstitial brachytherapy,ISBT)或混合(IC/ISBT)技术。ISBT可有效弥补ICBT在高剂量照射肿瘤组织时临床靶区体积(clinical target volume,CTV)覆盖率不足的问题[5]。
正向优化与逆向优化在近距离治疗中都有广泛的应用,正向优化的图形优化(graphical optimization,GO)优化需依赖经验技巧较为丰富的物理师,从多个层面,包括矢状面、横截面、冠状面等综合考虑剂量线是否外放或内收,计划不可重复,且耗时长。在二十多年前,治疗计划系统(Treatment Planning System, TPS)中就已成功实施了基于解剖学的逆向计划[6-7]。与GO相比,逆向计划的优势包括减少主观性、减少生成治疗计划所需的时间、减少危及器官(organs at risk, OARs)受照射量并增加靶区覆盖率等。其中模拟退火逆向计划优化算法(inverse planning simulated annealing,IPSA)是基于解剖学结构进行计算的快速模拟退火随机算法优化源驻留时间,优化的过程不超过1 min。另外混合逆向计划优化算法(hybrid inverse planning optimization,HIPO)用于3D剂量分布优化,结合了模拟退火随机算法和有限内存确定性算法,允许手动步源和部分导管优化[8]。本研究的主要目的是基于放射生物学模型,比较使用GO、IPSA和HIPO优化算法制定的放疗计划之间是否存在差异。另外,TCP和NTCP等指标可以帮助临床医生更全面地评估治疗方案,在临床应用中具有较大的优势。
资料与方法1. 临床资料:经四川省肿瘤医院伦理委员会审批, 并在中国临床试验中心注册(www.chictr.org.cn, 注册号KY-2022-145-01),回顾性分析从2022年1月1日到2022年8月30日时间内在四川省肿瘤医院行根治性放疗的65名宫颈癌患者的资料,年龄为30~77岁,病理类型均为鳞癌,均行手术接受根治性放疗,排除术后宫颈癌患者。根据国际妇产科联盟(Federation of International of Gynecologists and Obstetricians,FIGO)2018年的分期标准,所有患者均为ⅠB2至ⅣA期。所有患者均接受45 Gy的全骨盆的EBRT,随后接受CT引导下的IC/ISBT,单次处方剂量为6 Gy,每次IC/ISBT治疗前都进行单独评估。所有患者已签署知情同意。
2. 手术操作:所有患者均已完成术前检查,排除手术禁忌证。术前排空膀胱,取截石位平卧于妇科治疗床,常规外阴消毒操作后,置入Foley导尿管,导管内注入7 ml生理盐水确定膀胱参考点。而后转运至CT室(荷兰飞利浦公司生产的Brilliance Big Bore大孔径CT)完成第一次CT扫描。医师基于CT图像,根据患者肿瘤部位及大小规划插植位置,针数一般为4~8根,于患者全麻后完成宫腔管与插植针的置入。
3. CT定位及靶区勾画:患者膀胱注入100 ml生理盐水,再次推入CT室完成第二次CT定位扫描,扫描范围从髂前上脊至坐骨结节下缘,层厚3 mm,之后将图像传至瑞典医科达公司核通(医科达,瑞典,v4.3)放疗计划系统,临床医生按照国际辐射单位与测量委员会(International Commission on Radiation Units,ICRU)89号报告的推荐标准进行靶区和OARs勾画[9]。
4. 治疗计划的设计:采用瑞典医科达公司的核通放疗计划系统,施源器重建参照ICRU推荐[9],放射源步进长度为5 mm。偏移值以实际测量为准,金属宫腔管为-0.6 cm,插植针值为-0.35 cm[10]。基于患者第一次IC/ISBT影像,由后装专职物理师进行IC/ISBT计划的设计和优化(科室工作量每天30~35次治疗),65例患者分别使用GO、HIPO与IPSA各制定1例计划,共制定了195个放疗计划。GO的方式主要在矢状面进行优化,同时参照横截面,冠状面的等剂量线分布以及剂量体积直方图(dose volume histogram, DVH)参数,不断拖动等剂量线直至达到优化目标。IPSA计划的约束条件,优化时最小剂量设置为6 Gy,权重为100,为了更好地完成目标剂量要求,需要不断调节参数达到最优剂量。HIPO计划的约束条件,优化最小剂量设置为6 Gy,权重为100,最大剂量设置为12 Gy,权重为1(表 1),参照3个断面的等剂量线分布以及DVH参数,根据每位患者的实际解剖结构,不断调整优化目标参数,直至达到理想剂量分布,OARs的D1 cm3和D2 cm3尽可能的低。IPSA、HIPO的停留时间偏差约束(dwell time deviation constraint, DTDC)、驻留时间梯度限制(dwell time gradient restriction,DTGR)均为0.6。3种计划的处方剂量均为HRCTV D90 6 Gy/次。每个计划都是在相同放射源活度下对比,本文中数据是在放射源活度为4 Bq时进行对比。
|
|
表 1 IPSA和HIPO用于创建初始治疗计划的约束条件 Table 1 Constraints of IPSA and HIPO used to create initial treatment plans |
5. 观察指标及数据处理(1)观察指标包括:等剂量线差异、各个计划优化所需时间、HRCTV的D100、V150%、V200%、均匀性指数(homogeneity index,HI)和适形度指数(conformity index,CI)、OARs(膀胱、直肠、小肠)的D1 cm3、D2 cm3、肿瘤控制率(tumor control probability,TCP)、正常组织并发症概率(normal tissue complication probability,NTCP)、生物有效剂量(biologically effective dose,BED)、等效均匀生物有效剂量(equivalent uniform biologically effective dose,EUBED),其中Dx为x%相对体积或x cm3绝对体积收到的照射剂量,Vy%为y%的处方剂量照射的体积百分比。HI和CI计算公式:
| $\mathrm{HI}=\frac{V_{100 \%}-V_{150 \%}}{V_{100 \%}}$ | (1) |
| $\mathrm{CI}=\frac{V_{T . r e f}}{V_T} \times \frac{V_{T, r e f}}{V_{r e f}}$ | (2) |
式中,VT.ref为满足HRCTV处方剂量体积,cm3;VT为HRCTV体积,cm3;Vref为接受剂量等于或大于处方剂量体积,cm3[11]。TCP采用公式(3)计算:
| $\mathrm{TCP}=\frac{1}{1+\left(\frac{D_{50}}{D_i}\right)^k}$ | (3) |
式中,k为控制曲线的斜率,D50表示肿瘤控制率为50%的剂量,Di为体素i处的剂量。由于肿瘤实际接受的剂量并不均匀,引入等效均匀剂量(equivalent uniform dose,EUD)[公式(4)]代替Di,TCD50代替D50更为准确,使用Niemierko model[12],公式如下:
| $\mathrm{EUD}=\left(\sum\limits_i V_i\left(D_i \frac{\alpha / \beta+D_i / n_f}{\alpha / \beta+2}\right)^a\right)^{\frac{1}{a}}$ | (4) |
式中,Vi为收到剂量Di照射的靶体积,nf为分次,a为描述肿瘤或正常组织剂量体积效应的一个参数因子。
| $\mathrm{TCP}=\frac{1}{1+\left(\frac{\mathrm{TCD}_{50}}{\mathrm{EUD}}\right)^{4 \gamma_{50}}}$ | (5) |
式中,TCD50表示肿瘤控制为50%的剂量,γ为描述剂量效应曲线特征的一个参数因子,与剂量效应曲线的斜率有关,称为剂量效应曲线的归一化斜率,γ50是TCP=0.5、D=D50如时的一个特殊值。NTCP采用下式计算:
| $\mathrm{NTCP}=\frac{1}{1+\left(\frac{T D_{50}}{E U D}\right)^{4 \gamma_{50}}}$ | (6) |
式中,TD50表示为整体体积受到辐射引起某器官出现50%并发症概率所需要的剂量,cGy。
本研究中,TCP、NTCP均为预估值,是在患者单次治疗基础上进行评估,假设Di如公式(7)所示,d为单次治疗的体素i处剂量,本文的总剂量Di表示为(EBRT 45 Gy + IC/ISBT d× 5次)[13]。
| $D_i=d \times 5+45$ | (7) |
|
|
表 2 TCP与NTCP中参数值 Table 2 Parameters used for TCP and NTCP calculation |
BED和EUBED计算公式:从TPS中提取了所有患者的单次治疗的数据,把导出的数据带入到公式8~10中计算需要最终比较分析的EUBED参数,BED采用下式计算[16]。
| $\mathrm{BED}_i=\sum\limits_n d_i\left(1+G_i \frac{d_i}{\alpha_i / \beta_i}\right)$ | (8) |
式中,n为分割次数,di为体素i的剂量,αi/βi为体素i处的LQ模型参数比值,Gi为剂量延长因子,Gi根据公式(9)评估:
| $\begin{gathered}G_i=\left(\frac{2}{d_i^2}\right) \int\limits_0^T d u\; \tilde{d}_l(u) \int\limits_0^T d w\; \tilde{d}_l(w) H(u-w) \times \\ \exp \left(-(u-w) \ln (2) / T_{1 / 2}\right)\end{gathered}$ | (9) |
式中,T为单次治疗照射时间,
BED的经典计算是假设剂量分布是均匀的,但实际上在放射治疗中肿瘤与正常器官体积的剂量分布从来都不是完全均匀的,而且近距离治疗中的不均匀性更为明显。Jones和Hobanl[19]提出的EUBED的概念,是一个考虑到非均匀剂量分布的分次剂量效应模型。与EUD同样考虑了剂量分布不均,EUBED它结合了Niemnierko[12]的EUD概念和Barenudoenl[20]的BED概念。由此引入EUBED的概念,以更好地描述剂量不均匀性产生的放射生物学效应在临床结局中的作用[19]。EUBED采用公式(10):
| $\mathrm{EUBED}=-\frac{1}{\alpha_{nominal}} \ln \left(\sum\limits_{i=1}^N v_i e^{-\alpha_i \cdot B E D_i}\right)$ | (10) |
式中,αnominal为0.3,vi为体素的权重因子1/N。
6. 统计学处理:采用SPSS 26.0软件包进行分析,3种不同优化方式的放疗计划中,剂量-体积参数及生物学参数不符合正态分布,为了验证其是否存在统计差异,进行了Friedman检验[21-22]。如果同组的假设被拒绝(P < 0.05),使用非参数Wilcoxon秩检验进行分析以比较组间差异。P < 0.05为差异有统计学意义。
结果1. 等剂量线:图 1显示了来自患者队列的1个代表性病例的图像。GO的9 Gy白色等剂量线(高剂量区)比IPSA和HIPO更平滑,特别是在需要高剂量照射的宫颈区。
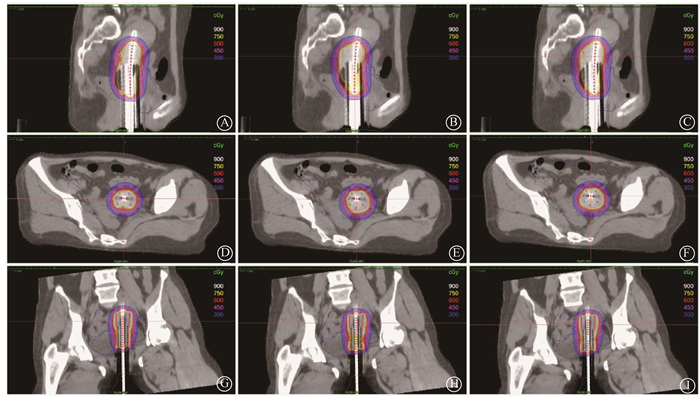
|
注:GO.图形优化;IPSA.模拟退火逆向计划优化算法;HIPO.混合逆向计划优化算法 图 1 同一个患者的GO、IPSA、HIPO在横截面、冠状位、矢状位等剂量线图 A、D、G.GO计划;B、E、H.IPSA计划;C、F、I.HIPO计划 Figure 1 Figure 1 Isodose lines of the transverse plane, the coronal view, and the sagittal view of the same patient under GO-, IPSA-, and HIPO-optimized plans A, D, G. GO; B, E, H. IPSA; C, F, I. HIPO |
2. 计划优化所需时间:3种方式的优化时间是有差异的(χ2=43.8,P < 0.001),其中IPSA(46.53 s)优化的耗时最短,GO(135.03 s)优化耗时最长,HIPO计划优化时间居中(98.36 s)
3. 靶区剂量:3个计划靶区的对比如表 3所示。图2显示了患者队列中HIPO计划的V150%、V200%更高的代表性病例。GO、IPSA、HIPO的D100分别是3.10、3.09、3.20 Gy,差异无统计学意义(P>0.05);HIPO计划中高剂量照射的V150%略高,而高剂量照射的V200%在GO计划中更高。3种计划的HI差异较小,GO的CI较其他计划更好。
|
|
表 3 GO、IPSA、HIPO计划相关物理参数对比[M(Q1, Q3)] Table 3 Comparison of physical parameters in GO-, IPSA-, and HIPO-optimized plans [M (Q1, Q3)] |
4. OARs剂量:在OARs的剂量对比中,HIPO计划中膀胱与直肠的受照射量较低(χ2=11.48~31.02,P≤0.003),具体数值见表 3。3个计划小肠剂量未见明显区别(P>0.05)。
5. 生物学模型结果:3个计划的EUBED对比如表 4所示,HIPO计划中HRCTV的EUBED比GO、IPSA高,具体值见表 4。而且GO、HIPO中膀胱受照射量的EUBED较IPSA低,HIPO计划中直肠的EUBED也是最低的。3个计划小肠的EUBED未见明显区别(P>0.05)。如表 5所示,3个优化计划预测的TCP未见明显区别(P>0.05),在预测膀胱与直肠的NTCP中,HIPO计划比GO、IPSA计划更低。小肠的NTCP未见明显区别(P>0.05)。
|
|
表 4 GO、IPSA、HIPO计划相关EUBED对比[Gy,M(Q1, Q3)] Table 4 Comparison of EUBED in GO-, IPSA-, and HIPO-optimized plans [Gy, M (Q1, Q3)] |
|
|
表 5 GO、IPSA、HIPO计划TCP与NTCP的对比[%,M(Q1, Q3)] Table 5 Comparison of TCP and NTCP in GO-, IPSA-, and HIPO-optimized plans [%, M (Q1, Q3)] |
讨论
已有研究表明,GO、IPSA和HIPO计划从剂量学和靶区覆盖率的角度来看具有可比性[23],这是以剂量学和放射生物学相结合的方式提出GO、IPSA和HIPO计划的分析,其中治疗方案优化的主要目标是在生物学模型帮助下进行剂量-体积参数之间的对比。
当治疗相对较大的靶区时,插植针与驻留点较少时,为了实现足够的靶区覆盖,优化通常会增大驻留时间,从而产生相对较大的热点。因此,无论使用哪种优化算法,治疗计划都会表现出很大的标准偏差,由于参数的偏差很大,得出的体积-剂量参数呈非正态分布,所以进行了非参数检验[21-22],假设数据不是正态分布的。Friedman检验可以进行较大或较小参数的比较,参数之间偏差的大小不会影响结果。且非参数检验之间的对比,主要是比较中位数之间的差异,这样才能得出较为准确的对比结果。
Palmqvist等[24]证明了逆向优化计划优于手动优化计划。Tang等[25]关于GO与IPSA在宫颈癌近距离治疗剂量学的比较中,得出GO与IPSA在靶区剂量覆盖方面没有显著差异。但从本研究中等剂量线的对比中可以看出,GO计划在矢状面、横截面及冠状面上的白色9 Gy等剂量线处较IPSA、HIPO更加平滑,尤其是在需要高剂量照射的肿瘤区域。且GO的CI也是3个优化计划中较高较好的,说明GO是一种直观、有效的、适形度高的优化计划。但因为GO需要在多个层面上进行优化,所以较IPSA、HIPO计划耗时更长,IPSA计划虽然是耗时最短的,但是在等剂量线的对比中,IPSA计划在需要高剂量照射的区域,剂量冷点也较其他计划多。
Trnková等[26]认为HIPO在消除正常组织中的高剂量区域方面具有优势。Fu等[27]认为IPSA和HIPO都可以产生临床上可接受的治疗计划,直肠的D2 cm3与IPSA相比,HIPO略低。Fröhlich等[21]认为在宫颈癌的后装治疗中,IPSA对直肠、小肠的剂量大于HIPO或GO。Matias等[28]得出结论,HIPO计划略好于GO的计划,因此逆向计划可以产生至少与手动图形优化一样好的结果。和上述研究类似,在本研究中显示,3个计划OARs的对比中,HIPO计划在控制膀胱与直肠最大剂量点方面有明显的优势,从各个方面的差异中,可以看出HIPO计划略好于GO以及IPSA计划。
生物学模型在对于宫颈癌IC/ISBT治疗方面还不是很完善,本研究患者的治疗是EBRT与BT结合治疗,这部分模型的参数在实验研究中还未有成熟的数据,且缺少个体化特性。而且肿瘤和正常组织的生物学特性不仅受到外照射和内照射的影响,还受到以下5个生物学因素的影响,这些因素构成了分次放射治疗的基本原则:放射敏感性、修复、再生、再分布和再氧合。本研究的主要目的是比较单个IC/ISBT中不同优化方法在物理剂量和放射生物学方面的差异,研究中EBRT与总治疗中的其他4种BT均统一简化处理。虽然可以通过各种成像技术获得个别患者的解剖信息,然而,很难以简单和非创伤性的方式获得各种组织和器官的生物信息。放射生物模型在目前关于肿瘤和OARs的参数尚不完善,未来期望进一步研究。本研究的统计结果可为临床放射治疗工作者提供参考,但对这些放射生物学因素的影响仍需更深入的研究。
本研究目标是创建临床适用的计划,能够基于临床环境来比较不同的优化方法,而不是为所有患者应用同一个固定类别的解决方案。本研究确实还存在一些局限性,例如放疗计划在很大程度上取决于物理师的经验,但为了克服这一点,选择足够多的病例进行对比分析,减少因物理师主观操作带来的差异。另一个方面是在IPSA与HIPO优化过程中只以表面剂量点为目标,特别是HRCTV的Dmin和OARs的Dmax,没有使用剂量体积限制的参数。以上研究结果表明,HIPO计划在控制膀胱和直肠的最大剂量点方面仍然更好。最后,本研究是基于患者单次治疗,人体生物学信息复杂多样,可能在放射学模型的对比中,没有考虑到的其他生理变化,这还需要进一步研究。
综上所述,在进行宫颈癌IC/ISBT时,正向优化与逆向优化算法从整体上均能满足临床要求,IPSA与HIPO耗时较GO耗时短,GO计划较IPSA、HIPO计划更适形。HIPO计划可以增加靶区生物学覆盖剂量,减小膀胱与直肠的最大物理或生物受照射量,同时也可以减少膀胱与直肠的NTCP,因此逆向计划可以产生与手动优化一样好的结果,甚至在有些方面,HIPO计划更优于手动计划。所有推荐首先使用HIPO作为宫颈癌IC/ISBT的优化算法。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 晏川钧负责论文撰写及收集数据;王先良、温爱萍、罗静月负责技术支持、实验设计;王培负责数据分析;黎杰负责论文审查,指导论文修改
| [1] |
Khumalo PG, Carey M, Mackenzie L, et al. Non-adherence to cervical cancer screening recommendations among women in Eswatini: a cross-sectional study[J]. BMC Public Health, 2023, 23(1): 290. DOI:10.1186/s12889-023-15022-1 |
| [2] |
Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48. DOI:10.3322/caac.21763 |
| [3] |
Solikhah S, Ayu N, Sangruangake MJKI. Perceptions, knowledge, attitudes, and cervical cancer prevention behavior among health and non-health scholar[J]. J Kesmas Indonesia, 2023, 15(1): 75-84. DOI:10.20884/1.ki.2023.15.1.7552 |
| [4] |
National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology. cervical cancer[EB/OL]. [2023-01-06]. https://www.nccn.org/professionals/physician_gls/pdf/cervical.pdf.
|
| [5] |
成慧君, 肖艳, 于晓, 等. 子宫颈癌组织间插植近距离放疗的问题和挑战[J]. 中华妇产科杂志, 2018, 53(9): 644-647. Chen HJ, Xiao Y, Yu X, et al. Problems and challenges of interstitial brachytherapy for cervical cancer[J]. Chin J Obstet Gynecol, 2018, 53(9): 644-647. DOI:10.3760/cma.j.issn.0529-567x.2018.09.014 |
| [6] |
Lahanas M, Baltas D, Zamboglou N. A hybrid evolutionary algorithm for multi-objective anatomy-based dose optimization in high-dose-rate brachytherapy[J]. Phys Med Biol, 2003, 48(3): 399-415. DOI:10.1088/0031-9155/48/3/309 |
| [7] |
Lessard E, Pouliot J. Inverse planning anatomy-based dose optimization for HDR-brachytherapy of the prostate using fast simulated annealing algorithm and dedicated objective function[J]. Med Phys, 2001, 28(5): 773-779. DOI:10.1118/1.1368127 |
| [8] |
Maree SC, Bosman P, van Wieringen N, et al. Automatic bi-objective parameter tuning for inverse planning of high-dose-rate prostate brachytherapy[J]. Phys Med Biol, 2020, 65(7): 075009. DOI:10.1088/1361-6560/ab7362 |
| [9] |
International Commission on Radiation Units and Measurements. ICRU Report 89. Prescribing, recording, and reporting brachytherapy for cancer of the cervix[J]. J ICRU, 2013, 13(1-2): 13-20. DOI:10.1093/jicru/ndw042 |
| [10] |
刘敏, 王先良, 袁珂, 等. 后装施源器Offset值验证研究[J]. 中华放射肿瘤学杂志, 2020, 29(2): 126-130. Liu M, Wang XL, Yuan K, et al. A verification study of offset values of diferent applicators in afterloading brachytherapy[J]. Chin J Radiat Oncol, 2020, 29(2): 126-130. DOI:10.3760/cma.j.issn.1004-4221.2020.02.011 |
| [11] |
Yan G, Kang S, Tang B, et al. Effect of the dwell time deviation constraint on brachytherapy treatment planning for cervical cancer[J]. J Int Med Res, 2021, 49(8): 3000605211037477. DOI:10.1177/03000605211037477 |
| [12] |
Niemierko A. Reporting and analyzing dose distributions: a concept of equivalent uniform dose[J]. Med Phys, 1997, 24(1): 103-110. DOI:10.1118/1.598063 |
| [13] |
Nesvacil N, Tanderup K, Lindegaard JC, et al. Can reduction of uncertainties in cervix cancer brachytherapy potentially improve clinical outcome?[J]. Radiother Oncol, 2016, 120(3): 390-396. DOI:10.1016/j.radonc.2016.06.008 |
| [14] |
Oinam AS, Singh L, Shukla A, et al. Dose volume histogram analysis and comparison of different radiobiological models using in-house developed software[J]. J Med Phys, 2011, 36(4): 220-229. DOI:10.4103/0971-6203.89971 |
| [15] |
Gay HA, Niemierko A. A free program for calculating EUD-based NTCP and TCP in external beam radiotherapy[J]. Phys Med, 2007, 23(3-4): 115-125. DOI:10.1016/j.ejmp.2007.07.001 |
| [16] |
Perez-Calatayud J, Ballester F, Das RK, et al. Dose calculation for photon-emitting brachytherapy sources with average energy higher than 50 keV: report of the AAPM and ESTRO[J]. Med Phys, 2012, 39(5): 2904-2929. DOI:10.1118/1.3703892 |
| [17] |
Chow B, Warkentin B, Menon G. Radiobiological dose calculation parameters for cervix cancer brachytherapy: a systematic review[J]. Brachytherapy, 2019, 18(4): 546-558. DOI:10.1016/j.brachy.2019.02.007 |
| [18] |
Manning MA, Zwicker RD, Arthur DW, et al. Biologic treatment planning for high-dose-rate brachytherapy[J]. Int J Radiat Oncol Biol Phys, 2001, 49(3): 839-845. DOI:10.1016/s0360-3016(00)01453-x |
| [19] |
Jones LC, Hoban PW. Treatment plan comparison using equivalent uniform biologically effective dose (EUBED)[J]. Phys Med Biol, 2000, 45(1): 159-170. DOI:10.1088/0031-9155/45/1/311 |
| [20] |
Barendsen GW. Dose fractionation, dose rate and iso-effect relationships for normal tissue responses[J]. Int J Radiat Oncol Biol Phys, 1982, 8(11): 1981-1997. DOI:10.1016/0360-3016(82)90459-x |
| [21] |
Fröhlich G, Geszti G, Vízkeleti J, et al. Dosimetric comparison of inverse optimisation methods versus forward optimisation in HDR brachytherapy of breast, cervical and prostate cancer[J]. Strahlenther Onkol, 2019, 195(11): 991-1000. DOI:10.1007/s00066-019-01513-x |
| [22] |
Dinkla AM, van der Laarse R, Kaljouw E, et al. A comparison of inverse optimization algorithms for HDR/PDR prostate brachytherapy treatment planning[J]. Brachytherapy, 2015, 14(2): 279-288. DOI:10.1016/j.brachy.2014.09.006 |
| [23] |
Carrara M, Cusumano D, Giandini T, et al. Comparison of different treatment planning optimization methods for vaginal HDR brachytherapy with multichannel applicators: a reduction of the high doses to the vaginal mucosa is possible[J]. Phys Med, 2017, 44: 58-65. DOI:10.1016/j.ejmp.2017.11.007 |
| [24] |
Palmqvist T, Dybdahl Wanderås A, Langeland Marthinsen AB, et al. Dosimetric evaluation of manually and inversely optimized treatment planning for high dose rate brachytherapy of cervical cancer[J]. Acta Oncol, 2014, 53(8): 1012-1018. DOI:10.3109/0284186x.2014.928829 |
| [25] |
Tang B, Liu X, Wang X, et al. Dosimetric comparison of graphical optimization and inverse planning simulated annealing for brachytherapy of cervical cancer[J]. J Contemp Brachytherapy, 2019, 11(4): 379-383. DOI:10.5114/jcb.2019.87145 |
| [26] |
Trnková P, Baltas D, Karabis A, et al. A detailed dosimetric comparison between manual and inverse plans in HDR intracavitary/interstitial cervical cancer brachytherapy[J]. J Contemp Brachyther, 2010, 2(4): 163-170. DOI:10.5114/jcb.2010.19497 |
| [27] |
Fu Q, Xu Y, Zuo J, et al. Comparison of two inverse planning algorithms for cervical cancer brachytherapy[J]. J Appl Clin Med Phys, 2021, 22(3): 157-165. DOI:10.1002/acm2.13195 |
| [28] |
Matias Ldos S, Palmqvist T, Wolke J, et al. Dosimetric and radiobiological evaluation of hybrid inverse planning and optimization for cervical cancer brachytherapy[J]. Anticancer Res, 2015, 35(11): 6091-6096. |
 2023, Vol. 43
2023, Vol. 43


