2. 北京大学第一医院放疗科,北京 100034;
3. 北京大学人民医院放疗科,北京 100044
2. Department of Radiation Oncology, Peking University First Hospital, Beijing 100034, China;
3. Department of Radiation Oncology, Peking University People's Hospital, Beijing 100044, China
临床放射治疗中,X射线只有在进入人体组织一定深度后才能达到最大辐射剂量,称为剂量建成效应[1]。因此,在浅表肿瘤的治疗中,应在皮肤表面放置等效的组织补偿物,以提高浅表肿瘤靶区的剂量[2]。目前常用的补偿物是表面平坦、质地均一的普通组织补偿物[3],但在表面不平坦的浅表肿瘤(头面部、鼻部、四肢等)放疗中,普通组织补偿物无法与不规则体表紧密贴合,产生的空气间隙会影响放疗效果。3D打印组织补偿物具有“个体化”定制的独特优势,可以紧密贴合不规则体表部位,提高浅表靶区的剂量,可能适用于不规则部位浅表肿瘤的放疗[4]。目前已有很多研究将3D打印组织补偿物应用于不规则部位浅表肿瘤的放疗中,但这些研究大多集中在工作流程和不同物理计划的对比,实测表面剂量研究较少[5],需要进一步明确3D打印组织补偿物在提升浅表肿瘤放疗剂量中的优势。因此,本研究构建了裸鼠皮下移植瘤模型,使用3D打印组织补偿物,通过物理计划的对比和测量真实肿瘤的表面剂量,探究3D打印组织补偿物在不规则部位浅表肿瘤调强放疗中的优势,为浅表肿瘤的放疗和临床应用提供理论基础和实验依据。
材料与方法1. 实验动物和细胞培养:SPF级雄性BALB/c裸鼠18只,3~4周龄,体重18~22 g,购于北京斯贝福生物技术有限公司,生产许可证号:SCXK(京)2019-0008。裸鼠饲养于北京大学第一医院实验动物中心屏障环境内,环境温度维持在25℃,相对湿度60%~70%。本研究所有程序和方案均经北京大学第一医院动物福利伦理审查机构和动物伦理委员会批准(伦理编号:J202150)。人前列腺癌PC-3细胞株购于中国协和细胞库,用含10%胎牛血清(以色列BI公司)、1%双抗(100 μg/ml青霉素和100 μg/ml链霉素,北京中科迈晨公司)、89%RPMI 1640基础培养基(美国GIBCO公司)的完全培养基,置于37℃、5% CO2培养箱中培养,倒置显微镜观察细胞生长状态,每1~2天更换培养基,每2~3天加入胰酶消化、传代,取对数生长期的细胞进行后续实验。
2. 裸鼠前列腺癌移植瘤模型的构建及分组:取对数生长期的前列腺癌PC-3细胞,加入完全培养基制成密度为1×108/ml的细胞悬液。每只裸鼠取0.1 ml细胞悬液注入右后腿皮下,构建裸鼠前列腺癌皮下移植瘤模型。接种后观察裸鼠状态,每隔1天观察移植瘤生长情况,并观察裸鼠行为学变化,包括饮食、体重、精神及活动情况,1周后再次观察成瘤状态。待肿瘤的直径达到6~8 mm,采用单纯随机抽样法将裸鼠分为3组:无组织补偿物组、普通组织补偿物组和3D打印组织补偿物组,每组6只。
3. 3D打印组织补偿物的制作:3D打印组织补偿物组的裸鼠用0.5%的戊巴比妥钠(0.1 ml/10 g)麻醉后固定,采用荷兰飞利浦16排大孔径CT模拟定位机扫描裸鼠,扫描层厚为1 mm。扫描区域为裸鼠下腹部至后腿跟部。在Eclipse 13.5治疗计划系统中勾画大体肿瘤区(gross tumor volume,GTV),并根据勾画的CT图像设计每只裸鼠的组织补偿物的形状、厚度。设计稿经确定后,传输给3D打印机系统(MakerBot Replicator2X, 美国Makerbot公司),使用聚乳酸(polylactic acid,PLA)打印出个体化模型。材料评估PLA材料电子密度值均在(1.0~1.1)g/cm3,与水的密度十分接近,适合作为人体的等效组织补偿物。
4. CT定位及靶区勾画:分别扫描无组织补偿物组、普通组织补偿物组和3D打印组织补偿物组的CT图像,裸鼠摆位和扫描区域同3,层厚为3 mm。将普通组织补偿物和3D打印组织补偿物分别置于裸鼠右后腿部位进行固定,与体表轮廓重合后进行扫描得到CT图像,传至MIM软件(北京明维视景公司),由医师分别勾画出两组的GTV和空气间隙,为保证3D打印组织补偿物位置正确,必要时重新固定并扫描图像。
5. 放疗计划设计及实施:采用6 MV X射线,在Eclipse治疗计划系统中使用各项特异性分析算法(anisotropic analytical algorithm,AAA)设计放疗计划,并采集GTV的以下物理参数:Dmean(靶区所受到的平均照射剂量)、Dmax(靶区所受到的最大照射剂量)、D2%(靶区2%体积所受到的最小照射剂量)、D50%(靶区50%体积所受到的最小照射剂量)、D98%(靶区98%体积所受到的最小照射剂量),评价上述剂量学指标和改善程度。处方剂量为单次1 500 cGy,要求100%的处方剂量至少包绕95%的GTV。裸鼠治疗后每3天记录一次肿瘤体积,移植瘤用游标卡尺测量肿瘤最大长径(a)和最大短径(b),按照公式V=ab2/2计算肿瘤体积,并绘制荷瘤鼠肿瘤生长曲线。
6. 皮肤表面剂量的测定:表面剂量测定前需要对直线加速器和金属-氧化物半导体场效应晶体管(metal-oxide-semiconductor field-effect transistor,MOSFET)进行验证。在源皮距SSD=100 cm,照射野大小10 cm×10 cm时,将MOSFET剂量仪探测器探头置于固体水模体内射野中心轴6 MV X射线的最大剂量点(dmax=1.5 cm) 处,加速器输入200 MU,测定探测器探头的校准因子(calibration factor,CF)。验证结束后,将MOSFET剂量监测仪探头固定在皮肤肿瘤中心点上,分别在无组织补偿物、普通组织补偿物及3D打印组织补偿物组3种情况下,测量裸鼠的浅表剂量。
7. 统计学处理:使用GraphPad Prism 9.0统计软件进行分析,符合正态分布的数据以x±s表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA),非正态分布的数据采用非参数检验。P<0.05为差异具有统计学意义。
结果1. 空气间隙的比较:使用3D打印组织补偿物的空气间隙为(0.20±0.07)cm3,普通组织补偿物组的空气间隙为(0.37±0.07)cm3,3D打印组织补偿物组的空气间隙明显小于普通组织补偿物组,差异具有统计学意义(t=4.02,P<0.01)。为了进一步评估空气间隙对治疗效果的影响,本研究计算了两组裸鼠照射后的肿瘤体积增长百分比,结果发现照射后第3天、第6天两组肿瘤体积增长差异无统计学意义(P>0.05)。
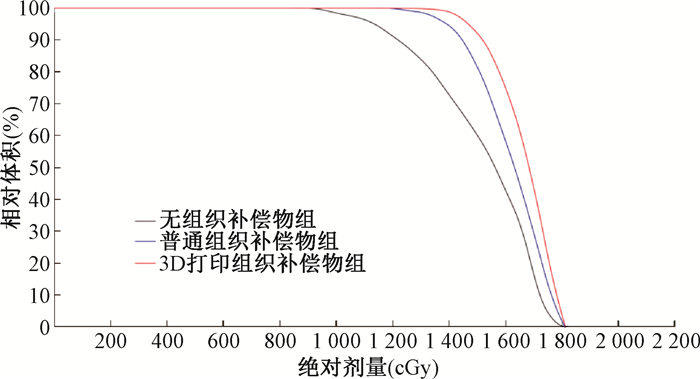
2. 靶区剂量学评价:3组的GTV D95%、D98%列于表 1。由表 1可知,3D打印组织补偿物组的靶区剂量明显优于其他两组(F=9.49、11.17,P < 0.01)。从各组的剂量体积直方图(dose volume histogram, DVH)来看,3D打印组织补偿物较其他两组更能满足临床D95%=1 500 cGy的处方要求,如图 1所示。图 2为3组裸鼠的靶区剂量分布图,相比于其他两组,3D打印组织补偿物可以有效提高靠近皮肤的浅表肿瘤区域的表面剂量,靶区适形度更好。
|
|
表 1 各组裸鼠照射计划的剂量学参数(cGy,x±s) Table 1 Dosimetric parameters of the treatment plan in each group (cGy, x±s) |
|
图 1 不同类型组织补偿物DVH对比图 Figure 1 DVH comparison of different tissue compensators |

|
注:绿色为PTV;红线为1 500 cGy等剂量线 图 2 3组裸鼠断层剂量分布比较 A.无组织补偿物组;B.普通组织补偿物组;C.3D打印组织补偿物组 Figure 2 Comparison of tomographic dose distributions of the nude mice in three groups A. No tissue compensators group; B. Normal tissue compensators group; C. 3D-printed tissue compensators group |
3. 浅表剂量的测量:无组织补偿物、普通组织补偿物、3D打印组织补偿物3组的浅表剂量分别为(626.03±26.75)、(1 259.83±71.94)和(1 435.30±67.22)cGy,与无组织补偿物和普通组织补偿物组相比,3D打印组织补偿物组裸鼠浅表剂量更高(F=263.20,P < 0.001),并且无组织补偿物组的浅表剂量最低。
讨论放射治疗中,由于X射线建成效应的影响,常使得皮肤表面剂量较低[1],因此,临床上治疗浅表病变时,通常使用表面平坦的等效组织补偿物提高浅表靶区剂量[2]。Rong等[6]使用组织补偿物治疗非黑色素瘤皮肤癌。Dahn等[7]探究了乳腺癌切除术后放疗中使用补偿物的不良反应和局部控制率。目前各种计划系统默认的虚拟组织补偿物都是与体表紧密贴合的理想状态,对于一些不规则部位的肿瘤,普通组织补偿物和皮肤之间会存在空气间隙,并不能达到紧密贴合的理想状态[8],这会导致计算剂量与实际剂量之间存在误差,影响剂量分布及计划系统剂量计算的准确性,甚至造成不可逆损伤。本研究使用了3D打印技术,针对肿瘤的形状及不规则的皮肤部位进行个体化定制,实现补偿物和不规则肿瘤部位的紧密贴合,并通过测量浅表剂量,真实地反映了3D打印组织补偿物可以提高不规则部位肿瘤的浅表剂量,为不规则部位浅表肿瘤的放疗提供了参考和依据。
组织补偿物材料形状的选择对于不规则部位的肿瘤放疗非常重要,目前临床上常用的补偿物是与皮肤贴合较差的膜状组织补偿物。张敏等[9]研究证明,在头颈部、会阴区等体表不规则区域,传统组织补偿物的补偿效果不甚满意;Martin等[10]的研究中也发现了这样的问题。随着3D打印技术的发展,3D打印组织补偿物得以使用,可以针对每位患者进行个体化定制,使补偿物贴合不规则部位的浅表肿瘤。Perkins等[11]研究采用了特殊制造的3D打印组织补偿物作为乳腺癌改良根治术后放疗时的组织补偿物,改善了心肺等危及器官的受量。Hsu等[12]发现,使用定制的3D打印组织补偿物可以最大限度地减少产生空气间隙的风险,对头皮恶性肿瘤患者的放射治疗效果良好。本研究也使用了3D打印技术制作组织补偿物,使组织补偿物与不规则部位皮肤紧密贴合,减少空气间隙,从而提高靶区剂量。因此,3D打印的组织补偿物可能是未来临床上治疗不规则部位肿瘤的一种选择。
目前对于补偿物的效果评价主要以物理计划的对比为主[5],例如张敏等[9]的研究通过计算模体剂量学的参数发现3D打印组织补偿物的D95%、D98%、HI等计划参数明显优于普通组织补偿物组。Canters等[13]在非黑色素瘤皮肤癌病例中比较了普通组织补偿物和3D打印组织补偿物之间的剂量覆盖度,发现GTV(V95%)从84%上升至97%(P=0.05),临床肿瘤靶区(V85%)从88%上升至97%(P=0.006),说明3D打印组织补偿物剂量分布的优越性。相比于普通组织补偿物,3D打印组织补偿物减少了空气间隙,从而提高靶区浅表剂量[14]。Robar等[15]在乳房切除术后放疗患者中应用了3D打印组织补偿物,结果发现,使用3D打印组织补偿物的患者体表>5 mm的气隙从30%降到13%(P<0.000 3),最大气隙从(5±3)mm降到(3±3)mm。这些研究发现组织补偿物具有减少空气间隙和提升靶区剂量的效果,但实际浅表剂量尚不明确。因此,本研究利用MOSFET在裸鼠移植瘤模型上测定了不同组别的表面剂量,结果显示,3D打印组织补偿物的皮肤浅表剂量最高,并且趋势和计划系统参数一致,从计划系统的参数、实际测定的剂量学的角度都证实了3D打印组织补偿物相比较于普通组织补偿物能提高不规则区域浅表肿瘤的剂量。除此之外,本研究构建的动物移植瘤模型,实测了动物皮肤的表面剂量数值,从而为临床应用提供参考价值。
本研究也存在一些局限性。虽构建了裸鼠移植瘤模型,但两组裸鼠体积太小,和体表之间的空气间隙差别并不明显,因此很难观察到两组肿瘤治疗效果的生物学差异。并且,裸鼠治疗时的摆位误差也可能影响放疗效果,导致各组放疗时肿瘤体积变化对比没有明显趋势。此外,本研究中的移植瘤面积较小且立体,有可能影响到裸鼠的治疗,3D打印组织补偿物可能对于治疗大面积的浅表皮肤肿瘤效果更好。
因此,在后续的研究中,可以寻找体积较大的实验动物(如比格犬、实验用小型猪等)制作移植瘤模型,并加强质控减少摆位误差,进一步明确3D打印组织补偿物在放疗中的生物学优势,并且,在测量实验动物的剂量时,测量不同位置的浅表剂量和建成区深度剂量。除此之外,目前关于3D打印组织补偿物材料的选择尚未有明确的标准,使用任何材料都有可能发生不良皮肤反应,需要进一步寻找和研究合适的材料,以充分利用3D打印组织补偿物的优势,同时减少急性皮肤反应。
综上所述,本研究构建了动物移植瘤模型,根据CT图像制作个体化的3D打印组织补偿物,通过物理计划的对比和测量真实肿瘤的表面剂量,探究3D打印组织补偿物在不规则部位浅表肿瘤中的剂量学分布的影响,明确3D打印组织补偿物的剂量补偿和实际提升浅表剂量的能力。并且,3D打印组织补偿物对放疗方案可以实现精准的个体化定制,贴合性好,减少了空气间隙,为临床上一些不规则部位浅表肿瘤的放疗提供思路。
利益冲突 无
作者贡献声明 尚士钰负责实验操作、数据处理及论文撰写;吕峰负责实验指导和实验操作;高研、商兆财负责实验操作、物理计划设计和实施;任雪盈、陈佳琰负责数据分析、协助论文修改;高献书、张敏负责课题整体设计,论文撰写指导及修改
| [1] |
Tuğrul T. Absorption ratio of treatment couch and effect on surface and build-up region doses[J]. Rep Pract Oncol Radiother, 2018, 23(1): 1-5. DOI:10.1016/j.rpor.2017.10.004 |
| [2] |
Vyas V, Palmer L, Mudge R, et al. On bolus for megavoltage photon and electron radiation therapy[J]. Med Dosim, 2013, 38(3): 268-273. DOI:10.1016/j.meddos.2013.02.007 |
| [3] |
Ordonez-Sanz C, Bowles S, Hirst A, et al. A single plan solution to chest wall radiotherapy with bolus?[J]. Br J Radiol, 2014, 87(1037): 20140035. DOI:10.1259/bjr.20140035 |
| [4] |
Baek S, Ahn S, Ju E, et al. Customized 3D bolus applied to the oral cavity and supraclavicular area for head and neck cancer[J]. In Vivo, 2021, 35(1): 579-584. DOI:10.21873/invivo.12294 |
| [5] |
Pollmann S, Toussaint A, Flentje M, et al. Dosimetric evaluation of commercially available flat vs. self-produced 3D-conformal silicone boluses for the head and neck region[J]. Front Oncol, 2022, 12: 881439. DOI:10.3389/fonc.2022.881439 |
| [6] |
Rong Y, Zuo L, Shang L, et al. Radiotherapy treatment for nonmelanoma skin cancer[J]. Expert Rev Anticancer Ther, 2015, 15(7): 765-776. DOI:10.1586/14737140.2015.1042865 |
| [7] |
Dahn HM, Boersma LJ, de Ruysscher D, et al. The use of bolus in postmastectomy radiation therapy for breast cancer: a systematic review[J]. Crit Rev Oncol Hematol, 2021, 163: 103391. DOI:10.1016/j.critrevonc.2021.103391 |
| [8] |
Chatchumnan N, Kingkaew S, Aumnate C, et al. Development and dosimetric verification of 3D customized bolus in head and neck radiotherapy[J]. J Radiat Res, 2022, 63(3): 428-434. DOI:10.1093/jrr/rrac013 |
| [9] |
张敏, 赵波, 尹金鹏, 等. 新型3D打印组织补偿物的放疗应用研究[J]. 中华放射肿瘤学杂志, 2017, 26(2): 210-214. Zhang M, Zhao B, Yin JP, et al. Application of new three-dimensional printed tissue compensators in radiotherapy[J]. Chin J Radiat Oncol, 2017, 26(2): 210-214. DOI:10.3760/cma.j.issn.1004-4211.2017.02.018 |
| [10] |
Martin TW, Boss MK, LaRue SM, et al. 3D-printed bolus improves dose distribution for veterinary patients treated with photon beam radiation therapy[J]. Can Vet J, 2020, 61(6): 638-644. |
| [11] |
Perkins GH, McNeese MD, Antolak JA, et al. A custom three-dimensional electron bolus technique for optimization of postmastectomy irradiation[J]. Int J Radiat Oncol Biol Phys, 2001, 51(4): 1142-1151. DOI:10.1016/s0360-3016(01)01744-8 |
| [12] |
Hsu EJ, Parsons D, Chiu T, et al. 3D printed integrated bolus/headrest for radiation therapy for malignancies involving the posterior scalp and neck[J]. 3D Print Med, 2022, 8(1): 22. DOI:10.1186/s41205-022-00152-w |
| [13] |
Canters RA, Lips IM, Wendling M, et al. Clinical implementation of 3D printing in the construction of patient specific bolus for electron beam radiotherapy for non-melanoma skin cancer[J]. Radiother Oncol, 2016, 121(1): 148-153. DOI:10.1016/j.radonc.2016.07.011 |
| [14] |
Baltz GC, Chi PM, Wong PF, et al. Development and validation of a 3D-printed bolus cap for total scalp irradiation[J]. J Appl Clin Med Phys, 2019, 20(3): 89-96. DOI:10.1002/acm2.12552 |
| [15] |
Robar JL, Moran K, Allan J, et al. Intrapatient study comparing 3D printed bolus versus standard vinyl gel sheet bolus for postmastectomy chest wall radiation therapy[J]. Pract Radiat Oncol, 2018, 8(4): 221-229. DOI:10.1016/j.prro.2017.12.008 |
 2023, Vol. 43
2023, Vol. 43


