我国是食管癌高发国家,以鳞状细胞癌为主要病理类型[1]。多数食管癌患者临床初诊已失去手术机会,根治性放化疗成为不可手术或拒绝手术食管癌患者的标准治疗手段[2]。即使放疗技术发展和化疗药物不断更新,食管癌患者的预后仍不能令人满意,病变局部复发仍然是放疗后最主要的失败原因[3-4]。而关于食管癌病变局部复发的位置特点及剂量学研究相对较少。医学图像融合技术如今广泛应用于肿瘤放射治疗领域,为肿瘤诊断、靶区精准勾画等方面提供一定便利及优势[5-6]。本研究回顾性分析行根治性同步放化疗的209例胸段食管鳞癌患者的临床资料和治疗计划参数,应用图像融合技术探讨三维适形调强放疗后食管癌局部复发的分布特点,分析局部复发与各靶区剂量及剂量体积之间的关系,从而为治疗计划的设计评估提供参考依据,进一步实现个体化治疗。
资料与方法1. 病例资料:回顾性选取2016年1月至2019年8月于河北医科大学第四医院放疗科行根治性同步放化疗的食管癌患者。纳入标准:病理学证实的胸段食管鳞癌患者;ECOG评分0~2分;临床随访资料及治疗计划参数完整。排除标准:一般情况较差,无法耐受同期化疗;治疗前已发生远处脏器转移;合并其他恶性肿瘤;不能配合定期复查者。共收集符合入组条件的食管癌患者209例,其中男147例,女62例,中位年龄65岁(40~ 80岁),依据非手术治疗食管癌的临床分期标准草案[7]进行临床分期,Ⅰ期12例,Ⅱ期107例,Ⅲ期90例。
2. 放化疗方法:全组患者均接受美国瓦里安Trilogy、Unique医用直线加速器6 MV X射线三维调强放疗。在治疗计划系统中勾画食管大体肿瘤靶区(GTV)、临床靶区(CTV)及计划靶区(PTV),具体勾画方式见参考文献[8],要求95%PTV处方剂量为50.4~66 Gy,中位剂量60 Gy,根据中位剂量将全组患者分为≥60 Gy的高剂量组115例(62.03±1.47)Gy和<60 Gy的低剂量组94例(56.56±2.01)Gy。同时勾画双肺、心脏、脊髓等危及器官并进行限量:要求双肺V20<28%,Dmean<14 Gy,心脏V30<45%,Dmean<25 Gy,脊髓Dmax<45 Gy。全组患者放疗同期均接受1~2周期全身化疗,化疗方案以氟尿嘧啶联合顺铂(FP方案)及紫杉醇联合顺铂(TP方案)为主,141例患者后续行1~5周期巩固化疗,余68例患者未行巩固化疗。患者均签署知情同意书。
3. 放疗计划物理参数评估:通过治疗计划系统计算各靶区的剂量参数和体积参数。具体观察指标包括:①剂量参数:GTV、CTV、PTV其98%、95%、50%、2%的靶区体积所得到的照射剂量(D98%、D95%、D50%、D2%)。②体积参数:GTV、CTV、PTV分别接受60、50 Gy照射剂量的体积占该靶区体积的百分比(V60、V50)。
4. 随访:所有患者均进行规律门诊复查,其中放疗结束2年内每3个月复查1次,2~5年每半年复查1次,5年后每1年复查1次,复查项目主要包括胸部、上腹部CT和食管钡餐造影。对有吞咽困难症状加重或影像学结果疑似有食管原发肿瘤复发的患者,行电子胃镜检查并进行病理活检予以确诊。所有生存患者每年电话随访2次(医院随访中心完成),随访截至2022年9月30日,失访2例,随访率99%,随访满1、3、5年病例数分别为169、91、30例。总生存(OS)时间定义为从病理诊断至死亡或末次随访时间,无进展生存(PFS)时间从病理诊断至疾病进展或死亡,局部无复发生存(RFS)时间按病理诊断至原瘤床区域内肿瘤出现进展时间或死亡计算,失访患者按末次随访时间计算。
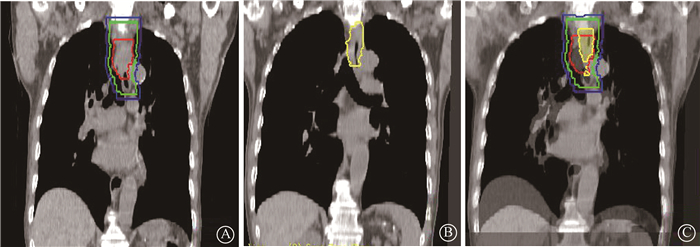
5. 失败模式定义及复发位置确定:局部失败为放疗后食管原发病变未控制或复发,区域失败为区域内淋巴结复发或转移。将食管病变局部失败、区域内淋巴结复发或转移定义为局部区域失败,将区域外淋巴结转移和血行脏器转移定义为远处转移。将食管复发患者胸部薄层CT图像通过图像存储与传输系统(PACS)传输至荷兰飞利浦Pinnacle3治疗计划系统(V9.10),运用Syntegra软件刚性配准算法行单模态图像配准,具体方法为应用最大平方交叉相关法,利用两次CT图像灰度值之间存在的全局线性关系进行图像配准融合,并应用目测检验法进行手动弹性调节。融合后将复发肿瘤中心位置与首次放疗勾画的GTV、CTV、PTV进行比对,确定复发部位与各靶区的重叠程度和分离程度,最终判断食管病变复发所在的靶区范围,见图 1。
|
注:红色. GTV;绿色. CTV;蓝色. PTV;黄色. 复发肿瘤 图 1 食管癌复发患者CT图像融合示意图 A.首次放疗前CT;B.复发CT;C.融合后CT Figure 1 CT image fusion for patients with esophageal carcinoma recurrence A. CT before the first radiotherapy; B. CT of local recurrence; C. CT after image fusion |
6. 统计学处理:应用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以x±s表示,两组间均数比较采用独立样本t检验。计数资料比较采用χ2检验,采用倾向评分匹配法(propensity score matching,PSM)以1∶1比例校正组间差异。生存分析采用Kaplan-Meier法,单因素分析采用Log-rank χ2检验,多因素预后分析采用Cox回归模型。P<0.05为差异有统计学意义。
结果1. 生存分析:全组患者1、3、5年OS率分别为80.9%、42.6%、33.0%,中位OS 27.1个月(95%CI:21.7~32.5),1、3、5年PFS率分别为67.9%、34.0%、27.9%,中位PFS 19.5个月(95%CI:16.7~22.3),1、3、5年RFS率分别为71.3%、39.2%、30.5%,中位RFS 23.7个月(95%CI:19.5~27.9)。
2. 失败模式分析:全组209例患者中,81例(38.8%)出现局部区域失败,64例(30.6%)出现远处转移,其中17例(8.1%)患者为合并局部区域失败和远处转移。81例局部区域失败患者中,68例(84.0%)为单纯食管复发,12例(14.8%)为单纯区域淋巴结复发,1例(1.2%)患者为食管合并区域淋巴结复发。64例远处转移患者中,43例(67.2%)为单纯血行脏器转移,11例(17.2%)为单纯区域外淋巴结转移,10例(15.6%)患者合并血行脏器转移及区域外淋巴结转移。
3. 预后因素分析:单因素分析结果显示病变部位、肿瘤体积、T分期、N分期、TNM分期、放疗剂量与OS、PFS、RFS显著相关(χ2=8.06~18.89,P<0.05),见表 1。分别以OS、PFS及RFS为因变量,以单因素分析有统计学意义的因素为自变量,进一步行多因素Cox模型分析,结果显示T分期、N分期、放疗剂量为患者OS、PFS及RFS的独立影响因素(HR=1.42~1.87,P<0.05),见表 2。
|
|
表 1 食管癌患者OS、PFS和局部RFS单因素分析 Table 1 Univariate analysis of OS, PFS, and local RFS for patients with esophageal carcinoma |
|
|
表 2 食管癌患者OS、PFS和RFS多因素分析 Table 2 Multivariate analysis of OS, PFS, and RFS for patients with esophageal carcinoma |
4. 食管局部复发的分布特点:经过CT图像配准融合,发现68例食管复发患者中62例(91.2%)复发位于原放疗靶区的GTV内,4例(5.8%)位于CTV内,1例(1.5%)位于PTV内,1例(1.5%)位于PTV外。
5. 食管局部复发的剂量学分析:将68例单纯食管复发患者临床资料与128例无局部区域复发患者进行比较,两组患者在T分期(χ2=6.13,P=0.047)、放疗剂量(χ2=4.32,P=0.038)、是否巩固化疗(χ2=5.79,P=0.016)等因素存在不均衡性,故采用倾向评分匹配法(PSM),以相关不均衡变量为协变量,设置卡钳值为0.1,匹配后两组各62例患者临床资料具有可比性。调阅两组患者首次放疗计划的剂量、体积等物理参数,可见食管复发组患者的剂量参数(GTV、CTV)D95%以及(GTV、CTV、PTV)D50%均明显低于靶区内无复发组,差异均有统计学意义(t=1.90、1.95、1.98、2.01、1.96,P<0.05),见表 3。食管复发组的体积参数(GTV、CTV、PTV)V60均显著低于局部无复发组,差异有统计学意义(t=1.95、2.03、2.15,P<0.05),并发现食管复发组各靶体积(GTV、CTV、PTV)的V60均 < 95%,见表 4。进一步根据靶区内无复发生存的影响因素及PSM前的不均衡临床因素进行剂量、体积参数的分层分析,发现T3+4时,复发组(GTV、CTV、PTV)V60均 < 95%,且显著低于局部无复发组,差异有统计学意义(t=2.15、2.22、2.87,P<0.05),而T1+2患者中,两组体积参数未见明显差异(P>0.05),见表 5。
|
|
表 3 两组食管癌患者剂量参数比较(Gy,x±s) Table 3 Comparison of dose parameters between the recurrence group and the recurrence-free group of esophageal carcinoma(Gy, x±s) |
|
|
表 4 两组食管癌患者体积参数比较(%,x±s) Table 4 Comparison of recurrence volume parameters between the recurrence group and the recurrence-free group of esophageal carcinoma(%, x±s) |
|
|
表 5 两组食管癌患者体积参数比较的分层分析(%,x±s) Table 5 Stratified analysis for the comparison of recurrence volume parameters between the recurrence group and the recurrence-free group of esophageal carcinoma(%, x±s) |
讨论
食管癌根治性放化疗后病变局部复发为非手术治疗后的主要失败模式,近些年为降低食管癌放疗后的局部复发进行了大量临床及基础研究,如放疗处方剂量的改变[9-10]、后程加速超分割放疗[11]及选择性淋巴引流区预防照射[12-13]等,但食管癌患者的长期生存和局部控制结果仍不令人满意。医学信息及影像技术的不断发展为探讨食管复发部位的分布特点提供了极大的便利。本研究从临床实际出发,应用图像融合技术精准比对观察68例放疗后局部复发的食管癌患者,发现其中62例(91.2%)复发位于GTV内,表明食管癌放疗后病变局部复发仍然是以照射野内复发占绝大多数,这与既往报道结果一致。如Kim等[15]报道136例食管鳞癌患者在根治性放化疗后,74例患者出现局部区域失败,其中61例(82.4%)复发位于照射野内。沈文斌等[16]对374例接受根治性放化疗的食管鳞癌患者的研究发现,187例患者出现局部区域失败,其中143例(76.5%)失败部位在GTV内,与本研究结果一致。
目前,三维适形调强放疗技术已广泛应用于临床中,能够实现肿瘤靶区和正常组织的三维精确勾画,靶区剂量的优化等方面较传统二维放疗有更大优势。但调强放疗中剂量分布较传统二维放疗更不均匀,因此,选择参考点剂量很难代表靶区整体受照射的剂量情况。国际辐射单位与测量委员会(ICRU)83号报告[17]指出:在相对均匀的受照射体积中,D50%对所要求的靶区处方剂量具有很好的代表性,与D2%、D98%相比,D50%更具有稳定性和可比性,是将传统二维放疗与三维适形调强放疗进行联系的纽带,因此建议将该值纳入剂量报告内容中。多项研究表明,D50%所代表整体靶区平均受量与ICRU参考点的剂量相对应[18-20]。本研究利用三维适形放疗计划系统的优势,对不同靶体积照射后接受的剂量-体积参数进行分析,发现复发组各靶体积的剂量参数D50%,特别是PTV-D50%均明显低于局部无复发组,这提示在评价放疗计划时,应特别对各靶体积的D50%的受量情况予以重视并记录。另外,本研究结果显示,局部复发组特别是T3+4患者各靶体积接受处方剂量60 Gy照射的体积百分比(V60)均显著低于局部无复发组,且复发组各靶体积的V60均 < 95%,这说明食管癌的放疗后局部复发可能是因为肿瘤病变范围较大,导致靶区存在低剂量区或漏照,因而未达到控制病变的处方剂量。也说明ICRU系列报告中要求95%PTV体积接受所给予的处方剂量,是确保肿瘤局部控制的必要条件。当然,本研究剂量学研究仅比较两组患者各靶体积间受量情况,未对复发部位的受量情况予以计算、比较,后续将利用CT图像融合的技术优势对复发部位进行更加精准、深入的剂量学研究。
对于食管癌根治性放疗最佳剂量,仍然是一个争论的话题。目前美国国立综合癌症网络(NCCN)指南推荐,食管癌同步放化疗标准放疗剂量为50.0~50.4 Gy[21]。然而,约50%的食管癌患者接受标准剂量放疗后仍出现局部失败。在精准放疗时代,一些研究已经探讨了食管癌放疗剂量增加的潜在生存获益可能。Zhu等[22]回顾性分析112例接受调强放疗联合奈达铂为基础的同期化疗的食管鳞癌患者,结果显示高剂量组(60 Gy)OS显著优于低剂量组(50.4 Gy),中位OS期分别为25.5及17.5个月(P=0.021)。但You等[23]的一项Ⅲ期多中心随机对照研究最终纳入144例胸段食管鳞癌,同期行紫杉醇联合卡铂周方案化疗,分为59.4 Gy的高剂量组71例和50.4 Gy的标准剂量组73例,两组3年OS率分别为43.5%和38.1%(P=0.54),3年PFS率分别为36.7%和32.2%(P=0.28)。本研究基于同步放化疗的治疗背景,显示放疗剂量是OS及RFS的独立影响因素,这些结果的不同可能与入组患者临床期别、化疗方案、放疗靶区勾画、放疗技术及放疗不良反应的评估与处理的差异有关,后续仍需更大样本量的前瞻性研究对放疗剂量与生存的关系进行探讨。
本研究存在一定的局限性:①尽管采用CT图像融合技术,但时间、患者体位的不同以及器官运动等因素均可能影响融合的准确性,今后需要应用PET/CT等先进影像技术并优化图像配准融合软件对复发肿瘤位置及相关剂量参数进行更为准确的判断和分析。②作为回顾性研究,原发灶影像分型、病理分化程度等临床病理资料不可避免的出现缺失,且混杂因素较多,即使经过倾向性评分匹配,仍可能存在一定的病例选择偏倚。③回顾性研究的固有缺陷导致确定患者PFS、RFS时间的准确性受一定的影响。④本研究重点关注放疗各靶体积的受量情况,缺少对正常组织器官受量情况进行比较分析,这可能对提高靶区剂量改善生存的结果产生干扰。
综上所述,本研究认为病变局部复发仍然是食管癌根治性放化疗后最主要的失败原因,且多发生在GTV内。提高放疗剂量存在一定的生存获益,放疗计划各靶体积D50%的受量情况可能与局部复发有关,今后需要开展多中心前瞻性研究利用图像融合技术对食管癌患者剂量学做进一步深入研究。
利益冲突 所有人研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 闫可负责选题和文章撰写;张雪原、杜星语负责统计分析;李曙光、邓文钊负责随访;王晓斌、苏景伟负责收集整理病历资料;沈文斌、祝淑钗负责论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Li C, Tan L, Liu X, et al. Concurrent chemoradiotherapy versus radiotherapy alone for patients with locally advanced esophageal squamous cell carcinoma in the era of intensity modulated radiotherapy: a propensity score-matched analysis[J]. Thorac Cancer, 2021, 12(12): 1831-1840. DOI:10.1111/1759-7714.13971 |
| [3] |
Lin CY, Lien MY, Chen CC, et al. Consolidative chemotherapy after definitive concurrent chemoradiotherapy for esophageal squamous cell carcinoma patients: a population based cohort study[J]. BMC Gastroenterol, 2022, 22(1): 381. DOI:10.1186/s12876-022-02464-x |
| [4] |
Chen C, Chen J, Luo T, et al. Late toxicities, failure patterns, local tumor control, and survival of esophageal squamous cell carcinoma patients after chemoradiotherapy with a simultaneous integrated boost: a 5-year phase Ⅱ study[J]. Front Oncol, 2021, 11: 738936. DOI:10.3389/fonc.2021.738936 |
| [5] |
Hu LH, Zhang WB, Yu Y, et al. Accuracy of multimodal image fusion for oral and maxillofacial tumors: a revised evaluation method and its application[J]. J Craniomaxillofac Surg, 2020, 48(8): 741-750. DOI:10.1016/j.jcms.2020.05.009 |
| [6] |
Zhou QP, Zhao YH, Gao L. Positron emission tomography and magnetic resonance imaging combined with computed tomography in tumor volume delineation: a case report[J]. World J Clin Cases, 2022, 10(1): 249-253. DOI:10.12998/wjcc.v10.i1.249 |
| [7] |
中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准草案[J]. 中华放射肿瘤学杂志, 2010, 19(3): 179-180. Chinese Expert Group on Clinical Staging of Non-Surgical Treatment of Esophageal Cancer. Draft standard for clinical staging of non-surgical treatment of esophageal cancer[J]. Chin J Radiat Oncol, 2010, 19(3): 179-180. DOI:10.3760/cma.j.issn.1004-4221.2010.03.001 |
| [8] |
闫可, 魏菀怡, 杨洁, 等. 系统免疫炎症指数联合临床分期对食管癌患者预后的预测价值[J]. 中华放射医学与防护杂志, 2022, 42(1): 25-31. Yan K, Wei WY, Yang J, et al. Predictive value of systemic immune-inflammation index combined with clinical staging for prognosis of esophageal cancer patients[J]. Chin J Radiol Med Prot, 2022, 42(1): 25-31. DOI:10.3760/cma.j.cn112271-20210823-00340 |
| [9] |
Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123 (Radiation Therapy Oncology Group 94-05) phase Ⅲ trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy[J]. J Clin Oncol, 2002, 20(5): 1167-1174. DOI:10.1200/JCO.2002.20.5.1167 |
| [10] |
Hulshof M, Geijsen ED, Rozema T, et al. Randomized study on dose escalation in definitive chemoradiation for patients with locally advanced esophageal cancer (ARTDECO Study)[J]. J Clin Oncol, 2021, 39(25): 2816-2824. DOI:10.1200/JCO.20.03697 |
| [11] |
Wang JH, Lu XJ, Zhou J, et al. A randomized controlled trial of conventional fraction and late course accelerated hyperfraction three-dimensional conformal radiotherapy for esophageal cancer[J]. Cell Biochem Biophys, 2012, 62(1): 107-112. DOI:10.1007/s12013-011-9267-4 |
| [12] |
祝淑钗, 李巧芳, 张雪原, 等. 食管癌根治性调强放疗靶区范围对患者预后的影响[J]. 中华肿瘤杂志, 2020, 42(12): 1040-1047. Zhu SC, Li QF, Zhang XY, et al. Clinical outcomes of different irradiation ranges in definitive intensity-modulated radiotherapy for esophageal cancer[J]. Chin J Oncol, 2020, 42(12): 1040-1047. DOI:10.3760/cma.j.cn112152-20191225-00842 |
| [13] |
Lyu J, Yisikandaer A, Li T, et al. Comparison between the effects of elective nodal irradiation and involved-field irradiation on long-term survival in thoracic esophageal squamous cell carcinoma patients: a prospective, multicenter, randomized, controlled study in China[J]. Cancer Med, 2020, 9(20): 7460-7468. DOI:10.1002/cam4.3409 |
| [14] |
Zhang J, Chen Y, Chen Y, et al. A noninvasive body setup method for radiotherapy by using a multimodal image fusion technique[J]. Technol Cancer Res Treat, 2017, 16(6): 1187-1193. DOI:10.1177/1533034617740302 |
| [15] |
Kim HW, Kim JH, Lee IJ, et al. Local control may be the key in improving treatment outcomes of esophageal squamous cell carcinoma undergoing concurrent chemoradiation[J]. Digestion, 2014, 90(4): 254-260. DOI:10.1159/000368983 |
| [16] |
沈文斌, 高红梅, 许金蕊, 等. 肿瘤局部相关因素对N0期食管癌IMRT预后影响[J]. 中华放射肿瘤学杂志, 2020, 29(2): 96-101. Shen WB, Gao HM, Xu JR, et al. Effect of locoregional risk factors on long-term prognosis of patients with N0 stage esophageal cancer receiving intensity-modulated radiotherapy[J]. Chin J Radiat Oncol, 2020, 29(2): 96-101. DOI:10.3760/cma.j.issn.1004-4221.2020.02.004 |
| [17] |
International Commission on Radiation Units and Measurements. ICRU Report 83. Pre-scribing, recording, and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. J ICRU, 2010, 10(1): 106. |
| [18] |
Das IJ, Andersen A, Chen ZJ, et al. State of dose prescription and compliance to international standard (ICRU-83) in intensity modulated radiation therapy among academic institutions[J]. Pract Radiat Oncol, 2017, 7(2): e145-e155. DOI:10.1016/j.prro.2016.11.003 |
| [19] |
Burnet NG, Noble DJ, Paul A, et al. Target volume concepts in radiotherapy and their implications for imaging[J]. Radiologe, 2018, 58(8): 708-721. DOI:10.1007/s00117-018-0420-6 |
| [20] |
Mohan A, Forde E. Adherence to ICRU-83 reporting recommendations is inadequate in prostate dosimetry studies[J]. Pract Radiat Oncol, 2018, 8(3): e133-e138. DOI:10.1016/j.prro.2017.08.006 |
| [21] |
Ajani JA, D'Amico TA, Bentrem DJ, et al. Esophageal and esophagogastric junction cancers, Version 2.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(7): 855-883. DOI:10.6004/jnccn.2019.0033 |
| [22] |
Zhu H, Lu X, Jiang J, et al. Radiotherapy combined with concurrent nedaplatin-based chemotherapy for stage Ⅱ-Ⅲ esophageal squamous cell carcinoma[J]. Dose Response, 2022, 20(1): 15593258221076720. DOI:10.1177/15593258221076720 |
| [23] |
You J, Zhu S, Li J, et al. High-dose versus standard-dose intensity-modulated radiotherapy with concurrent paclitaxel plus carboplatin for patients with thoracic esophageal squamous cell carcinoma: a randomized, multicenter, open-label, phase 3 superiority trial[J]. Int J Radiat Oncol Biol Phys, 2023, 115(5): 1129-1137. DOI:10.1016/j.ijrobp.2022.11.006 |
 2023, Vol. 43
2023, Vol. 43


