2. 解放军总医院第五医学中心放疗科, 北京 100071
2. Department of Radiation Oncology, Fifth Medical Center of Chinese PLA General Hospital, Beijing 100071, China
容积旋转调强放射治疗(VMAT)在治疗过程中通过实时调整机架的转速、角度、多叶光栅的位置、剂量率等参数,实现高度适形的剂量分布和高梯度的剂量跌落,更好地保护危及器官[1-2]。但是越是复杂的治疗技术越需要全面的质量保证。美国医学物理学家协会(AAPM)建议在每例患者初次治疗前都应对治疗计划进行剂量验证[3]。因此,高效的质量保证与日益增多的治疗计划保持同步至关重要。传统的剂量验证方法如电离室、胶片、电子射野影像系统(EPID)、矩阵等都有其自身的局限性[4-6],并对高剂量梯度剂量变化不敏感。二维矩阵剂量验证只提供了平面通量的剂量分布和二维γ通过率的结果,二维γ通过率与危及器官的剂量差异缺乏相关性[7]。Compass三维剂量系统(IBA Dosimetry,比利时)是一种基于患者三维解剖结构图像进行体内剂量重建的计划验证系统,能直观的观察三维剂量分布和剂量体积直方图(DVH)数据。Compass三维剂量验证系统既可以实现基于模型的剂量重建以实现对治疗计划的独立核算功能,又能实现基于测量的重建以探测数据传输以及治疗过程中可能发生的错误,即加速器叶片运行、机架和准直器角度等可能发生的偏差。本研究对基于模型和基于测量的剂量验证相结合进行了研究,通过3%/3 mm标准γ通过率观察50%靶区处方剂区的平均γ值的结果[8],探讨Compass验证系统中50%靶区处方剂区的平均γ值在治疗前剂量验证中的应用价值,为评价三维剂量验证中代表计划通过可执行参数指标的选择提供参考。
资料与方法1. 临床资料:选取在首都医科大学石景山教学医院北京市石景山医院放疗科于2020年9月至2022年10月收治的放疗患者70例,其中头部14例、头颈部8例、胸部8例、盆腔部17例,腹部23例,年龄:31~90岁,中位年龄为66岁。
2. 加速器和治疗计划系统(TPS):高端四维双模影像引导直线加速器(Infinity,瑞典医科达),配备常规均整6和10 MV两档X射线和非均整6 MV FFF高剂量率能量模块,最大剂量率为1 400 MU/min;可以进行四维锥形束CT扫描,进行分次内和分次间影像引导;160对多叶光栅,最小叶片间距为0.5 cm,X射线设野尺寸从0.5 cm × 0.5 cm到40 cm × 40 cm连续可调,等中心处叶片最大移动速度为6.5 cm/s,钨门跟随最大移动速度为9 cm/s。Monaco5.11 TPS(瑞典医科达)为每例患者制定VMAT计划,选用能量为6 MV均整X射线,采用蒙特卡罗(MC)算法,计算网格为0.3 mm,最小叶片间距为0.5 cm,最大子野数量150,蒙卡算法每个单元统计不确定度为0.5%,配套MOSAIQ网络系统,治疗计划通过该系统从TPS上传输到加速器执行。
3. 主要验证仪器和设备:Compass三维质量保证系统(比利时IBA公司)是一种基于患者三维解剖结构图像进行体内剂量重建的计划验证系统,该系统分为软件计算系统和测量系统[9]:测量系统包括Matrixx Evolution二维矩阵(IBA Dosimetry,比利时)、角度传感器、固体水、加速器机头专用托架等。Matrixx Evolution二维矩阵是由1 020个电离室探测器组成的矩阵阵列,每个电离室中心之间的距离为7.6 mm,矩阵探测面积为24 cm × 24 cm。软件计算系统包括3个模块:Beam Commission、Detector Setup和Patient 3D Dosimetry。Beam Commission模块中将三维水箱采集的加速器数据导入该系统,模拟加速器机头的剂量学参数,用于构建Compass独立计算的数据模型;Detector Commissioning模块用于对Matrixx Evolution二维矩阵、角度传感器进行标定和校正,并进行三维剂量验证的数据采集的线上操作;Patient 3D Dosimetry用于数据计算和分析。
4. 验证步骤:①在TPS中将每例患者的计划信息包括RT dose、RT structure、RT plan和CT图像以DICOM的格式保存到桌面该患者专属文件夹里,然后将该数据包导入到Compass系统中。②在Patient 3D Dosimetry模块中,利用卷积/超分割算法(CCC)重新计算基于模型独立核算剂量分布(CCD),对该患者计划进行二次核算验证。③通过专用托架将二维矩阵固定在加速器机头上,矩阵上加2 cm固体水作为剂量建成并固定;连接角度传感器并转机架一圈以排除角度传感器连接线是否有刮蹭的可能,接通电源连接软件,对矩阵电离室进行预照射、测冷本底、测热本底、几何位置校准、绝对剂量校准、角度修正等;加速器以QA模式执行计划进行测量。测量数据以din格式保存,导入Patient 3D Dosimetry模块中,重建三维实测剂量分布(CRD)。
5. 平均γ值定义及评估标准:平均γ值:感兴趣区域γ分布中的平均值;评估标准:Golbal全局归一3 mm/3%标准,γ≤0.4为计划验证通过、0.4<γ≤0.6为参考评估临床可用计划、γ>0.6为验证失败临床不可用,建议查找失败原因重新计划设计。
6. 统计学处理:采用SPSS 26.0软件对数据进行统计学分析。计量资料数据符合正态分布以x±s来表示。采用配对样本t检验对基于模型独立核算剂量和基于测量重建剂量进行统计学分析。P<0.05为差异有统计学意义。
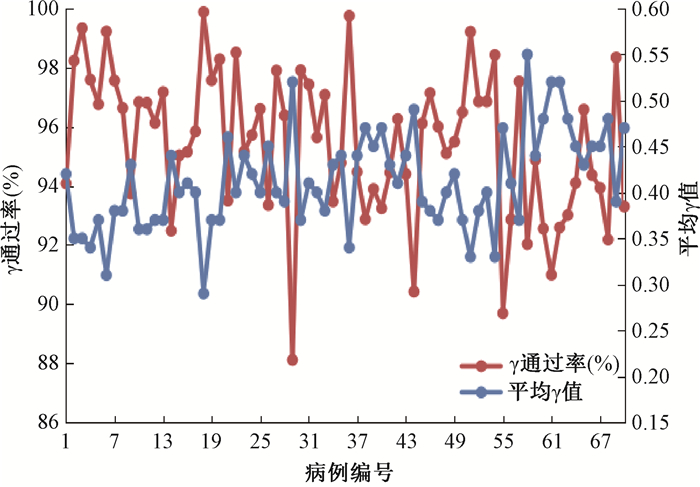
结果1. 基于模型独立核算与基于实测重建剂量验证结果:基于模型独立核算剂量与TPS计算剂量两者具有较好的一致性,平均γ值均<0.6,其中γ≤0.4的67例,0.4<γ≤0.6的3例,γ通过率均>92%,随着平均γ值的增大通过率有降低的趋势,二者呈负相关关系,详见图 1。基于测量重建体内三维剂量的平均γ值均<0.6,其中γ≤0.4的35例,0.4<γ≤0.6的35例,γ通过率均>88%,其中68例通过率>90%,2例<90%,随着平均γ值的增大通过率有降低的趋势,且均符合临床剂量验证要求(图 2)。

|
图 1 基于模型独立核算剂量与TPS计算50%处方剂量形成区域的平均γ值和γ通过率 Figure 1 The mean GI and gamma passing rate in target area receiving 50% of prescribed dose using model-based independent dose calculation and TPS calculation |
|
图 2 基于实测重建剂量与TPS计算的50%处方剂量形成区域的平均γ值和γ通过率 Figure 2 Mean GI and gamma passing rate in target area receiving 50% of prescried dose using measurement-based reconstruction dose and TPS-calculated dose |
2. 基于模型独立核算剂量验证和基于实测重建剂量验证结果差异分析:基于模型的独立核算剂量验证(CCD-TPS)处方剂量50%区域的平均γ值为0.31±0.04,γ通过率为(98.56±1.23)%;基于实测重建剂量验证(CRD-TPS)处方剂量50%区域的平均γ值为0.41±0.05,γ通过率为(95.46±2.47)%;CCD-TPS的结果优于CRD-TPS的结果,两者差异有统计学意义(t=15.20、10.71,P < 0.05)。
讨论基于VMAT技术的复杂性和治疗过程中很多不确定因素的影响,治疗计划的剂量是否能准确高效地实施与疗效直接相关,因此治疗前的剂量验证起到至关重要的作用。与传统的二维验证相比,三维验证最能反映计划执行的真实情况,具有明显的优势[10-11]。
Compass剂量验证系统不仅拥有基于模型的独立核算功能,还可以通过二维矩阵采集患者治疗计划的照射野通量,然后在其CT影像上重建出三维剂量分布,反映患者真实受照情况,不仅可以提供更加丰富的三维剂量分布信息,还能呈现剂量偏差和差异的空间位置信息,能直观的判断该计划的验证结果。张秀春等[12]以三维水箱为基准,比较分析Compass系统在百分深度剂量(PDD)、输出因子(OUF)、离轴比曲线(Profile)和绝对剂量等方面的测量数据与三维水箱所测数据的相关性和一致性,并在均匀模体和非均匀模体中验证了放疗计划,检测Compass软件的剂量计算精度和剂量重建精度,并且通过BallBearing模体测试了Compass硬件对加速器等中心的影响,结果显示Compass数据模型可靠,独立计算功能和重建剂量功能与TPS具有类似精度,硬件对等中心影响可忽略不计。邢晓汾等[13]以胶片和电离室为基准,对Compass系统计算点剂量和平面剂量分布进行的测试,结果显示具有较好的一致性,可满足调强计划验证的要求。宋孟孟[14]比较了Compass系统与EBT3胶片在验证计划的同一层面的γ通过率,结果显示,Compass系统在中心层面的冠状位层面的结果可以真实地反映TPS计划设计与执行的一致性。这些报告都证实了Compass系统验证的可信度和准确性。近年来,基于Compass剂量验证系统的相关报主要包括了鼻咽癌、食管癌、肺癌、直肠癌、宫颈癌等病种[15-26],大部分文献数据集中体现在靶区和危及器官的剂量偏差方面,以及引起基于模型独立核算计划和基于测量重建剂量结果的偏差分析方面,鲜有对处方剂量的50%形成区域的平均γ值和γ通过率方面的报道。魏鹏等[21]的研究显示Compass独立计算剂量和基于测量的重建剂量分布之间的γ通过率均>99%,且靶区剂量阈值的50%形成区域的平均γ值均 < 0.4;Visser等[8]的研究中,采用3%/3 mm的DTA标准,在均匀介质、非均匀介质中的验证结果证实了Compass计算和蒙卡计算的高度一致性,并做了300多例IMRT计划的剂量验证,提出了平均γ值≤0.4为通过、>0.4且≤0.6为临床评估可接受计划、>0.6为不通过的结论。本研究中,将靶区处方剂量的50%剂量线包围的区域作为一个器官,此器官基本包括了靶区和其周围重要的危及器官,计划的平均剂量保持在比较高的水平,计算此区域内的平均γ值和γ通过率,结果显示,基于模型独立核算和TPS计算结果具有较好的一致性,平均γ值均<0.6,其中γ≤0.4的67例,0.4<γ≤0.6的3例,γ通过率均>90%,在92.58%~99.91%之间;基于测量重建体内三维剂量的平均γ值略差于基于模型的计划结果,但γ值均<0.6,其中γ≤0.4的35例,0.4<γ≤0.6的35例,γ通过率均>88%,在88.11%~99.88%之间, 其中68例通过率>90%,2例<90%,且随着平均γ值的增大通过率有降低的趋势,平均γ值与通过率之间呈负相关关系。目前尚没有三维剂量验证靶区和危及器官通过率的判定标准,AAPM TG119号报告指出:每个野的通过率>90%或者多个野复合通过率>88%为临床可用计划[3]。
本研究结果显示,基于模型的独立核算剂量分布结果优于基于测量重建剂量的结果。主要是由于与纯计算相比,在实测中引入了加速器机械精度因素如:叶片的到位精度、机架角度、剂量准确度等。临床上要做好周期性质控工作,保证加速器的稳定性,降低系统误差。
本研究根据50%处方剂量形成区域的平均γ值展开,基于Stock等[27]工作的γ评估和科室的临床经验,平均γ值最能代表真实的三维剂量分布,但此项指标对于IMRT治疗计划的三维剂量验证的适用性还没有被彻底研究,有研究表明γ评估在分辨率方面有其局限性和临床相关性的预测能力[7, 28]。因此,本研究结合了三维γ通过率的结果对剂量验证的结果进行综合评估;另外,50%处方剂量生成区域的γ值指标在应用过程中的不足之处在于此值只分析了50%以上的剂量区域,对于50%以下的剂量区域并未考虑,而有的危及器官需要评估低剂量区,如头部的晶状体、肺的V5、乳腺癌的健侧乳腺及盆腔的睾丸、卵巢等,该指标无法体现,后续还需进一步研究其适应范围。
综上所述,在Compass三维剂量验证中,将重建剂量与独立核算剂量结合使用是一种更可靠的方法,处方剂量的50%形成的区域内的平均γ值和通过率可以作为评价计划是临床可用的一项指标。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 郑倩倩、陈文彰负责提出研究思路及论文撰写;曹婧设计研究方案及收集临床数据;曲荣荣负责方案实施;高文超参与论文讨论及修改
| [1] |
Alvarez-Moret J, Pohl F, Koelbl O, et al. Evaluation of volumetric modulated arc therapy (VMAT) with Oncentra MasterPlan Ⓡ for the treatment of head and neck cancer[J]. Radiat Oncol, 2010, 5: 110. DOI:10.1186/1748-717X-5-110 |
| [2] |
Rao M, Yang W, Chen F, et al. Comparison of Elekta VMAT with helical tomotherapy and fixed field IMRT: plan quality, delivery efficiency and accuracy[J]. Med Phys, 2010, 37(3): 1350-1359. DOI:10.1118/1.3326965 |
| [3] |
Ezzell GA, Burmeister JW, Dogan N, et al. IMRT commissioning: multiple institution planning and dosimetry comparisons, a report from AAPM Task Group 119[J]. Med Phys, 2009, 36(11): 5359-5373. |
| [4] |
Poppe B, Blechschmidt A, Djouguela A, et al. Two-dimensional ionization chamber arrays for IMRT plan verification[J]. Med Phys, 2006, 33(4): 1005-1015. DOI:10.1118/1.2179167 |
| [5] |
Bucciolini M, Buonamici FB, Casati M. Verification of IMRT fields by film dosimetry[J]. Med Phys, 2004, 31(1): 161-168. DOI:10.1118/1.1631093 |
| [6] |
郑倩倩, 杨涛, 王小深, 等. 基于电子射野影像系统与加速器日志文件重建模体内剂量的初步比较[J]. 中华放射医学与防护杂志, 2017, 37(4): 298-301. Zheng QQ, Yang T, Wang XS, et al. The preliminary comparison of the reconstructed doses with electronic portal imaging device (EPID) and dynalogs files for in vivo phantom dosimetry[J]. Chin J Radiol Med Prot, 2017, 37(4): 298-301. DOI:10.3760/cma.j.issn.0254-5098.2017.04.008 |
| [7] |
Nelms BE, Zhen H, Tomé WA. Per-beam, planar IMRT QA passing rates do not predict clinically relevant patient dose errors[J]. Med Phys, 2011, 38(2): 1037-1044. DOI:10.1118/1.3544657 |
| [8] |
Visser R, Wauben DJ, de Groot M, et al. Efficient and reliable 3D dose quality assurance for IMRT by combining independent dose calculations with measurements[J]. Med Phys, 2013, 40(2): 021710. DOI:10.1118/1.4774048 |
| [9] |
Nakaguchi Y, Ono T, Onitsuka R, et al. Comparison of 3-dimensional dose reconstruction system between fluence-based system and dose measurement-guided system[J]. Med Dosim, 2016, 41(3): 205-211. DOI:10.1016/j.meddos.2016.03.001 |
| [10] |
Tyagi N, Yang K, Yan D. Comparing measurement-derived (3DVH) and machine log file-derived dose reconstruction methods for VMAT QA in patient geometries[J]. J Appl Clin Med Phys, 2014, 15(4): 4645. DOI:10.1120/jacmp.v15i4.4645 |
| [11] |
McDermott LN, Wendling M, Nijkamp J, et al. 3D in vivo dose verification of entire hypo-fractionated IMRT treatments using an EPID and cone-beam CT[J]. Radiother Oncol, 2008, 86(1): 35-42. DOI:10.1016/j.radonc.2007.11.010 |
| [12] |
张秀春, 胡彩容, 陈开强, 等. COMPASS验证系统在放射治疗中的应用研究[J]. 肿瘤预防与治疗, 2012, 25(5): 273-279. DOI: CNKI:SUN:SCZF.0.2012-05-003. Zhang XC, Hu CR, Chen KQ, et al. Commissioning of the Compass system for clinical dose verification[J]. J Cancer Control Treat, 2012, 25(5): 273-279. DOI: CNKI:SUN:SCZF.0.2012-05-003. |
| [13] |
邢晓汾, 褚薛刚, 崔桐, 等. 调强放疗三维剂量验证系统精度测试及临床应用研究[J]. 中华放射医学与防护杂志, 2014, 34(6): 427-430. Xing XF, Chu XG, Cui T, et al. A clinical test and application research of IMRT 3D dose verification system[J]. Chin J Radiol Med Prot, 2014, 34(6): 427-430. DOI:10.3760/cma.j.issn.0254-5098.2014.06.007 |
| [14] |
宋孟孟. Compass系统与EBT3胶片的验证计划通过率[J]. 医疗装备, 2021, 34(23): 1-3. Song MM. The verification plan pass rate between compass system and EBT3 film[J]. Med Equip, 2021, 34(23): 1-3. DOI:10.3969/j.issn.1002-2376.2021.23.001 |
| [15] |
柏朋刚, 李奇欣, 陈开强, 等. COMPASS系统在鼻咽癌容积旋转调强剂量验证中的应用[J]. 中华放射医学与防护杂志, 2012, 32(3): 304-307. Bai PG, Li QX, Chen KQ, et al. Dosimetric verification of volumetric modulated arc therapy in nasopharyngeal carcinoma using COMPASS 3D patient anatomy based system[J]. Chin J Radiol Med Prot, 2012, 32(3): 304-307. DOI:10.3760/cma.j.issn.0254-5098.2012.03.021 |
| [16] |
彭莹莹, 张书旭, 张全彬, 等. COMPASS系统在头颈部肿瘤调强放疗计划验证中的应用[J]. 中国医疗设备, 2018, 33(4): 65-68. Peng YY, Zhang SX, Zhang QB, et al. Dosimetric verification of IMRT in head and neck neoplasms using Compass system[J]. China Med Devices, 2018, 33(4): 65-68. DOI:10.3969/j.issn.1674-1633.2018.04.016 |
| [17] |
林晓辉, 张书旭, 廖煜良, 等. 基于Compass的鼻咽癌调强放疗三维剂量验证[J]. 中国医疗设备, 2020, 35(2): 67-71, 89. Lin XH, Zhang SX, Liao YL, et al. Three-dimensional dose verification of intensity-modulated radiotherapy for nasopharyngeal carcinoma based on Compass[J]. China Med Devices, 2020, 35(2): 67-71, 89. |
| [18] |
宋婷婷, 盛晓芳, 汪洋, 等. Compass剂量验证系统在VMAT脑肿瘤瘤床同步追量中的应用[J]. 中国医学物理学杂志, 2016, 33(10): 1012-1016. Song TT, Sheng XF, Wang Y, et al. Application of Compass dose verification system in tumor bed synchronous integrated boost radiation of VMAT for brain tumor[J]. Chin J Med Phys, 2016, 33(10): 1012-1016. DOI:10.3969/j.issn.1005-202X.2016.10.008 |
| [19] |
邢晓汾, 褚薛刚, 郑旭亮, 等. Compass在食管癌IMRT三维剂量验证中应用研究[J]. 中华放射肿瘤学杂志, 2015, 24(3): 327-330. Xing XF, Chu XG, Zheng XL, et al. A clinical application research of 3D dose verification for esophageal carcinoma intensity-modulated radiation therapy with Compass[J]. Chin J Radiat Oncol, 2015, 24(3): 327-330. DOI:10.3760/cma.j.issn.1004-4221.2015.03.024 |
| [20] |
魏鹏, 葛双, 陈其超, 等. Compass三维剂量验证系统在非小细胞肺癌立体定向放射治疗中的应用[J]. 中国医学装备, 2021, 18(8): 43-47. Wei P, Ge S, Chen QC, et al. Application of Compass 3D dose validation system in SBRT of NSCLC[J]. China Med Devices, 2021, 18(8): 43-47. DOI:10.3969/J.ISSN.1672-8270.2021.08.010 |
| [21] |
魏鹏, 孙力军, 叶书成, 等. Compass验证系统在非小细胞肺癌新型动态适形弧放射治疗三维剂量验证中的应用[J]. 医疗装备, 2022, 35(21): 6-9. Wei P, Sun LJ, Ye SC, et al. Application of Compass verification system in three-dimensional dose verification of new dynamic conformal arc radiotherapy for non-small cell lung cancer[J]. Med Equip, 2022, 35(21): 6-9. DOI:10.3969/j.issn.1002-2376.2022.21.002 |
| [22] |
吴继平. COMPASS系统在直肠癌术前调强放射治疗三维剂量验证中的应用[J]. 医疗装备, 2020, 33(5): 28-29. Wu JP. The application of Compass system in raising three dimensional dose verification of radiation therapy before rectal cancer surgery[J]. Med Equip, 2020, 33(5): 28-29. DOI:10.3969/j.issn.1002-2376,2020.05.012 |
| [23] |
段隆焱, 蔡钢, 陈毅, 等. Compass在直肠癌术前调强放射治疗三维剂量验证中的应用[J]. 中国医学物理学杂志, 2017, 34(12): 1200-1205. DOI: CNKI:SUN:YXWZ.0.2017-12-003. Duan LY, Cai G, Chen Y, et al. Application of Compass system in three-dimensional dose verification of preoperative intensity-modulated radiotherapy plan for rectal cancer[J]. Chin J Med Phys, 2017, 34(12): 1200-1205. DOI: CNKI:SUN:YXWZ.0.2017-12-003. |
| [24] |
陈旭明, 姚升宇, 许奕. 宫颈癌调强放疗的三维剂量验证[J]. 中国医疗设备, 2017, 32(2): 74-76. Chen XM, Yao SY, Xu Y, et al. Three-dimensional dose verification of cervix cancer intensity modulated radiation therapy[J]. China Med Devices, 2017, 32(2): 74-76. DOI:10.3969/j.issn.1674-1633.2017.02.020 |
| [25] |
陈俊颖, 夏火生, 赵剑, 等. Dolphin在调强放射治疗计划三维剂量验证中的应用[J]. 医疗装备, 2022, 35(3): 32-34, 38. Chen JY, Xia HS, Zhao J, et al. Application of dolphin in the three-dimensional dose verification in intensity modulated radiation therapy plan[J]. Med Equip, 2022, 35(3): 32-34, 38. DOI:10.3969/j.issn.1002-2376.2022.03.009 |
| [26] |
贾飞, 张艺宝, 王美娇, 等. 算法差异在Compass调强计划验证中的作用[J]. 中国医学物理学杂志, 2017, 34(4): 330-334. Jia F, Zhang YB, Wang MJ, et al. Effects of different algorithms on quality assurance of Compass-based radiotherapy plan[J]. Chin J Med Phys, 2017, 34(4): 330-334. DOI:10.3969/j.issn.1005-202X.2017.04.002 |
| [27] |
Stock M, Kroupa B, Georg D. Interpretation and evaluation of the gamma index and the gamma index angle for the verification of IMRT hybrid plans[J]. Phys Med Biol, 2005, 50(3): 399-411. DOI:10.1088/0031-9155/50/3/001 |
| [28] |
Depuydt T, Van Esch A, Huyskens DP. A quantitative evaluation of IMRT dose distributions: refinement and clinical assessment of the gamma evaluation[J]. Radiother Oncol, 2002, 62(3): 309-319. DOI:10.1016/s0167-8140(01)00497-2 |
 2023, Vol. 43
2023, Vol. 43
