放射治疗是前列腺癌的有效治疗方案之一[1],但治疗过程繁琐,尤其是放疗前,医师需在CT图像上逐层勾画危及器官,不仅需耗费大量时间,且勾画结果具有一定的主观性。为了简化危及器官轮廓的勾画,缩短患者等待时间,国内外出现了大量用于自动勾画的软件[2-4]。目前自动勾画的研究主要集中在图谱库与深度学习[5-6]。但尚鲜有研究对比基于深度学习的uPWS R15软件与基于图谱库的MIM-Maestro 6.9软件自动勾画前列腺癌危及器官的勾画效果,故而本研究通过对比上述两种自动勾画软件的勾画效果,以期为临床恶性肿瘤放疗危及器官的自动勾画提供参考依据。
资料与方法1. 临床资料:回顾性选取2018年11月至2022年11月90例于川北医学院附属医院接受放疗的前列腺癌患者CT图像,年龄49~87岁,中位年龄72岁。纳入标准:①经病理活检确诊前列腺癌。②依从性高。③既往未接受过放疗。排除标准:①ECOG评分>1分或存在放疗禁忌证。②CT定位和复位时无法保持仰卧位。③无法坚持完成放疗全过程。该研究获得医院伦理审批通过(审批号:2023ER101-1)。
2. CT图像获取及危及器官勾画:采用上海西门子医疗器械有限公司的Emotion 16 Slice Configuration模拟定位机进行盆腔扫描,嘱患者喝1 000 ml水充盈膀胱后采取仰卧位扫描,范围为髂嵴至耻骨联合下2 cm,层厚5 mm,将所得图像通过DICOM传输至Monaco计划系统,由1名具有2年工作经验的放疗科住院医师手动逐层勾画CT图像中危及器官,包括双侧股骨头、双侧肾脏、脊髓、膀胱、皮肤、直肠和小肠,再由资深副主任医师审核修改,以手动勾画为“金标准”。同时分别将图像传输至基于深度学习的uPWS软件和基于图谱库的MIM-Maestro 6.9软件上进行危及器官的自动勾画。
3. 自动勾画软件:uPWS软件由上海联影医疗科技股份有限公司开发,是基于深度学习的自动勾画软件,其原理是:在勾画时,将患者CT图像导入软件,基于深度学习神经网络训练模型全自动且快速分割出危及器官[7-8];MIM-Maestro 6.9软件由北京明维视景医疗软件有限公司开发,是基于图谱库的自动勾画软件,其原理是:在勾画时,将患者CT图像与Atlas库中的影像进行匹配,并将最匹配的Atlas对象的勾画形变到患者CT图像上自动生成勾画。
4. 评价指标
(1) 勾画时间:手动勾画时间、uPWS软件自动勾画时间及MIM软件自动勾画时间均为从打开CT图像到所有危及器官勾画完成的时间。
(2) 戴斯相似性系数(Dice similarity coefficient,DSC):反映2种勾画结果之间的相似度,越接近1代表相似度越高,勾画效果越好,DSC<0.7为不能满足临床要求[9],见式(1):
| $ \operatorname{DSC}(\operatorname{A, B})=\frac{2|\operatorname{A} \cap \operatorname{B}|}{|\operatorname{A}|+|\operatorname{B}|} $ | (1) |
(3) 雅卡尔相似系数(Jaccard similarity coefficient,JSC):2个集合之间的差异性[10],数值越接近1代表二者越相似、勾画效果越好;越接近0代表二者差异性大、勾画效果差,见式(2):
| $ \mathrm{JSC}(\mathrm{A}, \mathrm{B})=\frac{|\mathrm{A} \cap \mathrm{B}|-|\mathrm{A} \cap \mathrm{B}|}{|\mathrm{A} \cap \mathrm{B}|} $ | (2) |
(4) 豪斯多夫距离(Hausdorff distance,HD):指2个轮廓点集之间的最大差异[11],越接近0代表勾画效果越好,见式(3):
| $ \mathrm{HD}(\mathrm{A}, \mathrm{B})=\max [\mathrm{h}(\mathrm{A}, \mathrm{B}), \mathrm{h}(\mathrm{B}, \mathrm{A})] $ | (3) |
(5) 平均最小距离(mean distance to agreement,MDA):描述2个集合之间的距离[12],越接近0代表其间差别越小、勾画效果越好,见式(4)。式中,A为uPWS软件或MIM软件自动勾画图像轮廓,B为手工勾画图像轮廓。
| $ \begin{gathered} \operatorname{MDA}(\mathrm{A}, \mathrm{B})=\\ \frac{1}{2}\left\{\frac{\sum\limits_{ {\alpha e\partial } A} d(a, \partial B)}{|\partial A|}+\frac{\sum\limits_{b e \partial \ B} d(b, \partial A)}{|\partial B|}\right\} \end{gathered} $ | (4) |
5. 统计学处理:采用SPSS 26.0软件进行分析。危及器官的DSC、JSC、HD、MDA以x±s表示。经Shapiro-Wilk检验结果显示除双侧肾脏DSC和JSC、脊髓MDA、小肠DSC、直肠HD和MDA、膀胱的4项参数这几组数据不符合正态分布外,其他各参数均符合正态分布。采用配对样本t检验比较服从正态分布的两种软件间各指标差异。Wilcoxon符号秩和检验比较不服从正态分布的两种软件间各指标差异。P<0.05为差异有统计学意义。
结果1. 自动勾画危及器官的时间:uPWS软件的自动勾画所需时间为(0.19±0.03)min,小于MIM软件的勾画时间(2.50±0.19)min,差异有统计学意义(z=-12.90,P<0.001),且两软件的勾画时间均小于手动勾画的时间(21.45±0.91)min。
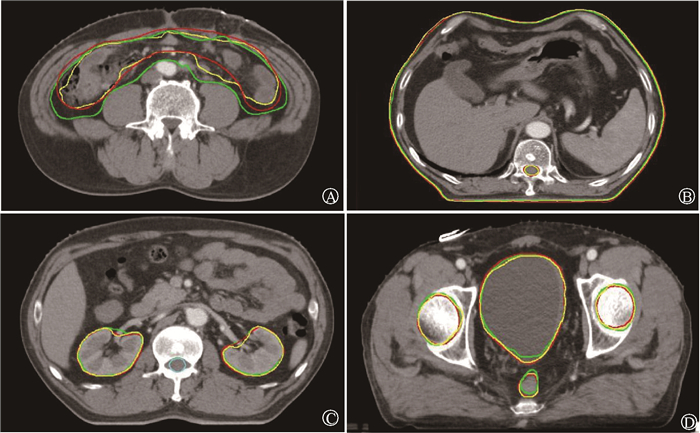
2. 危及器官勾画:uPWS软件和MIM软件自动勾画各危及器官的4项参数分析结果如表 1所示。勾画结果示意图如图 1所示。两种软件勾画双侧股骨头、皮肤的效果差异无统计学意义(P>0.05);勾画结果基本相同,4项参数的值也均较理想。双侧肾脏、小肠和直肠的勾画除HD外差异均有统计学意义,右侧肾脏(tMDA=-3.43,zDSC=-4.03,zJSC=-4.16, P<0.05)、左侧肾脏(tMDA=-3.87,zDSC=-4.18,zJSC=-4.41, P<0.05)、小肠(tMDA=-8.57,zDSC=-9.99,tJSC=14.21, P<0.05)和直肠(zMDA=-4.00,tDSC=-9.98,tJSC= 9.72, P<0.05)。uPWS软件勾画的左肾、右肾、小肠和直肠MDA值均小于MIM软件的勾画结果,而DSC、JSC值均大于MIM软件的勾画结果。对于膀胱和脊髓的勾画,4项参数HD、MDA、DSC、JSC差异均有统计学意义,分别为膀胱(z=-7.88、-9.00、-8.17、-8.74, P<0.05)、脊髓(z=-3.87、-4.43、4.03、3.05, P<0.05)。uPWS软件勾画的膀胱和脊髓HD、MDA值均小于MIM软件的勾画结果,而DSC、JSC值均大于MIM软件的勾画结果。
|
|
表 1 MIM软件与uPWS软件对90例前列腺癌自动勾画危及器官的效果比较(x±s) Table 1 Comparison of the effect of MIM software and uPWS software on automatic delineation of organs at risk in 90 cases of prostate cancer(x±s) |
|
注: 红色:人工勾画;绿色:MIM软件勾画,黄色:uPWS软件勾画 图 1 MIM软件与uPWS软件自动勾画危及器官的效果比较 A.小肠;B.脊髓及皮肤;C.双侧肾脏;D.双侧股骨头、膀胱和直肠 Figure 1 Comparison of the effect of MIM software and uPWS software on automatic delineation of organs at risk A.Small intestine; B.Spinalcord and skin; C.Bilateral kidneys; D.Bilateral femoral head, bladder and rectum |
讨论
根据2020年版的全球癌症统计报告显示,2020年前列腺癌新发病例达1 414 259例,发病率位于全球第3位,仅次于乳腺癌和肺癌[13]。为缩短患者放疗过程中的等待时间,国内外涌出大量自动勾画软件。本研究就基于深度学习的uPWS R15软件与基于图谱库的MIM-Maestro 6.9软件自动勾画前列腺癌危及器官效果的对比讨论如下。
通过分析4项评价系数,发现uPWS软件的勾画时间小于MIM软件的勾画时间,更是极大地小于手动勾画时间,有助于患者更快接受治疗。uPWS软件自动勾画危及器官的HD、MDA、DSC、JSC值普遍优于MIM软件的勾画。双侧股骨头骨性标志明显,密度值较高,在CT图像上与周围组织对比度高,而皮肤与周围组织分界较清,因此两种软件均可准确地识别和勾画股骨头、皮肤的边界轮廓[14]。据报道,DSC>0.7则能满足临床要求[9],uPWS软件自动勾画各危及器官的DSC值均>0.7,而MIM软件自动勾画的小肠和直肠DSC值<0.7,说明MIM软件勾画的小肠和直肠的勾画不能满足临床要求,可能是因为小肠和直肠与周围组织对比度低且直肠的范围较小而小肠的动度较大,受患者饮食、体位等因素影响较大,故MIM软件无法准确勾画出肠壁[15]。膀胱的勾画受充盈度的影响,即与患者憋尿程度有关[16],不同个体差异较大。对于脊髓的勾画,因其体积较小,MIM软件容易勾画偏大以致于DSC值低于uPWS软件。
综上所述,uPWS软件自动勾画前列腺癌危及器官的效果优于MIM软件,极大的提高了勾画的效率,但MIM软件经过修改也能满足临床使用,自动勾画软件的使用能大量节省放疗前的准备时间。但本研究尚未讨论患者肿瘤分期、有无新辅助化疗、剂量学差异对放疗准确性造成的影响[17-18]等,这些临床因素可能会对研究结果产生一定的影响。在今后的研究中,将纳入更全面的患者信息及结合临床剂量学参数和几何参数共同评估勾画效果,以期为临床提供更加可靠的参考依据。
利益冲突 本文由署名作者按以下贡献声明独立开展,不涉及各相关方的利益冲突
作者贡献声明 向雪静负责设计研究方案,研究实施及论文撰写;罗媛媛负责文献调研及研究实施;李镰负责实验数据收集;邓宇负责收集和分析数据;马晓洁提出研究思路,指导论文修改
| [1] |
Kanesvaran R, Castro E, Wong A, et al. Pan-Asian adapted ESMO clinical practice guidelines for the diagnosis, treatment and follow-up of patients with prostate cancer[J]. ESMO Open, 2022, 7(4): 100518. DOI:10.1016/j.esmoop.2022.100518 |
| [2] |
Li D, Wei S, Li T, et al. Study of spinal cord substructure expansion margin in esophageal cancer[J]. Technol Cancer Res Treat, 2021, 20: 15330338211024559. DOI:10.1177/15330338211024559 |
| [3] |
Nikolov S, Blackwell S, Zverovitch A, et al. Clinically applicable segmentation of head and neck anatomy for radiotherapy: Deep learning algorithm development and validation study[J]. J Med Internet Res, 2021, 23(7): e26151. DOI:10.2196/26151 |
| [4] |
Wong J, Huang V, Wells D, et al. Implementation of deep learning-based auto-segmentation for radiotherapy planning structures: a workflow study at two cancer centers[J]. Radiat Oncol, 2021, 16(1): 101. DOI:10.1186/s13014-021-01831-4 |
| [5] |
傅玉川, 余行. 医学影像自动分割技术在放射治疗中的应用及发展趋势[J]. 中国医疗器械杂志, 2020, 44(5): 420-424. Fu YC, Yu H. Application and development trend of medical image automatic segmentation technology in radiation therapy[J]. Chin J Med lnstru, 2020, 44(5): 420-424. DOI:10.3969/j.issn.1671-7104.2020.05.009 |
| [6] |
Harrison K, Pullen H, Welsh C, et al. Machine learning for auto-segmentation in radiotherapy planning[J]. Clin Oncol (R Coll Radiol), 2022, 34(2): 74-88. DOI:10.1016/j.clon.2021.12.003 |
| [7] |
Rhee DJ, Jhingran A, Rigaud B, et al. Automatic contouring system for cervical cancer using convolutional neural networks[J]. Med Phys, 2020, 47(11): 5648-5658. DOI:10.1002/mp.14467 |
| [8] |
Lin YC, Lin CH, Lu HY, et al. Deep learning for fully automated tumor segmentation and extraction of magnetic resonance radiomics features in cervical cancer[J]. Eur Radiol, 2020, 30(3): 1297-1305. DOI:10.1007/s00330-019-06467-3 |
| [9] |
曹世鹏, 王大奖, 王骁踊, 等. AccuContour和United Imaging软件自动勾画胸部危及器官[J]. 中国医学影像技术, 2021, 37(11): 1715-1719. Cao SP, Wang DJ, Wang XY, et al. AccuContour and United Imaging software for automatic segmenting the accuracy of chest organ at risk[J]. Chin J Med Imag Tech, 2021, 37(11): 1715-1719. DOI:10.13929/j.issn.1003-3289.2021.11.029 |
| [10] |
张富利, 崔德琪, 王秋生, 等. 基于深度学习和图谱库方法自动勾画肿瘤放疗中危及器官的比较[J]. 中国医学物理学杂志, 2019, 36(12): 1486-1490. Zhang FL, Cui DQ, Wang QS, et al. Comparative study of deep learning-versus atlas-based auto-segmentation of organs-at-risk in tumor radiotherapy[J]. Chin J Med Phys, 2019, 36(12): 1486-1490. DOI:10.3969/j.issn.1005-202X.2019.12.024 |
| [11] |
何奕松, 蒋家良, 余行, 等. 影像分割中Dice系数和Hausdorff距离的比较[J]. 中国医学物理学杂志, 2019, 36(11): 1307-1311. He YS, Jiang JL, Yu H, et al. Comparison of Dice similarity coefficient and Hausdorff distance in image segmentation[J]. Chin J Med Phys, 2019, 36(11): 1307-1311. DOI:10.3969/j.issn.1005-202X.2019.11.012 |
| [12] |
Fung N, Hung WM, Sze CK, et al. Automatic segmentation for adaptive planning in nasopharyngeal carcinoma IMRT: time, geometrical, and dosimetric analysis[J]. Med Dosim, 2020, 45(1): 60-65. DOI:10.1016/j.meddos.2019.06.002 |
| [13] |
刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-13. Liu ZC, Li ZX, Zhang Y, et al. Interpretation on the report of global cancer statistics 2020[J]. Elect J Integ Oncol Ther, 2021, 7(2): 1-13. DOI:10.12151/JMCM.2021.02-01 |
| [14] |
全科润, 柏朋刚, 陈文娟, 等. 基于深度学习的宫颈癌放疗靶区及危及器官自动勾画研究[J]. 现代肿瘤医学, 2022, 30(20): 3759-3762. Quan KR, Bai PG, Chen WJ, et al. Automatic contouring of clinical target volume and organs at risk in radiotherapy for cer-vical cancer based on deep learning[J]. J Med Oncol, 2022, 30(20): 3759-3762. DOI:10.3969/j.issn.1672-4992.2022.20.024 |
| [15] |
Kamran SC, D'Amico AV. Radiation therapy for prostate cancer[J]. Hematol Oncol Clin North Am, 2020, 34(1): 45-69. DOI:10.1016/j.hoc.2019.08.017 |
| [16] |
Bulten W, Pinckaers H, van Boven H, et al. Automated deep-learning system for gleason grading of prostate cancer using biopsies: a diagnostic study[J]. Lancet Oncol, 2020, 21(2): 233-241. DOI:10.1016/S1470-2045(19)30739-9 |
| [17] |
鲜利勋, 李光俊, 肖青, 等. 基于食管癌放疗的剂量学参数研究几何指标评价自动勾画轮廓准确度的可行性[J]. 中国医学物理学杂志, 2021, 38(2): 148-152. Xian LX, Li GJ, Xiao Q, et al. Feasibility study of evaluating autosegmentation accuracy with geometric indices based on dosimetric parameters of esophageal cancer radiotherapy[J]. Chin J Med Phys, 2021, 38(2): 148-152. DOI:10.3969/j.issn.1005-202X.2021.02.004 |
| [18] |
Dai Z, Zhang Y, Zhu L, et al. Geometric and dosimetric evaluation of deep learning-based automatic delineation on CBCT-synthesized CT and planning CT for breast cancer adaptive radiotherapy: A multi-institutional study[J]. Front Oncol, 2021, 11: 725507. DOI:10.3389/fonc.2021.725507 |
 2023, Vol. 43
2023, Vol. 43


