2. 复旦大学附属中山医院肝肿瘤外科, 上海 200032
2. Department of Liver Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是指起源于二级胆管及其分支上皮的原发性肝癌,是仅次于肝细胞癌的第二大原发性肝癌[1]。ICC发病隐匿,进展快,就诊时多为晚期,若不接受治疗,整体生存期仅3~6个月[2]。基于随机对照的Ⅲ期ABC-02研究,对于不适宜手术切除的晚期ICC患者,双药联合化疗方案(吉西他滨+顺铂,GC)是一线治疗,然而,患者中位生存期通常不超过1年[3]。因此,迫切需要探索针对ICC患者,特别是无法接受手术治疗的ICC患者的新型、有效的治疗方案。
近年来,已有多种靶向和免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)在ICC治疗中崭露头角,然而在总体人群中疗效一般,需筛选获益人群[4]。有研究显示,ICIs的联合治疗(放疗、化疗、免疫与靶向治疗)策略是一种有效的抗肿瘤治疗方案[5]。本课题组报道了仑伐替尼联合特瑞普利单抗和GEMOX(吉西他滨+奥沙利铂)(三联疗法)一线治疗晚期和不可切除ICC的Ⅱ期临床试验数据,结果显示,三联疗法疗效优异,客观缓解率(objective response rate,ORR)达80%,疾病控制率(disease control rate,DCR)达93.3%,为晚期ICC提供了一种有效的治疗选择[6]。
随着放疗技术的不断发展,放疗在ICC治疗中的地位越来越重要[7]。放疗与靶向药物、ICIs和化疗等治疗手段相结合的联合治疗策略,已在多种恶性肿瘤的治疗中显示出良好疗效[8]。基于此,进行了这项回顾性研究,旨在观察放疗联合仑伐替尼、anti-PD-1抗体和GEMOX化疗(四联疗法)在不可切除的ICC中的疗效和安全性。
资料与方法1. 研究对象:经复旦大学附属中山医院医学伦理委员会通过后(B2023-116),收集2018年9月至2022年5月在复旦大学附属中山医院接受四联疗法的复发、转移或不可切除的ICC患者。入组标准:①年龄≥18岁。②美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0或1。③病理学检查确诊为ICC。④不可手术切除的Ⅲ~Ⅳ期ICC。⑤Child-Pugh评分≤9分。⑥肝、肾和骨髓功能正常。⑦在接受四联疗法期间未接受其他ICC治疗。⑧序贯或同步使用仑伐替尼、anti-PD-1抗体和GEMOX化疗。⑨在系统治疗开始后的12个月内接受放疗。B10预计生存时间>3个月。排除标准:①伴随另一种肿瘤或合并可能影响患者生命的严重疾病。②持续进行性感染;③自身免疫性疾病史或正在接受类固醇或者其他免疫抑制药物治疗。④曾经接受过靶向或免疫治疗。⑤未完成规定方案的放疗。⑥治疗开始后随访时间间隔超过3个月。⑦治疗开始前未对疾病进行全面评估和准确分期。在四联疗法前接受过局部抗肿瘤治疗,如手术切除、经动脉化疗栓塞或射频消融等的患者允许入组,但在四联疗法开始前6个月内接受过化疗的患者将被排除在外。
2. 治疗方法:最终纳入41例ICC患者,其中,男性27例,女性14例;中位年龄58岁[四分位间距(IQR):51.5~63.0岁]。15例患者在接受四联疗法前接受了手术切除,其中8例患者接受的四联疗法为术后辅助治疗,7例患者为手术后出现复发或转移后治疗。28例患者接受了同步仑伐替尼、anti-PD-1抗体和GEMOX化疗,13例患者在完成GEMOX化疗后序贯使用仑伐替尼和anti-PD-1抗体。仑伐替尼和anti-PD-1抗体持续至疾病进展或出现无法耐受的不良反应。GEMOX化疗剂量为吉西他滨(1 g/m2,第1、8天)+奥沙利铂(85 mg/m2,每3周1次),仑伐替尼为8 mg/d。使用的anti-PD-1抗体为信迪利单抗(200 mg)15例,特瑞普利单抗(240 mg)15例,卡瑞利珠单抗(200 mg)4例,替雷利珠单抗(200 mg)3例,帕博利珠单抗(200 mg)3例,纳武利尤单抗(240 mg)1例。其中,纳武利尤单抗为每2周1次,其他单抗均为每3周1次。
患者接受中位6个周期(IQR:6~8)的GEMOX化疗方案,仑伐替尼和anti-PD-1抗体的中位治疗时间分别为11.5个月(IQR:7.25~17.50)和10.0个月(IQR:6.50~18.00)。放疗与系统治疗的中位时间间隔为7个月(IQR:4~10)。13例患者的放疗靶区为肝内病灶,8例为转移淋巴结,7例为肝内病灶和转移淋巴结,10例为骨转移灶,2例为腹膜后转移灶,1例为肺转移灶。放疗采用调强放疗(IMRT,ONCORTM, 德国Siemens Healthcare公司)或者螺旋断层(HT Hi-Art)治疗系统(Accuray, 美国Madison公司)。放疗靶区、处方剂量和分割模式由主治医师根据疾病分期、肿瘤位置、肿瘤大小和放疗设备决定。在满足危及器官剂量限制的条件下,尽量采用中等剂量大分割或立体定向放疗。其中24例患者接受处方剂量为50~60 Gy/25次,5例为30 Gy/10次,4例为48 Gy/6次,2例为40 Gy/20次,2例为60 Gy/15次,1例为50 Gy/5次,1例为54 Gy/6次,1例为50 Gy/10次,1例为45 Gy/15次。
患有乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)的患者在接受四联疗法抗肿瘤过程中需接受标准化抗病毒治疗。
3. 数据收集:入组患者的临床信息、实验室参数和影像学数据从电子病历中进行采集,包括年龄、性别、ECOG评分、Child-Pugh分级、糖类抗原199(CA199)和癌胚抗原(CEA)水平、肝功能、仑伐替尼信息、anti-PD-1抗体信息、化疗信息,淋巴结转移、肝外转移和疾病分期等。寡转移定义为转移灶数目≤5个,且转移器官数目≤3个。
4. 疗效评价:患者在接受四联疗法前以及治疗后每两个周期应用CT或MRI对靶病灶进行疗效评估,部分患者根据实际情况按需进行疗效评估。无进展生存期(progression-free survival, PFS)定义为仑伐替尼/anti-PD-1抗体/GEMOX第1次治疗剂量开始的日期至患者出现疾病进展或者死亡的日期时间间隔。总生存期(overall survival, OS)定义为仑伐替尼/anti-PD-1抗体/GEMOX第1次治疗剂量开始日期至因任何原因导致死亡的日期或者随访截止日期的时间间隔。采用查阅病例、电话和复诊方式进行随访,末次随访时间截至2022年12月31日。在治疗期间和随访过程中,参照美国癌症常见不良反应事件评价标准(common terminology criteria for adverse events, CTCAE)5.0版对治疗的安全性和耐受性进行了评估和分级。
5. 统计学处理:采用SPSS 26.0软件对数据进行统计学处理。本研究统计分析了患者的基线资料、肿瘤特征和治疗相关的变量,并应用描述性统计分析方法对临床指标进行归纳总结。Kaplan-Meier法绘制生存曲线。对在数据分析时未经历进展事件或死亡事件的患者的生存时间进行了截断,以最后随访日期的评估为依据。
结果1. 研究对象一般资料:入组患者的基本临床特征见表 1。治疗终止的原因主要是临床和影像学进展(25例)或者治疗不良反应(3例)。3例患者接受同步放疗、靶向、免疫和化疗,11例患者化疗期间序贯放疗同步靶向和免疫治疗,9例患者完成同步的化疗、靶向和免疫治疗后,在维持治疗开始时针对化疗后残存病灶放疗,18例患者完成规定方案的化疗后,在维持治疗期间出现疾病进展后接受放疗。
|
|
表 1 入组患者临床特征 Table 1 Characteristics of all patients |
2. 治疗效果和失败模式:整个研究人群的中位随访时间为15个月(IQR:12~25个月)。截止随访日期,36例患者发生疾病进展(18例死亡),3例失访。死亡原因包括肝内肿瘤进展引起的肝衰竭(6例)、远处转移(肺或脑)(6例)、腹部淋巴结转移(3例)、癌症恶病质(2例)和不明原因(1例)。随访期间,6例患者在放疗野内出现复发,20例在放疗野外出现新的转移病灶。
为减少放疗介入时机对疗效评估的影响,本研究仅对初诊接受三联疗法且在化疗结束后针对残存病灶进行放疗的13例患者进行了疗效评估。放疗结束后3个月,7例患者的靶病灶在接受四联疗法后疗效评估为部分缓解(CR),5例为疾病稳定(SD),1例为疾病进展(PD),疾病控制率达92.3%(12/13)。中位PFS为19个月(95% CI:11.5~26.4),中位OS未达到。预后数据提示41例患者的中位PFS为11个月(95% CI:9.2~12.8),中位OS为35个月(95% CI:17.0~52.0),见图 1。总人群1年总生存率为81.3%(95% CI:68.8~93.8),2年总生存率为53.5%(95% CI:36.4~70.6)。
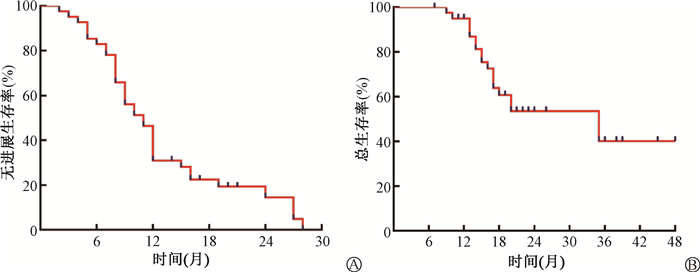
|
图 1 41例ICC患者四联治疗后的中位无进展生存期(A)和总生存期(B) Figure 1 The progression-free survival (A) and the overall survival (B) of 41 ICC patients underwent quadruple therapy |
3. 安全性:如表 2所示,所有患者均出现与治疗相关的不良事件(adverse events, AEs),13例(31.7%)患者至少出现1次≥3级AEs。所有AEs经保守支持治疗后均顺利康复。28例患者(68.3%)因AEs需要减少吉西他滨或奥沙利铂剂量,16例(39.0%)需要延迟全身系统治疗。治疗和随访期间未出现与治疗相关死亡事件。
|
|
表 2 放疗联合仑伐替尼、anti-PD-1抗体和GEMOX治疗不可手术切除的肝内胆管癌的不良反应 Table 2 Toxicities of patients with unresectable intrahepatic cholangiocarcinoma treated with radiotherapy, Lenvatinib, anti-PD-1 antibody, and GEMOX chemotherapy |
讨论
ICC发病率呈明显上升趋势,其治疗面临极大挑战[9-10]。在靶向、免疫治疗出现之前,本课题组曾对比了不可手术切除的ICC患者接受与不接受二维或三维的非图像引导的外放疗的效果,结果显示,接受放疗的ICC患者,其1年OS率和中位OS分别为36.1%和9.9个月,不接受放疗的ICC患者,其1年OS率和中位OS分别为19%和5.2个月[11]。同一时期,GC方案被认为是不可手术切除的ICC有效一线治疗[3],随着分子靶向和ICIs等治疗方案的兴起,多种恶性肿瘤的治疗开始探索联合治疗策略[12]。这项单中心、回顾性临床研究提供了不可手术切除的ICC患者接受放疗联合仑伐替尼、anti-PD-1抗体和GEMOX化疗的疗效和安全性数据,研究结果为ICC患者在临床实践中的治疗选择提供了参考数据。
近年来,ICIs在ICC中发挥了一定的作用,逐步引起关注[13-17]。探索ICIs联合化疗或ICIs联合靶向治疗在ICC中疗效和安全性的多项临床试验结果已出炉[18-19]。此外,2021年美国临床肿瘤学会(ASCO)报告了仑伐替尼联合特瑞普利单抗一线治疗晚期ICC的一项Ⅱ期研究,结果显示,中位随访时间为6.9个月时,31例患者的ORR为32.3%,DCR为74.2%。研究期间没有发生≥5级的AEs[20]。2022年ASCO-胃肠道肿瘤研讨会报告TOPAZ-1 Ⅲ期的中期结果:与单独化疗比较,度伐利尤单抗联合GC化疗可降低20%不可切除晚期或转移性胆道癌(BTCs)患者死亡风险,中位OS为12.8个月,单独化疗患者中位OS为11.5个月。安全性方面,联合治疗患者与单独化疗患者3~4级AEs、因药物不良反应导致的停药率比较,差异均无统计学意义[5]。此外,2022年ASCO报告一项特瑞普利单抗联合GS(吉西他滨联合替吉奥)方案一线治疗包含ICC的晚期BTCs研究,结果显示:中位PFS、OS、ORR、DCR分别为7.0个月、15.0个月、30.6%、87.8%,治疗方案具有良好的疗效与安全性[21]。基于靶向药物、ICIs和化疗的联合治疗方案在ICC治疗中显示出良好的疗效和安全性,对于身体状况良好的晚期ICC,推荐联合治疗方案。本研究结果进一步提示,加入放疗提高了仑伐替尼、anti-PD-1抗体和化疗在ICC治疗中的疗效。
本研究结果与历史资料对比,接受放疗的不可手术切除的ICC患者,中位OS从9.9个月提高到35个月,1年OS从36%升到81%[11]。对比本单位开展的前瞻性临床数据,本研究部分患者在化疗结束后针对残存病灶进行放疗,中位PFS明显提高(10.2 vs.19.0个月)[6]。三联疗法结合外放疗,明显提高疗效,除了靶向免疫药物所起的系统性治疗之外,外放疗技术的进步,也起到很大的作用。靶向免疫药物出现的同时,图像引导下的调强放疗也得到推广和普及,本研究所用的放疗技术,都是图像引导下的调强放疗,提高了放疗的精确度和放疗剂量,减少了放疗导致的不良反应。
然而,本研究存在一定的局限性。首先,缺乏同一个时期仅接受三联疗法药物治疗的对照组;其次,本研究为单中心、回顾性分析,样本量相对较少,选择放疗的患者缺乏统一标准,存在一定偏倚;再次,本研究人群使用了不同的anti-PD-1抗体,由于样本数量有限,无法基于anti-PD-1抗体进一步分层分析;最后,入组人群的放疗部位和处方剂量差异较大。但是,本研究结果提示有必要进行随机、前瞻的多中心研究,以比较不能手术切除的ICC患者,在接受系统性药物治疗的同时结合或不结合局部放疗的疗效差异。
综上所述,放疗联合仑伐替尼、anti-PD-1抗体和GEMOX的四联疗法治疗不可手术切除的ICC患者,其结果显示出较好的疗效,不良反应可耐受,值得进一步开展高级别的临床研究以指导临床工作。
利益冲突 无
作者贡献声明 赵倩倩负责收集病例资料、随访患者、数据整理、统计分析和论文撰写;周俭、樊嘉、施国明负责不能手术切除的ICC患者诊断和药物治疗;杜世锁、陈一兴、杨平负责ICC患者放疗和收集病例资料;曾昭冲指导研究设计和论文修改
| [1] |
Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48. DOI:10.3322/caac.21763 |
| [2] |
Moazzam Z, Alaimo L, Endo Y, et al. Predictors, patterns, and impact of adequate lymphadenectomy in intrahepatic cholangiocarcinoma[J]. Ann Surg Oncol, 2023, 30(4): 1966-1977. DOI:10.1245/s10434-022-13044-4 |
| [3] |
Lamarca A, Ross P, Wasan HS, et al. Advanced intrahepatic cholangiocarcinoma: post hoc analysis of the ABC-01, -02, and -03 clinical trials[J]. J Natl Cancer Inst, 2020, 112(2): 200-210. DOI:10.1093/jnci/djz071 |
| [4] |
Fiste O, Ntanasis-Stathopoulos I, Gavriatopoulou M, et al. The emerging role of immunotherapy in intrahepatic cholangiocarcinoma[J]. Vaccines (Basel), 2021, 9(5): 422. DOI:10.3390/vaccines9050422 |
| [5] |
Oh DY, Chen LT, He AR, et al. A phase Ⅲ, randomized, double-blind, placebo-controlled, international study of durvalumab in combination with gemcitabine plus cisplatin for patients with advanced biliary tract cancers: TOPAZ-1[J]. Ann Oncol, 2019, 30(Suppl 5): v319. DOI:10.1093/annonc/mdz247.157 |
| [6] |
Shi GM, Huang XY, Wu D, et al. Toripalimab combined with lenvatinib and GEMOX is a promising regimen as first-line treatment for advanced intrahepatic cholangiocarcinoma: a single-center, single-arm, phase 2 study[J]. Signal Transduct Target Ther, 2023, 8(1): 106. DOI:10.1038/s41392-023-01317-7 |
| [7] |
Wang N, Huang A, Kuang B, et al. Progress in radiotherapy for cholangiocarcinoma[J]. Front Oncol, 2022, 12: 868034. DOI:10.3389/fonc.2022.868034 |
| [8] |
Herrera FG, Bourhis J, Coukos G. Radiotherapy combination opportunities leveraging immunity for the next oncology practice[J]. CA Cancer J Clin, 2017, 67(1): 65-85. DOI:10.3322/caac.21358 |
| [9] |
Fong ZV, Brownlee SA, Qadan M, et al. The clinical management of cholangiocarcinoma in the United States and Europe: A comprehensive and evidence-based comparison of huidelines[J]. Ann Surg Oncol, 2021, 28(5): 2660-2674. DOI:10.1245/s10434-021-09671-y |
| [10] |
Moris D, Palta M, Kim C, et al. Advances in the treatment of intrahepatic cholangiocarcinoma: An overview of the current and future therapeutic landscape for clinicians[J]. CA Cancer J Clin, 2023, 73(2): 198-222. DOI:10.3322/caac.21759 |
| [11] |
Zeng ZC, Tang ZY, Fan J, et al. Consideration of the role of radiotherapy for unresectable intrahepatic cholangiocarcinoma: a retrospective analysis of 75 patients[J]. Cancer J, 2006, 12(2): 113-122. |
| [12] |
Patel SA, Minn AJ. Combination cancer therapy with immune checkpoint blockade: mechanisms and strategies[J]. Immunity, 2018, 48(3): 417-433. DOI:10.1016/j.immuni.2018.03.007 |
| [13] |
Zhao Q, Chen Y, Du S, et al. Integration of radiotherapy with anti-PD-1 antibody for the treatment of intrahepatic or hilar cholangiocarcinoma: reflection from four cases[J]. Cancer Biol Ther, 2021, 22(3): 175-183. DOI:10.1080/15384047.2020.1834792 |
| [14] |
Piha-Paul SA, Oh DY, Ueno M, et al. Efficacy and safety of pembrolizumab for the treatment of advanced biliary cancer: Results from the KEYNOTE-158 and KEYNOTE-028 studies[J]. Int J Cancer, 2020, 147(8): 2190-2198. DOI:10.1002/ijc.33013 |
| [15] |
Kang S, El-Rayes BF, Akce M. Evolving role of immunotherapy in advanced biliary tract cancers[J]. Cancers (Basel), 2022, 14(7): 1748. DOI:10.3390/cancers14071748 |
| [16] |
Rizzo A, Ricci AD, Brandi G. Recent advances of immunotherapy for biliary tract cancer[J]. Expert Rev Gastroenterol Hepatol, 2021, 15(5): 527-536. DOI:10.1080/17474124.2021.1853527 |
| [17] |
Kim RD, Chung V, Alese OB, et al. A phase 2 multi-institutional study of nivolumab for patients with advanced refractory biliary tract cancer[J]. JAMA Oncol, 2020, 6(6): 888-894. DOI:10.1001/jamaoncol.2020.0930 |
| [18] |
Hack SP, Verret W, Mulla S, et al. IMbrave 151: a randomized phase Ⅱ trial of atezolizumab combined with bevacizumab and chemotherapy in patients with advanced biliary tract cancer[J]. Ther Adv Med Oncol, 2021, 13: 17588359211036544. DOI:10.1177/17588359211036544 |
| [19] |
Oh DY, Lee KH, Lee DW, et al. Gemcitabine and cisplatin plus durvalumab with or without tremelimumab in chemotherapy-naive patients with advanced biliary tract cancer: an open-label, single-centre, phase 2 study[J]. Lancet Gastroenterol Hepatol, 2022, 7(6): 522-532. DOI:10.1016/S2468-1253(22)00043-7 |
| [20] |
Jian Z, Fan J, Shi GM, et al. Lenvatinib plus toripalimab as first-line treatment for advanced intrahepatic cholangiocarcinoma: a single-arm, phase 2 trial[J]. J Clin Oncol, 2021, 39(15_suppl): 4099. DOI:10.1200/JCO.2021.39.15_suppl.4099 |
| [21] |
Li W, Wu YQ, Yu YY, et al. Toripalimab combined with gemcitabine and S-1 in the first-line treatment of advanced biliary tract cancer[J]. J Clin Oncol, 2022, 40(16_suppl): 4081. DOI:10.1200/JCO.2022.40.16_suppl.4081 |
 2023, Vol. 43
2023, Vol. 43


