2. 南京医科大学康达学院附属涟水人民医院放疗科, 淮安 223400;
3. 扬州大学医学院临床学院 江苏省中西医结合老年病防治重点实验室, 扬州 225009
2. Department of Radiotherapy, Lianshui People's Hospital, Kangda College of Nanjing Medical University, Huai'an 223400;
3. School of Clinical Medicine, Medical College of Yangzhou University, Jiangsu Key Laboratory of Integrated Traditional Chinese and Western Medicine for Prevention and Treatment of Senile Diseases, Yangzhou 225009, China
放疗是肺癌等胸腔肿瘤的主要治疗手段,但临床应用受限于其对正常组织的损伤,如放射性肺损伤(radiation-induced lung injury,RILI)。RILI一般包括放射性肺炎和放射性肺纤维化两个阶段,RILI发病率较高,对患者的生活质量影响很大,可导致呼吸衰竭甚至死亡[1-2]。目前缺乏有效的治疗方式,主要依靠非特异性和改善症状的治疗,糖皮质激素及抗生素等是最常用的药物[3],但不良反应较多且对损伤细胞无修复作用,因此积极地探寻更为有效的RILI治疗策略具有重要的临床意义。
消旋山莨菪碱(racanisodamine)是我国首先从茄科植物山莨菪中提取的生物碱,为毒蕈碱型M受体拮抗剂,常用于治疗有机磷中毒、感染性休克、肺动脉瓣闭锁不全以及胃溃疡等疾病用[4-5]。此外,消旋山莨菪碱可缓解博来霉素诱导的急性肺损伤小鼠体内氧化应激、炎症及细胞凋亡情况[6],还可抑制炎症从而缓解脂多糖(lipopolysaccharide,LPS)诱导的急性肺损伤大鼠模型[7]。消旋山莨菪碱对于丙三醇[8]、LPS[9]、横纹肌溶解[10]等诱导的急性肾损伤同样具有保护作用,但目前尚无研究探讨消旋山莨菪碱对于RILI的保护作用及其机制。本研究基于小鼠RILI模型探究消旋山莨菪碱对于RILI是否具有治疗作用,为临床治疗RILI提供新理论、新方法。
材料与方法1. 主要试剂:消旋山莨菪碱购自上海阿拉丁生化科技股份有限公司;肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、IL-1β试剂盒购自杭州联科生物公司;Diff-Qick染色试剂盒购自北京索莱宝公司,细胞衰老相关半乳糖苷酶染色试剂盒、二喹啉甲酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒购自上海碧云天公司;核因子E2相关因子2(Nrf2)抗体、p-Nrf2抗体、p62抗体购自武汉三鹰公司;化学发光辣根过氧化物酶(HRP)底物电化学发光(electrochemiluminescence,ECL)试剂盒购自大连美仑公司。
2. 实验动物及分组:雄性C57BL/6小鼠20只,6~8周龄,体重16~18 g,购自南京集萃药康生物科技公司,实验动物生产许可证号:SCXK(苏)2018-0008。饲养环境:22℃~25℃,湿度55%~65%。适应喂养1周后,根据随机数表法分为4组:对照组(不接受辐照)、模型组(接受一次性18 Gy全肺辐照)、给药组(不接受辐照,但注射消旋山莨菪碱)、治疗组(接受一次性18 Gy全肺辐照并给予消旋山莨菪碱治疗)。每组5只,自由摄食饮水。给药组和治疗组照射前3天给予消旋山莨菪碱注射液腹腔注射(5 mg/kg),辐照后每隔1天给药,直至实验结束。
3. 照射条件及RILI造模方法:利用10%水合氯醛经腹腔注射(0.35 ml/100 g)麻醉小鼠,将其四肢及头部充分拉伸后固定于特制的胸部照射装置上。将小鼠置于CT扫描床,行1.8 mm薄层扫描,后将所得图像传至加速器Eclipse计划系统便于后续肺部靶区勾画,针对肺部的靶区,采用美国瓦里安23-EX直线加速器进行6 MV X射线照射,源皮距100 cm,剂量率300 cGy/min,总照射剂量18 Gy。
4. 标本采集与处理:照射后6周处死小鼠,眼球取血,3 000 r/min,离心半径8.37 cm,4℃离心10 min,取上清,-80℃冻存备用。小鼠处死后暴露气管,采用自制软管采集肺泡灌洗液,回收的灌洗液4℃,1 500 r/min,离心半径8.37 cm,离心10 min,回收上清置于-20℃用于细胞因子检测,细胞沉淀进行Diff-Qick染色。左肺一半组织用4%多聚甲醛溶液固定,用于病理观察及免疫组化;另一半进行冰冻切片留作衰老相关染色。右肺组织置于-80℃留作RNA及蛋白提取。
5. 肺组织病理学观察及评分:取肺组织制作石蜡包埋切片,5 μm切片脱蜡后,苏木素-伊红(HE)染色,显微镜观察并作图像采集分析。肺损伤评分参照文献[11]:根据肺泡间隔增宽、肺泡腔内纤维化渗出的严重度、血管周围炎细胞浸润的程度进行分类评分,根据病变程度分为:0分,正常;1分,轻度;2分,中度;3分,重度;4分,极重度。合并各项后记分。
6. 酶联免疫吸附法(ELISA)检测血清及肺泡灌洗液中炎症因子:取血清及肺泡灌洗液,TNF-α、IL-6、IL-1β按照试剂盒说明书检测,酶标仪450 nm波长检测吸光度(A450)值,根据标准曲线计算各因子表达。
7. Diff-Qick染色:根据试剂盒说明书进行,取肺泡灌洗液中的细胞沉淀,常规法制备细胞涂片,自然干燥,后用Diff-Quik Fixative固定20 s。Diff-QuikⅠ染色5~10 s。Diff-QuikⅡ染色10~20 s。显微镜下观察,二甲苯透明,封固、保存。
8. 细胞衰老相关β-半乳糖苷酶(senescence-associatedβ-galactosidase, SA-β-Gal)检测:按照试剂盒说明进行操作,肺组织冰冻切片,复温后用磷酸盐缓冲液(PBS)浸泡洗涤组织3次,每次不少于5 min;加入适当体积的SA-β-Gal染色固定液,室温固定15 min;PBS浸泡洗涤组织3次;加入染色工作液,37℃孵育过夜,镜下观察拍照。
9. 组织免疫化学染色:取肺组织石蜡切片,脱蜡、水化和抗原修复,封闭60 min,去封闭液,用稀释的特定一抗作用60 min,4℃过夜;去除一抗,加入HRP标记二抗避光孵育60 min,镜下观察拍照。
10. Western blot检测相关蛋白:按照试剂盒说明提取肺组织总蛋白,BCA法测定浓度。聚丙烯酰胺凝胶电泳分离、湿法转膜、脱脂牛奶封闭。一抗Nrf2、p-Nrf2 1 ∶2000稀释,p62 1 ∶3 000稀释,4℃过夜后二抗(1 ∶10 000稀释)室温孵育1 h,按照ECL化学发光试剂盒说明操作,ImageJ软件分析条带灰度值。
11. 统计学处理:利用GraphPad Prism8进行实验数据分析。数据符合正态分布,以x±s表示。组间比较采用独立样本t检验,多组数据比较经方差齐性检验后,采用单因素ANOVA方差分析。P < 0.05为差异有统计学意义。
结果1. 各组小鼠体重变化:对照组小鼠精神状态良好、饮水及进食量均正常,体重增加;模型组小鼠自辐照后第5~7天出现精神变差,饮水及进食量减少;第14天逐渐出现皮肤欠光泽,甚至背部区域脱毛现象,治疗组与模型组情况相似。与模型组比较,治疗组至第6周体重增加,差异具有统计学意义[(27.59±0.66)g vs. (28.83±0.60)g,t=3.09,P < 0.05]。
2. 肺组织病理学改变及评分:HE染色显示,对照组小鼠肺组织的肺泡壁较薄,肺泡结构清晰,毛细血管完整,无充血及水肿,也无炎症细胞浸润,给药组与对照组相似(图 1B);模型组小鼠肺组织以渗出性病变为主,肺组织间质明显水肿,肺泡隔增大,支气管周围出现炎性细胞浸润(图 1C);治疗组可见少许炎性细胞浸润,肺组织间质稍有水肿,肺泡壁毛细血管略充血,肺泡壁轻度增厚,整体较模型组明显减轻(图 1D);与模型组相比,治疗组的HE评分降低,差异具有统计学意义(7.4±0.55 vs. 4.4±0.55,t=8.66,P < 0.01)。

|
图 1 各组小鼠肺组织病理形态的改变 HE染色 ×100 A. 对照组;B. 给药组;C. 模型组;D. 治疗组 Figure 1 The pathological changes in lung tissue of mice at 6 weeks post-irradiation HE staining ×100 A. Control group; B. Racanisodamine group; C. Model group; D. Treatment group |
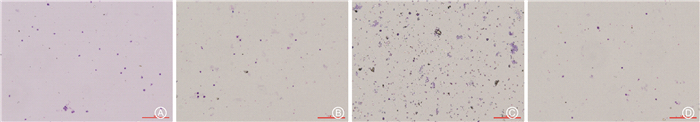
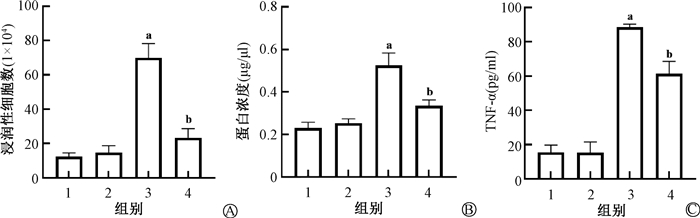
3. 肺泡灌洗液(bronchoalveolar lavage fluid, BALF)及全身炎症情况:Diff-Qick染色细胞显示,与对照组相比,模型组小鼠BALF中细胞明显增多(t=15.20,P < 0.01,图 2A、2B、图 3A);蛋白浓度升高(t=10.53,P < 0.01,图 3B),TNF-α显著升高(t=36.13,P < 0.01,图 3C);而消旋山莨菪碱可以显著减少BALF中的细胞数量(t=10.70,P < 0.01,图 2D、图 3A)、蛋白浓度(t=6.75,P < 0.01,图 3B)及炎性细胞因子分泌(t=8.21,P < 0.01,图 3C)。此外,与模型组相比,治疗组小鼠血清中TNA-α、IL-6、IL-1β等细胞因子的表达分泌明显减少(t=8.17、6.54、4.58,P < 0.01,表 1)。
|
图 2 各组小鼠肺泡灌洗液(BALF)的改变 Diff-Qick染色 ×100 A. 对照组;B. 给药组;C. 模型组;D. 治疗组 Figure 2 The changes of bronchoalveolar lavage fluid at 6 weeks post-irradiation Diff-Qick staining ×100 A. Control group; B. Racanisodamine group; C. Model group; D. Treatment group |
|
注:1. 对照组;2. 给药组;3. 模型组;4. 治疗组;a与对照组比较,t=15.20、10.53、36.13,P < 0.01;b与模型组比较,t=10.70、6.75、8.21,P < 0.05 图 3 各组小鼠肺泡灌洗液(BALF)中细胞、蛋白浓度及炎症因子改变 A. 浸润性细胞数;B. 蛋白浓度;C. TNF-α Figure 3 The changes of bronchoalveolar lavage fluid at 6 weeks post-irradiation A. Infiltrated cells; B. Protein concentration; C. TNF-α |
|
|
表 1 4组小鼠照射6周后血清炎症因子的表达(pg/ml,x±s) Table 1 Expression of serum inflammatory factors in each group at 6 weeks post-irradiation (pg/ml, x±s) |
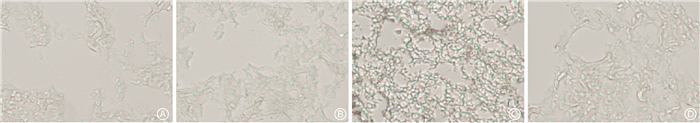
4. 肺组织细胞衰老:SA-β-gal活性的测定是鉴定细胞衰老最常用的方法之一。与对照组相比,模型组C57BL/6小鼠肺组织上皮细胞SA-β-gal活性明显增强(图 4A),细胞衰老明显,而治疗组SA-β-gal活性明显降低(图 4D),提示消旋山莨菪碱可以减少肺组织的细胞衰老。
|
图 4 各组小鼠肺组织细胞衰老情况 SA-β-Gal染色 ×400 A. 对照组;B. 给药组;C. 模型组;D. 治疗组 Figure 4 Cell senescence in the lung tissues of four group of mice SA-β-Gal staining ×400 A. Control group; B. Racanisodamine group; C. Model group; D. Treatment group |
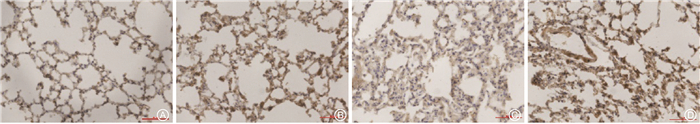
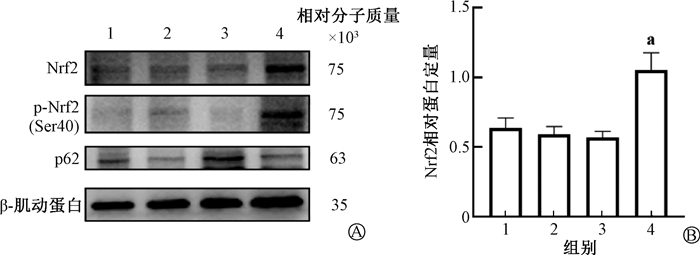
5. 肺组织Nrf2表达:Nrf2是抑制细胞衰老的重要靶标之一。免疫组织化学染色结果显示,与模型组相比,治疗组Nrf2的表达增强(图 5)。Western blot也显示,Nrf2及磷酸化Nrf2的蛋白表达增加(t=6.42、7.30,P < 0.01),说明Nrf2入核量增加。此外,还发现治疗组与自噬相关的p62表达降低,差异具有统计学意义(t=4.62, P < 0.01),见图 6。
|
图 5 消旋山莨菪碱对Nrf2活性的影响 免疫组织化学染色 ×100 A. 对照组;B. 给药组;C. 模型组;D. 治疗组 Figure 5 Effect of racanisodamine on the activity of Nrf2 Immunohistochemistry ×100 A. Control group; B. Racanisodamine group; C. Model group; D. Treatment group |
|
注:1. 对照组;2. 给药组;3. 模型组;4. 治疗组;a与模型组比较,t=6.42,P < 0.01 图 6 消旋山莨菪碱对Nrf2、p-Nrf2及p62蛋白表达的影响 A. Western blot检测Nrf2、p-Nrf2、p62蛋白表达;B. Nrf2蛋白相对表达量 Figure 6 Effect of racanisodamine on the protein expressions of Nrf2, p-Nrf2 and p62 A. NRF2, p-NRF2 and p62 were detected by Western blot; B. Relative protein expression of Nrf2 |
讨论
RILI是照射后涉及多种细胞、细胞因子及信号通路的复杂网状动态反应过程。辐照导致肺泡屏障功能损伤,促炎性、促纤维化及促血管生成的细胞因子大量产生,使得一种非正常修复性的组织反应长期存在,最终导致慢性放射性肺损伤的发生[12]。
消旋山莨菪碱在急性肺损伤、急性肾损伤等疾病中也具有治疗前景,而其作用的发挥与其抗炎、抗氧化能力密切相关[8-10]。但目前尚无研究报道消旋山莨菪碱在RILI中的保护作用及其机制。本研究中,发现消旋山莨菪碱可以减轻RILI小鼠的肺组织及全身炎症,减少BALF中炎性细胞浸润及血清中TNF-α、IL-6、IL-1β分泌,RILI的急性反应阶段,上述细胞因子的持续分泌与DNA损伤及氧化压力有关,也与细胞衰老有关[13]。免疫细胞在肺部内稳态的调节过程中发挥了重要作用,辐照导致肺部免疫细胞特别是组织内原巨噬细胞大量减少,刺激免疫系统吸引外周循环系统的炎性细胞进入损伤部位,进一步导致免疫系统的调节失衡。本研究发现,消旋山莨菪碱可以减少BALF中浸润性炎性细胞的数量、蛋白浓度及TNF-α分泌,进一步说明了消旋山莨菪碱对炎症的缓解。
近年来,电离辐射导致的细胞衰老在RILI发生发展中的作用越来越受到广泛关注。SA-β-gal活性的测定是鉴定细胞衰老最常用的方法之一[14]。此外,衰老细胞表现出一种分泌多种细胞因子、趋化因子、基质金属蛋白酶及生长因子的表型,称为衰老细胞相关分泌表型(senescence associated secretory phenotype, SASP),包括IL-1、IL-6、TNF-α、CXCL1、CCL2、MMPs等。SASP因子常被作为细胞衰老的间接证据用于衰老细胞的鉴定[15]。本研究中,辐照组SA-β-gal染色阳性细胞比例增加,说明辐照导致了肺组织的细胞衰老,而消旋山莨菪碱可减少SA-β-gal染色阳性的细胞比例,提示消旋山莨菪碱可减轻辐照导致的细胞衰老。衰老细胞可通过多种机制促进RILI的发展,比如诱导肺泡表皮干细胞耗竭、诱导慢性氧化应激及炎症、破坏正常组织结构及功能[16-18]。目前,抑制细胞衰老和延缓机体衰老的分子靶标包括FoxO、SIRT和Nrf2等。其中,Nrf2是体内主要的氧化应激应答因子之一,其结合到抗氧化反应元件(antioxidant response elements, AREs)后以转录激活的形式激活多种抗氧化剂细胞保护性基因的表达[19];此外,Nrf2还可能与NF-κB相互作用以调节TNF-α等炎症因子的表达[20]。Nrf2通路与细胞衰老相关疾病密切相关[21-22],而Nrf2通路在RILI中也具有重要的保护作用[23-25]。Li等[26]研究发现,p62-Keap1-Nrf2通路的激活可通过抑制铁死亡发挥对RILI的保护作用。本研究中,消旋山莨菪碱增强了小鼠肺组织Nrf2的表达,促进了Nrf2的入核,减少了肺组织炎症因子分泌及增强肺组织抗氧化能力,结合上述SA-β-gal染色结果可以推测,消旋山莨菪碱很可能激活了Nrf2,从而抑制了细胞衰老,最终缓解了RILI。此外,本研究发现消旋山莨菪碱在激活Nrf2的同时,p62的表达减少,而p62蛋白是一种自噬底物蛋白,其表达水平通常与细胞内自噬水平成反比[27]。p62还能与Keap1竞争性结合Nrf2,促进Nrf2与Keap1的解离,从而促进Nrf2的表达,这也提示本研究中消旋山莨菪碱对于Nrf2的激活很可能与Keap1的p62依赖性自噬降解有关,但仍需更多实验验证。
综上,本研究发现消旋山莨菪碱可以减轻RILI,且这一作用可能与Nrf2通路的激活及减少的细胞衰老有关。该发现可能为RILI的深层发病机制及寻找RILI的新治疗策略提供理论依据。本研究还存在一定的缺陷,如动物辐照剂量及干预时间点单一,缺乏RILI在小鼠体内的进行性发展过程及相应的鉴定指标。此外,对于肺组织衰老细胞的来源鉴定及消旋山莨菪碱激活Nrf2的深层分子机制(抑制其降解或促进其表达)还需进一步实验验证。
利益冲突 研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突,排名无争议
作者贡献声明 郭浩淳、陈佳佳负责小鼠饲养及模型建立,免疫组织化学及蛋白印迹实验,并撰写论文;濮娟负责论文审阅;丁洲、郁汉旭协助小鼠模型建立时的靶区划定;董磊参与论文修改;张海军、王万鹏指导实验设计及论文修改
| [1] |
Féréol S, Fodil R, Pelle G, et al. Cell mechanics of alveolar epithelial cells (AECs) and macrophages (AMs)[J]. Respir Physiol Neurobiol, 2008, 163(1-3): 3-16. DOI:10.1016/j.resp.2008.04.018 |
| [2] |
Zhao L, Yee M, O'Reilly MA. Transdifferentiation of alveolar epithelial type Ⅱ to type Ⅰ cells is controlled by opposing TGF-β and BMP signaling[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(6): L409-418. DOI:10.1152/ajplung.00032.2013 |
| [3] |
王绿化, 傅小龙, 陈明, 等. 放射性肺损伤的诊断及治疗[J]. 中华放射肿瘤学杂志, 2015, 24(1): 4-9. Wang LH, Fu XL, Chen M, et al. Diagnosis and treatment of radiation induced lung injury[J]. Chin J Radiat Oncol, 2015, 24(1): 4-9. DOI:10.3760/cma.j.issn.1004-4221.2015.01.003 |
| [4] |
Poupko JM, Baskin SI, Moore E. The pharmacological properties of anisodamine[J]. J Appl Toxicol, 2007, 27(2): 116-121. DOI:10.1002/jat.1154 |
| [5] |
Li Z, Xu C, Tao Y, et al. Anisodamine alleviates lipopolysaccharide-induced pancreatic acinar cell injury through NLRP3 inflammasome and NF-κB signaling pathway[J]. J Recept Signal Transduct Res, 2020, 40(1): 58-66. DOI:10.1080/10799893.2020.1713808 |
| [6] |
Zhao X, Zhao B, Zhao Y, et al. Protective effect of anisodamine on bleomycin-induced acute lung injury in immature rats via modulating oxidative stress, inflammation, and cell apoptosis by inhibiting the JAK2/STAT3 pathway[J]. Ann Transl Med, 2021, 9(10): 859. DOI:10.21037/atm-21-1750 |
| [7] |
Zhang Y, Song D, Peng Z, et al. Anisodamine enhances macrophage M2 polarization through suppressing G9a-mediated interferon regulatory factor 4 silencing to alleviate lipopolysaccharide-induced acute lung injury[J]. J Pharmacol Exp Ther, 2022, 381(3): 247-256. DOI:10.1124/jpet.121.001019 |
| [8] |
Li YF, Xu BY, An R, et al. Protective effect of anisodamine in rats with glycerol-induced acute kidney injury[J]. BMC Nephrol, 2019, 20(1): 223. DOI:10.1186/s12882-019-1394-y |
| [9] |
Wan F, Du X, Liu H, et al. Protective effect of anisodamine hydrobromide on lipopolysaccharide-induced acute kidney injury[J]. Biosci Rep, 2020, 40(7): BSR20201812. DOI:10.1042/BSR20201812 |
| [10] |
Yuan X, Zheng Y, Chen C, et al. Anisodamine inhibits endoplasmic reticulum stress-associated TXNIP/NLRP3 inflammasome activation in rhabdomyolysis-induced acute kidney injury[J]. Apoptosis, 2017, 22(12): 1524-1531. DOI:10.1007/s10495-017-1414-y |
| [11] |
Zhang J, Cui R, Feng Y, et al. Serotonin exhibits accelerated bleomycin-induced pulmonary fibrosis through TPH1 knockout mouse experiments[J]. Mediators Inflamm, 2018, 2018: 7967868. DOI:10.1155/2018/7967868 |
| [12] |
Tsoutsou PG, Koukourakis MI. Radiation pneumonitis and fibrosis: mechanisms underlying its pathogenesis and implications for future research[J]. Int J Radiat Oncol Biol Phys, 2006, 66(5): 1281-1293. DOI:10.1016/j.ijrobp.2006.08.058 |
| [13] |
Beach TA, Groves AM, Williams JP, et al. Modeling radiation-induced lung injury: lessons learned from whole thorax irradiation[J]. Int J Radiat Biol, 2020, 96(1): 129-144. DOI:10.1080/09553002.2018.1532619 |
| [14] |
González-Gualda E, Baker AG, Fruk L, et al. A guide to assessing cellular senescence in vitro and in vivo[J]. FEBS J, 2021, 288(1): 56-80. DOI:10.1111/febs.15570 |
| [15] |
Shang D, Sun D, Shi C, et al. Activation of epidermal growth factor receptor signaling mediates cellular senescence induced by certain pro-inflammatory cytokines[J]. Aging Cell, 2020, 19(5): e13145. DOI:10.1111/acel.13145 |
| [16] |
Campisi J. Aging, cellular senescence, and cancer[J]. Annu Rev Physiol, 2013, 75: 685-705. DOI:10.1146/annurev-physiol-030212-183653 |
| [17] |
Childs BG, Durik M, Baker DJ, et al. Cellular senescence in aging and age-related disease: from mechanisms to therapy[J]. Nat Med, 2015, 21(12): 1424-1435. DOI:10.1038/nm.4000 |
| [18] |
Muñoz-Espín D, Serrano M. Cellular senescence: from physiology to pathology[J]. Nat Rev Mol Cell Biol, 2014, 15(7): 482-496. DOI:10.1038/nrm3823 |
| [19] |
Lewis KN, Mele J, Hayes JD, et al. Nrf2, a guardian of healthspan and gatekeeper of species longevity[J]. Integr Comp Biol, 2010, 50(5): 829-843. DOI:10.1093/icb/icq034 |
| [20] |
Sivandzade F, Prasad S, Bhalerao A, et al. NRF2 and NF-κB interplay in cerebrovascular and neurodegenerative disorders: Molecular mechanisms and possible therapeutic approaches[J]. Redox Biol, 2019, 21: 101059. DOI:10.1016/j.redox.2018.11.017 |
| [21] |
Yang J, Li J, Suzuki K, et al. Genetic enhancement in cultured human adult stem cells conferred by a single nucleotide recoding[J]. Cell Res, 2017, 27(9): 1178-1181. DOI:10.1038/cr.2017.86 |
| [22] |
Kubben N, Zhang W, Wang L, et al. Repression of the antioxidant NRF2 pathway in premature aging[J]. Cell, 2016, 165(6): 1361-1374. DOI:10.1016/j.cell.2016.05.017 |
| [23] |
Traver G, Mont S, Gius D, et al. Loss of Nrf2 promotes alveolar type 2 cell loss in irradiated, fibrotic lung[J]. Free Radic Biol Med, 2017, 112: 578-586. DOI:10.1016/j.freeradbiomed.2017.08.026 |
| [24] |
Travis EL, Rachakonda G, Zhou X, et al. NRF2 deficiency reduces life span of mice administered thoracic irradiation[J]. Free Radic Biol Med, 2011, 51(6): 1175-1183. DOI:10.1016/j.freeradbiomed.2011.05.038 |
| [25] |
Tian X, Wang F, Luo Y, et al. Protective role of nuclear factor-erythroid 2-related factor 2 against radiation-induced lung injury and inflammation[J]. Front Oncol, 2018, 8: 542. DOI:10.3389/fonc.2018.00542 |
| [26] |
Li X, Chen J, Yuan S, et al. Activation of the P62-Keap1-NRF2 pathway protects against ferroptosis in radiation-induced lung injury[J]. Oxid Med Cell Longev, 2022, 2022: 8973509. DOI:10.1155/2022/8973509 |
| [27] |
Kumar AV, Mills J, Lapierre LR. Selective autophagy receptor p62/SQSTM1, a pivotal player in stress and aging[J]. Front Cell Dev Biol, 2022, 10: 793328. DOI:10.3389/fcell.2022.793328 |
 2023, Vol. 43
2023, Vol. 43


