放射治疗是临床乳腺癌治疗的重要组成部分。但是,肿瘤辐射抵抗严重阻碍了乳腺癌放射治疗的疗效和应用。因此,探索涉及乳腺癌辐射抵抗的机制至关重要。miRNAs(microRNAs)是由19~25个核苷酸组成的非编码RNA分子[1],能够通过结合靶基因mRNAs的3′ UTR发挥生物学功能[2]。相关研究报道提示,miR-27b-3p与乳腺癌的增殖、迁移、侵袭、转移和耐药性密切相关[3-5]。然而,miR-27b-3p是否参与乳腺癌的辐射抵抗尚不清楚。前期研究显示,PLK2是miR-27b-3p的一种潜在靶蛋白。PLK2属于Polo样激酶(Polo-like kinases,PLKs)家族。PLKs家族在真核生物中高度保守[6]。PLK2还是p53依赖性蛋白[7],被证实在血液肿瘤、结直肠癌和肺癌中发挥抑制肿瘤的作用[8-11]。Cao等[12]研究发现,敲除PLK2能够抑制神经胶质瘤细胞增殖和诱导细胞凋亡。PLK2通过Notch信号通路与胶质母细胞瘤对替莫唑胺获得性耐药有关[13]。但是,PLK2在乳腺癌中是否参与抗辐射作用仍不清楚。本研究旨在探讨miR-27b-3p在乳腺癌辐射抵抗中的作用及其机制。
材料与方法1. 生物信息学分析:通过基因表达(Gene Expression Omnibus,GEO,美国)数据库分析miR-27b-3p在正常组织和乳腺癌组织中的表达水平。根据癌症基因组图谱(TCGA)数据库分析人乳腺癌样本中PLK2的mRNA表达水平。
2. 细胞培养:人正常乳腺上皮细胞MCF-12A、乳腺癌细胞系MCF-7和MDA-MB-231、人胚肾上皮细胞293T均购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),用DMEM培养基(Biological Industries,以色列)加1%青霉素/链霉素(北京Solarbio公司)和10% 胎牛血清(FBS,北京Solarbio公司)在37℃、5% CO2条件下培养。
3. 辐照方法:用铯源Gammacell® 40 Exactor机器(加拿大原子能有限公司)进行γ射线照射,剂量率为0.88 Gy/min。
4. 建立MCF-7R细胞系:将MCF-7细胞按照1×103/孔的密度接种到6孔板,待细胞贴壁后进行2 Gy的γ射线照射处理。2周后,用胰蛋白酶将辐照过的细胞消化为单细胞悬液,再次接种到6孔板,直到细胞克隆形成。重复上述步骤,辐射剂量依次为4、6、8 Gy,当细胞稳定传代后,扩大细胞培养进行后续实验。
5. 质粒构建:将miR-27b-3p序列克隆到pRNAT-U6.1/Neo载体(Clonetech,美国)构建成miR-27b-3p过表达质粒。抗miR-27b-3p(HmiR-AN0361-AM02)购自广州GeneCopoeia公司。将人PLK2基因的CDS序列克隆到pEGFP-C1载体(Clonetech,美国)构建过表达PLK2的质粒。将PLK2的shRNA序列克隆到pRNAT-U6.1/Neo载体上,构建PLK2干扰质粒,shRNA的序列如下:5′-CCGGGCACAGAGATCTCAAACTAGGCTCGAGCCTAGTTTGAGATCTCTGTGCTTTTT-3′,PLK2干扰载体1组;5′-CCGGGTGACGGTGCTGAAATACTTTCTCGAGAAAGTATTTCAGCACCGTCACTTTTT-3′,PLK2干扰载体2组。将PLK2 mRNA的3′UTR上miR-27b-3p对应的靶点序列克隆到pGL3-Control质粒中,命名为pGL3-PLK2-wt;将含有PLK2 mRNA的3′UTR上miR-27b-3p对应靶点突变序列的质粒命名为pGL3-PLK2-mut。质粒均由苏州Genewiz公司合成。使用Lipofectamine 3000 (美国Invitrogen公司)对细胞进行瞬时转染。
6. 实时荧光定量PCR(qRT-PCR):用TRIzol试剂(美国Invitrogen公司)提取细胞总RNA,用poly(A)聚合酶(美国Thermo Fisher公司)进行加尾。然后用PrimeScript反转录酶试剂盒(TaKaRa,日本)进行反转录。qRT-PCR操作参考文献[14]进行。本研究中使用的引物序列见表 1。
|
|
表 1 qRT-PCR引物序列 Table 1 Primer sequences used for qRT-PCR |
7. 蛋白免疫印迹法(Western blot):收集MCF-7细胞后,用蛋白裂解缓冲液(上海Beyotime公司)和蛋白酶抑制剂cooktail(瑞士Roche公司)在冰上裂解30 min。用蛋白质浓度测定试剂盒(北京TransGen Biotech公司)测定总蛋白浓度。将等量的蛋白质与4×缓冲液(北京Solarbio公司)混合,用10%浓度的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。然后,将分离后的蛋白转移到PVDF膜上(美国Millipore公司)。用5%的牛血清白蛋白(北京Solarbio公司)封闭1 h,在4℃下用PLK2一抗(1 ∶1 000,美国CST公司)和GAPDH一抗(1 ∶ 5 000,美国Proteintech公司)孵育过夜。PBS洗两次,随后用辣根过氧化物酶标记的二抗(1 ∶5 000,美国Proteintech公司)孵育1 h,用PBS洗3次。采用电化学发光法(ECL)对膜上的蛋白质信号进行曝光,凝胶成像系统拍照,用ImageJ软件分析图像。
8. 细胞克隆形成:将4 Gy照射后的MCF-7和MCF-7R细胞消化悬浮,按照1×103个细胞每孔的密度接种到6孔板,连续培养2周直到克隆形成。用甲醇固定细胞克隆,结晶紫染色后拍照计数。
9. 免疫荧光检测:将MCF-7细胞转染miR-27b-3p、miR-27b-3p+PLK2,MCF-7R细胞转染anti-miR27b-3p、anti-miR-27b-3p+shPLK2。处理后接种在24孔板中,照射前培养24 h。4 Gy照射后,采用4%多聚甲醛固定细胞30 min,用0.25% Triton X-100处理30 min。用5%的牛血清白蛋白(BSA)封闭1 h。将细胞与γ-H2AX(1 ∶1 000,CST)在室温下孵育1 h,二抗(与Alexa 488结合的兔单抗,CST,1 ∶2 000)孵育30 min。用10 μg/ml DAPI溶液对细胞核进行染色。封片处理后,用共聚焦显微镜LSM880成像,统计γ-H2AX病灶。
10. 5-乙炔基-2′-脱氧尿苷(EDU)检测:MCF-7细胞转染miR-27b-3p,MCF-7R细胞转染anti-miR27b-3p。处理24 h后,将4×105个细胞接种到24孔板,培养12 h,用4 Gy剂量照射,培养24 h。用EDU试剂盒(广州Ribobio公司)按照说明检测细胞增殖能力。
11. 荧光素酶报告基因检测:本研究选用细胞转染效率高且在荧光素酶报告基因检测系统中成熟应用的293T细胞做荧光素酶报告基因检测。将293T细胞接种到24孔板中,用200 ng pRL-TK和pGL3-PLK2-wt或pGL3-PLK2-mut质粒转染细胞。使用双荧光素酶报告基因试剂盒(北京TransGen Biotech公司)进行检测。
12. 统计学处理:应用SPSS 19.0软件进行统计分析。计量资料符合正态分布,以x±s表示。采用独立样本t检验比较组间差异。P<0.05为差异有统计学意义。
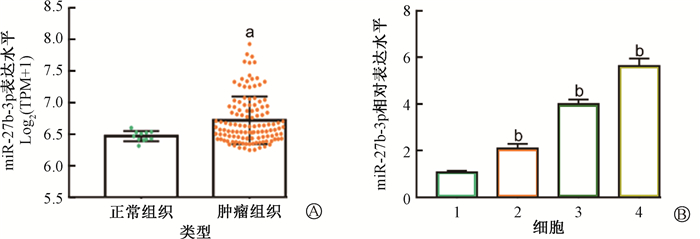
结果1. miR-27b-3p在乳腺组织和乳腺癌细胞中高水平表达:基于GSE58606数据分析,miR-27b-3p在乳腺癌细胞中的表达水平比正常乳腺组织显著升高(t=2.99,P < 0.01,图 1A)。与人乳腺上皮细胞MCF-12A相比,miR-27b-3p在乳腺癌细胞(MCF-7、MDA-MB-231和MCF-7R)中表达水平均明显升高(t=21.21、32.88、25.63,P < 0.05,图 1B),而且miR-27b-3p在MCF-7R细胞中的表达水平显著高于在MCF-7中的转录水平,表明miR-27b-3p可能在乳腺癌中发挥潜在的抗辐射作用。结合miR-27b-3p在乳腺癌细胞系中的相对高水平表达,在本研究中,选择MCF-7和MCF-7R细胞完成miR-27b-3p相关的功能实验。
|
注:1. MCF-12A;2. MCF-7;3. MDA-MB-231;4. MCF-7R。a与正常组织相比,t=2.99,P < 0.01;b与MCF-12A相比,t=21.21、32.88、25.63,P < 0.05 图 1 miR-27b-3p在乳腺癌组织和乳腺癌细胞系中被上调 A. GEO数据库GSE58606中miR-27b-3p在正常组织和乳腺癌组织中的表达水平;B. qRT-PCR检测miR-27b-3p的表达水平 Figure 1 miR-27b-3p expression levels in breast cancer tissues and breast cancer cell lines A. The expression level of miR-27b-3p in the breast cancer tissues and paracancerous normal tissues in the dataset GSE58606 of GEO database; B. qRT-PCR assay of the expression levels of miR-27b-3p in the breast cancer cell lines and normal breast epithelial cells |
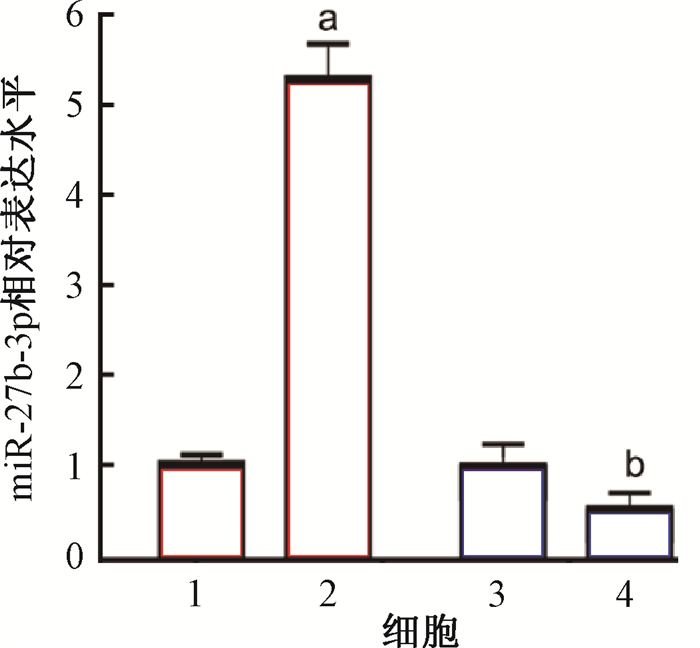
2. miR-27b-3p增强乳腺癌细胞的辐射抗性:为了研究miR-27b-3p在乳腺癌细胞中是否影响辐射敏感性,在MCF-7细胞中过表达miR-27b-3p,在MCF-7R细胞中干扰miR-27b-3p的表达,qRT-PCR检测结果显示,在转染miR-27b-3p后,MCF-7细胞中miR-27b-3p的转录水平显著升高(t=9.64,P < 0.05),在干扰miR-27b-3p后,MCF-7R细胞的miR-27b-3pd的转录水平显著降低(t=6.42,P < 0.05),如图 2所示。
|
注:1. MCF-7;2. 过表达miR-27b-3p的MCF-7;3. MCF-7R;4.干扰miR-27b-3p的MCF-7R。a与MCF-7比较,t=9.64,P < 0.05;b与MCF-7R比较,t=6.42,P < 0.05 图 2 qRT-PCR检测不同处理后miR-27b-3p在乳腺癌细胞中的表达水平 Figure 2 The expression levels of miR-27b-3p in the breast cancer cells after indicated treatment |
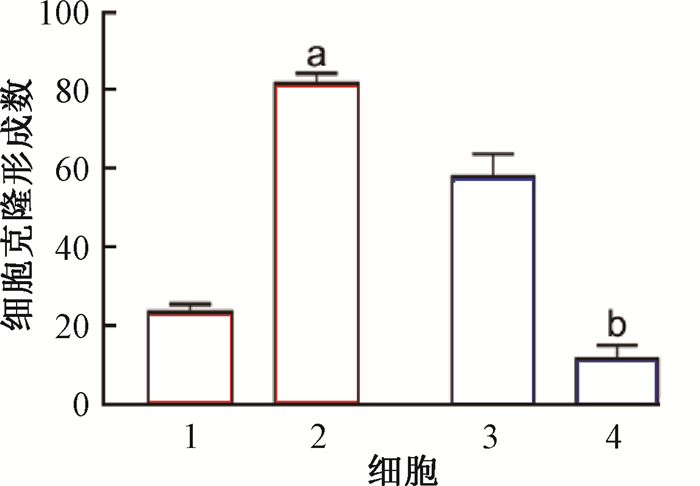
细胞克隆形成结果显示,用4 Gy剂量辐照细胞后,过表达miR-27b-3p明显增加了MCF-7细胞克隆形成数(t=10.32,P < 0.05),而干扰miR-27b-3p则显著抑制MCF-7R细胞克隆形成数(t=40.00,P < 0.05),如图 3所示。
|
注:1. MCF-7;2. 过表达miR-27b-3p的MCF-7;3. MCF-7R;4. 干扰miR-27b-3p的MCF-7R。a与MCF-7比较,t=10.32,P < 0.05;b与MCF-7R比较,t=40.00,P < 0.05 图 3 4 Gy γ射线照射各组细胞克隆形成结果 Figure 3 The cloning formation of breast cancer cells after 4 Gy γ-rays irradiation |
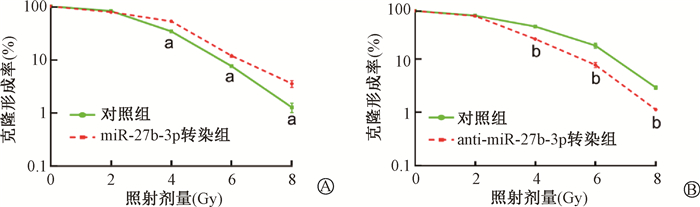
随着剂量(0、2、4、6、8 Gy)的增加,miR-27b-3p对乳腺癌细胞MCF-7增殖能力的保护效应逐渐凸显(t=8.77、8.26、8.03,P < 0.05,图 4A),而降低miR-27b-3p的表达则进一步削弱了MCF-7R细胞的增殖能力(t=8.54、8.32、8.23,P < 0.05,图 4B)。
|
注:与MCF-7对照组相比,at=8.77、8.26、8.03,P < 0.05;与MCF-7R对照组相比,b t=8.54、8.32、8.23,P < 0.05 图 4 不同剂量γ射线照射后两种细胞克隆形成结果 A. MCF-7;B. MCF-7R Figure 4 The survival of the irradiated breast cancer cells with indicated treatment A. MCF-7 cells; B. MCF-7R cells |
与对照组相比,过表达miR-27b-3p可减少MCF-7细胞中γ-H2AX病灶的数量(t=10.12,P < 0.05);相反,干扰miR-27b-3p可增加MCF-7R细胞中γ-H2AX病灶的数量(t=10.96,P < 0.05),如图 5所示。
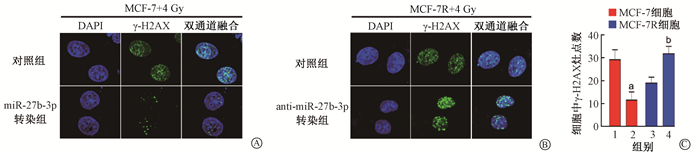
|
注:1.MCF-7对照组;2. MCF-7过表达miR-27b-3p组;3. MCF-7R对照组;4. MCF-7R干扰miR-27b-3p组。a与组1相比,t=10.12,P < 0.05;b与组3相比,t=10.96,P < 0.05 图 5 两种细胞4 Gy γ射线照射后γ-H2AX免疫荧光结果 ×400 A.MCF-7;B.MCF-7R;C. γ-H2AX染色灶点数统计结果 Figure 5 γ-H2AX immunofluorescence of the breast cancer cells after 4 Gy γ-ray irradiation ×400 A. MCF-7 cells; B. MCF-7R cells; C. Statistical data of the number of γ-H2AX foci |
这些实验结果表明,miR-27b-3p可抑制辐照乳腺癌细胞的DNA损伤。如图 6所示,5-乙炔基-2′-脱氧尿苷(EDU)实验结果进一步证实上述结果,miR-27b-3p确实可以改变乳腺癌细胞的放射敏感性。这些结果表明,miR-27b-3p增强了乳腺癌细胞的辐射抗性。
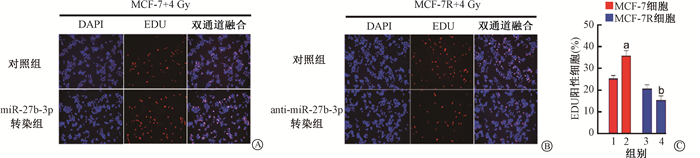
|
注:1.MCF-7对照组;2. MCF-7过表达miR-27b-3p组;3. MCF-7R对照组;4. MCF-7R干扰miR-27b-3p组。a与组1相比,t=3.32,P < 0.05;b与组3相比,t=2.82,P < 0.05 图 6 两种细胞4 Gy γ射线照射后EDU染色结果 ×200 A.MCF-7;B.MCF-7R;C.EDU染色统计结果 Figure 6 Representative images of EDU staining cells after 4 Gy γ-ray irradiation ×200 A. MCF-7 cells; B. MCF-7R cells; C. The percentage of EDU-positive cells |
3. PLK2是miR-27b-3p的靶基因:为了筛选miR-27b-3p的潜在靶向基因,本研究选用Miranda、PicTar和Targetscan 3个数据库进行分析。在3个数据库中共同出现的候选基因有8个,即NOVA1、PLK2、SNAP25、MAP2K4、GPAM、SLC6A1、TXN2和GRB2(图 7A)。将其中5个在乳腺癌组织中低水平表达的基因(NOVA1、PLK2、SNAP25、GPAM、TXN2)进行分析筛选。结果显示,MCF-7R细胞过表达miR-27b-3p后,PLK2明显降低(t=17.00、49.37、25.49、10.29,P < 0.05,图 7B)。随后,对miR-27b-3p在PLK2 mRNA的3′UTR上的结合位点进行预测分析,并构建PLK2野生型和突变型载体(图 7C)。荧光素酶报告基因检测结果显示,与突变体相比,过表达miR-27b-3p明显降低pGL3-PLK2-wt的荧光活性(t=5.14、6.28,P < 0.05,图 7D),而抑制miR-27b-3p能够增加pGL3-PLK2-wt荧光活性,但对突变体没有明显影响(t=7.34、26.77,P < 0.05,图 7E)。这些结果表明,miR-27b-3p可直接结合PLK2的3′ UTR,PLK2是miR-27b-3p的一个重要靶基因。
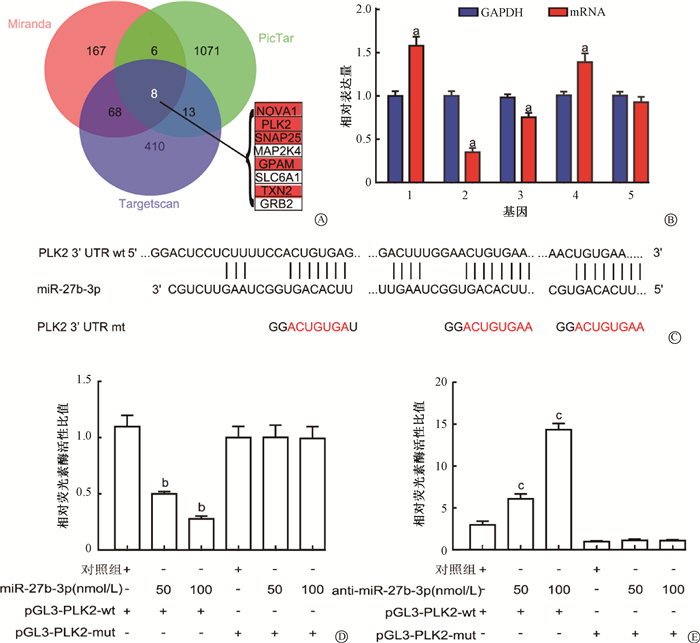
|
注:1. NOVA1;2. PLK2;3. SNAP25;4. GPAM;5. TXN2。a MCF-7R细胞中,与内参GAPDH相比,t=17.00、49.37、25.49、10.29,P < 0.05;b与对照组相比,t=5.14、6.28,P < 0.05;c与对照组相比,t=7.34、26.77,P < 0.05 图 7 miR-27b-3p通过3′UTR结合靶向PLK2 A. 维恩图;B. qRT-PCR检测基因表达水平;C. miR-27b-3p与PLK2的3′UTR靶向示意图;D、E. MCF-7过表达、抑制miR-27b-3p双荧光素酶报告基因检测结果 Figure 7 PLK2 was the target of miR-27b-3p by directly binding to its 3′UTR A. The Venn diagram; B. The qRT-PCR assay; C. The interaction diagram of PLK2 and miR-27b-3p; D, E. The dual-luciferase reporter assay of the cells with MCF-7 overexpression and/or miR-27b-3p inhibition |
4. PLK2在乳腺癌组织和乳腺癌细胞中低水平表达:对PLK2在乳腺癌组织和细胞中的表达水平进行了检测,通过分析TCGA数据库结果显示,PLK2在乳腺癌组织中的表达水平低于正常乳腺组织(t=2.77,P < 0.01,图 8A)。qRT-PCR结果显示,与乳腺上皮细胞MCF-12A相比,PLK2在乳腺癌细胞(MCF-7、MDA-MB-231和MCF-7R)中的表达水平较低(t=25.48、10.54、25.90,P < 0.05,图 8B)。这些结果表明,PLK2在乳腺癌组织和乳腺癌细胞中呈现低水平表达。
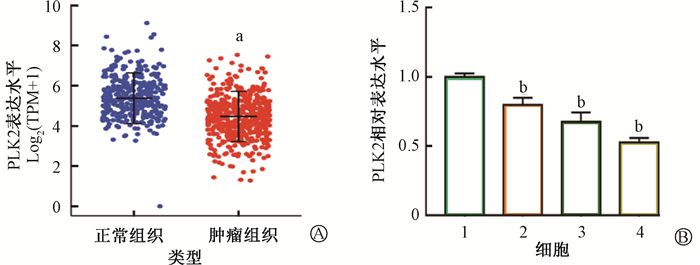
|
注:1. MCF-12A;2. MCF-7;3. MDA-MB-231;4. MCF-7R。a与正常组织相比,t=2.77,P < 0.01;b与MCF-12A组相比,t=25.48、10.54、25.90,P < 0.05 图 8 PLK2在乳腺癌组织和乳腺癌细胞中低水平表达 A. 基于TCGA数据库分析PLK2在正常组织和乳腺癌组织中的表达水平;B. qRT-PCR检测PLK2的表达水平 Figure 8 PLK2 had a low expression level in the breast cancer tissues and breast cancer cells A. The expression levels of PLK2 in the breast cancer tissues and paracancerous normal tissues obtained from TCGA database; B. qRT-PCR assay of the expression level of PLK2 in different breast cells |
5. PLK2逆转miR-27b-3p介导的乳腺癌细胞辐射抵抗:为了明确PLK2是否参与乳腺癌细胞辐射抵抗以及是否与miR-27b-3p存在相关性,采用PLK2拯救实验进行了验证。首先,构建PLK2干扰载体并验证其干扰效果,如图 9所示。PLK2干扰载体2组干扰效率较好,后续实验选择2组干扰载体进行实验。

|
注:1. MCF-7对照组;2. PLK2干扰载体1组;3. PLK2干扰载体2组 图 9 Western blot检测PLK2干扰载体效率 Figure 9 Western blot assay of PLK2 protein after PLK2 interfering |
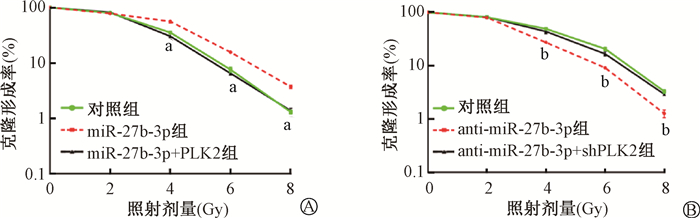
细胞克隆形成实验结果显示,随着辐照剂量(0、2、4、6、8 Gy)的增加,PLK2对miR-27b-3p介导的乳腺癌细胞辐射抵抗逆转趋势更大(MCF-7:t=8.34、8.45、8.24,P < 0.05;MCF-7R:t=8.53、8.36、8.15,P < 0.05,图 10)。
|
注:a与MCF-7对照组相比,t=8.34、8.45、8.24,P < 0.05;b与MCF-7R对照组相比,t=8.53、8.36、8.15,P < 0.05 图 10 两种细胞不同剂量照射后细胞克隆形成结果 A. MCF-7;B. MCF-7R Figure 10 Survival of irradiated breast cancer cells with indicated treatment A. MCF-7 cells; B. MCF-7R cells |
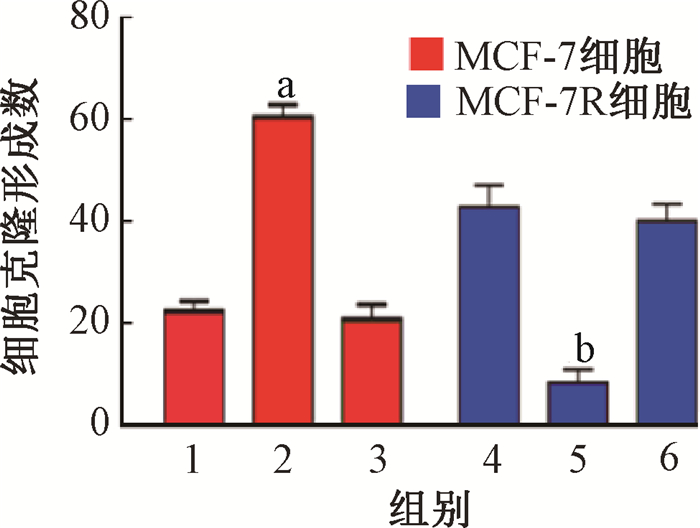
用4 Gy剂量辐照不同方式处理的MCF-7和MCF-7R细胞,结果显示,PLK2能够反转miR-27b-3p介导的乳腺癌细胞辐射抵抗(MCF-7:t=9.66,P < 0.05;MCF-7R:t=6.42,P < 0.05,图 11)。
|
注:1.MCF-7对照组;2. MCF-7 miR-27b-3p转染组;3. MCF-7 miR-27b-3p+PLK2转染组;4.MCF-7R对照组;5. MCF-7R anti-miR-27b-3p转染组;6. MCF-7R anti-miR-27b-3p+shPLK2转染组。与组1相比,a t=9.66,P < 0.05;与组4相比,bt=6.42,P < 0.05 图 11 两种细胞4 Gy γ射线照射后克隆形成结果 Figure 11 Cloning formation of 4 Gy irradiated breast cancer cells with indicated treatment |
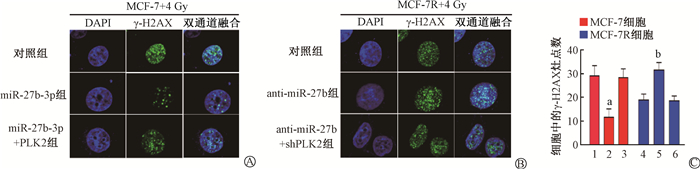
与对照组相比,过表达miR-27b-3p可减少MCF-7细胞中γ-H2AX病灶的数量(t=10.23,P < 0.05);相反,干扰miR-27b-3p可增加MCF-7R细胞中γ-H2AX病灶的数量(t=10.17,P < 0.05),如图 12所示。因此,PLK2确实可以逆转miR-27b-3p介导的乳腺癌细胞辐射抵抗。
|
注:1.MCF-7对照组;2. MCF-7 miR-27b-3p转染组;3. MCF-7 miR-27b-3p+PLK2转染组;4.MCF-7R对照组;5. MCF-7R anti-miR-27b-3p转染组;6. MCF-7R anti-miR-27b-3p+shPLK2转染组。a与组1相比,t=10.23,P < 0.05;b与组4相比,t=10.17,P < 0.05 图 12 两种细胞4 Gy γ射线照射后γ-H2AX免疫荧光结果 ×400 A. MCF-7;B. MCF-7R;C. γ-H2AX染色灶点数统计结果 Figure 12 Representative images of γ-H2AX staining of breast cancer cells after 4 Gy γ-ray irradiation ×400 A. MCF-7 cells; B. MCF-7R cells; C. The number of γ-H2AX foci |
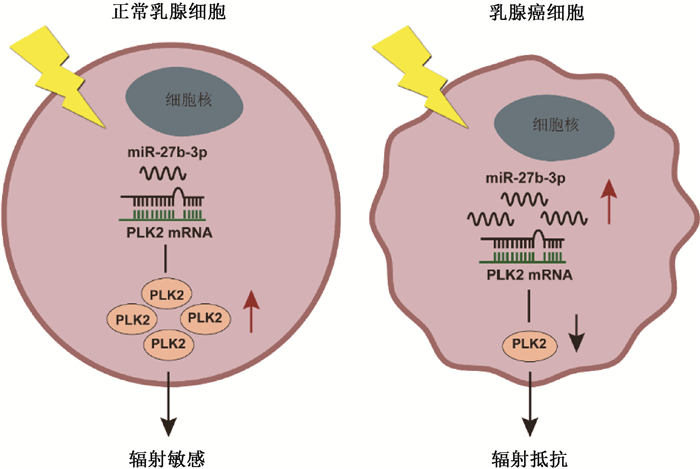
以上结果提示,miR-27b-3p通过靶向PLK2促进乳腺癌细胞的辐射抵抗(图 13)。
|
图 13 miR-27b-3p通过靶向PLK2促进乳腺癌细胞的辐射抵抗示意图 Figure 13 Schematic diagram showing that miR-27b-3p enhances the radioresistance of breast cancer cells by targeting PLK2 |
讨论
放射治疗是乳腺癌治疗的常规手段之一。乳腺癌放疗的效果与其放射敏感性相关,由于乳腺癌细胞对射线的抵抗而引起肿瘤复发和转移往往导致治疗失败[15-16],因此,对放射抵抗的分子机制仍需不断探索。本研究中,对miR-27b-3p及其靶向基因PLK2在乳腺癌细胞中发挥电离辐射抵抗的作用和分子机制进行了探讨,为乳腺癌放疗抵抗的分子机制提供了理论依据。
miRNA是一种19~25 bp长度的非编码RNA,在多种生物学过程中发挥作用。不同表达的miRNAs可以影响乳腺癌的辐射反应,通过调节辐射诱导的信号通路,包括表皮生长因子受体(EGFR)信号、DNA损伤应答、细胞周期停滞、细胞凋亡和自噬提高乳腺癌细胞的辐射敏感性[17-18]。研究表明,miR-27b-3p在乳腺癌中具有致癌性的作用,在体外和体内模型中研究发现,miR-27b-3p通过靶向NR5A2和CREB1能够抑制乳腺癌的他莫昔芬抗性[4, 19]。本研究发现,miR-27b-3p在乳腺癌中呈高水平表达,在抗辐射细胞系MCF-7R中的表达水平显著高于MCF-7细胞。细胞克隆形成实验结果证实了在MCF-7细胞中过表达miR-27b-3p促进了抗辐射性,而干扰miR-27b-3p可以抑制MCF-7R乳腺癌细胞对辐射的抵抗。
PLK2是Polo样激酶家族成员,参与早期有丝分裂、细胞周期和DNA损伤[20-22]。DNA损伤是辐射的主要细胞效应。为了应对DNA损伤,细胞激活DNA损伤应答以感知损伤并启动DNA修复。DNA损伤反应机制的缺陷和全基因组的miRNA表达抑制目前被认为是许多人类癌症的特征。由DNA损伤信号调节的miRNA和调节DNA损伤反应的miRNA对肿瘤的发生和发展都有一定的影响。PLK2在多种癌症中发挥致癌基因的功能[6, 11]。PLK2还具有抗凋亡作用,参与结直肠癌的化疗抵抗[23]。本研究中,通过生物信息学数据库筛选和荧光素酶报告基因方法证实,PLK2是miR-27b-3p的一个靶基因。PLK2在乳腺癌组织和乳腺癌细胞中呈较低水平表达,特别是在MCF-7R细胞中。进一步说明PLK2与乳腺癌的辐射抵抗有潜在的相关性。在本研究中,过表达PLK2能够逆转miR-27b-3p介导的乳腺癌辐射抵抗作用,证实PLK2参与乳腺癌的辐射抵抗。
综上所述,本研究在细胞水平证实了miR-27b-3p增强乳腺癌的辐射抵抗能力,而且靶向蛋白基因PLK2起到了重要的调节作用。本实验的一个不足是仅在细胞水平上进行了研究,模型单一,因此希望通过动物体内实验加以验证,这将在后续研究中进一步探索。总之,本研究结果为乳腺癌辐射抵抗的基础研究和临床放疗研究提供了一个新的思路和研究基础。
利益冲突 无
作者贡献声明 张松灵负责实验操作,分析实验数据,撰写论文;朱长春参与实验操作;冯国兴、樊赛军负责研究设计
| [1] |
He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation[J]. Nat Rev Genet, 2004, 5(7): 522-531. DOI:10.1038/nrg1379 |
| [2] |
Pan D, Du Y, Li R, et al. miR-29b-3p increases radiosensitivity in stemness cancer cells via modulating oncogenes axis[J]. Front Cell Dev Biol, 2021, 9: 741074. DOI:10.3389/fcell.2021.741074 |
| [3] |
Chen D, Si W, Shen J, et al. miR-27b-3p inhibits proliferation and potentially reverses multi-chemoresistance by targeting CBLB/GRB2 in breast cancer cells[J]. Cell Death Dis, 2018, 9(2): 188. DOI:10.1038/s41419-017-0211-4 |
| [4] |
Zhu J, Zou Z, Nie P, et al. Downregulation of microRNA-27b-3p enhances tamoxifen resistance in breast cancer by increasing NR5A2 and CREB1 expression[J]. Cell Death Dis, 2016, 7(11): e2454. DOI:10.1038/cddis.2016.361 |
| [5] |
Shen SJ, Song Y, Ren XY, et al. MicroRNA-27b-3p promotes tumor progression and metastasis by inhibiting peroxisome proliferator-activated receptor gamma in triple-negative breast cancer[J]. Front Oncol, 2020, 10: 1371. DOI:10.3389/fonc.2020.01371 |
| [6] |
Wang CH, Lu TJ, Wang LK, et al. Tazarotene-induced gene 1 interacts with Polo-like kinase 2 and inhibits cell proliferation in HCT116 colorectal cancer cells[J]. Cell Biol Int, 2021, 45(11): 2347-2356. DOI:10.1002/cbin.11681 |
| [7] |
Kim JH, Lee JO, Lee SK, et al. Celastrol suppresses breast cancer MCF-7 cell viability via the AMP-activated protein kinase (AMPK)-induced p53-polo like kinase 2 (PLK-2) pathway[J]. Cell Signal, 2013, 25(4): 805-813. DOI:10.1016/j.cellsig.2012.12.005 |
| [8] |
Smith P, Syed N, Crook T. Epigenetic inactivation implies a tumor suppressor function in hematologic malignancies for Polo-like kinase 2 but not Polo-like kinase 3[J]. Cell Cycle, 2006, 5(12): 1262-1264. DOI:10.4161/cc.5.12.2813 |
| [9] |
Syed N, Smith P, Sullivan A, et al. Transcriptional silencing of Polo-like kinase 2 (SNK/PLK2) is a frequent event in B-cell malignancies[J]. Blood, 2006, 107(1): 250-256. DOI:10.1182/blood-2005-03-1194 |
| [10] |
Han T, Lin J, Wang Y, et al. Forkhead box D1 promotes proliferation and suppresses apoptosis via regulating polo-like kinase 2 in colorectal cancer[J]. Biomed Pharmacother, 2018, 103: 1369-1375. DOI:10.1016/j.biopha.2018.04.190 |
| [11] |
Deng S, Lu X, Zhang Z, et al. Identification and assessment of PLK1/2/3/4 in lung adenocarcinoma and lung squamous cell carcinoma: Evidence from methylation profile[J]. J Cell Mol Med, 2021, 25(14): 6652-6663. DOI:10.1111/jcmm.16668 |
| [12] |
Cao F, Xia X, Fan Y, et al. Knocking down of Polo-like kinase 2 inhibits cell proliferation and induced cell apoptosis in human glioma cells[J]. Life Sci, 2021, 270(11): 119084. DOI:10.1016/j.lfs.2021.119084 |
| [13] |
Alafate W, Xu D, Wu W, et al. Loss of PLK2 induces acquired resistance to temozolomide in GBM via activation of notch signaling[J]. J Exp Clin Cancer Res, 2020, 39(1): 239. DOI:10.1186/s13046-020-01750-4 |
| [14] |
Zhu C, Ge C, He J, et al. Identification of key genes and pathways associated with irradiation in breast cancer tissue and breast cancer cell lines[J]. Dose Response, 2020, 18(2): 1559325820931252. DOI:10.1177/1559325820931252 |
| [15] |
Darby S, McGale P, Correa C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10, 801 women in 17 randomised trials[J]. Lancet, 2011, 378(9804): 1707-1716. DOI:10.1016/S0140-6736(11)61629-2 |
| [16] |
Beduk Esen CS, Gultekin M, Yildiz F. Role of radiotherapy in oligometastatic breast cancer: Review of the literature[J]. World J Clin Oncol, 2022, 13(1): 39-48. DOI:10.5306/wjco.v13.i1.39 |
| [17] |
Nilsen A, Hillestad T, Skingen VE, et al. miR-200a/b/-429 downregulation is a candidate biomarker of tumor radioresistance and independent of hypoxia in locally advanced cervical cancer[J]. Mol Oncol, 2022, 16(6): 1402-1419. DOI:10.1002/1878-0261.13184 |
| [18] |
Li H, Zhao S, Chen X, et al. MiR-145 modulates the radiosensitivity of non-small cell lung cancer cells by suppression of TMOD3[J]. Carcinogenesis, 2022, 43(3): 288-296. DOI:10.1093/carcin/bgab121 |
| [19] |
Hannafon BN, Cai A, Calloway CL, et al. miR-23b and miR-27b are oncogenic microRNAs in breast cancer: evidence from a CRISPR/Cas9 deletion study[J]. BMC Cancer, 2019, 19(1): 642. DOI:10.1186/s12885-019-5839-2 |
| [20] |
Raab CA, Raab M, Becker S, et al. Non-mitotic functions of polo-like kinases in cancer cells[J]. Biochim Biophys Acta Rev Cancer, 2021, 1875(1): 188467. DOI:10.1016/j.bbcan.2020.188467 |
| [21] |
Kressin M, Fietz D, Becker S, et al. Modelling the functions of polo-like kinases in mice and their applications as cancer targets with a special focus on ovarian cancer[J]. Cells, 2021, 10(5): 1-27. DOI:10.3390/cells10051176 |
| [22] |
Burns TF, Fei P, Scata KA, et al. Silencing of the novel p53 target gene Snk/Plk2 leads to mitotic catastrophe in paclitaxel (taxol)-exposed cells[J]. Mol Cell Biol, 2003, 23(16): 5556-5571. DOI:10.1128/MCB.23.16.5556-5571.2003 |
| [23] |
Xie Y, Liu Y, Li Q, et al. Polo-like kinase 2 promotes chemoresistance and predicts limited survival benefit from adjuvant chemotherapy in colorectal cancer[J]. Int J Oncol, 2018, 52(5): 1401-1414. DOI:10.3892/ijo.2018.4328 |
 2023, Vol. 43
2023, Vol. 43


