2. 成都医学院第二附属医院 核工业四一六医院, 成都 610051
2. Second Affiliated Hospital of Chengdu Medical College, China National Nuclear Corporation No. 416 Hospital, Chengdu 610051, China
由于肠道具有快速更新的能力,是腹盆腔放射治疗期间损伤的主要部位[1-2]。迄今为止,临床尚缺乏有效的肠道辐射保护剂[3]。尽管有关放射性肠损伤的机制学研究在不断深入[4],但对于其发病机制的认识仍然不足。有研究表明电离辐射诱导肠道内的铜离子异常沉积[5],过量的铜导致细胞内的氧化应激水平增加[6],产生活性氧(reactive oxygen species, ROS),从而引发DNA双链断裂、碱基氧化等破坏细胞增殖以及代谢活动[7-8]。并且辐射诱导铜吸收转运蛋白(copper transporter 1, CTR1)表达的变化会影响铜离子在肠道内的水平和分布[9-11]。然而,有关CTR1调控铜离子稳态是否参与放射性肠损伤及其相关机制的探索仍不全面。
本研究通过检测电离辐射以及沉默CTR1后,HIEC和IEC-6细胞的增殖活力、细胞内铜水平、ROS产生、DNA损伤、抗氧化以及铜死亡相关蛋白的表达,探讨CTR1在放射性肠损伤中发挥的生物学功能及机制。以上的全部实验均未额外添加铜离子,铜离子仅来源于培养基。预期本研究的相关结果将为更好地应对放射性肠损伤提供必要的补充。
材料与方法1. 实验材料:人小肠上皮HIEC细胞和大鼠小肠隐窝上皮IEC-6细胞均购于美国ATCC公司,并由本实验室一直保存。DMEM高糖培养基、胎牛血清(FBS)、胰蛋白酶购于美国HyClone公司,磷酸盐缓冲液(PBS)粉末、RIPA裂解液、牛血清白蛋白(BSA)购于北京索莱宝公司,青霉素-链霉素双抗溶液、二喹啉甲酸(BCA)蛋白检测试剂盒、含4′,6-二脒基-2-苯基吲哚(DAPI)封片液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒、活性氧检测试剂盒、Tubulin兔多克隆抗体、Alexa Flour 555标记山羊抗兔IgG(H+L)和辣根过氧化物酶标记山羊抗兔IgG购于上海碧云天生物技术公司,CTR1敲除腺病毒及对照腺病毒购于山东维真生物科技公司。FDX1、Nrf2和HO-1兔单克隆抗体购于英国Abcam公司,DLAT兔单克隆抗体购于美国SAB公司,CTR1兔单克隆抗体购于美国GeneTex公司,LIAS兔单克隆抗体购于美国Proteintech公司,γ-H2AX兔单克隆抗体购于美国CST公司。
2. 细胞培养与照射条件:使用含10% 胎牛血清的DMEM高糖培养基(含青霉素和链霉素各100 U/ml)在37℃、含5% CO2恒温培养箱中培养HIEC细胞和IEC-6细胞。采用美国RAD SOURCE公司RS 2000 X射线生物辐照仪,能量为160 kVp,源靶距48 cm,吸收剂量率为1.16 Gy/min,在室温条件下进行照射。
3. 实验分组:将细胞分为空白组(不做任何处理)、对照组(对照腺病毒转染的小肠细胞)、沉默组(沉默CTR1腺病毒转染的小肠细胞)、照射对照组(给予对照组相应剂量的电离辐射)、照射沉默组(给予沉默组相应剂量的电离辐射)。
4. 沉默CTR1腺病毒载体构建包装:利用生物信息学软件根据CTR1基因的编码序列设计了针对CTR1的1组shRNA靶点, 具体序列为shRNA1:5′CGGTACAGGATACTTCCTCTTTCAAGAGAAGAGGAAGTATCCTGTACCGTTTTTT3′,shRNA2:5′GATGCCTATGACCTTCTACTTTCAAGAGAAGTAGAAGGTCATAGGCATCTTTTTT3′,shRNA3:5′GCGTAAGTCACAAGTCAGCATTTCAAGAGAATGCTGACTTGTGACTTACGCTTTTTT3′,shRNA4:5′CCAACAGTACCATGCAACCTTTCAAGAGAAGGTTGCATGGTACTGTTGGTTTTTT3′。待细胞密度达到50%,根据最佳感染复数稀释腺病毒原液后进行转染。
5. 克隆形成实验:将处于对数生长期的细胞,根据不同的照射剂量取不同数量的细胞,接种于6孔板中,每组设置3个平行样品,然后将其置于培养箱中。培养24 h后分别给予0、2、4、6、8 Gy的X射线照射,继续培养2周,直到出现肉眼可见的细胞克隆终止培养。用无水甲醇配制的0.2 %结晶紫溶液进行固定和染色。镜下观察超过50个细胞的克隆群落,干燥后进行拍照、克隆计数并计算克隆存活分数(SF)。SF=实验组的克隆形成率/对照组的克隆形成率×100%。
6. 电感耦合等离子体质谱仪(ICP-MS)检测:称取适量样品至聚四氟乙烯消解罐中,加入5 ml硝酸。静置待反应结束后,放入微波消解仪中进行消解。待温度冷却至50℃以下,取出消解罐放入通风橱中,打开消解罐并用超纯水润洗3~4次,转移至25 ml容量瓶中,用超纯水稀释定容至刻度。ICP-MS仪器参数如下:射频功率1 550 W,泵速40 r/min,雾化室温度2.7℃,采样深度5 mm,冷却气流速14 L/min,辅助气流速0.8 L/min,雾化气流速1.122 L/min,使用ICP-MS检测不同处理条件下各组细胞内的铜水平。
7. ROS检测:2, 7-二氯二氢氟醚(DCFH-DA)是氧化敏感的荧光探针,本身没有荧光,可自由穿过细胞膜,进入细胞后被胞内的酯酶水解为2′, 7′-二氯二氢荧光素(DCFH)。活性氧会将DCFH氧化成带荧光的二氯荧光素(DCF),检测DCF的荧光即可得到细胞内的ROS水平。接种HIEC和IEC-6细胞至直径35 mm的培养皿中,待细胞贴壁后于次日分别进行4、10 Gy X射线照射。并在照后0.5 h用10 μmol/L DCFH-DA探针37℃避光孵育20 min,PBS洗涤后用荧光显微镜观察。
8. 免疫荧光染色:将HIEC和IEC-6细胞培养于细胞爬片上,进行照射和预处理后,用4%的中性多聚甲醛固定细胞,室温下10 min,PBS洗3次,加入0.5% Triton X-100,室温通透10 min,5% BSA室温封闭1 h,将1 ∶50稀释的抗兔DLAT抗体滴加在细胞上,4℃孵育过夜,PBS洗3次,1 ∶1 000稀释的FITC标记Alexa Flour 555山羊抗兔二抗避光孵育1 h,PBS洗3次。最后用含有DAPI抗荧光淬灭封片剂与细胞相结合,室温封片20 min。封片完成后立即使用激光共聚焦显微镜观察并拍照。
9. Western blot分析:使用RIPA细胞裂解液提取电离辐射后的细胞蛋白,用BCA蛋白检测试剂盒计算待测样品的蛋白浓度。取40 μg蛋白于12.5%的SDS-PAGE凝胶中进行电泳分离,并将蛋白转移到聚偏二氟乙烯(PVDF)膜上;5% BSA室温封闭2 h后加入稀释至适当浓度的一抗,摇床上4℃孵育过夜。用磷酸盐吐温缓冲液(PBST)洗膜3次,二抗室温孵育1 h后PBST洗膜3次。最后用电化学发光(ECL)显影,化学发光成像仪进行曝光。以Tubulin为内参,采用ImageJ软件分析目的蛋白表达水平,作图使用GraphPad软件。
10. 统计学处理:采用SPSS 24.0软件进行统计学分析。实验数据符合正态分布,用x±s表示。组间比较使用独立样本t检验。P < 0.05为差异有统计学意义。
结果1. 铜吸收转运蛋白CTR1的表达具有辐射响应性:结果如图 1所示,受照后24 h,CTR1的表达水平随着照射剂量的增加,呈剂量依赖的方式增加(t=3.53,P < 0.05)。HIEC细胞经4 Gy照射,IEC-6细胞经10 Gy照射,发现随着照后时间的延长,照射后2、4、8、24 h,CTR1蛋白表达有所上调(t=3.45、6.37、11.11、11.13,P < 0.05)。说明辐射诱导小肠细胞内的铜离子蓄积,在一定程度上可能是由于照后CTR1的显著上调所致。

|
注:a与0 Gy比较,t=3.53,P < 0.05;b与照后0 h比较,t=3.45、6.37、11.11、11.13,P < 0.05 图 1 电离辐射对CTR1表达水平的影响 A、C. HIEC (A)和IEC-6细胞(C)在不同剂量X射线照射后24 h CTR1蛋白的表达;B、D. HIEC (B)和IEC-6细胞(D)分别给予4、10 Gy照后不同时间CTR1蛋白的表达;E、F. CTR1蛋白表达随照射剂量(E)以及照后时间(F)的变化趋势 Figure 1 Effects of ionizing radiation on CTR1 expression levels A, C.Western blot assay of CTR1 protein of HIEC (A) and IEC-6 cells (C) at 24 h after irradiation with different doses; B, D.HIEC (B) and IEC-6 cells (D) were irradiated with 4 Gy or 10 Gy, respectively, and the protein was detected at indicated time points after irradiation; E, F.The dose- and time- response of the relative expression level of CTR1 protein after irradiation |
2. 经腺病毒转染获得沉默CTR1的小肠细胞模型:Western blot检测结果显示,CTR1 shRNA腺病毒感染的两株细胞中CTR1蛋白表达均明显减少(图 2A、B)。

|
注:1. 空白组;2. 对照组;3. 沉默组 图 2 Western blot检测shRNA腺病毒感染两种细胞后CTR1的蛋白表达和抑制CTR1后不同剂量照射下的细胞存活曲线 A、C. HIEC;B、D. IEC-6 Figure 2 Influence of CTR1 shRNA in the expression of CTR1 expression (A, B) and survival fraction (C, D) of HIEC and IEC-6 cells A, C. HIEC; B, D. IEC-6 |
3. CTR1缺失使受照射小肠细胞增殖活力增强:设3个平行组在转染后72 h分别给予HIEC和IEC-6细胞0、2、4、6、8 Gy X射线照射,以0 Gy时的细胞数为100%,绘制细胞存活曲线,计算克隆存活分数(图 2C、D,表 1、2)。X射线照射能够明显抑制两株细胞的生长,而沉默组相较于对照组的放射增敏比分别为1.146和1.201,说明沉默CTR1能够缓解两株细胞因电离辐射所导致的增殖抑制现象,起到一定的辐射防护效果。
|
|
表 1 HIEC细胞单击多靶模型参数值 Table 1 The fitting parameters of HIEC cells survival curves |
|
|
表 2 IEC-6细胞单击多靶模型参数值 Table 2 The fitting parameters of IEC-6 cells survival curves |
4. 沉默CTR1对小肠细胞内铜水平的影响:HIEC和IEC-6细胞在分别经过4和10 Gy X射线照射后,定量检测细胞内的铜水平。HIEC细胞对照组和沉默组铜水平分别为(1.29±0.10) 和(1.21±0.06) mg/kg,照射对照组与照射沉默组的铜水平分别为(1.65±0.11) 和(1.23±0.15) mg/kg,差异均无统计学意义(P>0.05)。IEC-6细胞对照组和沉默组铜水平分别为(1.66±0.17) 和(1.84±0.53) mg/kg,差异无统计学意义(P>0.05);而照射对照组与照射沉默组铜水平分别为(2.62±0.60)和(2.13±0.58) mg/kg,照射沉默组的铜水平较照射对照组低,差异有统计学意义(t=3.10,P < 0.05),提示沉默CTR1可能缓解了由辐射引起的IEC-6细胞内铜蓄积效应。
5. 沉默CTR1抑制小肠细胞内ROS的生成:HIEC细胞在4 Gy X射线照射后0.5 h,通过DCFH-DA检测各组细胞中ROS的形成,以对照组为1,沉默组ROS相对表达量为0.42±0.16;照射对照组和照射沉默组ROS相对表达量分别为13.35± 1.72、5.25±1.37。IEC-6细胞在给予10 Gy X射线照后0.5 h,以对照组为1,沉默组ROS相对表达量为3.35±0.86;照射对照组和照射沉默组ROS相对表达量分别为21.69±5.34、13.06±2.16。与对照组相比, 两株细胞照射后ROS生成量均显著增加, 差异有统计学意义(t=7.96、5.96、9.02、13.05,P < 0.05);而照射沉默组相较于照射对照组ROS有所降低,差异有统计学意义(t=5.23、2.96,P < 0.05)。即沉默CTR1抑制辐射诱导小肠细胞内的氧化应激,使细胞辐射抗性增强(图 3)。

|
注:ROS. 活性氧。1. 对照组;2. 沉默组;3. 照射对照组;4. 照射沉默组。a与对照组比较,t=7.96、5.96、9.02、13.05,P < 0.05;b与照射对照组比较,t=5.23、2.96,P < 0.05 图 3 沉默CTR1对4 Gy照射后0.5 h HIEC (A)和10 Gy照射后0.5 h IEC-6细胞(B)内ROS水平的影响 Figure 3 Effect of CTR1 shRNA on the ROS levels in HIEC cells at 0.5 h after 4 Gy irradiation (A) and IEC-6 cells at 0.5 h after 10 Gy irradiation (B) |
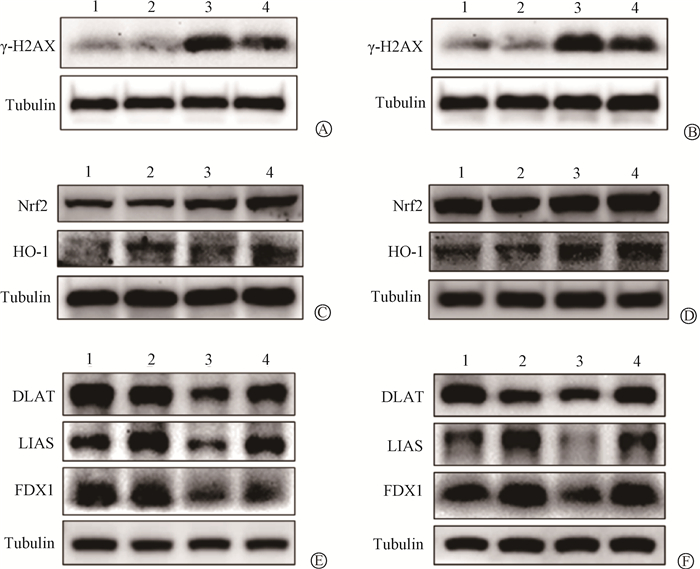
6. CTR1影响受照射小肠细胞DNA损伤蛋白的表达:如图 4A、B所示,Western blot检测了γ-H2AX的蛋白表达,两株细胞的结果均显示,照后1 h,照射沉默组相较于照射对照组γ-H2AX的表达相对减少(t=7.50、4.29,P < 0.05);并且照射前后沉默组γ-H2AX所增加的表达量少于对照组,说明沉默CTR1可减轻X射线所诱导的DNA双链断裂。
|
注:1. 对照组;2. 沉默组;3. 照射对照组;4. 照射沉默组 图 4 Western blot检测不同处理条件下HIEC (A、C、E)和IEC-6细胞(B、D、F)中γ-H2AX、抗氧化蛋白Nrf2、HO-1以及铜死亡相关蛋白DLAT、LIAS和FDX1的表达 Figure 4 Western blot of the protein expressions of γ-H2AX, the antioxidants Nrf2 and HO-1, and the cuproptosis associated proteins DLAT, LIAS and FDX1 in HIEC cells (A, C, E) and IEC-6 cells (B, D, F) under different conditions |
7. 沉默CTR1增加受照小肠细胞中抗氧化蛋白的表达:HIEC和IEC-6细胞在分别给予4和10 Gy X射线照射后24 h,Nrf2、HO-1表达水平均显著上调;而沉默CTR1后,照射沉默组相较于照射对照组Nrf2和HO-1的表达均有所增加(图 4C、D)。说明电离辐射动员了小肠细胞的抗氧化防御机制,而沉默CTR1能进一步提高其抗氧化能力。
8. CTR1介导小肠细胞的辐射损伤与铜死亡途径有关:HIEC和IEC-6细胞在分别经过4和10 Gy的X射线照射,如图 4E、F所示,DLAT、LIAS和FDX1的表达均有所降低;而照射沉默组相较于照射对照组,上述蛋白的表达水平在辐照后得以恢复正常。说明电离辐射导致铜死亡标志物DLAT以及铁硫簇蛋白LIAS、FDX1发生丢失,而沉默CTR1缓解了这一现象,提示CTR1介导的铜死亡可能是放射性肠损伤分子机制之一。
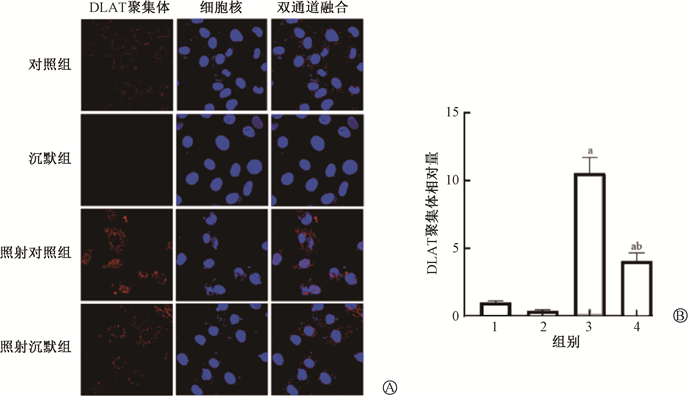
此外,小肠细胞在辐照后出现明显的铜死亡标志性DLAT寡聚现象,DLAT聚集体有显著增多的趋势(t=9.09、4.89,P < 0.05);而沉默CTR1能抑制这一现象,DLAT聚集体也在相应地减少,差异具有统计学意义(t=5.22,P < 0.05,图 5)。
|
注:1. 对照组;2. 沉默组;3. 照射对照组;4. 照射沉默组。a与对照组比较,t=9.09、4.89,P < 0.05;b与照射对照组比较,t=5.22,P < 0.05 图 5 沉默CTR1以及照射后肠上皮细胞DLAT聚集体的观察 A. 激光共聚焦显微镜下观察DLAT聚集体的免疫荧光染色×20;B. DLAT聚集体相对量分析 Figure 5 DLAT oligomers in enterocytes after silencing CTR1 or irradiation A. Fluorescent staining of DLAT oligomers with a laser confocal microscope ×20; B. Relative levels of DLAT oligomers in different groups |
讨论
肠道作为机体摄取铜的主要部位,小肠细胞内的铜转运系统对于维持机体内铜离子的稳态平衡,保证组织脏器的正常运转起到关键作用[12-13]。高亲和力铜吸收转运蛋白CTR1作为肠道吸收铜离子的主要途径[14-15],电离辐射和胞内铜离子浓度都会影响CTR1的表达,辐照后CTR1表达有所升高,铜浓度降低时CTR1的表达也会相应地增加[16]。此前的研究表明,铜离子在人体内的氧化还原反应中发挥着重要作用,铜离子稳态破坏所导致的氧化应激是一种活性氧形成增加超过机体抗氧化保护的状态。铜离子超负荷引发的芬顿(Fenton)氧化还原反应、哈伯-韦斯(Haber-Weiss)反应可直接催化ROS的形成,ROS产量的增加会破坏细胞的氧化还原状态,产生剧毒的羟自由基而引发脂质过氧化、细胞死亡、酶失活和遗传毒性等[8]。此外,高水平的铜离子还会消耗体内存在的诸多抗氧化剂,例如谷胱甘肽[17]。然而,电离辐射引发的辐射损伤主要是通过机体内的氧化应激途径,继而诱导DNA双链断裂等生物大分子的破坏,因此猜测放射性肠损伤很可能与铜离子稳态失衡有关。
本研究发现小肠细胞CTR1的表达可被电离辐射所诱导。相关研究表明,辐射诱导CTR1表达水平升高可能使得大量的铜离子进入小肠细胞内,而后过量的铜离子则通过增强辐射诱导的ROS,降低小肠细胞增殖活力[5]。本研究在此基础上,通过沉默小肠细胞中CTR1表达,干预电离辐射对CTR1的诱导作用,抑制照射后细胞内的氧化应激,并减轻DNA损伤,增加了抗氧化蛋白的表达,从而增强小肠细胞的辐射抗性,说明CTR1很可能是铜离子稳态失衡参与放射性肠损伤的关键调控环节。
此外,本研究相关结果还提示CTR1可能通过铜死亡,这一细胞体内依赖于铜离子并受其调控的新型细胞死亡方式[18],介导放射性肠损伤的发生与进展。据报道,CTR1的过表达能激活铜死亡,使得大量的铜离子蓄积于胞内,而后与线粒体呼吸中三羧酸循环的脂酰化成分直接结合,并且铜离子的结合会导致脂酰化修饰的三羧酸循环相关酶寡聚化形成聚集体,促使脂酰化蛋白异常聚集以及铁硫簇蛋白的丢失,从而发生蛋白质毒性应激反应并最终导致细胞死亡[19],这不同于以往发现的细胞死亡方式[20]。有些肿瘤细胞内表达大量的线粒体脂酰化蛋白,利用铜离子金属载体杀伤肿瘤细胞将有可能成为癌症治疗的新手段。
本研究结果表明电离辐射能够显著上调CTR1的表达,继而可能会诱导铜死亡的发生。由于脂酰化蛋白DLAT与铜离子结合后形成寡聚物,故能检测到DLAT蛋白表达上的丢失,并且通过免疫荧光能够观测到受照射细胞内的DLAT寡聚。文献里的Western blot实验结果显示,发生铜死亡时DLAT蛋白会相应地减少,而免疫荧光却能观察到DLAT寡聚物的增多[18]。本研究的相关结果提示,电离辐射引起的CTR1失调可能通过氧化应激与铜死亡两种途径来共同参与调控放射性肠损伤。
尽管如此,目前尚无确切的研究证实电离辐射促使胞内铜离子聚集诱发了铜死亡,辐射诱导CTR1过表达继而引发细胞铜死亡的机制尚未完全阐明,还需进一步验证DLAT寡聚化蛋白条带的表达,以及明确受照射小肠细胞内发生铜离子与脂酰化DLAT的紧密结合。综上,本研究发现沉默小肠细胞CTR1缓解了照后细胞内的铜蓄积,电离辐射引起铜死亡标志物DLAT蛋白与铁硫簇蛋白的丢失也有所恢复,这些结果为辐射诱导小肠细胞发生铜死亡提供了关键证据,也为放射性肠损伤的防治开拓了新的思路。
利益冲突 无
作者贡献声明 王议贤负责实验操作、论文撰写;刘立、莫韦负责数据分析;朱巍、冯亚辉提供实验内容相关建议;焦旸、曹建平指导课题设计与论文修改
| [1] |
Riehl TE, Alvarado D, Ee X, et al. Lactobacillus rhamnosus GG protects the intestinal epithelium from radiation injury through release of lipoteichoic acid, macrophage activation and the migration of mesenchymal stem cells[J]. Gut, 2019, 68(6): 1003-1013. DOI:10.1136/gutjnl-2018-316226 |
| [2] |
Kumagai T, Rahman F, Smith AM. The microbiome and radiation induced-bowel injury: evidence for potential mechanistic role in disease pathogenesis[J]. Nutrients, 2018, 10(10): 1405. DOI:10.3390/nu10101405 |
| [3] |
Bhanja P, Norris A, Gupta-Saraf P, et al. BCN057 induces intestinal stem cell repair and mitigates radiation-induced intestinal injury[J]. Stem Cell Res Ther, 2018, 9(1): 26. DOI:10.1186/s13287-017-0763-3 |
| [4] |
Zhou H, Zhou YL, Mao JA, et al. NCOA4-mediated ferritinophagy is involved in ionizing radiation-induced ferroptosis of intestinal epithelial cells[J]. Redox Biol, 2022, 55: 102413. DOI:10.1016/j.redox.2022.102413 |
| [5] |
Zhong L, Dong A, Feng Y, et al. Alteration of metal elements in radiation injury: radiation-induced copper accumulation aggravates intestinal damage[J]. Dose Response, 2020, 18(1): 1559325820904547. DOI:10.1177/1559325820904547 |
| [6] |
Fang Y, Xing C, Wang X, et al. Activation of the ROS/HO-1/NQO1 signaling pathway contributes to the copper-induced oxidative stress and autophagy in duck renal tubular epithelial cells[J]. Sci Total Environ, 2021, 757: 143753. DOI:10.1016/j.scitotenv.2020.143753 |
| [7] |
Fahmy HM, Ebrahim NM, Gaber MH. In-vitro evaluation of copper/copper oxide nanoparticles cytotoxicity and genotoxicity in normal and cancer lung cell lines[J]. J Trace Elem Med Biol, 2020, 60: 126481. DOI:10.1016/j.jtemb.2020.126481 |
| [8] |
Theophanides T, Anastassopoulou J. The effects of metal ion contaminants on the double stranded DNA helix and diseases[J]. J Environ Sci Health A Tox Hazard Subst Environ Eng, 2017, 52(10): 1030-1040. DOI:10.1080/10934529.2017.1328950 |
| [9] |
Bossak K, Drew SC, Stefaniak E, et al. The Cu(Ⅱ) affinity of the N-terminus of human copper transporter CTR1: Comparison of human and mouse sequences[J]. J Inorg Biochem, 2018, 182: 230-237. DOI:10.1016/j.jinorgbio.2018.01.011 |
| [10] |
Lutsenko S. Dynamic and cell-specific transport networks for intracellular copper ions[J]. J Cell Sci, 2021, 134(21). DOI:10.1242/jcs.240523 |
| [11] |
Masaldan S, Clatworthy S, Gamell C, et al. Copper accumulation in senescent cells: Interplay between copper transporters and impaired autophagy[J]. Redox Biol, 2018, 16: 322-331. DOI:10.1016/j.redox.2018.03.007 |
| [12] |
Liu Y, Miao J. An emerging role of defective copper metabolism in heart disease[J]. Nutrients, 2022, 14(3): 700. DOI:10.3390/nu14030700 |
| [13] |
Doguer C, Ha JH, Collins JF. Intersection of iron and copper metabolism in the mammalian intestine and liver[J]. Compr Physiol, 2018, 8(4): 1433-1461. DOI:10.1002/cphy.c170045 |
| [14] |
Chen J, Jiang Y, Shi H, et al. The molecular mechanisms of copper metabolism and its roles in human diseases[J]. Pflugers Arch, 2020, 472(10): 1415-1429. DOI:10.1007/s00424-020-02412-2 |
| [15] |
Gromadzka G, Tarnacka B, Flaga A, et al. Copper dyshomeostasis in neurodegenerative diseases-therapeutic implications[J]. Int J Mol Sci, 2020, 21(23): 9259. DOI:10.3390/ijms21239259 |
| [16] |
Ren F, Logeman BL, Zhang X, et al. X-ray structures of the high-affinity copper transporter Ctr1[J]. Nat Commun, 2019, 10(1): 1386. DOI:10.1038/s41467-019-09376-7 |
| [17] |
Bhattacharjee A, Chakraborty K, Shukla A. Cellular copper homeostasis: current concepts on its interplay with glutathione homeostasis and its implication in physiology and human diseases[J]. Metallomics, 2017, 9(10): 1376-1388. DOI:10.1039/c7mt00066a |
| [18] |
Tsvetkov P, Coy S, Petrova B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins[J]. Science, 2022, 375(6586): 1254-1261. DOI:10.1126/science.abf0529 |
| [19] |
Tang D, Chen X, Kroemer G. Cuproptosis: a copper-triggered modality of mitochondrial cell death[J]. Cell Res, 2022, 32(5): 417-418. DOI:10.1038/s41422-022-00653-7 |
| [20] |
Cobine PA, Brady DC. Cuproptosis: cellular and molecular mechanisms underlying copper-induced cell death[J]. Mol Cell, 2022, 82(10): 1786-1787. DOI:10.1016/j.molcel.2022.05.001 |
 2023, Vol. 43
2023, Vol. 43


