2. 天津医科大学眼视光学院, 天津 300070
2. School of Optometry & Ophthalmology, Tianjin Medical University, Tianjin 300070, China
放射治疗是临床腹腔或盆腔恶性肿瘤治疗的主要手段之一,由于大部分肠道位于腹腔和盆腔内,而且在体内代谢活跃的肠道组织对电离辐射非常敏感,因此在腹腔或盆腔肿瘤的放射治疗中,放射性肠损伤是这些患者最常见的并发症。一般在几个月内出现以肠黏膜炎性反应为主的效应,严重影响患者的生活质量和肿瘤的放疗疗效[1]。如何在保证疗效的同时,减少对肠道组织的放射性损伤,是辐射防护领域亟需解决的科学问题。
前期研究发现,在照射前对小鼠进行褪黑素给药,能明显缓解小鼠小肠组织的辐射损伤效应[2]。基因决定生物的遗传特征,生物体的所有生命现象都与基因密切相关[3-4]。本研究采用DNA微阵列分析,检测小鼠小肠组织全基因体表达图谱的变化,探讨褪黑素在放射性肠损伤作用中基因的改变。
材料与方法1. 实验材料:褪黑素购自美国Sigma公司,RNA稳定剂购自上海凯杰公司,TRIzol试剂、氨基烯丙基扩增试剂盒购自美国赛默飞世尔公司,Quantscript RT试剂盒购自北京天根公司,qPCR MasterMix试剂盒购自上海爱必梦公司,小鼠表达谱芯片购自台湾华联生物公司(型号MOA生物芯片),微阵列扫描仪G2505C购自美国安捷伦公司,Rosetta Resolver 7.2软件购自美国Rosetta生物软件公司,137Cs γ射线辐照仪购自加拿大Gammacell公司。
2. 实验动物:雄性C57BL/6J小鼠购自北京维通利华实验动物中心,实验动物使用许可证号:SCXY(京)2021-0006, 体重(20±2)g,年龄6~8周。所有小鼠置恒温(25±2)℃、恒湿45%~50%、12 h ∶12 h光照与黑暗条件、无菌净化屏障系统内饲养。在中国医学科学院放射医学研究所实验动物中心完成动物实验,由实验动物伦理福利委员会审核实验方案(批号DWLL-20210517)。
3. 褪黑素溶液配置:褪黑素用无水乙醇溶解,用生理盐水配制成1 g/L的褪黑素溶液,乙醇含量为0.01%,现用现配。
4. 照射方法:对小鼠进行腹腔注射10%水合氯醛(0.1 ml/10 g),小鼠麻醉后俯卧固定于特制的盒子中,小鼠腹部接受γ射线辐照仪14 Gy剂量照射,源皮距为50 cm,剂量率为0.883 Gy/min。
5. 实验分组:将小鼠随机分为3组,每组5只。健康对照组:小鼠不进行任何处理;照射组:小鼠腹部进行14 Gy剂量照射;照射前给药组:按10 mg/kg(体重)对小鼠进行腹腔注射褪黑素,1次/d,连续5 d,于给药后24 h以14 Gy剂量进行腹部照射。
6. DNA微阵列分析:照射后3 d处死小鼠,取小鼠小肠组织,立即浸泡在RNA稳定剂中。用TRIzol试剂提取总RNA,使用Quantscript RT试剂盒反转录成互补DNA。使用氨基烯丙基扩增试剂盒扩增得到的氨基-烯丙基反义RNA与NHS-CyDye(Cy5)在50℃下杂交16 h,完成荧光标记,进行小鼠寡核苷酸微阵列分析。使用微阵列扫描仪以10 μm的分辨率扫描所有阵列。从扫描的图像中获得原始数据,使用Rosetta Resolver 7.2软件进行分析,使用PLIER默认设定对数据进行归一化。芯片讯号值经数据log转换及平均数中心化后,依据以下条件筛选出差异基因,需同时满足两个条件:①log2 |倍数变化| ≥1且P < 0.05。②log2 |倍数变化| =NA,且两样本间的讯号差异需≥1 000。
7. GO注释及KEGG通路分析:利用DAVID v6.8(https://david.ncifcrf.gov/)网络数据库工具及基因本体论(GO)数据库(www.geneontology.org)[5]和京都基因与基因组百科全书(KEGG)数据库(https://www.kegg.jp)[6],使用Rosetta Resolver 7.2软件对差异基因进行GO注释和KEGG通路分析。GO注释包括生物过程、分子功能和细胞成分。KEGG通路分析计算各个通路基因富集度的显著性水平,从而确定受到显著影响的信号转导途径。
8. qRT-PCR:使用1 ml TRIzol试剂提取小鼠小肠组织RNA,使用反转录试剂盒50℃ 15 min,85℃ 5 s合成互补DNA。使用qPCR MasterMix试剂盒进行PCR扩增,引物序列如下: ELOVL6正向引物5′ C G G C A T C T G A T G A A C A A G C G A G 3′,反向引物5′ G T A C A G C A T G T A A G C A C C A G T T C 3′;ATG12正向引物5′ G A A G G C T G T A G G A G A C A C T C C T 3′,反向引物5′ G G A A G G G G C A A A G G A C T G A T T C 3′;ATG16L2正向引物5′ T G G C A G C T A C T T A C A A C C A G G C 3′,反向引物5′ A G T C A C T G C C T G G T G C C T T G T T 3′;AMBRA1正向引物5′ C T C A G A C A A C C A G G G T C C A T C A 3′,反向引物5′ T C G T C C A A G T G A A G G T G C A G A C 3′;GAPDH正向引物5′ C A T C A C T G C C A C C C A G A A G A C T G 3′,反向引物5′ A T G C C A G T G A G C T T C C C G T T C A G 3′。引物由上海生工公司合成。
9. 统计学处理:采用SPSS 19.0软件进行统计学分析,计量资料符合正态分布,数据用x±s表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
结果1. 小鼠肠道组织的差异基因数量:照射组和照射前给药组小鼠差异表达基因的数量如表 1所示。将照射组和照射前给药组差异基因取交集,两组共有的上调基因或下调基因数量分别是243和199个。
|
|
表 1 小鼠肠道组织差异表达基因的数量 Table 1 The number of differentially expressed genes of the intestines for mice |
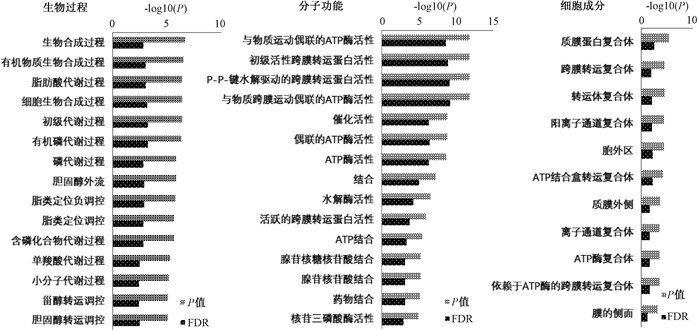
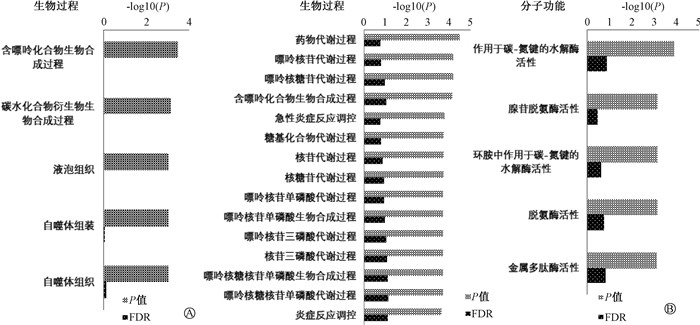
2. 小鼠肠道组织差异基因的GO功能注释:将照射组或照射前给药组小鼠特有的上调或下调差异基因进行GO功能注释。针对上调基因,照射组排名前15显著富集参与的生物过程主要包括生物合成过程(GO: 0009058)、脂肪酸代谢(GO: 0006631)、胆固醇外流(GO: 0033344)(图 1);照射前给药组排名前5显著富集的生物过程主要包括自噬体组装(GO: 0000045)和自噬体组织(GO: 1905037)(图 2)。针对下调基因,照射组排名前15显著富集的生物过程主要参与胆固醇外流(GO: 0033344)、脂类定位调节(GO: 1905952)、甾醇和胆固醇转运调节(GO: 0032371、GO: 0032374)(图 3);照射前给药组排名前15显著富集的生物过程主要参与药物代谢过程(GO: 0017144)、嘌呤核苷代谢过程(GO: 0042278)、急性炎症反应调节(GO: 0002673)(图 2)。此外,对照射前给药组小鼠显著富集的自噬体组装、自噬体组织和急性炎症反应调节这3个生物过程中的差异基因进行了分析,发现ATG12、ATG16L2和AMBRA1基因参与自噬体组装和自噬体组织,C3、CPN1、CD55、CFP、CNR1、C1QA、C2和CREB3L3基因参与急性炎症反应调节(表 2)。
|
图 1 照射组小鼠上调基因排序前15的GO富集 Figure 1 The top 15 enriched GO terms for the upregulated genes in the irradiated mice |
|
图 2 照射前给药组小鼠差异基因排序前15的GO富集 A.上调基因;B. 下调基因 Figure 2 The top 15 enriched GO terms for the differential genes in the administrated mice pre-irradiation A. The upregulated genes; B. The downregulated genes |

|
图 3 照射组小鼠下调基因排序前15的GO富集 Figure 3 The top 15 enriched GO terms for the downregulated genes in the irradiated mice |
|
|
表 2 照射前给药组小鼠显著富集的生物过程中的差异基因 Table 2 The differential genes of the significantly enriched biological processes for the administrated mice pre-irradiation |
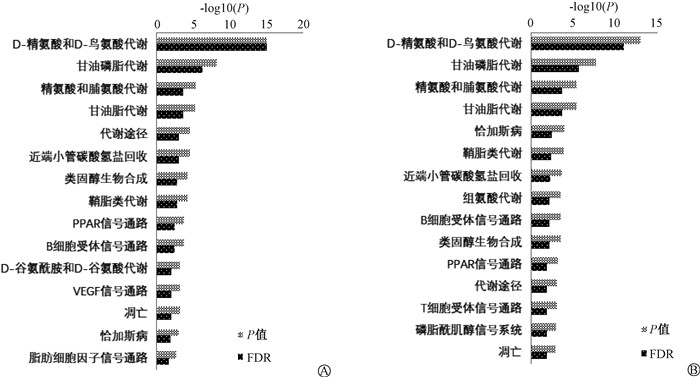
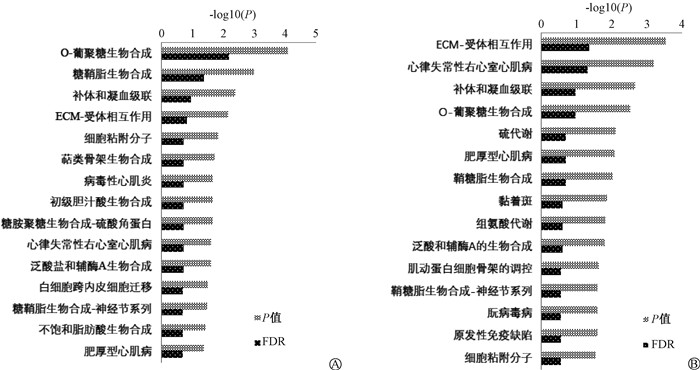
3. 小鼠肠道组织差异基因的KEGG通路分析:将照射组或照射前给药组特有的上调或下调差异基因参与的KEGG通路进行分析。针对上调基因参与的通路,照射组排名前15显著富集的通路主要包括D-精氨酸和D-鸟氨酸代谢(hsa00472)、甘油磷脂代谢(hsa00564)、类固醇生物合成(hsa00100)(图 4);照射前给药组排名前15显著富集的通路主要包括O-聚糖生物合成(hsa00512)、鞘糖脂生物合成(hsa00603)、细胞外基质-受体互作(hsa04512)和不饱和脂肪酸生物合成(hsa01040)(图 5)。针对下调基因参与的通路,照射组排名前15显著富集的通路中有12条通路与上调基因参与的通路相同(图 4);照射前给药组排名前15显著富集的通路与上调基因参与的通路有8条相同(图 5)。此外,表 3列出了照射前给药组小鼠参与O-聚糖生物合成、鞘糖脂生物合成、细胞外基质-受体互作和不饱和脂肪酸生物合成这4条通路中的差异基因。
|
图 4 照射组小鼠差异基因参与的排序前15的KEGG通路 A.上调基因;B.下调基因 Figure 4 The top 15 KEGG pathways of the differential genes involved in the irradiated mice A. The upregulated genes; B. The downregulated genes |
|
图 5 照射前给药组小鼠差异基因参与的排序前15的KEGG通路 A.上调基因;B.下调基因 Figure 5 The top 15 KEGG pathways of the differential genes involved in the administrated mice pre-irradiation A. The upregulated genes; B. The downregulated genes |
|
|
表 3 照射前给药组小鼠参与的显著富集KEGG通路中的差异基因 Table 3 The differential genes involved in the significantly enriched KEGG pathways for the administrated mice pre-irradiation |
4. 小鼠肠道组织差异基因表达量的验证:将DNA微阵列检测的照射前给药组参与自噬生物过程和不饱和脂肪酸生物合成通路中的差异基因,包括ATG12、ATG16L2、AMBRA1和ELOVL6基因,采用qRT-PCR实验进行基因的表达量验证。如图 6所示,照射前给药组ATG12、ATG16L2和AMBRA1基因的表达高于健康对照组和照射组,与DNA微阵列检测的相一致,ATG12和ATG16L2的表达量与照射组相比,差异有统计学意义(t=2.40、4.35, P < 0.05);ELOVL6基因的表达也较照射组增加。
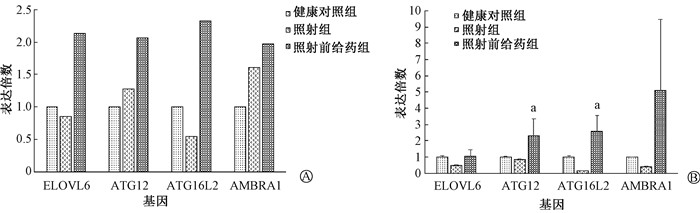
|
注:a与照射组比较,t=2.40、4.35, P < 0.05 图 6 差异基因表达量的qRT-PCR验证 A. DNA微阵列检测的差异基因的相对表达量;B. qRT-PCR验证的差异基因的相对表达量 Figure 6 qRT-PCR verification of the expression levels of the differential genes A. The relative expression levels of the differential genes in the DNA microarray data; B. The relative expression levels of the differential genes validated in the qRT-PCR |
讨论
目前对辐射损伤的治疗主要是使用辐射防护剂、辐射缓解剂和治疗剂等。辐射防护剂作为最早采取的辐射防护措施,通常在受到辐射之前给予,因此其效果远远优于辐射缓解剂和治疗剂[7-8]。辐射防护剂的使用是防护与救治辐射损伤最为有效和直接的手段之一。多年来,科研人员一直在寻找一种安全、高效的用于急性辐射损伤的防护药。近年来,褪黑素用于辐射损伤的防护与治疗的良好效果已被证实[9]。
褪黑素主要是由哺乳动物和人类的松果体在夜间合成与分泌的一种吲哚类物质。由于褪黑素是机体自身分泌的物质,毒性极小,易被机体接受,而且具有显著的抗辐射效果,褪黑素是减少因辐射暴露引起机体损伤适宜的辐射防护剂[10],因此,褪黑素引起了研究者的广泛关注。值得一提的是,在日本福岛核事故中,进入污染区执行任务的人员首次使用褪黑素作为抗辐射损伤药物,取得了很好的防护作用。
前期研究表明, 照射前给予褪黑素能有效缓解小鼠急性放射性肠损伤的症状[2]。为了阐明褪黑素在放射性肠损伤作用中哪些基因的表达发生了改变,本研究采用DNA微阵列分析,检测了小鼠小肠组织全基因体表达图谱的变化。实验发现,照射前给药组与健康对照组相比,显著改变了小肠组织全基因体的表达,特有的差异基因显著富集的生物过程主要涉及急性炎症反应调节和自噬。肠黏膜发生炎性反应的放射性肠炎是放射性肠损伤主要的表现,有研究表明,褪黑素对放射性肠炎的发生具有防护作用[11]。本研究发现,照射前给药处理后的差异基因参与了急性炎症反应调节,这与文献[11]报道相一致。因此推断,之前研究发现褪黑素能减轻放射性肠损伤的症状,可能是由于小鼠小肠黏膜的炎性反应受到了调节。另有研究表明,褪黑素通过刺激自噬提高了肿瘤患者放疗后的疗效[12]。本研究发现,照射前给药后小鼠的差异基因也参与了自噬过程。同样可以推断,褪黑素能够减轻放射性肠损伤症状的原因之一可能是由于小肠组织自噬的发生。本研究发现,在急性炎症反应调节中,C3、CPN1、CD55、CFP、CNR1、C1QA、C2和CREB3L3基因参与了该过程;在自噬过程中,ATG12(autophagy related 12)、ATG16L2和AMBRA1基因参与了自噬体的组装和自噬体的组织,这些基因编码自噬反应的关键蛋白。ATG12是细胞自噬通路上一个关键基因,其编码的ATG12蛋白分子与ATG5蛋白和ATG16L1蛋白形成复合物,调控自噬小体早期形成和延伸[13-14]。本研究采用qRT-PCR实验验证,发现照射前给药组ATG12、ATG16L2和AMBRA1基因的表达量高于照射组。这些与急性炎症反应和自噬过程相关的基因与放射性肠损伤的关系如何,目前少见报道。
此外,本研究通过定位差异表达基因参与哪些KEGG通路,来揭示褪黑素对放射性肠损伤的辐射保护作用机制。发现不饱和脂肪酸生物合成这条通路显著富集在照射前给药组小鼠。有研究报道,多不饱和脂肪酸由于能够缓解肿瘤患者在接受放疗时辐射对机体造成的损伤,因此大大提高了肿瘤放疗的效果[15-16]。还有研究表明,给予多不饱和脂肪酸对小鼠放射性肠损伤具有保护作用, 其中以ω-3多不饱和脂肪酸干预效果最为明显[17]。本研究通路结果也表明,不饱和脂肪酸的生物合成在褪黑素缓解辐射诱导的放射性肠损伤中可能发挥着重要作用,这与文献[15]、[16]报道相一致。本研究发现ELOVL6基因参与了不饱和脂肪酸的生物合成这条通路。ELOVL6是超长链脂肪酸延伸酶家族成员6基因,主要催化C12、C14、C16饱和或单不饱和脂肪酸的延伸, 是长链脂肪酸延长反应的限速酶[18]。本研究采用qRT-PCR实验验证,发现照射前给药组ELOVL6基因的表达量较照射组也增加。ELOVL6基因与辐射的关系如何,目前也少有研究报道。ELOVL6基因在褪黑素缓解放射性肠损伤中如何发挥作用,需要进一步深入研究。
总之,本研究认为,与自噬和急性炎症反应相关的生物过程中的差异基因,以及参与不饱和脂肪酸生物合成的通路,参与了褪黑素在放射性肠损伤中的作用。这些差异基因以及通路如何发挥作用,需要进行大量深入研究。
利益冲突 无
作者贡献声明 何宁宁负责实验操作,论文撰写;高志旭、杨蒙蒙负责数据处理与分析;陆欣然负责动物实验;樊赛军指导论文修改;王芹负责课题设计,指导论文撰写
| [1] |
王津晗, 徐畅, 王彦, 等. 放射性肠损伤模型及其评价研究进展[J]. 国际放射医学核医学杂志, 2017, 41(1): 33-39, 44. Wang JH, Xu C, Wang Y, et al. Progress on the evaluating and establishing methods of radiation-induced intestinal injuries animal model[J]. Int J Radiat Med Nucl Med, 2017, 41(1): 33-39, 44. DOI:10.3760/cma.j.issn.1673-4114.2017.01.007 |
| [2] |
Wang Q, Wang Y, Du L, et al. Quantitative proteomic analysis of the effects of melatonin treatment for mice suffered from small intestinal damage induced by γ-ray radiation[J]. Int J Radiat Biol, 2021, 97(9): 1206-1216. DOI:10.1080/09553002.2021.1956006 |
| [3] |
唐绍凯, 陈建辉, 耿凤豪, 等. 干扰素基因激活因子激动剂对人皮肤黑色素瘤细胞的放射增敏作用研究[J]. 中华放射医学与防护杂志, 2023, 43(1): 1-7. Tang SK, Chen JH, Geng FH, et al. The radiosensitization effect of STING agonist on cutaneous melanoma cells[J]. Chin J Radiol Med Prot, 2023, 43(1): 1-7. DOI:10.3760/cma.j.cn112271-20220826-00350 |
| [4] |
夏琪, 赵国平, 吴李君. ZNF451通过调控53BP1/MDC1促进A549和HeLa细胞DNA损伤修复[J]. 中华放射医学与防护杂志, 2022, 42(4): 248-255. Xia Q, Zhao GP, Wu LJ. ZNF451 promotes DNA damage repair by recruiting 53BP1/MDC1 in A549 and HeLa cells[J]. Chin J Radiol Med Prot, 2022, 42(4): 248-255. DOI:10.3760/cma.j.cn112271-20220826-00350 |
| [5] |
Milano M. Using gene ontology to annotate and prioritize microarray data[J]. Methods Mol Biol, 2022, 2401: 273-287. DOI:10.1007/978-1-0716-1839-4_18 |
| [6] |
Kanehisa M, Furumichi M, Sato Y, et al. KEGG for taxonomy-based analysis of pathways and genomes[J]. Nucleic Acids Res, 2023, 51(D1): D587-D592. DOI:10.1093/nar/gkac963 |
| [7] |
Obrador E, Salvador-Palmer R, Villaescusa JI, et al. Nuclear and radiological emergencies: biological effects, countermeasures and biodosimetry[J]. Antioxidants (Basel), 2022, 11(6): 1098. DOI:10.3390/antiox11061098 |
| [8] |
张源, 杨福军, 徐文清. 辐射防护药物研究最新进展[J]. 国际放射医学核医学杂志, 2017, 41(5): 353-358. Zhang Y, Yang FJ, Xu WQ. Recent advances in radioprotective agents[J]. Int J Radiat Med Nucl Med, 2017, 41(5): 353-358. DOI:10.3760/cma.j.issn.1673-4114.2017.05.009 |
| [9] |
Amini P, Mirtavoos-Mahyari H, Motevaseli E, et al. Mechanisms for radioprotection by melatonin; can it be used as a radiation countermeasure?[J]. Curr Mol Pharmacol, 2019, 12(1): 2-11. DOI:10.2174/1874467211666180802164449 |
| [10] |
Reiter RJ, Tan DX, Korkmaz A, et al. The disaster in Japan: utility of melatonin in providing protection against ionizing radiation[J]. J Pineal Res, 2011, 50(4): 357-358. DOI:10.1111/j.1600-079X.2011.00881.x |
| [11] |
Musa AE, Shabeeb D, Alhilfi HSQ. Protective effect of melatonin against radiotherapy-induced small intestinal oxidative stress: biochemical evaluation[J]. Medicina (Kaunas), 2019, 55(6): 308. DOI:10.3390/medicina55060308 |
| [12] |
Fernandez-Gil BI, Guerra-Librero A, Shen YQ, et al. Melatonin enhances cisplatin and radiation cytotoxicity in head and neck squamous cell carcinoma by stimulating mitochondrial ROS generation, apoptosis, and autophagy[J]. Oxid Med Cell Longev, 2019, 2019: 7187128. DOI:10.1155/2019/7187128 |
| [13] |
Li X, He S, Ma B. Autophagy and autophagy-related proteins in cancer[J]. Mol Cancer, 2020, 19(1): 12. DOI:10.1186/s12943-020-1138-4 |
| [14] |
Don Wai Luu L, Kaakoush NO, Castaño-Rodríguez N. The role of ATG16L2 in autophagy and disease[J]. Autophagy, 2022, 18(11): 2537-2546. DOI:10.1080/15548627.2022.2042783 |
| [15] |
Tao X, Zhou Q, Rao Z. Efficacy of ω-3 polyunsaturated fatty acids in patients with lung cancer undergoing radiotherapy and chemotherapy: a meta-analysis[J]. Int J Clin Pract, 2022, 2022: 6564466. DOI:10.1155/2022/6564466 |
| [16] |
Muhammad N, Ruiz F, Stanley J, et al. Monounsaturated and diunsaturated fatty acids sensitize cervical cancer to radiation therapy[J]. Cancer Res, 2022, 82(24): 4515-4527. DOI:10.1158/0008-5472.CAN-21-4369 |
| [17] |
刘轩辰. 多不饱和脂肪酸对放射性肠损伤的保护作用[D]. 长春: 吉林大学, 2018. Liu XC. Protective effects of polyunsaturated fatty acids on radiation-induced intestinal injury[D]. Changchun: Jilin University, 2018. |
| [18] |
Matsuzaka T. Role of fatty acid elongase Elovl6 in the regulation of energy metabolism and pathophysiological significance in diabetes[J]. Diabetol Int, 2020, 12(1): 68-73. DOI:10.1007/s13340-020-00481-3 |
 2023, Vol. 43
2023, Vol. 43


